乳腺癌中Nestin与CD133的表达与上皮间质转化的关系
黄思念,程美红 ,谭云山,姚俊霞,靖红艳
(1.复旦大学附属中山医院青浦分院病理科,上海 201700;2.复旦大学附属中山医院病理科,上海 200032)
乳腺癌中Nestin与CD133的表达与上皮间质转化的关系
黄思念1,程美红1,谭云山2,姚俊霞1,靖红艳1
(1.复旦大学附属中山医院青浦分院病理科,上海 201700;2.复旦大学附属中山医院病理科,上海 200032)
目的 探讨乳腺癌中巢蛋白(Nestin)与CD133的表达与上皮间质转化(EMT)的关系。方法 收集复旦大学附属中山医院青浦分院2010年1月至2013年6月67例乳腺癌病理标本,使用免疫组织化学染色,观察Nestin、CD133与E-cadherin在乳腺癌中的表达。结果 Nestin的总体阳性率为73.13%(49/67),CD133的总体阳性率为40.30%(27/67)。Nestin在三阴性乳腺癌和非三阴性乳腺癌中的阳性率分别为90.48%(19/21)和65.22%(30/46),差异无统计学意义(P>0.05),而CD133的分别为71.43%(15/21)和26.09%(12/46),差异有统计学意义(P<0.01)。Nestin和CD133在E-cadherin阴性组中的阳性率为95.83%(23/24)和58.33%(14/24),高于在E-cadherin阳性组中的60.47%(26/43)和30.23%(13/43),差异均有显著统计学意义(P<0.01)。结论 Nestin能够用以特异性检测乳腺癌干细胞的表达,CD133能够用以特异性检测三阴性乳腺癌中干细胞的表达,乳腺癌组织表达干细胞标记可能与肿瘤细胞发生EMT有关。
乳腺癌;三阴性乳腺癌;巢蛋白;CD133;上皮间质转化
近年来乳腺癌干细胞与上皮间质转化(epithelial mesenchymal transition,EMT)关系的研究给乳腺癌的治疗提供了新的方向。EMT是上皮细胞转化为间质细胞表型的一种去分化现象,是有极性的上皮细胞转换为有移行能力的间质细胞,同时获得侵袭性和迁移能力[1]。有研究者发现,通过外界刺激,乳腺癌细胞发生EMT,开始表达间质表型,同时获得自我更新能力和干细胞表型[2]。传统的乳腺癌干细胞研究一般选用CD44+/CD24-/low作为干细胞标记,而进一步的研究显示CD44+/CD24-/low的乳腺癌细胞群存在异质性,其筛选出来的干细胞还可以细分为不同的亚群,有些细胞亚群并没有形成肿瘤的能力,提示用该分子标记筛选出的细胞不完全是乳腺癌干细胞[3]。因此有必要筛选其他的干细胞标记或联合运用多种干细胞标记用于乳腺癌干细胞的研究。巢蛋白(Nestin)作为一种干细胞标记,多表达于一些神经源性肿瘤中,其表达提示肿瘤的恶性程度和侵袭性更大[4]。而CD133是一种位于细胞表面的跨膜糖蛋白,其表达水平随着细胞的成熟分化迅速下调,可以分离和鉴定干细胞和祖细胞[5]。两者能否作为一个新的乳腺癌干细胞标记,成为干细胞治疗的靶点,尚需进一步的研究。
三阴性乳腺癌是一类对雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(Her-2)三种蛋白均不表达的乳腺癌亚型。三阴性乳腺癌不能从内分泌和靶向治疗中获益,预后较差,是临床治疗的难题。三阴性乳腺癌对治疗的抵抗性是否与其存在较高的乳腺癌干细胞比例有关,尚未得到深入研究。
1 资料与方法
1.1 一般资料 收集复旦大学附属中山医院青浦分院2010年1月至2013年6月的67例乳腺癌手术根治标本,肿瘤直径0.8~3.5 cm,术后病理检查均为浸润性导管癌,Ⅱ~Ⅲ级,所有标本均已检测ER、PR、Her-2、上皮细胞钙粘蛋白(E-cadherin)。
1.2 实验方法 手术切除标本经10%中性福尔马林固定,常规脱水,石蜡包埋,3 μm厚切片,HE染色,光镜观察。所有标本均采用免疫组化Envision二步法,使用Leica全自动免疫组织化学仪操作,切片常规脱蜡,水化,常温阻断,抗原枸橼酸盐热修复,一抗室温孵育60 min,二抗室温孵育15 min,二氨基联苯胺(DAB)显色,苏木素复染、常规脱水,透明中性树胶封片。一抗包括ER(工作浓度1:50)、PR(工作浓度1:50)、E-cadherin(工作浓度 1:150),购自福建迈新生物技术有限公司;Her-2(工作浓度1:100)、Nestin(工作浓度1:100)、CD133(工作浓度1:100),购自北京中杉金桥生物技术有限公司。DS9800(LEICA)为二抗,购自上海誉源医疗设备有限公司。用已知阳性切片作阳性对照,磷酸盐缓冲液(PBS)代替一抗作阴性对照Envision二步法。
1.3 阳性判读标准
1.3.1 Nestin和CD133阳性结果 Nestin阳性表达为胞浆出现棕黄色,使用阳性细胞占肿瘤细胞百分比的方法分析结果,标准如下:Nestin阳性细胞百分比<1%判读为阴性;Nestin阳性细胞百分比≥1%判读为阳性[6]。CD133阳性表达为胞膜出现棕黄色,使用阳性细胞数分析结果,选取4个阳性范围最大的高倍视野(×400倍),计数约200个细胞,CD133阳性细胞数>10%判读为阳性,≤10%判读为阴性[7]。
1.3.2 ER、PR判读标准[8]肿瘤细胞胞核有棕黄色颗粒为阳性,阳性细胞数少于10%为阴性,阳性细胞数大于10%判定为ER、PR阳性。
1.3.3 Her-2判读结果 按照ASCO临床实践指南推荐的评分系统[9]:肿瘤细胞环绕胞膜有棕黄色颗粒为阳性,未观察到着色或≤10%的肿瘤细胞呈现不完整着色为阴性;>10%的肿瘤细胞呈现不完整的着色或≤10%的肿瘤细胞呈现完整着色判读为++;>10%的肿瘤细胞呈现完整着色判读为+++。我们在实验中将染色结果3++才判定为阳性。
1.3.4 E-cadherin判读标准[10]肿瘤细胞胞核有棕黄色颗粒为阳性,≤50%判读为阴性,>50%判读为阳性。
1.4 统计学方法 应用SPSS统计软件(Version 19.0,Chicago,IL,USA)进行数据分析,计数资料以百分比(%)表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
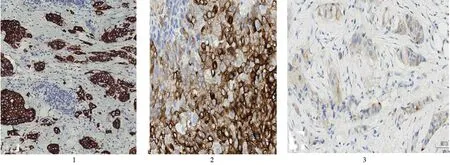
图1 乳腺癌细胞完整环绕胞膜出现棕黄色颗粒为Her-2阳性,Envision二步法(×100);图2 乳腺癌细胞胞浆出现棕黄色颗粒为Nestin阳性,Envision二步法(×200);图3 乳腺癌细胞胞膜出现突出于背景的棕黄色颗粒为CD133阳性,Envision二步法(×200)
2 结果
2.1 临床特征 67例乳腺癌患者年龄36~92岁,平均64岁。三阴性乳腺癌21例,非三阴性乳腺癌46例。其中Her-2阳性患者12例,Her-2阳性表达为环周膜染色(图1)。
2.2 Nestin和CD133在乳腺癌中的表达 免疫组织化学染色显示Nestin阳性表达为细胞胞浆出现棕黄色颗粒(图2)。Nestin在乳腺癌、三阴性乳腺癌和非三阴性乳腺癌中的阳性率分别为73.13%(49/67)、90.48%(19/21)、65.22%(30/46),Nestin在三阴性乳腺癌和非三阴性乳腺癌中阳性率比较差异无统计学意义(P>0.05)。免疫组织化学染色显示CD133阳性表达为细胞膜出现突出于背景的棕黄色(图3)。CD133在乳腺癌、三阴性乳腺癌和非三阴性乳腺癌中的阳性率 分 别 为 40.30%(27/67)、71.43%(15/21)、26.09%(12/46),CD133在三阴性乳腺癌和非三阴性乳腺癌中阳性率比较差异有显著统计学意义(P<0.01)。
2.3 乳腺癌中Nestin和CD133的表达与E-cadherin的关系 Nestin在E-cadherin阳性组和E-cadherin阴性组中的阳性率分别为60.47%(26/43)和95.83%(23/24),两组间比较差异具有显著统计学意义(P<0.01)。CD133在 E-cadherin阳性组和 E-cadherin阴性组中的阳性率分别为30.23%(13/43)和58.33%(14/24),两组间比较差异具有统计学意义(P<0.05)。
3 讨论
近年来的研究表明,EMT和获得干细胞表型之间似乎存在某种关联,并形成了一个假设,即发生了EMT的肿瘤细胞通过获得了类似于干细胞的自我更新的能力,同时表达干细胞标记[2]。人体乳腺组织中显示存在表达干细胞标记Nestin的细胞,有研究在人体乳腺组织中分离出Nestin阳性的干细胞[11]。我们在实验中,同样观察到Nestin阳性的肿瘤细胞,其73.13%的阳性率远远高于传统的乳腺癌干细胞标记CD44+/CD24-/low 58.7%[12]的阳性率。Nestin在乳腺癌中的表达率较高,或许可以作为一个较敏感的乳腺癌干细胞标记。
Wright等[13]从乳腺癌细胞系中分选出表达CD133标记的细胞亚群,这些细胞较不表达CD133的细胞具有更高的克隆能力和增殖活性,接种于免疫缺陷小鼠后具有更高的肿瘤形成能力,提示表达CD133的乳腺癌细胞具有肿瘤干细胞的特性。本实验中干细胞标记CD133阳性率为40.30%,与传统乳腺癌干细胞标记阳性率相近,但其三阴性乳腺癌中的阳性率较非三阴性乳腺癌高。本研究与Lehmann等[14]的研究结果相似,他们通过对587例三阴性乳腺癌患者的基因分析,发现三阴性乳腺癌特异性表达干细胞标记。在三阴性乳腺癌中,特异性表达CD133的癌细胞或许是乳腺癌干细胞。
有研究者发现肿瘤细胞可以通过EMT获得干细胞样特征,Salnikov等[15]在胰腺肿瘤中发现,低氧刺激细胞发生EMT,而发生EMT的细胞在干细胞标记高表达的细胞中比例较高。高表达干细胞标记的细胞,低表达或是不表达上皮标记E-cadherin[15]。我们在乳腺癌组织中也发现同样的现象,在本实验中,CD133、Nestin在E-cadherin阴性组中的阳性率均高于E-cadherin阳性组。发生EMT的肿瘤组织,细胞失去极性,出现E-cadherin表达的缺失。干细胞标记CD133、Nestin在发生EMT的乳腺癌组织中表达率更高,提示乳腺癌组织表达干细胞表型可能与肿瘤组织发生EMT有关。
Zhao等[16]发现,通过敲除Nestin基因,能明显上调E-cadherin的表达,同时逆转肿瘤细胞的EMT过程。Nestin在乳腺癌中的表达率较高,通过抑制Nestin的表达来逆转乳腺癌细胞的EMT过程,或许可以成为靶向干细胞治疗乳腺癌的新方向。而CD133在三阴性乳腺癌表达率较高,抑制CD133的表达,或许可以为三阴性乳腺癌的治疗提供新方向。
综上所述,Nestin可以用来特异性检测乳腺癌干细胞的表达,而CD133可以用于特异性检测三阴性乳腺癌中干细胞的表达。干细胞标记CD133、Nestin在发生EMT的乳腺癌组织中表达率更高,提示肿瘤细胞可以通过EMT获得干细胞样特征。通过抑制Nestin的表达可能可以逆转乳腺癌的EMT过程,成为乳腺癌靶向干细胞治疗的新方向。三阴性乳腺癌目前尚无相关靶向治疗药物,因此抑制三阴性乳腺癌中CD133的表达或许可以成为三阴性乳腺癌靶向治疗的新方向。
[1] Cavallaro U,Schaffhauser B,Christofori G.Cadhefins and the tumour progression:is it all in a switch?[J].Cancer Lett,2002,176(2):123-128.
[2]Mani SA,Guo W,Liao MJ,et al.The epithelial—mesenehymal transition generates cells with properties of stem cells[J].Cell,2008,133(4):704-715.
[3]Ricardo S,Vieira AF,Gerhard R,et al.Breast cancer stem cell markers CD44,CD24 and ALDH1:expression distribution within intrinsic molecular subtype[J].J Clin Pathol,2011,64(11):937-946.
[4]Ishiwata T,Matsuda Y,Naito Z,et al.Nestin in gastrointestinal and other cancers:effects on cells and tumor angiogenesis[J].World J Gastroenterol,2011,17(4),409-418.
[5]Shmelkov SV,St Clair R,Lyden D,et al.AC133/CD133/Prominin-1[J].Int J Biochem Cell Biol,2005,37(4):715-719.
[6]Parry S,Savage K,Marehio C,et al.Nestin is expressed in basal-like and triple negative breast cancers[J].J Clin Pathol,2008,61(9):1045-1050.
[7]Hilbe W,Dirnhofer S,Oberwasserlechner F,et al.CD133 positive endothelial progenitor cells contribute to the tumour vasculature in non-small cell lung cancer[J].J Clin Pathol,2004,57(9):965-969.
[8]Helin HJ,Helle MJ,Kallioniemi OP,et al.Immunohistochemical determination of estrogen and progesterone receptors in human breast carcinoma.Correlation with histopathology and DNA flow cytometry[J].Cancer,1989,63(9):1761-1767.
[9]Wolff AC,Hammond ME,Hicks DG,et al.Recommendations for human epidermal growth factor receptor 2 testing in breast cancer:American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update[J].J Clin Oncol,2013,31(31):3997-4013.
[10]Mahler-Araujo B,Savage K,Parry S,et al.Reduction of E-cadherin expression is associated with non-lobular breast carcinomas of basal-like and triple negative phenotype[J].J Clin Pathol,2008,61(5):615-620.
[11]Richter A,Nissen N,Mailänder P,et al.Mammary gland-derived nes-tin-positive cell populations can be isolated from human male and female donors[J].Stem Cell Res Ther,2013,4(4):78.
[12]Mylona E,Giannopoulou I,Fasomytakis E,et al.The clinicopathologic and prognostic significance of CD44+/CD24-/low and CD44-/CD24+tumor cells in invasive breast carcinomas[J].Hum Pathol,2008,39(7):1096-1102.
[13]Wright MH,Calcagno AM,Salcido CD,et al.Brca1 breast tumors contain distinct CD44+/CD24-and CD133+cells with cancer stem cell characteristics[J].Breast Cancer Res,2008,10(1):R10.
[14]Lehmann BD,Bauer JA,Chen X,et al.Identification of human triple-negative breast cancer subtypes and preclinical models for selection of targeted therapies[J].J Clin Invest,2011,121(7):2750-2767.
[15]Salnikov AV,Liu L,Platen M,et al.Hypoxia induces EMT in low and highly aggressive pancreatic tumor cells but only cells with cancer stem cell characteristics acquire pronounced migratory potential[J].PLoS One,2012,7(9):e46391.
[16]Zhao Z,Lu P,Zhang H,et al.Nestin positively regulates the Wnt/β-catenin pathway and the proliferation,survival and invasiveness of breast cancer stem cells[J].Breast Cancer Res,2014,16(4):408.
Relations between the expression of CD133,Nestin in breast cancer and epithelial-mesenchymal transition.
HUANG Si-nian1,CHENG Mei-hong1,TAN Yun-shan2,YAO Jun-xia1,JING Hong-yan1.1.Department of Pathology,Qingpu branch,Zhongshan Hospital Affiliated to Fudan University,Shanghai 201700,CHINA;2.Department of Pathology,Zhongshan Hospital Affiliated to Fudan University,Shanghai 200032,CHINA
Objective To investigate the Nestin and CD133 expression in breast tumors and analyze the relationship between them and epithelial-mesenchymal transition(EMT).Methods A total of 67 samples of breast cancer were collected from Qingpu branch,Zhongshan Hospital Affiliated to Fudan University from January 2010 to June 2013.Immunohistochemical staining was performed on these samples.Results Nestin expression was observed in 73.13%(49/67)cases.CD133 expression was observed in 40.30%(27/67)cases.Nestin expression in the triple-negative breast cancers was observed in 90.48%(19/21)cases,and Nestin expression in the other cancers was observed in 65.22%(30/46)cases,there was no significant difference between them(P>0.05).CD133 expression in the triple-negative breast cancers was observed in 71.43%(15/21)cases,and CD133 expression in the other cancers was observed in 26.09%(12/46)cases,there was significant difference between them(P<0.01).The expression rates of Nestin and CD133 in the E-cadherin-negative breast cancers were 95.83%(23/24)and 58.33%(14/24),which was significantly higher than 60.47%(26/43)and 30.23%(13/43)in the E-cadherin-positive breast cancers(P<0.01).Conclusion Nestin might be a new sensitive marker for breast cancer stem cells.CD133 might be a new special marker for breast cancer stem cells.The higher expression of Nestin and CD133 in breast cancers that undergo EMT,which have demonstrated an association between EMT and acquisition of stem cells phenotype.
Breast cancer;Triple-negative breast cancers;Nestin;CD133;Epithelial-mesenchymal transition(EMT)
R737.9
A
1003—6350(2017)19—3099—04
10.3969/j.issn.1003-6350.2017.19.002
上海市青浦区科委基金(编号:青科发2011-34)
程美红。E-mail:45087556@qq.com
2017-04-10)

