新疆春小麦品种(系)抗白粉病基因的分子检测
高海峰,白微微,刘恩良,赵海燕,李广阔*,张 航,曾潮武
(1.新疆农业科学院 植物保护研究所/农业部西北荒漠绿洲作物有害生物综合治理重点实验室/农业部库尔勒作物有害生物科学观测实验站,新疆 乌鲁木齐 830091; 2.新疆农业科学院 粮食作物研究所,新疆 乌鲁木齐 830091)
新疆春小麦品种(系)抗白粉病基因的分子检测
高海峰1,白微微1,刘恩良2*,赵海燕1,李广阔1*,张 航1,曾潮武2
(1.新疆农业科学院 植物保护研究所/农业部西北荒漠绿洲作物有害生物综合治理重点实验室/农业部库尔勒作物有害生物科学观测实验站,新疆 乌鲁木齐 830091; 2.新疆农业科学院 粮食作物研究所,新疆 乌鲁木齐 830091)
通过苗期抗性鉴定和抗病基因的分子标记检测,筛选对小麦白粉病具有抗性的春小麦品种(系),明确Pm4、Pm8和Pm21在新疆春小麦品种(系)中的分布现状,为新疆春小麦品种的合理布局及抗白粉病品种的选育提供依据。苗期抗性鉴定结果表明,新春38号和366S表现出抗性,高抗植株与中感植株的比率为2∶1,新春12号、新春15号、新春18号等29个小麦品种(系)对小麦白粉病均表现为高感。分子标记检测结果表明,新春27号、1354和1360含有Pm4基因;983-S、MJ307、HMJ555和1112含有Pm8基因;366S含有Pm21基因。采用苗期抗性鉴定和分子标记检测相结合的方法,可大大提高抗白粉病品种鉴定的准确性。
春小麦; 新疆; 小麦白粉病; 抗病基因; 分子标记
由专性寄生菌Blumeriagraminisf.sp.tritici引起的小麦白粉病是一种典型的气传病害,也是我国小麦主产区发生范围和危害程度最大的小麦病害之一,在新疆各地均有发生,近年来,受菌源变异、气候、栽培条件等因素影响,其危害愈发严重,发病时产量损失达5%~34%[1-4]。种植抗病品种是防治小麦白粉病最经济、有效的措施,但品种的单一性种植会对白粉菌群体产生定向化选择,往往导致品种抗性的丧失[5-7]。明确新疆春小麦品种(系)中抗白粉病基因,对抗病育种、品种的合理利用和布局及小麦白粉病的防治具有重要的意义。近年来,由于分子标记技术具有快速、准确和不受环境条件限制等优点被广泛应用于抗病基因的鉴定工作中[8],迄今为止,已有70多个小麦主效抗白粉病基因被正式定名[9]。很多学者利用特异性引物对全国各地的小麦种质资源进行了抗白粉病基因Pm4、Pm8和Pm21的分子检测[8,10-18]。本研究拟利用小麦抗病基因Pm4(STS标记)、Pm8(STS标记)和Pm21(SSR标记)的分子标记,对新疆春小麦生产品种、区试品系及高代品系进行检测,旨在明确新疆春小麦品种(系)中抗白粉病基因的分布现状,为指导抗病育种、品种的合理利用和布局及小麦白粉病的防治提供理论依据。
1 材料和方法
1.1试验材料
供试小麦生产品种、区试品系及高代品系共31份,其中新春12号、新春15号、新春18号、新春27号、新春29号、新春31号、新春33号、新春37号、新春38号、新春43号为育成品种;0721-1、983-S、1142、1201、1242为新疆区试品系;1112、1229、1245、1309、1330、1346、1352、1354、1357、1360为自育高代品系;HMJ555、MJ307、10H4670、HJ29为宁夏引进品系;Y-20为加拿大引进品系;366S为河南引进杂交品系。以上品种(系)由新疆农业科学院粮食作物研究所和核技术生物技术研究所提供。阳性对照Kavkaz(Pm8)、Armada(Pm4)、Khapli/8cc(Pm4)、南农9918(Pm21)及阴性对照Chancellor由中国农业科学院植物保护研究所麦类真菌病害课题组提供。
1.2供试菌株
小麦白粉病菌(Blumeriagraminisf.sp.tritici)采自新疆昌吉州军户农场试验站试验田,在新春6号上繁殖保存。
1.3苗期接菌及抗性鉴定
将小麦品种(系)播种于56 cm×32 cm×18 cm的塑料方盒内,以感病品种新春6号为对照,放在20 ℃的光照培养箱中培养,待第1片叶完全展开后,用抖接法充分接种小麦白粉病菌分生孢子,待感病品种充分发病后(接种后8~10 d),按司权民等[19]的方法,调查记载病情(表1)。

表1 苗期抗性反应型分级标准
1.4抗病基因的分子检测
小麦种子在室温下发芽,两叶一心期,剪取叶片按CTAB法[20]提取基因组DNA。用于检测Pm4、Pm8和Pm21基因的分子标记信息见表2,所用引物序列均由上海生工生物工程有限公司合成。反应体系为20.0 μL,含有2×TaqPCR Master Mix 10.0 μL,正向引物、反向引物、DNA模板各1.0 μL,ddH2O 7.0 μL。扩增程序为:94 ℃预变性5 min;94 ℃变性45 s,退火温度(视不同引物而定)45 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min,4 ℃保存。扩增产物用1.0%或2.0%的琼脂糖凝胶电泳检测。

表2 用于检测小麦抗白粉病基因的分子标记及其引物序列
2 结果与分析
2.1供试春小麦品种(系)苗期抗性鉴定
苗期接菌法抗性鉴定结果(表3)表明,新春38号和366S对小麦白粉病表现出抗性,HR∶MS=2∶1,推测其含有抗病基因;新春2号、新春6号和新春10号等29个品种(系)对小麦白粉病表现为高感。

表3 春小麦品种(系)苗期抗性鉴定结果
2.2供试春小麦品种(系)抗白粉病基因的分子检测
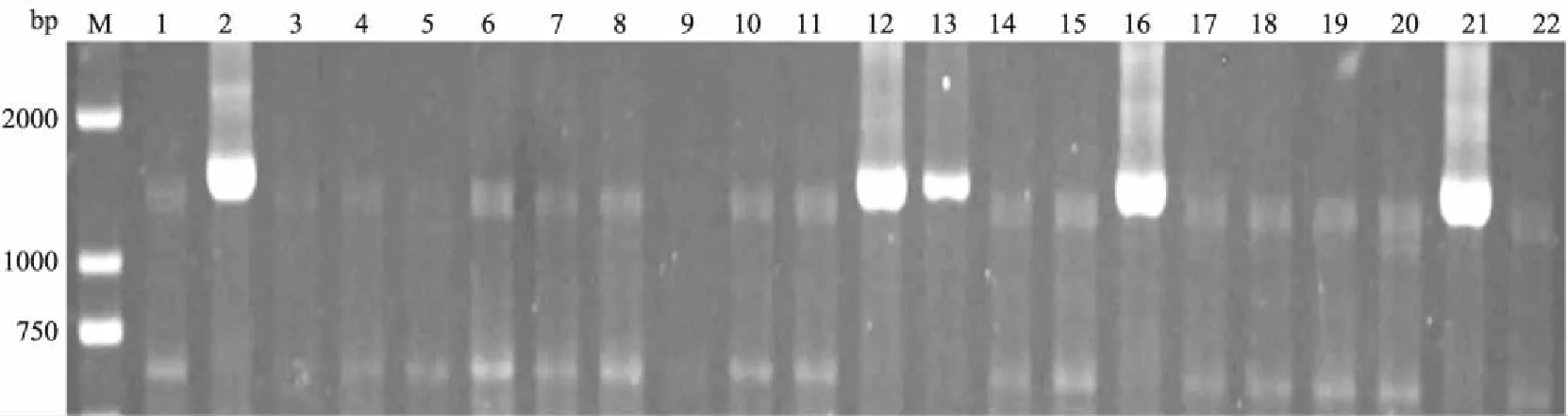
2.2.1Pm4基因的分子标记检测 利用与Pm4紧密连锁的分子标记R1/C1对31份春小麦品种(系)进行了检测,以Armada(Pm4)和Khapli/8cc(Pm4)为阳性对照,以Chancellor为阴性对照。结果表明,新春27号、1354和1360 能扩增出470 bp的特异条带,与Armada(Pm4)和Khapli/8cc(Pm4)的特征带相同,表明这些品系可能含有Pm4,占供试品系的9.68%;新春12号、新春15号、新春18号等28个小麦品种(系)不能扩增出与Armada(Pm4)和Khapli/8cc(Pm4)相同的特征带,表明这些品种(系)不含Pm4(图1,表4)。

M:D2000;1:Chancellor;2:Armada; 3:Khapli/8cc;4:新春12号;5:新春15号;6:新春18号;7:新春29号;8:新春31号; 9:新春33号;10:新春37号;11:新春38号;12:1309;13:983-S;14:MJ307;15:1360;16:新春43号; 17:HMJ555;18:366S;19:HJ29;20:新春27号;21:1346;22:1112
表4 春小麦品种(系)抗白粉病基因Pm4、Pm8和Pm21的分子标记检测结果
注:分子检测具有和不具有被测基因分别用“+”和“—”表示。
2.2.2Pm8基因的分子标记检测 利用黑麦染色质特异性引物AF1/AF4,以Kavkaz(Pm8)为阳性对照,以Chancellor为阴性对照,对31份春小麦品种(系)进行了检测。结果表明,983-S、MJ307、HMJ555和1112能扩增出1.5 kb的特异DNA片段(图2),与Kavkaz(Pm8)的特征带相同,表明这些品系可能含有Pm8,占供试品种(系)的12.90%;新春12号、新春15号、新春18号等27个小麦品种(系)不能扩增出与Kavkaz(Pm8)相同的特征带,表明这些品种(系)不含Pm8(表4)。
2.2.3Pm21基因的分子标记检测 利用与Pm21紧密连锁的分子标记WS-1 F/R对31份春小麦品种(系)进行了检测,以南农9918(Pm21)为阳性对照,以Chancellor为阴性对照。结果表明,366S能扩增出949 bp的特异条带(图3),与南农9918(Pm21)的特征带相同,表明该品系可能含有Pm21,占供试品种(系)的3.23%;新春12号、新春15号、新春18号等30个小麦品种(系)不能扩增出与南农9918(Pm21)相同的特征带,表明这些品种(系)不含Pm21(表4)。
M:D2000;1:Chancellor;2:Kavkaz;3:新春12号;4:新春15号;5:新春18号;6:新春29号;7:新春31号;8:新春33号; 9:新春37号;10:新春38号;11:1309;12:983-S;13:MJ307;14:1360;15:新春43号;16:HMJ555; 17:366S;18:HJ29;19:新春27号;20:1346;21:1112;22:1201

M:D2000;1:Chancellor;2:南农9918;3:新春12号;4:新春15号;5:新春18号;6:新春29号;7:新春31号;8:新春33号; 9:新春37号;10:新春38号;11:1309;12:983-S;13:MJ307;14:1360;15:新春43号;16:HMJ555; 17:366S;18:HJ29;19:新春27号;20:1346;21:1112;22:1201
3 结论与讨论
近年来,新疆小麦白粉病的发生呈加重趋势。研究表明,2012年核桃小麦间作和红枣小麦间作小麦白粉病病情指数最高时分别达到46.67和40.00,2013年病情指数最高时分别为39.22和36.67[21]。新疆小麦品种(系)抗白粉病鉴定结果表明,在68份供试品种(系)中,新疆冬小麦生产品种对小麦白粉病全部表现为高感[22],这严重威胁着新疆小麦安全生产。因此,本研究又对31份春小麦生产品种、区试品系、高代品系进行了抗白粉病研究,结果发现,在10份春小麦品种中,只有新春38号表现出抗性,且抗病植株与感病植株的比率为2∶1,其余9个品种均表现为高感;5个参加区试的品系和10个自育高代品系在苗期对小麦白粉病均表现为高感;只有引进的杂交品系366S表现出抗性,且抗病植株与感病植株的比率为2∶1。
据报道,新疆小麦品系新紫1号和14/8329对小麦白粉病表现为抗病[22],对其抗病基因进行分子鉴定发现,新紫1号和14/8329均含有Pm4[8]。Pm4在20世纪90年代开始被应用于抗病育种中,至今仍在使用。Pm8抗病基因曾被广泛应用于抗病育种中,但由于大面积单一种植含Pm8基因的小麦品种,会对小麦白粉菌群体产生定向化选择,导致品种抗性的丧失,1990—1991年我国小麦白粉病大流行的一个原因就是Pm8基因抗病性的丧失[23]。抗病基因Pm21对小麦白粉病具有持久和广谱抗性,20世纪80年代选育出的贵农21、贵农22等一系列材料对小麦白粉病具有较好的抗性,经分子标记检测证实,贵农21、贵农22含有的抗病基因为Pm21,被广泛应用于贵州、四川盆地和陇南等地小麦育种中[17]。本研究对31个春小麦品种(系)进行了抗病基因分子检测,发现新春27号、1354和1360含有抗病基因Pm4,占供试品种(系)的9.68%;983-S、MJ307、HMJ555和1112含有抗病基因Pm8,占供试品种(系)的12.90%;366S含有抗病基因Pm21,占供试品种(系)的3.23%。
本研究中,新春27号、1354和1360虽含有抗病基因Pm4,但在苗期抗病性鉴定中发现这3个品种(系)对小麦白粉病均表现为感病,这可能是由于Pm4抗性基因的长期使用,导致小麦白粉病菌对Pm4毒性频率上升,据报道,2005、2006、2007、2008年度其毒性频率分别为8.37%、29.01%、20.68%和25.10%[24],因此在生产上注意慎用。983-S、MJ307、HMJ555和1112含有抗病基因Pm8,但在苗期抗病性鉴定中发现这4个品系对小麦白粉病均表现为感病,表明Pm8在新疆小麦生产上已丧失抗病性。当前对小麦白粉病仍具较好抗性的Pm21基因在新疆春小麦主栽品种中分布较少,因此在今后育种中应加强Pm21的利用。新春38号对小麦白粉病表现出抗性,高抗植株与中感植株的比率为2∶1,但其不含抗性基因Pm4、Pm8和Pm21,因此,在以后的工作中应进一步明确新春38号含有的抗性基因。
[1] Bennett F G A.Resistance to powdery mildew in wheat:A review of its use in agriculture and breeding programmes[J].Plant Pathology,1984,33:279-300.
[2] 高海峰,努尔孜亚·亚力买买提,李广阔,等.几种杀菌剂对小麦白粉病的防治效果[J].新疆农业科学,2013,50(7):1260-1264.
[3] 陈卫民,郭文超,焦子伟,等.伊犁河谷小麦主要病害发生种类、分布危害与防治策略[J].新疆农业科学,2007,44(S1):124-126.
[4] 胡锐,邢彩云,吴营昌,等.11个优质小麦品种对小麦白粉病抗性的初步鉴定[J].河南农业科学,2011,40(5):108-110.
[5] Wolfe M S,Schwarzbach E.Patterns of race changes in powdery mildews[J].Annual Review of Phytopathology,1978,16(1):159-180.
[6] 曹学仁,周益林,段霞瑜,等.我国主要麦区101个小麦品种(系)的抗白粉病基因推导[J].麦类作物学报,2010,30(5):948-953.
[7] 李强,王保通,吴兴元,等.陕西省小麦抗白粉病基因及新育成小麦品种(系)抗白粉病分析[J].植物保护学报,2008,35(5):438-442.
[8] 高海峰,范洁茹,周益林,等.小麦品种(系)抗白粉病基因推导及分子标记鉴定[J].植物病理学报,2017,47(3):370-379.
[9] 曹廷杰,陈永兴,李丹,等.河南小麦新育成品种(系)白粉病抗性鉴定与分子标记检测[J].作物学报,2015,41(8):1172-1182.
[10] 刘兵,李绍慧,王永强,等.我国主要小麦推广品种抗白粉病基因的分子检测[J].植物保护学报,2010,37(2):113-117.
[11] 胡娜,王永玖,黄琼瑞,等.小麦抗白粉病基因的分子标记检测及其抗性评价[J].分子植物育种,2009,7(6):1093-1099.
[12] 董建力,张增艳,王敬东,等.3种小麦抗白粉病基因聚合体的STS和SCAR标记[J].西北农业学报,2007,16(3):64-67.
[13] 王竹林,王艺桦,刘联正,等.小麦抗白粉病基因Pm4的分子标记辅助育种研究[J].麦类作物学报,2011,31(5):819-823.
[14] 王俊美,柴春月,刘红彦,等.小麦抗白粉病基因Pm4三个STS标记的实用性分析[J].河南农业科学,2005(4):38-41.
[15] 雷秀玉,杜金友,孙果忠.小麦品种(系)的白粉病抗性鉴定及分子标记的实用性评价[J].麦类作物学报,2015,35(1):37-44.
[16] 桑大军,许为钢,胡琳,等.河南省小麦品种白粉病抗性基因的分子鉴定及分子标记辅助育种[J].华北农学报,2006,21(1):86-91.
[17] 王峥,王琪琳,吴建辉,等.基于基因特异性标记分析Pm21在中国冬小麦品种(系)中的分布[J].中国农业科学,2014,47(11):2078-2087.
[18] 董娜,李淦,张亚娟,等.354份小麦种质资源抗白粉病基因Pm21和Pm13的分布研究[J].植物保护,2015,41(5):164-168.
[19] 司权民,张新心,段霞渝,等.小麦抗白粉病品种的基因分析与归类研究[J].植物病理学报,1992,22(4):349-355.
[20] Hill-Ambroz K L,Brown-Guedira G L,Fellers J P,etal.Modified rapid DNA extraction protocol for high throughput microsatellite analysis in wheat[J].Crop Science,2002,42:2088-2091.
[21] 高海峰,赵海燕,刘恩良,等.新疆喀什地区不同种植模式下小麦白粉病田间消长规律研究[J].新疆农业科学,2016,53(10):1823-1828.
[22] 高海峰,白微微,刘恩良,等.新疆小麦品种(系)对小麦白粉病抗性的初步鉴定[J].新疆农业科学,2015,52(12):2259-2263.
[23] 李洪杰,王晓鸣,宋凤景,等.中国小麦对白粉病的抗性反应与抗病基因检测[J].作物学报,2011,37(6):943-954.
[24] 曹学仁,周益林,段霞渝,等.我国主要麦区101个小麦品种(系)的抗白粉病基因推导[J].麦类作物学报,2010,30(5):948-953.
Molecular Detection of Powdery Mildew Resistant Genes of Spring Wheat Varieties(Lines) in Xinjiang
GAO Haifeng1,BAI Weiwei1,LIU Enliang2*,ZHAO Haiyan1,LI Guangkuo1*,ZHANG Hang1,ZENG Chaowu2
(1.Institute of Plant Protection,Xinjiang Academy of Agricultural Sciences/Key Laboratory of Integrated Pest Management on Crop in Northwestern Oasis,Ministry of Agriculture/Scientific Observing and Experimental Station of Korla,Ministry of Agriculture,Urumqi 830091,China; 2.Institute of Grain Crop,Xinjiang Academy of Agricultural Sciences,Urumqi 830091,China)
The present study was conducted to screen spring wheat cultivars(lines) which had resistance to wheat powdery mildew,and to define the distribution ofPm4,Pm8 andPm21 in the spring wheat varieties(lines) in Xinjiang by seedling resistance identification and molecular markers detection of wheat resistance genes,so as to provide the basis for cultivar deployment and disease resistance breeding.The results showed that Xinchun No.38 and 366S showed resistance to wheat powdery mildew by wheat seedling resistance identification,and the ratio of high resistant plants to middle sensitive plants was 2∶1.Twenty nine wheat cultivars(lines) such as Xinchun No.12,Xinchun No.15,and Xinchun No.18 showed high sensitivity to wheat powdery mildew.Pm4 was detected in Xinchun No.27,1354 and 1360.Pm8 was detected in 983-S,MJ307,HMJ555 and 1112.Pm21 was detected in 366S.The combination of seedling resistance identification and molecular markers detection of wheat resistance genes can greatly improve the identification accuracy of wheat cultivars(lines) resistant to powdery mildew.
spring wheat; Xinjiang; wheat powdery mildew; resistant gene; molecular marker
S435.121
A
1004-3268(2017)10-0076-05
2017-04-18
新疆维吾尔自治区自然科学基金(2016D01B045)
高海峰(1983-),男,河南商水人,助理研究员,硕士,主要从事粮食作物病害研究。E-mail:ghf20044666@163.com
*通讯作者:李广阔(1973-),男,河南夏邑人,副研究员,硕士,主要从事农作物病虫草害防治研究。E-mail:1448832764@qq.com 刘恩良(1984-),男,甘肃天水人,助理研究员,主要从事小麦及甘薯栽培育种研究。E-mail:liuenliang_513@163.com

