拟南芥响应NO突变体的筛选及遗传分析
夏金婵,张小莉
(河南中医药大学,河南 郑州 450008)
拟南芥响应NO突变体的筛选及遗传分析
夏金婵,张小莉*
(河南中医药大学,河南 郑州 450008)
从甲基磺酸乙酯(EMS)诱变获得的拟南芥突变体库中筛选对一氧化氮(NO)胁迫敏感的突变体,以期为研究信号分子NO在植物中的分子调控机制提供遗传材料。从EMS诱变获得的拟南芥突变体库中筛选得到1株对NO敏感的突变体nsm1(nitric oxide sensitive mutant 1),在正常生长条件下,突变体nsm1与野生型拟南芥的表型并没有明显区别,但是对NO胁迫的敏感性明显高于野生型拟南芥,在50 μmol/L SNP(NO供体)处理下,野生型拟南芥的相对根长(与在正常生长的根长比值)为50.8%,而突变体nsm1的相对根长为22.4%。进一步研究发现,突变体nsm1对甘露醇模拟的干旱胁迫敏感,在100 mmol/L甘露醇处理下,野生型拟南芥的相对根长为83.4%,而突变体nsm1的相对根长仅为45.7%,这可能与突变体nsm1的失水率、水势、气孔导度和蒸腾速率高于野生型拟南芥有关。遗传学分析表明,该突变体为单基因隐性突变。
拟南芥; 一氧化氮; 突变体nsm1; 干旱
干旱严重影响植物的生长和发育,限制农作物的产量[1-2]。全球干旱和半干旱区约占世界陆地总面积的1/3,据统计,全球每年因干旱导致的作物减产高达20%。我国干旱缺水地区面积约占我国国土面积的1/2。因此,研究植物抗旱的分子调控机制对提高农作物的产量具有重要的理论与现实意义[3-5]。一氧化氮(NO)作为信号分子或生长调节物质,参与调节植物的生长发育过程,如植物开花、侧根形成、种子萌发、根向地性、下胚轴伸长以及果实等组织的成熟和衰老等,而且还参与调节植物对生物及非生物胁迫的响应过程[6-7],如在干旱胁迫下,NO能提高种子的淀粉酶活性、增加种子内促进萌发的渗透调节物质含量、诱导抗氧化基因的表达、降低质膜的透性以维持细胞的正常代谢[8]。在玉米中的研究发现,NO能提高根系中谷胱甘肽转移酶(GST)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、谷胱甘肽过氧化物酶(GPX)的活性[9]。PsbA编码类囊体膜蛋白D1蛋白(又称QB蛋白),是叶绿体基因组中重要的光合基因,在小麦中的研究发现,干旱能降低PsbA基因的表达量,而外源施加SNP(sodium nitroprusside,NO供体)能显著提高小麦叶片中PsbA基因的表达量,说明在小麦中NO可促进类囊体膜蛋白D1蛋白的合成,增强光合组织的抗旱能力[10]。
尽管人们在植物中已经发现了一些受NO调控的基因,但相对于NO对植物生长发育的整个调节网络而言还知之甚少。基于此,采用正向遗传学的方法,从甲基磺酸乙酯(EMS)诱变后的拟南芥突变体库中,通过在培养基中施加SNP观察其生长发育表型,筛选对NO敏感的突变体,并对筛选获得的潜在突变体进行详细的表型和生理分析,以期为揭示植物的NO信号网络提供遗传材料。
1 材料和方法
1.1植物材料的培养
拟南芥(Arabidopsisthaliana)野生型种子的生态型为Columbia(Col-0)。拟南芥在无菌培养皿中的培养过程为:首先将种子在1.5 mL离心管中用70%乙醇消毒30 s,再用10%~15%次氯酸钠溶液处理10~15 min,期间上下晃动离心管,用无菌水漂洗3~5次,将消毒后的拟南芥种子置于4 ℃条件下处理4 d,之后均匀种植在1/2MS培养基上,用Parafilm膜将培养皿口封好后置于16 h光照/8 h黑暗、光照强度为100 μmol/(m2·s)、温度为22 ℃条件下培养。拟南芥在营养土中的培养过程为:将拟南芥种子放在1.5 mL离心管中,添加适量水没过种子,之后将种子放在4 ℃条件下处理4 d,均匀种植在营养土上,浇水后置于16 h光照/8 h黑暗、光照强度为100 μmol/(m2·s)、温度为22 ℃条件下培养。
1.2突变体的筛选
利用EMS对拟南芥野生型种子进行诱变获得突变体库,将突变体库种子均匀撒播在含20 μmol/L SNP的灭菌的1/2MS培养基上,待种子萌发并生长至15 d时,挑选根生长相对较短的幼苗作为潜在突变体,即对NO敏感的突变体。然后将潜在突变体移至正常培养基上进行恢复生长1周,最后移至营养土中生长至成熟,收取种子。将拟南芥野生型与潜在突变体的种子分别种在营养土中,观察整个生长周期中这些突变体的株高、果荚长度、开花时莲座叶片的数量等生长发育表型,并与野生型拟南芥进行比较,将上述表型能够稳定遗传的个体作为NO敏感突变体。
1.3拟南芥突变体对NO抗性的检测
在经过灭菌的1/2MS培养基中分别添加0、10、20、30、40、50、60 μmol/L的SNP,然后将经过消毒的拟南芥野生型和突变体种子种在培养基上,统计拟南芥野生型与突变体的萌发率,生长20 d测量根长,并计算相对根长,相对根长=处理条件下的根长/在正常培养基上生长的根长×100%。
1.4拟南芥突变体对干旱胁迫的响应
采用甘露醇(渗透胁迫)模拟干旱胁迫。培养皿中甘露醇模拟干旱的处理过程为在1/2MS培养基中分别添加0、100、200 mmol/L甘露醇,之后对培养基灭菌,把经过消毒的拟南芥野生型和突变体种子种在培养基上,统计拟南芥野生型与突变体的萌发率,生长20 d测量根长,并计算相对根长。营养土中甘露醇模拟干旱的处理过程为,对在正常营养土中生长3周的拟南芥野生型和突变体nsm1植株,用300 mmol/L甘露醇溶液每周灌溉一次,3周后统计死亡率。
1.5拟南芥突变体吸水保水生理指标的测定
以在营养土中正常生长3周的拟南芥野生型与突变体植株为材料测定叶片的水势、失水速率、蒸腾速率及气孔导度。叶片水势的测定:剪取拟南芥野生型和突变体的叶片,用研磨棒磨碎后,吸取15 mL细胞液置于测量管中,用冰点渗透计(Fiske one-ten osmometer) 测定叶片水势的大小。叶片失水速率的测定:分别剪取拟南芥野生型和突变体的叶片各25片置于培养皿中,在温度22 ℃、空气湿度50%的条件下培养,隔一定的时间(1、3、5、7 h)称质量并计算叶片的失水率。叶片的蒸腾速率及气孔导度采用LI-6400便携式光合仪测定。每个试验重复3次,取平均值。
1.6突变体的遗传分析
将筛选得到的突变体M3代种子种于1/2MS培养基上,生长1周后移植于营养土中,培养至开花,以野生型Col-0为父本,突变体为母本,进行杂交,得到F1代。将野生型与F1代种子种在含有50 μmol/L SNP的1/2MS培养基上,生长20 d后,以根长为特征分别检测植株对NO的抗性表现,统计结果用于遗传分析。F1代植株自交得到F2代,将F2代种子种在含有50 μmol/L SNP的1/2MS培养基上,以根长为特征检测植株对NO的抗性表现,生长20 d后,统计对NO敏感与不敏感的植株数目,进行遗传分析。
2 结果与分析
2.1NO敏感突变体的筛选
从大约40 000粒种子的EMS突变体库中筛选获得18株候选突变体,这些突变体都不同程度地显
示出对NO敏感的表型。其中,突变体nsm1(nitric oxide sensitive mutant 1)在正常生长条件下与野生型没有明显的表型区别,生长50 d时,植株株高均可达26 cm,果荚长度均为1.52 cm,开花时莲座叶片的数量均为8~10片。根据突变体nsm1对NO抗性的检测结果发现,野生型拟南芥与突变体nsm1的萌发率没有明显区别;在正常生长条件下,野生型拟南芥与突变体nsm1的根长区别不明显,但是在SNP处理下,突变体nsm1的根生长受到的抑制程度比野生型拟南芥明显,如在50 μmol/L SNP处理下生长20 d后,野生型拟南芥的相对根长为50.8%,而突变体nsm1的相对根长仅为22.4%(图1)。这些结果表明,NSM1基因对拟南芥的正常生长发育影响不明显,但是参与了NO相关的信号传递过程。
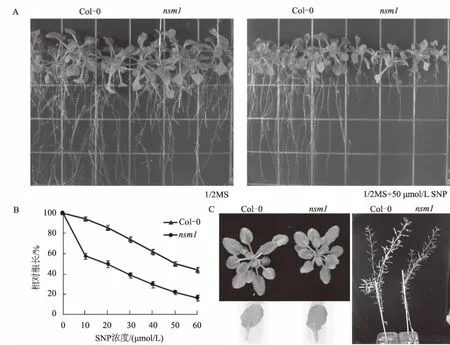
A为野生型拟南芥和突变体nsm1分别在0(左)、50(右) μmol/L SNP处理下生长20 d的表型; B为野生型拟南芥和突变体nsm1在不同浓度SNP处理下的相对根长(生长20 d); C为在正常培养基上生长的野生型拟南芥和突变体nsm1的表型
2.2突变体nsm1响应干旱胁迫的表型分析
NO作为信号分子参与植物对干旱、盐度、重金属等[11]非生物胁迫的响应过程。进一步研究发现,突变体nsm1对干旱胁迫敏感,用甘露醇模拟干旱处理检测突变体nsm1的抗性,结果显示,野生型拟南芥与突变体nsm1的萌发率没有明显区别,甘露醇对突变体nsm1根的抑制程度高于野生型拟南芥,在100 mmol/L甘露醇处理下,野生型拟南芥的相对根长为83.4%,而突变体nsm1的相对根长仅为45.7%(图2)。而且,为了进一步验证NSM1基因在抗旱反应中作用,对在营养土中生长3周的野生型拟南芥和突变体nsm1植株进行干旱处理,结果发现,野生型拟南芥的死亡率是70.2%,而突变体nsm1的死亡率为80.3%。
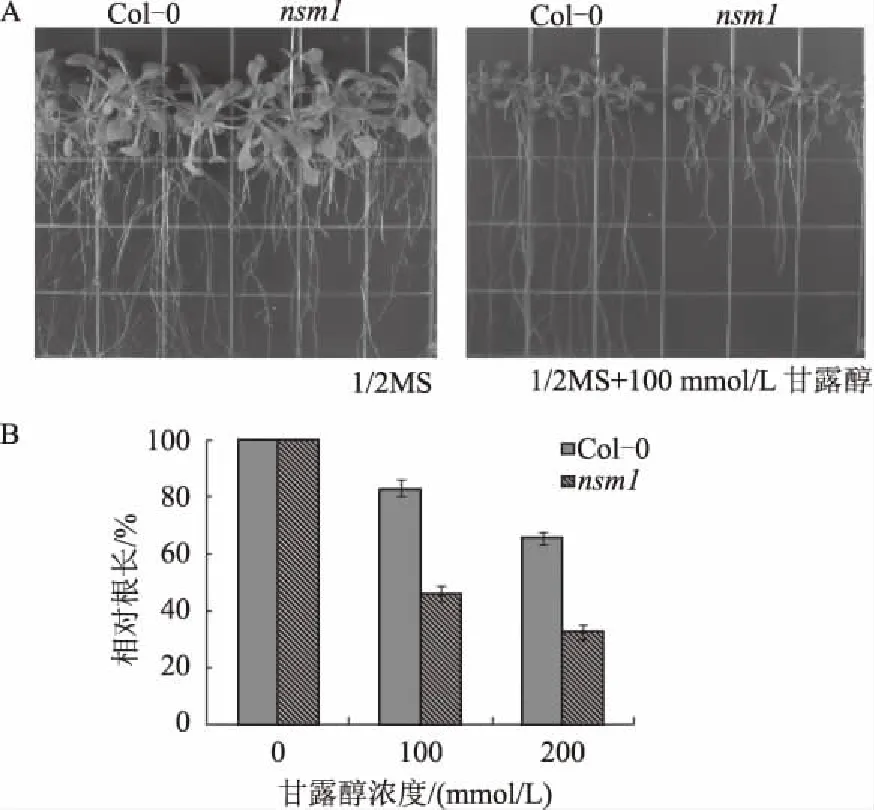
A为野生型拟南芥和突变体nsm1分别添加0(左)、100(右) mmol/L 甘露醇处理下生长20 d的表型; B.野生型拟南芥和突变体nsm1 在不同浓度甘露醇处理下的相对根长(生长20 d)
2.3野生型拟南芥和突变体nsm1的吸水保水能力比较
植物的吸水能力或保水能力在抗旱过程中起着非常重要的作用,突变体nsm1对干旱敏感的表型是否与其有一定的联系?图3表明,突变体nsm1的水势、失水率、气孔导度和蒸腾速率均高于野生型拟南芥,说明突变体nsm1的保水能力比野生型拟南芥差。
2.4突变体nsm1的遗传学分析
以突变株nsm1进行自交和杂交,检测F1和F2代对NO的抗性。结果表明,杂交成功的F1代用50 μmol/L SNP进行处理,植株的根长与野生型拟南芥无明显差异,即幼苗全部对SNP不敏感,表明NSM1基因是隐性突变基因。而F2代植株中对SNP处理敏感与不敏感的植株比例为1 850∶600,卡方检验结果表明符合孟德尔遗传分离规律(3∶1),证明nsm1突变体是由单基因控制的隐性突变体。
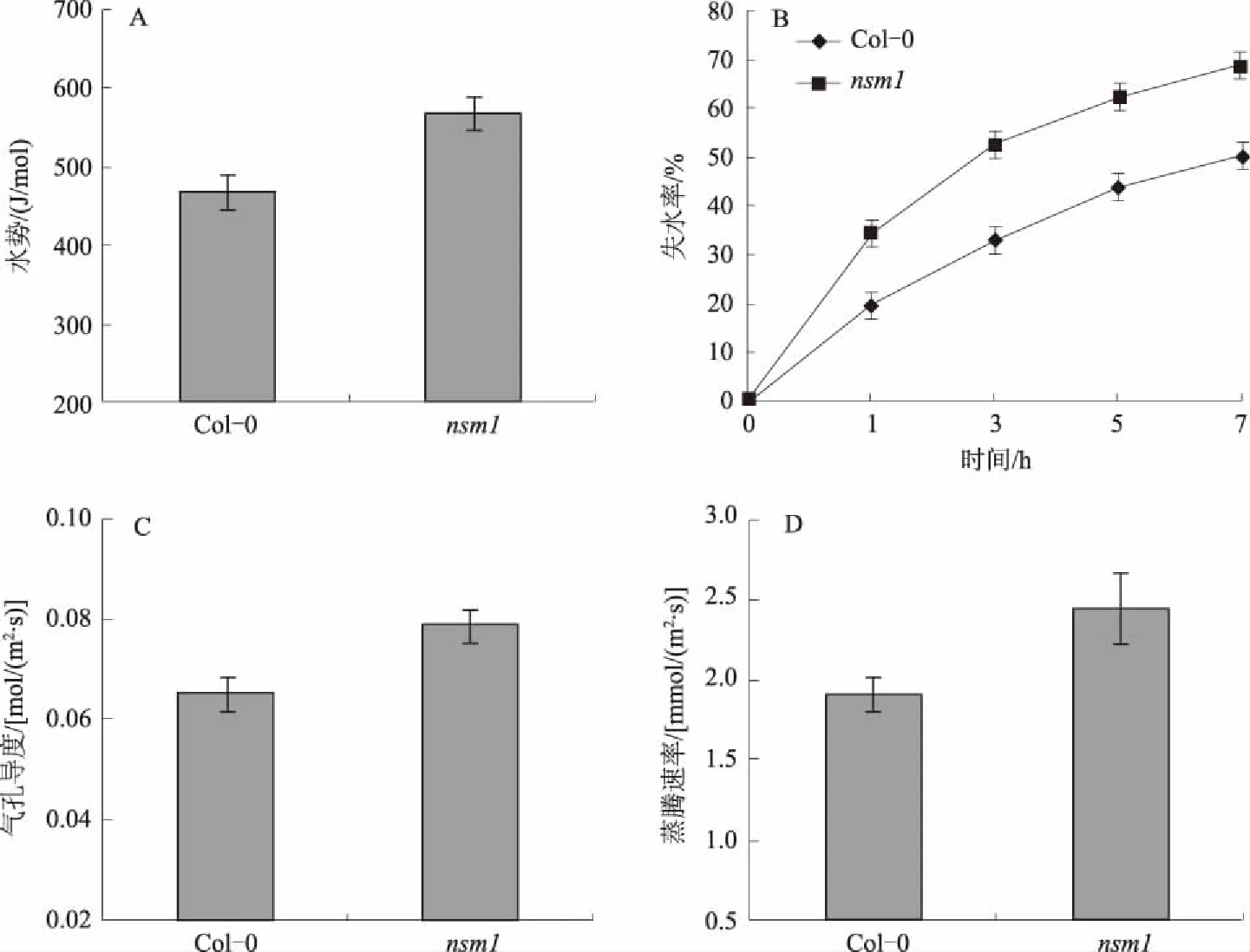
图3 正常生长3周的野生型拟南芥和突变体nsm1的生理指标
3 结论与讨论
NO作为一种信号分子,可在细胞间自由扩散,调节植物生长发育,并参与植物的抗逆反应过程[12-13]。目前的相关研究表明,NO能够有效缓解干旱胁迫对植物造成的伤害,对抗旱分子调控机制的研究也取得了一些进展[14-16]。气孔是植物与外界进行物质与能量交换的门户,气孔运动的调节能力影响植物的抗旱能力,外源NO处理小麦能够降低气孔导度与蒸腾作用,提高小麦的抗旱能力[17];干旱胁迫下NO参与ABA调节气孔运动的过程,能够诱导植物叶片气孔关闭,降低蒸腾速率,其分子机制为干旱条件下植物中NO含量增加,诱导胞内Ca2+浓度升高,从而抑制内向K+通道活性或激活外向K+通道,导致胞内K+浓度下降,气孔关闭[18-20]。刘建中等[21]研究表明,拟南芥NO合成缺陷突变体noa1的耐旱性与抗旱有关基因表达的相关性不明显。Shi等[22]研究发现,内源NO含量的升高可以激活ABA受体AtPYL5和AtPYL4的表达,该受体的过表达植株可以通过调节活性氧代谢和渗透调节物质的积累而增强植物的抗旱能力。但是,由于NO相关突变体稀少,目前对于其调控的分子机制还知之甚少。
本研究从EMS诱变获得的拟南芥突变体库中筛选到1株在NO处理下生长明显受到抑制、正常条件下与野生型生长状况并无明显区别的突变体nsm1。进一步分析发现,突变体nsm1对干旱胁迫也表现出敏感的表型,突变体nsm1的水势、失水率、气孔导度和蒸腾速率均高于野生型,说明NSM1基因可能参与了干旱胁迫与NO的信号交叉途径。遗传学分析表明,NSM1是单基因隐性突变。该突变体的获得将为研究植物干旱胁迫调控途径的分子机制提供理想的遗传材料。
[1] 袁蕊,李萍,胡晓雪,等.干旱胁迫对小麦生理特性及产量的影响[J].山西农业科学,2016,44(10):1446-1449.
[2] 刘紫娟,李萍,宗毓铮,等.干旱胁迫对糜子生理及产量的影响[J].山西农业科学,2016,44(9):1279-1283.
[3] 周义,覃志豪,包刚.气候变化对农业的影响及应对[J].中国农学通报,2011,27(32):299-303.
[4] 蔡东芳,张书芬,何俊平,等.甘蓝型油菜抗旱机制及育种研究进展[J].河南农业科学,2017,46(3):8-12.
[5] 郭莎莎,温思钰,乔亚琪,等.谷子BAS1基因生物信息学分析及其在干旱胁迫下的表达分析[J].山西农业科学,2017,45(2):151-155.
[6] Wendehenne D,Pugin A,Klessig D F,etal.Nitric oxide:Comparative synthesis and signaling in animal and plant cells[J].Trends Plant Sci,2001,6(4):177-183.
[7] 刘强,柳正葳,胡萃,等.外源一氧化氮对铝胁迫下烟草叶片呼吸作用和活性氧代谢的影响[J].河南农业科学,2017,46(1):42-47.
[8] 李江,吴黄铭,陈惠萍.外源CO和NO对水稻种子萌发过程中干旱胁迫损伤的缓解效应[J].西北植物学报,2011,31(4):731-738.
[9] Yildiztugay E,Ozfidan-Konakci C,Kucukoduk M.Exogenous nitric oxide(as sodium nitroprusside) ameliorates polyethylene glycol-induced osmotic stress in hydroponically grown maize roots[J].Plant Growth Regul,2014,33(3):683-696.
[10] 曲小菲.外源NO对不同抗旱性小麦品种叶绿体基因psbA表达的调节[D].郑州:河南农业大学,2010.
[11] Liu W C,Li Y H,Yuan H M,etal.WD40-REPEAT 5a functions in drought stress tolerance by regulating nitric oxide accumulation inArabidopsis[J].Plant Cell Environ,2017,40(4):543-552.
[12] Siddiqui M H,Al-Whaibi M H,Basalah M O.Role of nitric oxide in tolerance of plants to abiotic stress[J].Protoplasma,2011,248(3):447-455.
[13] Delledonne M,Xia Y,Dixon R A,etal.Nitric oxide functions as a signal in plant disease resistance[J].Nature,1998,394:585-588.
[14] Shan C J,Zhou Y,Liu M J.Nitric oxide participates in the regulation of the ascorbate-glutathione cycle by exogenous jasmonic acid in the leaves of wheat seedlings under drought stress[J].Protoplasma,2015,225(5):1-9.
[15] Huang X S,Liu J H.Cloning and molecular characterization of a mitogen-activated protein kinase gene fromPoncirustrifoliatawhose ectopic expression confers dehydration/drought tolerance in transgenic tobacco[J].Journal of Experimental Botany,2011,62(14):5191-5206.
[16] 李建新,任永信.外源NO对干旱下刺槐幼苗抗氧化特性的影响[J].河南农业科学,2012,41(11):129-131.
[17] García-Mata C,Lamattina L.Nitric oxide induces stomatal closure and enhances the adaptive plant responses against drought stress[J].Plant Physiol,2001,126(3):1196-1204.
[18] Fan Q J,Liu J H.Nitric oxide is involved in dehydration/drought tolerance inPoncirustrifoliataseedlings through regulation of antioxidant systems and stomatal response[J].Plant Cell Reports,2012,31(1):145-154.
[19] Gan L P,Wu X L,Zhong Y.Exogenously applied nitric oxide enhances the drought tolerance in hulless barley[J].Plant Production Science,2015,18(1):52-56.
[20] Xiong J,Zhang L,Fu G,etal.Drought-induced proline accumulation is uninvolved with increased nitric oxide,which alleviates drought stress by decreasing transpiration in rice[J].J Plant Res,2012,125(1):155-164.
[21] 刘建中,张双双,许为.拟南芥一氧化氮相关突变体在干旱胁迫下抗旱相关基因表达的研究[J].浙江师范大学学报(自然科学版),2014,37(4):367-372.
[22] Shi H T,Ye T T,Zhu J K,etal.Constitutive production of nitric oxide leads to enhanced drought stress resistance and extensive transcriptional reprogramming inArabidopsis[J].J Exp Bot,2014,65(15):4119-4131.
Screening and Genetic Analysis of Nitric Oxide Sensitive Mutant inArabidopsisthaliana
XIA Jinchan,ZHANG Xiaoli*
(Henan University of Traditional Chinese Medicine,Zhengzhou 450008,China)
In order to investigate the molecular regulation mechanism of nitric oxide inArabidopsis,we screened nitric oxide(NO)-sensitive mutants from an EMS mutant library in the plants.As a result,nsm1 mutant(nitric oxide sensitive mutant 1) was screened from this library.Mutantnsm1 was sensitive to nitric oxide though there was no obvious difference of phenotype between the mutant and wild type under normal growth conditions.Under 50 μmol/L SNP treatment,the relative root length of wild type(compared with root length in normal growth) was 50.8%,while the relative root length of mutant was 22.4%.Further study found that mutantnsm1 was sensitive to drought stress simulated by mannitol.Under 100 mmol/L mannitol treatment,the relative root length of wild type was 83.4%,while the relative root length of mutant was 45.7%.It possibly related with high dehydration rate,water potential,stomatal and transpiration rate in mutantnsm1.Genetic analysis suggested thatnsm1 was a single recessive mutant.
Arabidopsisthaliana; nitric oxide; mutantnsm1; drought
Q945.78;Q344+.12
A
1004-3268(2017)10-0021-05
2017-05-06
国家自然科学青年基金项目(31600206)
夏金婵(1978-),女,河南郑州人,副教授,博士,主要从事分子生物学研究。E-mail:epsalon@163.com
*通讯作者:张小莉(1962-),女,河南郑州人,教授,博士,主要从事分子生物学研究。E-mail:zxl7666@163.com

