外周血异型淋巴细胞及EBV DNA联合检测在儿童传染性单核细胞增多症中的临床应用价值
汤俊峰,余喜然,郑水娥,朱虹
(福建医科大学附属三明市第一医院检验科,福建 三明36500)
外周血异型淋巴细胞及EBV DNA联合检测在儿童传染性单核细胞增多症中的临床应用价值
汤俊峰,余喜然,郑水娥,朱虹
(福建医科大学附属三明市第一医院检验科,福建 三明36500)
目的 研究外周血异型淋巴细胞及EBV DNA联合检测在儿童传染性单核细胞增多症患者中临床诊断价值。方法从2015年8月-2017年1月,选择我院儿科208例发热患者,其中确诊传染性单核细胞增多症42例作为观察组,其他发热病人166例对照组。对两组使用外周血异型淋巴细胞及EBV DNA联合检测,对比两组不同检测方式的效果。结果 观察组的单核细胞%(M%)以及异型淋巴细胞%、EBV DNA显著高于对照组,差异均有统计学意义(均P<0.01)。各项指标的灵敏度:M%>异型淋巴细胞%>EBV DNA,特异度:EBV DNA>异型淋巴细胞%>M%。联合检测的灵敏度以及特异度均大于各个单项检测。结论 外周血异型淋巴细胞及EBV DNA联合检测在儿童传染性单核细胞增多症患者具有十分重要的意义,灵敏度以及特异度较高。
外周血异型淋巴细胞;EBV DNA;传染性单核细胞增多症
小儿传染性单核细胞增多症(infectious mononucleosis),是一种单核-巨噬细胞系统急性增生性传染病,主要由EBV病毒引起的,以侵犯淋巴系统为主的急性感染性疾病,患者的病程常具有一定的自限性[1-3]。临床表现变化多端,除了临床上常见有发热、咽峡炎、淋巴结及肝脾肿大外,实验室检测时可发现外周血液单核细胞明显增多,出现异常淋巴细胞,嗜异性凝集试验以及抗EBV病毒的抗体阳性。因此,实验室检查对传染性单核细胞增多症的诊断十分重要。鉴于此,本文特此研究外周血异型淋巴细胞及EBV DNA联合检测在儿童传染性单核细胞增多症中临床价值,得到了一些结论,现报告如下。
1 资料与方法
1.1 一般资料 从2015年8月-2017年1月,选取福建医科大学附属三明市第一医院儿科208例发热患者作为研究对象。其中确诊传染性单核细胞增多症42例作为观察组,符合中华医学会关于发热、传染性单核细胞增多症的诊断标准[4];排除先天畸形、严重脏器功能不全及恶性肿瘤者;排除临床资料不完整及不能配合研究者。其中男性29例,女性13例;年龄在5~16岁之间,平均年龄为(8.1±3.2)岁。其他发热病人166例作为对照组。其中男性101例,女性65例;年龄在6~15岁;平均年龄为(7.9±3.2)岁。具体诊断为:上呼吸道感染93例,支气管肺炎50例,其他诊断共23例。两组患者性别、年龄差异无统计学意义(P>0.05),具有可比性。本研究经院伦理委员会批准,并均签署知情同意书。
1.2 检测方法单核细胞百分比检测在日本Sysmex1000i全自动血细胞分析仪器上进行,使用抗凝管 EDTA-K2,对患者采取血量 1.5~2.5ml,将其颠倒混合摇匀3~5次,10min到1h之间将检测完成。采用配套的试剂以及原厂家质控品,所有操作按照规范要求进行。EBV DNA载量检测选取实时定量PCR技术(RT-PCR),具体操作为:先抽取患儿静脉血4ml置于枸橼酸钠抗凝管中,应用Taq-Man荧光标记探针基因扩增技术进行检测,探针序列为 FPEEBV5’-XC-CTCGGA-CAGCTCCTAAGAAGG-CACC-Y-3’,26bp。 PCR 扩增条件:将各反应管放入实时荧光PCR检测仪DA7600,按下列条件扩增:取PCR反应管若干,分别加入处理后的样品上清液2μl,8000r/min离心数秒放入荧光定量PCR检测仪样品槽。按对应顺序设置阴性质控品、阳性定量参考品及待测标本。在93℃环境下进行预变性2min后,再在93℃环境变性45s后转入55℃环境下变性60s,往复10个循环,最后在93℃环境变性30s后转55℃下变性45s,往复30个循环。试剂选购中山大学达安基因股份有限公司,具体操作按说明书进行。采患儿末梢血推片进行端氏染色,在高倍显微镜下计数异常淋巴细胞及比例。
1.3 观察指标比较两组的检测结果,以及各项检测项目在诊断传染性单核细胞增多症中的价值。
1.4 统计学处理通过SPSS 21.0统计软件分析,计数资料采用χ2检验,计量资料采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组检测结果比较结果表明,观察组的EBV DNA(copies/ml)、M%以及异型淋巴细胞%显著高于对照组,差异均有统计学意义(均P<0.01),见表1。

表1 两组检测结果比较(例,x±s)
2.2 各项检测结果对比各项指标的灵敏度:M%>异型淋巴细胞%>EBV DNA(copies/ml),特异度:EBV DNA(copies/ml)>异型淋巴细胞%>M%,阳性预测值:M%>异型淋巴细胞%>EBV DNA(copies/ml),阴性预测值:EBV DNA(copies/ml)>异型淋巴细胞%>M%。联合检测的灵敏度以及特异度均大于各个单项检测。
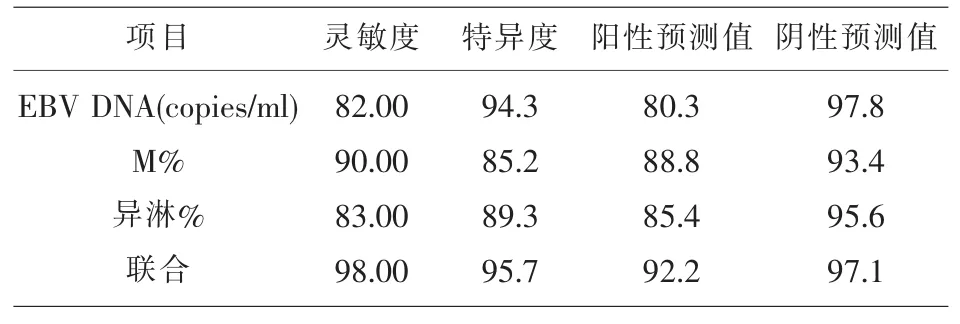
表2 各项检测项目诊断传染性单核细胞增多症的价值对比(%)
3 讨论
传染性单核细胞增多症是由EBV病毒导致的一种急性或者是亚急性的淋巴细胞良性增生的传染病症,常发生在儿童时期以及青少年时期,在成年人、老年群体以及婴儿中较为少见,成为儿科的常见病症。此病症的临床症状十分复杂,特征缺乏典型性,少数患者会发展为EBV病毒相关性质的嗜血细胞综合征,或者是自发性的脾破裂,进而威胁患者的生命[5,6]。在医院对患者进行检查时,诊断传染性单核细胞增多症必不可缺的辅助方式,每项都有方法学的限制,联合检测是现如今临床对病症进行诊断的发展趋势。
本文结果显示,观察组的EBV DNA、M%以及异型淋巴细胞%显著高于对照组,差异均有统计学意义(均P<0.01)。这是因为患者在出现感染之后,自身机体的淋巴细胞过度上升导致的。从观察结果表明,M%指标水平在灵敏度上优于其他的单项检测指标,这说明M%对于传染性单核细胞增多症检测具有十分重要的意义[7-9]。单核细胞的百分比上升是因为异型淋巴细胞的增加导致的,分析仪器将异型淋巴细胞错误认成了单核细胞,因此导致单核细胞的数量上升[10]。除此之外,单核细胞的上升伴随白细胞的数量上升,要防止发生白血病的可能性。因此要实施血涂片对细胞的形态进行检测。异型淋巴细胞成为诊断传染性单核细胞增多症较为可靠的指标[11]。异型淋巴细胞一般情况下,在发病之后的第3d发生,在第一周渐渐加多,能够达到10%以上,在第2~3周最多可以达到40%以上,之后渐渐减小,持续在5~7周。需要重视的是,异型淋巴细胞在一些其他的病毒感染病症中也会找到,例如巨细胞病毒等,因此需要其他项目来辅助小儿传染性单核细胞增多症的诊断[12,13]。
随着实时荧光定量PCR检测技术应用的越来越成熟,开展EBV DNA的定量检测成为越来越多临床实验室的选择。通过我们的实验可以看出观察组与对照的EBV DNA的表达量有明显的差异,具有统计学意义,具有较高的特异度。EBV DNA的定量检测作为EBV感染的分子生物学标记,有快速、简便、特异性强的特点,且PCR技术可以高效扩增,具有高特异性和高精确性的优点,这在临床诊疗中,可以帮助临床医师迅速确诊EBV病毒感染的患儿,并使其抗病毒疗效的判断可以很客观地从病毒核酸的量上反映出来。同时,PCR用于病原体感染的血液筛查,可以检出抗原抗体尚未出现的“窗口期”内的感染,从而避免经输血引发的感染性疾病的传播。因此,荧光定量PCR技术对于急性发热患儿是否为EBV感染的诊断和治疗疗效的观察都具有重要的指导意义[14,15]。
从表2中可以看出联合检测能明显提高检测的灵敏度与特异度。因此,外周血异型淋巴细胞及EBV DNA联合检测在传染性单核细胞增多症患者具有十分重要的意义,值得临床推荐使用。
[1]谢静,王焕玲,邱志峰,等.成人传染性单核细胞增多症和慢性活动性EBV病毒感染外周血淋巴细胞亚群分析 [J].中华内科杂志,2016,55(6):455-459.
[2]于嘉,任立红.传染性单核细胞增多症研究进展[J].中国医师进修杂志,2016,39(5):475-478.
[3]邹莹波,姜杰,黄波,等.传染性单核细胞增多症并发脾梗死一例[J].中国小儿急救医学,2016,23(5):359-360.
[4]谢正德.儿童EBV病毒传染性单核细胞增多症临床特征及诊断标准[J].实用儿科临床杂志,2007,22(22):1759.
[5]Ono S,Kobayashi T,Nishio K.A Case of Acute Acalculous Cholecystitis During Infectious Mononucleosis Caused by the Epstein-Barr Virus in a YoungWoman[J].Kansenshogaku Zasshi,2016,90(3):330-335.
[6]Medovic R,Igrutinovic Z,Radojevic-Marjanovic R,et al.Clinical andlaboratorydifferencesbetweenEpstein-Barrandcytomegalovirus infectiousmononucleosis in children[J].Srpski Arhiv Za Celokupno Lekarstvo,2016,144(1):56-62.
[7]刘雪萍,王爱兰,李佳静,等.EBV病毒感染性儿童传染性单核细胞增多症80例临床分析 [J].陕西医学杂志,2016,45(5):532-533.
[8]肖波,毛金娥,陈万新,等.外周血细胞形态学检查与EBV-DNA定量分析在小儿传染性单核细胞增多症早期诊断中的价值[J].现代检验医学杂志,2016,31(3):114-116.
[9]方莉萍,邵丽佳,吴俊琪,等.传染性单核细胞增多症患儿多个临床检测指标的临床意义 [J].全科医学临床与教育,2016,14(2):193-194.
[10]詹燕婷.探讨全自动血细胞分析仪Sysmex XT-1800i检测中单核细胞假性增高的原因[J].实践与检验医学,2014,32(6):752-754.
[11]王四利,钟天英,敖继红,等.传染性单核细胞增多症外周血淋巴细胞形态学观察[J].实践与检验医学,2010,28(5):521.
[12]刘莹,曹军皓,容东宁,孙洁.传染性单核细胞增多症异型淋巴细胞数量与 EBV病毒浓度的关系 [J].实用医学杂志,2008,24(20)3582-3583.
[13]吴为强,周敏榆,陆丹倩,彭明,等.白细胞计数联合外周血异型淋巴细胞检查在婴幼儿肺炎诊断中的应用[J].国际检验医学杂志,2014,35(20):2839-2840
[14]闫永彬,孙晓旭,张慧娟,等.四妙清瘟败毒饮治疗儿童热毒炽盛型传染性单核细胞增多症临床研究 [J].中医学报,2016,31(4):599-602.
[15]张苗,张洁,汤绍辉,等.传染性单核细胞增多症合并铜绿假单胞杆菌扁桃体炎1例[J].广东医学,2016,37(9):1423-1424.
R446.11+1,Q523,R512.7
A
1674-1129(2017)05-0722-03
10.3969/j.issn.1674-1129.2017.05.031
2017-05-09;
2017-08-08)

