艾叶挥发油诱导白念珠菌凋亡
施高翔 汪天明 吴生兵 汪云霞 邵菁 周美启 汪长中
[摘要]研究艾叶挥发油(Artemisia argyi essential oil,AAEO)誘导白念珠菌凋亡的活性。实验采用微量液基稀释法检测AAEO对白念珠菌(Candida albicans)SC5314的MIC;采用XTT还原法检测AAEO对白念珠菌SC5314代谢的影响;采用流式细胞仪检测AAEO对白念珠菌SC5314细胞内活性氧(reactive oxygen species,ROS)和线粒体膜电位(mitochondrial membrane potential,MMP)水平的影响;采用AnnexinV/PI法测定AAEO对白念珠菌SC5314细胞凋亡率的影响;采用荧光显微镜观察AAEO对白念珠菌SC5314细胞Caspase酶活性的影响;采用DAPI染色法观察AAEO对白念珠菌SC5314细胞核固缩的影响。结果显示,AAEO对白念珠菌SC5314的MIC为05 mL·L-1;XTT代谢活性显示AAEO对白念珠菌SC5314代谢呈剂量依赖性的抑制;>05 mL·L-1的AAEO干预后,白念珠菌SC5314细胞内活性氧水平显著升高、线粒体膜电位显著降低、凋亡比例明显增加、metacaspase活性显著升高、细胞核固缩。AAEO具有诱导白念珠菌细胞凋亡的活性,该作用可能与ROS积累和线粒体损伤相关。
[关键词]艾叶挥发油; 白念珠菌; 凋亡; 活性氧; 线粒体
Activity of essential oil extracted from Artemisia argyi in inducing
apoptosis of Candida albicans
SHI Gaoxiang1,2, WANG Tianming1,2, WU Shengbing4, WANG Yunxia1,2,
SHAO Jing1,2, ZHOU Meiqi3*, WANG Changzhong1,2*
(1. School of Integrated Traditional Chinese and Western Medicine, Anhui University of Chinese Medicine, Hefei 230038, China;
2. Institute of Integrated Traditional and Western Medicine, Anhui Academy of Chinese Medicine, Hefei 230038, China;
3. Division of Science and Technology, Anhui University of Chinese Medicine, Hefei 230038, China;
4. Experimental Center of Anhui University of Chinese Medicine, Hefei 230038, China)
[Abstract]To explore the activity of essential oil extracted from Artemisia argyi (AAEO) in inducing the apoptosis of Candida albicans SC5314. The effect of AAEO on reactive oxygen species(ROS) and mitochondria membrane potential(MMP) of C. albicans SC5314 was detected by flow cytometry. Phosphatidylserine externalization was observed under fluorescence microscopic with AnnexinV/PI staining at the early stage of apoptosis in C. albicans. Metacaspase activity was observed under fluorescence microscopic with FITCVADFMK staining at the early stage of apoptosis in C. albicans. C. albicans morphology was observed by DAPI nuclear staining and fluorescence microscopy. After intervention with 0.5 mL·L-1 AAEO, apoptosis of C. albicans significantly increased, metacaspase activity increased, nuclear pyknosis and fragmentation, and intracellular ROS were significantly increased, and mitochondrial membrane potential decreased significantly. The certain concentrations of AAEO could induce the apoptosis of C. albicans.
[Key words]Artemisia argyi essential oil; Candida albicans; apoptosis; ROS; mitochondrial
临床上,皮肤发生病毒、细菌或真菌等病原体感染时,除了常规的全身或局部用药外,艾灸往往也能产生显著疗效[12]。艾灸具有药物作用、温热作用与近红外辐射作用三大作用机制,其中药物作用与其含有的挥发油密切相关[3]。课题组前期研究表明,艾叶挥发油(Artemisia argyi essential oil,AAEO)对临床常见皮肤致病性真菌尤其是白念珠菌具有较强的抗菌活性[4],但其作用机制不详。有研究表明,植物挥发油可以通过诱导真菌凋亡而发挥其抗菌作用[5],本实验着重探讨艾叶挥发油是否能通过凋亡方式发挥抗白念珠菌活性。endprint
1材料
11菌株和试剂 白念珠菌(Candida albicans, C albicans)SC5314由第二军医大学药学院姜远英教授惠赠;艾叶购于安徽中医药大学第一附属医院并经鉴定;氟康唑(Fluconazole,FLC,Mr 30627,中国食品药品检定研究院,批号100314);两性霉素B(Amphotericin B,AmB,Mr 92408,Sigma A9528);RPMI1640培养基(美国Gibco公司);XTT[2, 3bis (2methoxy4nitro5sulfophenyl)2Htetrazolium5carboxanilide](加拿大BBI公司);维生素 K3 (美國Alexis公司);AnnexinV/FITC试剂盒(上海贝博生物公司);FITCVADFMK(Promega公司); 活性氧检测试剂盒(Solarbio公司);线粒体膜电位检测试剂盒(Solarbio公司)。
12仪器24孔细胞培养板、96孔细胞培养板(美国Corning公司);Spectra Max M2e多功能酶标仪(美国Molecular Devices公司);恒温培养箱(上海博迅实业公司);流式细胞仪(Flow Cytometer,Accuri C6,美国BD公司);倒置荧光显微镜(Olympus IX 81, 日本)。
2方法
21AAEO的制备参照文献并有所改动[6],将艾条燃烧后产生的艾烟通入玻璃冷凝器中,于10 ℃以下进行冷凝,收集玻璃冷凝器表面产生的冷凝液滴,去除冷凝物中的颗粒状沉淀,收集透明的、具有浓郁芳香气味的液体即得。经鉴定纯度≥98%。
22菌液的配制从4 ℃保存的YPD平板上挑取白念珠菌单菌落,接种至液体沙氏培养基,37 ℃恒温培养箱过夜培养,离心收集菌体,血细胞计数板计数,以RPMI1640培养基将菌液浓度调整至2×106 CFU/mL备用。
23AAEO对白念珠菌SC5314的MIC的测定[7]取100 μL菌液(2×10
3 CFU/mL)与100 μL终浓度分别为32,16,8,4,2,1,05,025,0125,0062 5 mL·L-1的AAEO于96孔板中混合,设阳性药组(氟康唑1 mg·L-1)和空白组(不含药物),37 ℃培养48 h后,肉眼观察,以观察不到白念珠菌生长的最低药物稀释度为MIC(minimum inhibitory concentration,MIC)。实验平行重复3次。
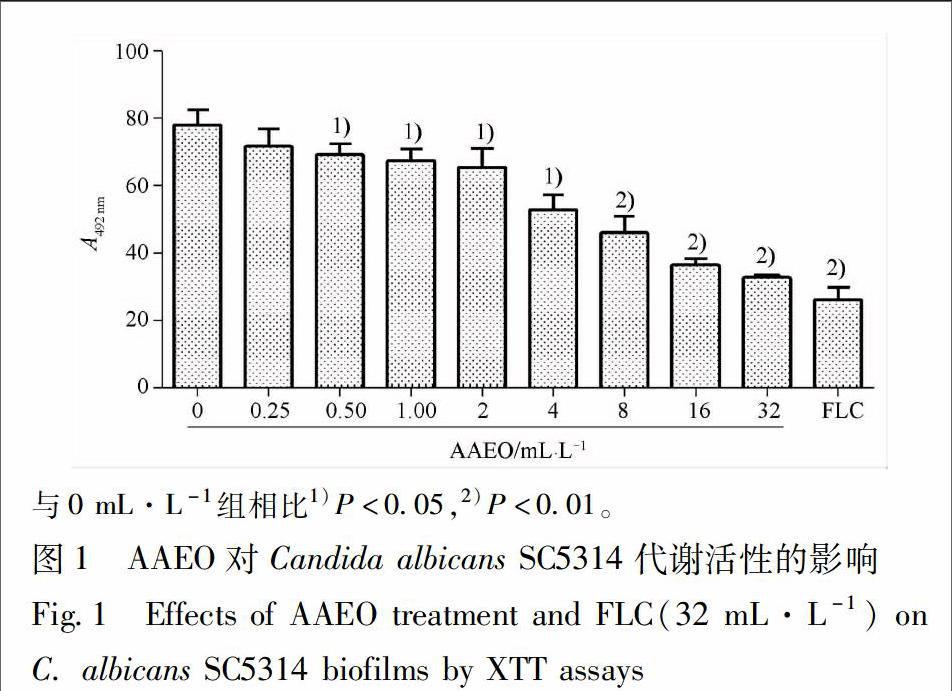
24AAEO对白念珠菌SC5314的代谢活性的影响[8]取100 μL菌液(浓度为2×106 CFU/mL),与100 μL终浓度分别为32,16,8,4,2,1,05,025 mL·L-1AAEO于96孔板中混合,设阳性药组(氟康唑32 mg·L-1)和空白组(不含药物),37 ℃培养24 h后,吸弃上清,每孔加入50 μL XTTVK3溶液,37 ℃避光继续孵育2 h。以多功能酶标仪检测492 nm处各孔的A。实验平行重复3次。
25AAEO对白念珠菌SC5314活性氧(reactive oxygen species,ROS)的影响[9]取菌悬液(2×106 CFU/mL),分别加入AAEO(1,05,025 mL·L-1)和AmB(05 mg·L-1),37 ℃作用12 h,3 000 r·min-1离心5 min收集细胞,无菌PBS缓冲液清洗3次后,重悬细胞至5×106 CFU/mL。临用前以DMSO溶解DCFHDA(-20 ℃避光存)得10 mmol·L-1储备液。加入终浓度为10 μmol·L-1的DCFHDA染液和不加DCFHDA液的对照菌液,37 ℃孵育20 min。流式细胞仪检测ROS水平。
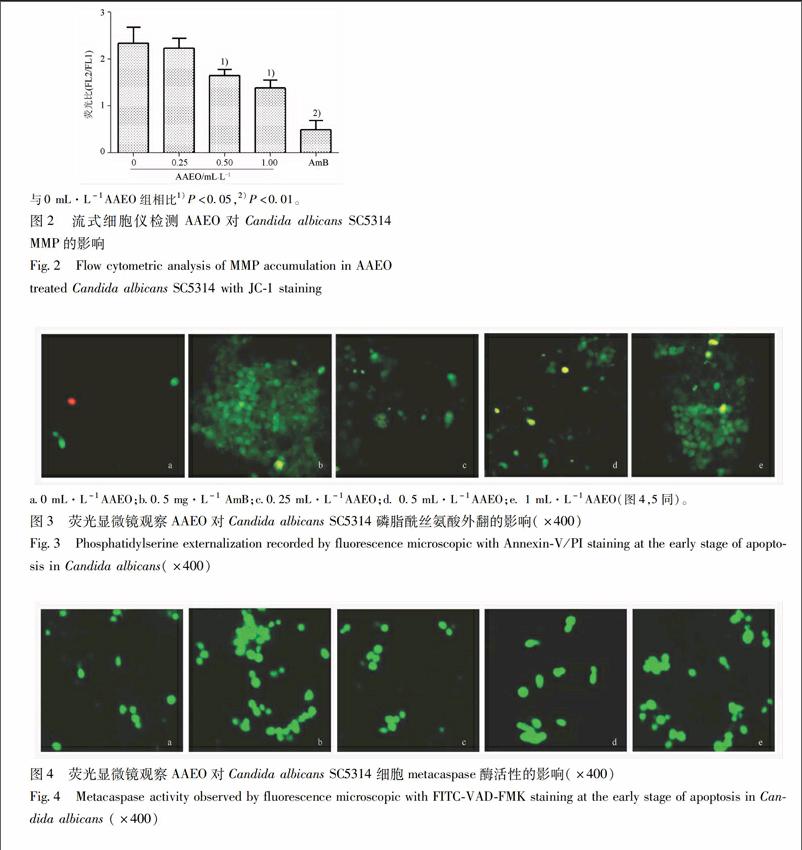
26AAEO对白念珠菌SC5314线粒体膜电位(mitochondrial membrane potential,MMP)的影响[10]取浓度为2×106 CFU/mL菌液,分别加入不同浓度的AAEO(1,05,025 mL·L-1)和AmB(05 mg·L-1),37 ℃干预12 h,离心(3 000 r·min-1)5 min收集细胞,无菌PBS缓冲液清洗3次后,重悬细胞调整浓度至5×106 CFU/mL。按照试剂盒说明书加入荧光染料JC1染色工作液,于暗处30 ℃孵育15 min,PBS洗涤3次,采用流式细胞仪检测荧光强度。
27AAEO对白念珠菌SC5314磷脂酰丝氨酸(phosphatidyl serine,PS)外翻和凋亡率的影响[11]在C albicans SC5314细胞悬液(5×106 CFU/mL)中分别加入AAEO(终浓度为1,05,025 mL·L-1)和AmB(05 mg·L-1),设空白对照组,37 ℃孵育12 h。离心收集菌体,对各组细胞进行脱壁处理,转移至15%蜗牛酶溶液中,30 ℃,100 r·min-1摇床孵育45 min,无菌PBS洗3次后,得脱壁的原生质体状态的白念珠菌。
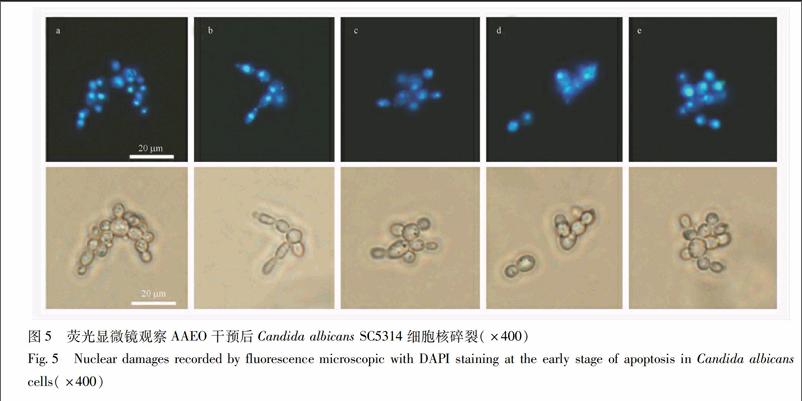
调整菌浓度为2×106 CFU/mL,用无菌PBS洗3次,以400 μL 1×Annexin V结合液重悬细胞,再加5 μL Annexin VFITC染液,轻轻混匀后于4 ℃避光孵育15 min,对细胞膜上的PS进行标记;再加入10 μL PI染液混匀继续孵育5 min,对死细胞进行染色。倒置荧光显微镜观察PS外翻情况并拍照,同时于流式细胞仪上分析凋亡率并统计。
28AAEO对白念珠菌SC5314细胞metacaspase活性的影响[12]取C albicans SC5314(浓度为5×106 CFU/mL),向菌液中加入AAEO(1,05,025 mL·L-1)和AmB(5 mg·L-1),设空白对照组,于37 ℃,100 r·min-1振荡培养12 h。离心收集细胞,无菌PBS缓冲液洗3遍,加100 μL的10 μmol·L-1的FITCVADFMK于30 ℃避光染色l h,均匀涂抹在含有多聚赖氨酸的载玻片上,置于倒置荧光显微镜下观察并拍照。endprint
29DAPI法检测白念珠菌SC5314细胞核碎裂[13]将经AAEO(1,05,025 mL·L-1)和AmB(5 mg·L-1)干预后的C albicans SC5314菌细胞以70%乙醇固定渗透10 min,3 000 r·min-1离心5 min收集菌体,无菌PBS缓冲液洗3次后加入10 mg·L-1的DAPI染液,室温避光染色20 min。取菌悬液涂抹于含有多聚赖氨酸的载玻片上,倒置荧光显微镜观察并拍照。
3结果
31AAEO对白念珠菌SC5314的MIC的判定根据M27A方案,艾叶挥发油对白念珠菌SC5314的MIC为05 mL·L-1。
32AAEO抑制白念珠菌SC5314的代谢活性通过XTT还原法检测发现,不同浓度AAEO作用后白念珠菌SC5314的代谢活性呈剂量依赖性降低,其中16 mL·L-1的AAEO能抑制50%白念珠菌的代谢活性(P<001),见图1。
33AAEO促进白念珠菌SC5314胞内ROS的累积实验以DCFHDA染料检测白念珠菌SC5314胞内ROS的累积,无荧光的DCFH可以自由穿过细胞膜,被超氧阴离子和过氧化氢等ROS氧化生成发荧光。实验结果显示,空白组(0 mL·L-1AAEO)的荧光强度较弱(17%),不同浓度AAEO干预后,荧光强度呈剂量依赖性增强,其中05 mg·L-1AmB和02,05,1 mL·L-1AAEO能显著提高其胞内ROS水平,分别提升91%,48%,65%,88%的活性氧水平。
34AAEO降低白念珠菌SC5314胞内MMP水平在线粒体膜电位较高时,JC1聚集在线粒体的基质中,形成聚合物产生红色荧光;在线粒体膜电位较低时,产生绿色荧光。通过JC1从红色荧光到绿色荧光的转变(FL2/FL1的比值)可检测到细胞膜电位的变化。实验结果显示,与空白组(0 mL·L-1AAEO)FL2/FL1值(233)相比较,05 mg·L-1AmB使FL2/FL1降低为0492, 025,05,1 mL·L-1的AAEO能剂量依赖性的降低白念珠菌的膜电位,FL2/FL1值分别为223,165,138(P<005),见图2。
35AAEO诱导白念珠菌SC5314 PS外翻,增加凋亡率PS外翻是真菌凋亡的典型表现之一。PS在细胞凋亡的早期,可从细胞膜的内侧翻转到细胞膜的表面。AnnexinV(膜联蛋白)可以与暴露在膜外侧的PS特异性结合,PI可标记死亡细胞。空白对照组的细胞有少量的绿色荧光,且有红色的荧光,阳性对照药AmB组绿色荧光细胞最多。经不同浓度AAEO处理后,随着药物浓度的升高,绿色荧光细胞数量越多,表明PS从细胞膜的内侧翻转到细胞膜的表面,提示AAEO可诱导白念珠菌细胞的凋亡。同时,以流式细胞仪检测AAEO对白念珠菌凋亡率的影响,结果发现,相比于空白组(0 mL·L-1AAEO)凋亡率(37%),05 mg·L-1 AmB 和025,05,1 mL·L-1AAEO可引起388%和48%,88%,105%的白念珠菌细胞凋亡(P<005),见图3。
36AAEO激活白念珠菌SC5314细胞metacaspase活性在C albicans细胞中,存在Caspase同源结构类似物metacaspase,负责选择性的切割某些蛋白质,从而造成细胞凋亡。因此,本实验中选用FITCVADFMK在原位检测metacaspase的活性。空白组(0 mL·L-1AAEO)中见有少量微弱荧光的细胞,AAEO处理后的细胞,多数细胞被标记上明亮的绿色荧光,阳性对照药AmB的荧光亮度最为明显,说明AAEO可激活C albicans SC5314细胞内的metacaspase活性,见图4。
37AAEO诱导白念珠菌SC5314细胞核碎裂DAPI能穿透细胞膜与细胞核中的双链结合产生蓝色荧光。空白组(0 mL·L-1AAEO)的白念珠菌呈弥漫均匀的低强度荧光,经AAEO处理过的细胞呈现不同程度的核固缩或颗粒状荧光。提示AAEO导致白念珠菌细胞核固缩或碎裂,见图5。
4讨论
细胞凋亡(apoptosis)是细胞普遍存在的一种生命过程。目前以细胞凋亡为研究手段,可深层次探讨和揭示疾病的发生机制,寻找新的治疗药物和方法[14]。近年来发现,引起常见真菌感染的白念珠菌在环境刺激或胁迫下,生长代谢受到抑制,引发细胞ROS累积、metacaspase 酶活性激活、MMP改变、核固缩或裂解、膜磷脂酰丝氨酸(PS)外翻等典型凋亡特征的变化,发生凋亡[15]。文献报道,乙酸、AmB等药物在适当浓度下可诱导白念珠菌细胞凋亡[1617]。
艾叶为菊科多年生植物艾蒿的干燥叶,是我国的常用中药。文献表明艾叶及其挥发油具有杀虫止痒、抑菌、抗炎等作用[18]。课题组前期研究结果发现艾叶挥发油具有良好的抗真菌效果,尤其对白念珠菌的效果最明显。本实验采用微量液基稀释法检测了AAEO对白念珠菌SC5314的MIC为05 mL·L-1且对白念珠菌SC5314的生物膜代谢活性有显著影响,可剂量依赖性的下调其代谢活性,其中16 mL·L-1的AAEO可抑制50%生物膜代谢。
线粒体是真核细胞内的能量产生中心场所,对维持细胞能量代谢和正常功能活动起重要作用。在凋亡信号的刺激条件下,线粒体膜通透性增加,会引发线粒体产生一系列的变化[19]。本实验采用DCFHDA和JC1荧光试剂,检测白念珠菌胞内ROS和MMP水平,结果发现经不同濃度AAEO干预后,胞内ROS大量累积,线粒体膜电位却显著下降,该结果提示AAEO诱导白念珠菌凋亡的过程可能与线粒体损伤相关。另外,实验以AnnexinV/PI染料染色白念珠菌后,荧光显微镜观察到白念珠菌细胞膜磷脂酰丝氨酸(PS)出现外翻现象,提示AAEO可诱导白念珠菌PS从细胞膜的内侧翻转到细胞膜的表面,引发菌体凋亡。流式细胞仪检测结果也证实,AAEO可显著提高白念珠菌的凋亡率。endprint
有文献表明,约40%的真菌凋亡由metacaspase介导[20],本实验结果表明AAEO可显著提升胞内ROS累积,而ROS不仅可以氧化细胞内的生物大分子,引起细胞损伤,而且可以激活metacaspase活性,导致真菌凋亡。本实验进一步测定AAEO对白念珠菌metacaspase活性的影响,结果表明AAEO可激活metacaspase活性。实验还以DAPI染料染色后,观察到AAEO可导致白念珠菌染色质凝集和细胞核浓缩。
综上所述,AAEO导致白念珠菌SC5314的细胞凋亡,表现出典型的凋亡特征,包括PS外翻、染色质凝集、细胞核固缩,另外使其胞内ROS大量累积、MMP下降,激活了metacaspase活性,随之启动细胞凋亡。本研究首次报道AAEO可诱导白念珠菌凋亡,凋亡进程可能与线粒体损伤有关。通过药物(包括中药及有效成分)诱导白念珠菌的凋亡是当前抗真菌的新策略,本研究为AAEO治疗皮肤常见真菌感染的作用机制研究提供了重要的实验基础,并进一步丰富了中医药抗真菌的科学理论。
[参考文献]
[1]段健伟,段丽丽. 艾灸治足癣[J]. 山西中医,2000,16(5):53.
[2]杨培俐,刘丽萍,田永红,等. 梅花针加艾灸治疗带状疤疹[J]. 内蒙古中医药,1996(S1):52.
[3]朱乃甫,杨玉林,江丹,等. 不同温度下蕲艾油的透皮吸收[J]. 辽宁中医药大学学报,2016, 18(8):46.
[4]吴生兵,曹健,汪天明,等. 艾叶挥发油抗真菌及抗带状疱疹病毒的实验研究[J]. 安徽中医药大学学报,2015,34(6):70.
[5]Khan A, Ahmad A, Khan L A, et al. Ocimum sanctum (L. ) essential oil and its lead molecules induce apoptosis in Candida albicans[J]. Res Microbiol, 2014, 165(6): 411.
[6]刘先华,周安,刘碧山,等. 艾叶挥发油体内外抑菌作用的实验研究[J]. 中国中医药信息杂志, 2006,13(8):25.
[7]P Wayne. Clinical and Laboratory Standards Institute: reference method for broth dilution antifungal susceptibility testing of yeast; approved standard; CLSI document M27A3[J]. CLSI, 2008,28:6.
[8]Pierce C G, Uppuluri P, Tristan A R, et al. A simple and reproducible 96well platebased method for the formation of fungal biofilms and its application to antifungal susceptibility testing[J]. Nat Protoc, 2008, 3(9): 1494.
[9]Ding Y, Li Z, Li Y, et al. HSAFinduced antifungal effects in Candida albicans through ROSmediated apoptosis[J]. RSC Adv, 2016, 6(37): 30895.
[10]Park C, Lee D G. Melittin induces apoptotic features in Candida albicans[J]. Biochem Biophys Res Commun, 2010, 394(1): 170.
[11]Chen Y X, Zeng H, Tian J, et al. Dill (Anethum graveolens L.) seed essential oil induces Candida albicans apoptosis in a metacaspasedependent manner[J]. Fungal Biol, 2014, 118(4): 394.
[12]Fu Z J, Lu H, Zhu Z Y, et al. Combination of baicalein and amphotericin B accelerates Candida albicans apoptosis[J]. Biol Pharm Bull, 2011, 34(2): 214.
[13]Hwang I S, Lee J, Lee D G. Indole3carbinol generates reactive oxygen species and induces apoptosis[J]. Biol Pharm Bull, 2011, 34(10): 1602.
[14]Hengartner M O. Apoptosis. DNA destroyers[J]. Nature, 2001, 412(6842): 27.
[15]Perrone G G, Tan S X, Dawes I W. Reactive oxygen species and yeast apoptosis[J]. Biochim Biophys Acta, 2008, 1783(7): 1354.
[16]Phillips A J, Sudbery I, Ramsdale M. Apoptosis induced by environmental stresses and amphotericin B in Candida albicans[J]. Proc Natl Acad Sci USA, 2003, 100(24): 14327.
[17]AlDhaheri R S, Douglas L J. Apoptosis in Candida biofilms exposed to amphotericin B[J]. J Med Microbiol, 2010, 59(Pt 2):149.
[18]Ge Y B, Wang Z G, Xiong Y, et al. Antiinflammatory and blood stasis activities of essential oil extracted from Artemisia argyi leaf in animals[J]. J Nat Med, 2016, 70(3): 531.
[19]Jeong S Y, Seol D W The role of mitochondria in apoptosis[J]. BMB Rep, 2008, 41(1): 11.
[20]Hill S M, Hao X, Liu B, et al. Lifespan extension by a metacaspase in the yeast Saccharomyces cerevisiae[J]. Science, 2014, 344(6190): 1389.
[責任编辑张宁宁]endprint

