表面改性多孔淀粉的制备及微生物固定化应用
周英男,钱斯日古楞,崔晓蕾,冀海龙,王红英
表面改性多孔淀粉的制备及微生物固定化应用
周英男,钱斯日古楞,崔晓蕾,冀海龙,王红英
(大连工业大学生物工程学院,辽宁大连 116034)
以玉米淀粉为原材料,利用生物酶解法制备多孔淀粉,并以聚乙烯亚胺(PEI)为表面改性剂,以戊二醇(GA)为交联剂,对多孔淀粉进行交联改性。以沉降积为指标,优化确定多孔淀粉改性的最佳工艺条件。利用Zeta电位仪检测分析改性多孔淀粉颗粒表面的电荷分布情况,并通过扫描电子显微镜观察改性多孔淀粉的外部形貌。α-淀粉酶和糖化酶的混合比例为1∶4,酶添加量为5%,反应体系pH保持6左右,在45℃条件下酶催化反应24h时,可制备出外部形态完整、表面分布较多孔洞的多孔淀粉。以GA为交联剂,用PEI对多孔淀粉表面进行改性的最佳条件为:PEI添加量6%,GA添加量5%,35℃条件下搅拌反应8h。此条件下制备的改性多孔淀粉,形态保持完整,沉降积表现最佳,且颗粒表面分布丰富的正电荷,等电点达到9.8。以表面改性的多孔淀粉为载体,在酸性条件下固定化大肠杆菌,制备了淀粉固定化大肠杆菌。
多孔淀粉;固定化微生物;Zeta电位;表面改性;载体
多孔淀粉是一种变性淀粉,其表层分布诸多孔洞,表面积显著提高,用做载体时,其载量明显提高,因此多孔淀粉是一种良好的吸附剂和微胶囊芯材[1-3]。多孔淀粉无毒、无副作用,且其制备成本低廉,因此在食品、医疗卫生、化妆品、农业和石油化工等领域有广泛的应用前景[4]。淀粉经过酶解处理表层形成诸多孔洞时,一定程度上破坏淀粉颗粒整体结构,致使结构不稳定,甚至容易坍塌[5]。用戊二醛(glutaraldehyde,GA)等多功能试剂为交联剂,对多孔淀粉进行交联处理,可以强化淀粉分子中的羟基或淀粉颗粒中形成氢键,稳定和巩固多孔淀粉的空间结构。因此经交联处理,多孔淀粉结构稳定性提高,应用范围扩大[6]。聚乙烯亚胺(polyethyleneimine,PEI)又叫聚氮杂环丙烷,其分子链上带有大量的氨基,显示强正电荷,与带负电的物质具有高度亲和性,属于阳离子聚电解质。许多研究者进行以PEI为主要试剂,对多种载体表面进行改性,制备表现正电荷的载体研究[7-9]。
本文以玉米淀粉为原材料,利用酶解法制备多孔淀粉。以PEI为改性剂和GA为交联剂,对多孔淀粉表面进行改性处理。以沉降积为指标,优化了多孔淀粉表面改性的最佳工艺条件,并利用Zeta电位仪和扫描电子显微镜对其表征进行检测。同时以表面改性的多孔淀粉为载体,在酸性条件下对大肠杆菌进行固定化,制备了固定化大肠杆菌。
1 实验部分
1.1 材料与仪器
玉米淀粉,市售食用玉米淀粉;α-淀粉酶和糖化酶,诺维信酶制剂公司;大肠杆菌,本实验室筛选;PEI(分子量为10000左右),上海原叶生物科技有限公司;GA,天津基准化学试剂有限公司;PHENOM扫描电子显微镜,飞纳科学仪器(上海)有限公司;马尔文Zeta电位分析仪,厦门名大科技有限公司。
1.2 酶法制备多孔淀粉颗粒
称取20g玉米淀粉,加入pH为6的磷酸缓冲溶液20mL后,添加α-淀粉酶与糖化酶混合液(其混合比为1∶4)至5%,在50℃条件下搅拌反应24h。加入0.5mL 4%的NaOH溶液,终止酶解反应。反应液在4000r/min条件下离心15min后弃上清液,用去离子水反复洗涤沉淀物,45℃挥干,得到多孔淀粉[10-13]。用扫描电子显微镜观察多孔淀粉外貌 形态。
1.3 表面改性多孔淀粉颗粒
准确称取10g多孔淀粉,与100mL去离子水混合。加入6% PEI,在35℃条件下搅拌反应8h。反应液在4000r/min条件下离心15min后,获得的沉淀移入到100mL 5% GA溶液中,继续搅拌反应1h。反应完后,反应液进行抽滤,滤饼用去离子水洗至中性,45℃挥干后得到PEI-多孔淀粉[14]。
1.4 多孔淀粉表面改性条件的优化
1.4.1 表面改性PEI用量的确定
通常以沉降积为指标,评价多孔淀粉的交联程度。沉降积与交联程度具有负相关关系,沉降积越小,交联度越好。以沉降积为指标,确定最佳的PEI用量[15]。
称取5份10g的多孔淀粉,悬浮于100mL去离子水中,分别加入4%、5%、6%、7%和8%的PEI,在35℃搅拌反应8h。反应液在4000r/min下离心15min,获得的沉淀移入100mL 5%的GA溶液中,继续搅拌反应1h。反应完后,反应液进行抽滤,滤饼用去离子水洗至中性,45℃挥发干燥后得到PEI-多孔淀粉。
称取10g干燥的PEI-多孔淀粉与50mL去离子水混合,在85℃水浴中缓慢搅拌3min。取出,冷却后在4000r/min条件下离心2min。取上清液,准确测量其体积,按以下公式计算其沉降积。
沉降积=10–(1)
式中,为上清液的体积,mL。
1.4.2 表面改性温度的确定
称取5份10g的多孔淀粉,悬浮于100mL去离子水中,加入6% PEI,分别在30℃、35℃、40℃、45℃和50℃条件下搅拌反应8h。反应液在4000r/min下离心15min,获得的沉淀移入100mL 5% 的GA溶液中,继续搅拌反应1h。反应完后,反应液进行抽滤,滤饼用去离子水洗至中性,45℃挥干后得到PEI-多孔淀粉,测定沉降积。以沉降积为指标,确定表面改性最佳温度。
1.4.3 表面改性时间的确定
称取5份10g的多孔淀粉,悬浮于100mL去离子水中,加入6%PEI,在35℃条件下分别搅拌反应4h、6h、8h、10h和12h。反应液在4000r/min下离心15min,获得的沉淀移入到100mL 5%的GA溶液中,继续搅拌反应1h。反应完后,反应液进行抽滤,滤饼用去离子水洗至中性,45℃挥干后得到PEI-多孔淀粉,测定沉降积。以沉降积为指标,确定表面改性最佳反应时间。
1.4.4 GA添加量的确定
称取5份10g的多孔淀粉,悬浮于100mL去离子水中,加入6% PEI,在35℃条件下搅拌反应8h。反应液在4000r/min下离心15min,获得的沉淀分别移入到100mL质量分数为3%、4%、5%、6%和7%的GA溶液中,继续搅拌反应1h。反应完后,反应液进行抽滤,滤饼用去离子水洗至中性,45℃挥干后得到PEI-多孔淀粉。用扫描电子显微镜进行外貌形态观察,确定合成PEI-多孔淀粉的GA最佳添 加量。
1.5 表面改性多孔淀粉的Zeta电位
称取2g的PEI-多孔淀粉置于烧杯中,加入到100mL去离子水中悬浮,用超声波分散30min后用注射器缓慢抽取1mL样品,注入Zeta电位测定仪测量池内。开启Zeta电位测定仪及自动滴定系统,校正pH,将仪器测定模式设为自动滴定模式,并将温度设定为25℃,自溶液所处的pH起滴定。酸性溶液用0.25mol/L NaOH溶液滴定,终点pH为12,碱性溶液用0.25 mol/L盐酸溶液滴定。起点pH为3,每隔0.5个pH自动测定一次电位,并作Zeta电位随pH变化曲线图[16-18]。
1.6 表面改性多孔淀粉固定化大肠杆菌
从大肠杆菌保藏菌种斜面上取几环菌种,接到活化培养基中,37℃、180r/min摇床培养18h。
活化培养基配方为:蛋白胨5g,牛肉膏2.5g,NaCl 2.5g,水500mL,pH 6.2。
5000r/min,5min离心收集活化菌种,用生理盐水洗净后,悬浮于0.02mol,pH 6.2的磷酸盐缓冲液中(菌体悬浮液OD600nm为1.0)。取2份50mL的菌体悬浮液,分别加入1g的多孔淀粉和PEI-多孔淀粉,在25℃下,180r/min条件下震荡反应1h。在1000r/min条件下离心5min,收集沉淀,用0.02mol,pH 6.2缓冲液洗涤至无微生物脱下为止(洗脱液OD600nm值0.01为止),低温挥干后,在扫描电镜下观察和比较多孔淀粉表面微生物分布情况[24-25]。
2 结果与讨论
2.1 酶法制备多孔淀粉的微观形态
将5%的α-淀粉酶与糖化酶混合液(其混合比为1∶4)与一定玉米淀粉混合,在pH为6,反应温度50℃条件下搅拌反应24h。用4%的NaOH溶液终止反应后离心获得的沉淀,用去离子水洗至中性,低温挥干后得到多孔淀粉。用扫描电子显微镜观察多孔淀粉外貌形态,结果如图1。
由图1可见,淀粉混合酶水解制备的多孔淀粉仍然保持原淀粉的颗粒形态,表面分布诸多孔洞,且孔洞深度适中,颗粒保持完整。

图1 多孔淀粉的微观形态
2.2 表面改性多孔淀粉制备条件的优化
2.2.1 PEI用量的确定
将PEI缓慢加入多孔淀粉改性的反应体系中,并通过GA交联,抽滤干燥后获得PEI-多孔淀粉,测定其沉降积。通过比较沉降积,研究PEI 添加量对表面改性多孔淀粉形成的影响。
由图2可知,PEI 开始添加时,形成PEI-多孔淀粉的沉降积开始下降,随着PEI添加量的增加,沉降积继续下降,6%时达到最低。随后PEI-多孔淀粉的继续添加,沉降积不依PEI 的加入量增加而明显提高。这是因为,PEI可以对多孔淀粉起到交联作用,随PEI用量增加,多孔淀粉与PEI反应增多,交联程度增加,因此沉降积会降低[19-20]。当PEI浓度达到6%时,反应达到饱和,过量的PEI被洗脱,沉降率保持相对稳定,因此,PEI的最适添加量选择为6%。
2.2.2 表面改性温度的确定
将PEI缓慢加入到多孔淀粉改性反应体系中,在不同温度下搅拌反应8h后,用GA交联,抽滤干燥,获得PEI-多孔淀粉,测定其沉降积。通过比较沉降积,分析多孔淀粉与PEI等分子间反应的温度条件对表面改性多孔淀粉形成的影响。
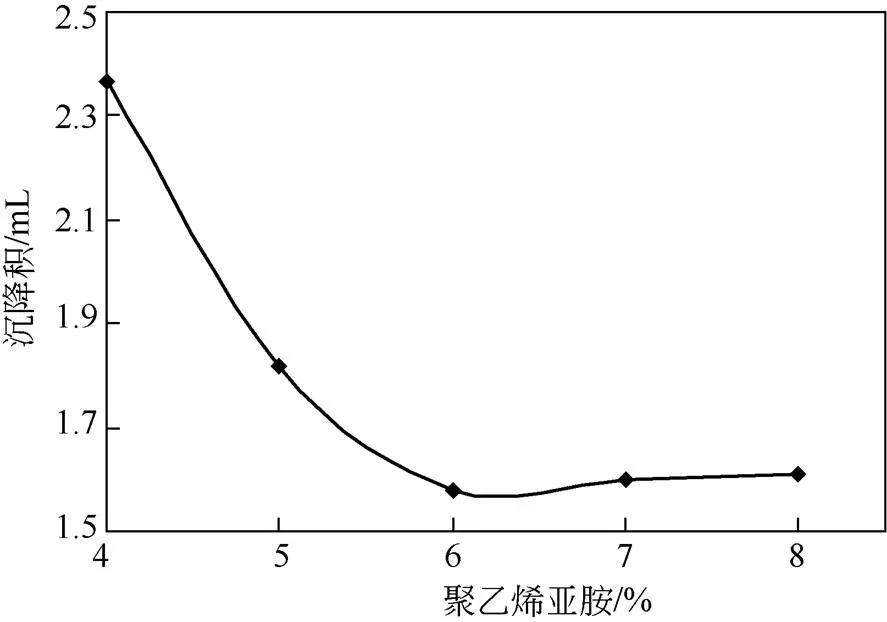
图2 PEI用量对PEI-多孔淀粉沉降积的影响
由图3可知,PEI分子与多孔淀粉间的反应由30℃开始时,随着温度的增加其沉降积下降,当反应温度达到35℃时,沉降积变最小,反应温度继续升高时,沉降积随之变大。这可能因为,在较高反应温度下,PEI分子的运动增加,不利于在多孔淀粉表面孔洞中有效分配或促使PEI分子从淀粉颗粒表面脱落,或造成淀粉的局部糊化,造成沉降积增 大[21]。因此,PEI表面改性最佳反应温度选定为35℃。
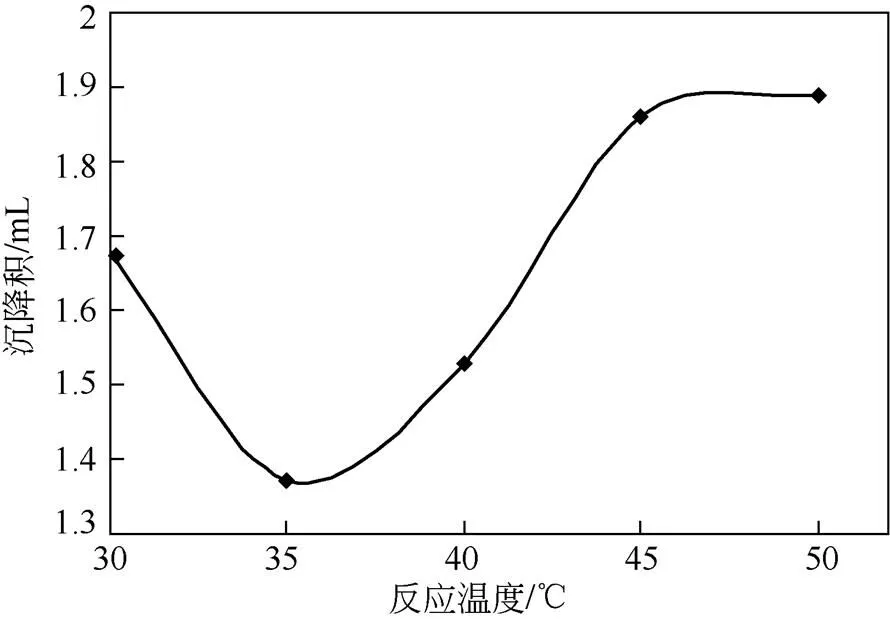
图3 反应温度对PEI-多孔淀粉沉降积的影响
2.2.3 表面改性时间的确定
将PEI缓慢加入多孔淀粉改性反应体系中,在35℃条件下搅拌不同时间,用GA交联,抽滤干燥后获得PEI-多孔淀粉,测定其沉降积。通过比较沉降积,分析多孔淀粉与PEI等分子间的反应时间对表面改性多孔淀粉形成的影响。
由图4可见,PEI分子与多孔淀粉表面分配的反应时间对PEI-多孔淀粉沉降积有一定影响。随着反应时间的进行,PEI-多孔淀粉沉降积随之下降,当反应时间接近8h时,PEI-多孔淀粉沉降积达到最小。继续延长反应时间,PEI-多孔淀粉的沉降积逐渐增大。这可能因为,开始反应时,随着反应的进行,PEI充分分配到多孔淀粉表面的孔洞中。但随着时间的延长,反应体系的弱碱性环境对交联酯键产生水解,造成PEI交联减小[22]。因此,PEI表面改性最佳反应时间选定为8h左右。
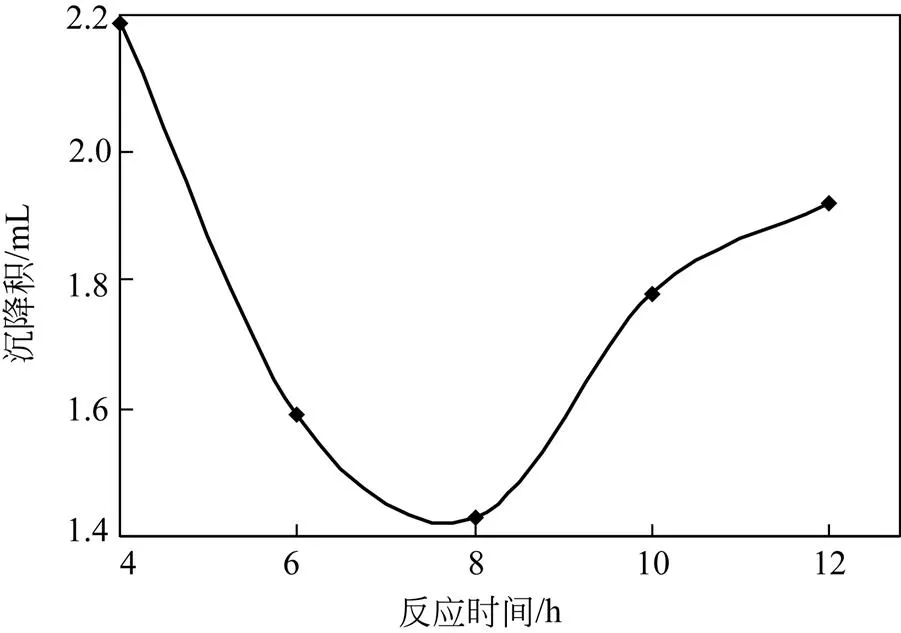
图4 反应时间对PEI-多孔淀粉沉降积的影响
2.2.4 GA浓度的确定
将一定量的多孔淀粉与PEI混合,在35℃条件下搅拌反应8h,抽滤干燥后得到PEI-多孔淀粉。将其移入到100mL不同浓度的GA溶液中,反应1h。洗涤,干燥后用扫描电子显微镜观察其形貌,结果如图5。
由图5可见,当GA的添加量为3%时[如图5(a)],形成的多孔淀粉颗粒的多数破损,孔道坍塌。这可能因为,3% GA的添加量不足以支撑多孔淀粉颗粒的形状。当GA的添加量达到5%时[如图5(b)],形成的多孔淀粉颗粒结构完整,表面形成的孔洞大小、数量均一,且没出现孔洞坍塌现象。这可能因为,5% GA中的醛基,足够与淀粉羟基间或GA分子本身醛基之间形成化学键,有效支撑和保护了淀粉颗粒空间结构。当GA的添加量至7%时[如图5(c)],淀粉颗粒虽然完整,形成孔洞没有塌陷,但过量GA的醛基与相邻淀粉羟基间形成化学键,促使淀粉颗粒堆积,这将会影响多孔淀粉的吸附性。因此,GA的最佳用量确定为5%。
2.3 改性多孔淀粉的表面电荷特性
用Zeta电位仪测量PEI改性的多孔淀粉表面电荷特性,进而测定其等电点,结果如图6。

图5 GA添加量对PEI-多孔淀粉的影响
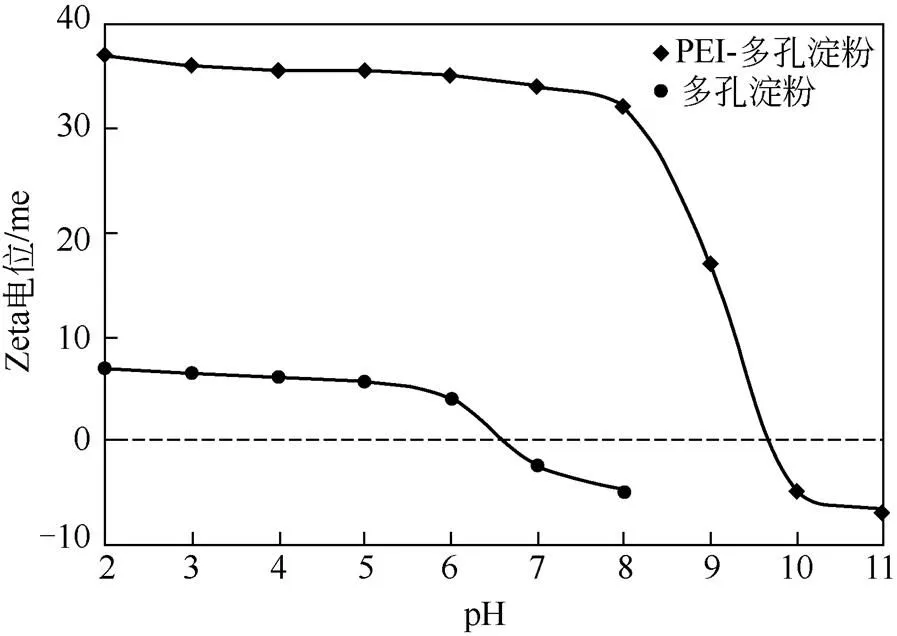
图6 多孔淀粉和PEI-多孔淀粉的等电点
由图6分析发现,在pH 3~6的条件下,PEI-多孔淀粉Zeta电位值能够达到+35me以上,而多孔淀粉的最高只有+6me左右。在pH 3~9.8范围内,PEI-多孔淀粉均带正电荷,且强度远比多孔淀粉的明显高。PEI-多孔淀粉的等电点能够达到9.8me,而多孔淀粉的只有6.2me。用PEI改性多孔淀粉表面,能够有效提高多孔淀粉的表面正电荷特性,这利于多孔淀粉的广泛应用。
2.4 改性多孔淀粉固定化大肠杆菌
以PEI-多孔淀粉为载体,在酸性条件下与一定量的大肠杆菌混合,通过它们的正、负电荷间形成的离子键,使大肠杆菌固定到多孔淀粉的表面,制成固定化大肠杆菌,并对其进行电镜扫描,结果见图7。
从图7中可以看出,与多孔淀粉固定化的比较,PEI-多孔淀粉孔洞内分布更多的大肠杆菌,说明,采用此法改性多孔淀粉表面,能使聚乙烯亚胺更有效地结合到淀粉颗粒表面,并在酸性条件下解离形成的正电荷通过离子键,与显负电荷的大肠杆菌连接,大肠杆菌菌体附着在多孔淀粉表面,形成多孔淀粉固定化微生物。

图7 多孔淀粉固定化大肠杆菌的扫描电镜图
3 结论
(1)将α-淀粉酶与糖化酶于1∶4混合,按加酶量为5%,在反应体系pH为6,反应温度为50℃和酶解时间24h条件下制得的多孔淀粉,颗粒形态完整,表面孔洞大小均一。
(2)通过条件优化得到,制备PEI-多孔淀粉的最佳工艺条件为,多孔淀粉与PEI的质量比为1∶0.06;反应温度为35℃,反应时间为8h;GA的添加量为5%。
(3)通过Zeta电位仪测得,PEI-多孔淀粉的等电点为9.8me,而且其表面明显分布正电荷,且其强度远比多孔淀粉的高,这有利于吸附负电荷 物质。
(4)多孔淀粉作为一种新型的微胶囊芯材、有机吸附剂[23],经PEI表面改性后,在酸性条件下表现正电荷,与负电荷微生物通过离子键结合,形成固定化微生物。多孔淀粉固定化益生菌,可以以微生态制剂形式应用于动物养殖中。微生物的固定化能使微生物的活性保持或延长。PEI-多孔淀粉同样在医药、化妆品、食品工业、农业等领域有广泛应用前景。
(5)多孔淀粉表面改性过程中应用的戊二醛,通过其与淀粉分子的连接,可增强多孔淀粉分子的空间结构和结构稳定性,并提高其使用率和使用范围。
[1] 张盼盼,夏文,王飞,等. 多孔淀粉制备方法及其应用的研究进展[J]. 广东化工,2015,42(17):102-105.
ZHANG P P,XIA W,WANG F,et al. Development of porous starch preparation and appilication[J]. Guangdong Chemical Indusry,2015,42(17):102-105.
[2] 钱斯日古楞,吕洋,王红英,等. 磁性多孔淀粉微球的制备及性质[J]. 化工学报,2014,65(s2):299-304.
QIAN S R G L,LV Y,WANG H Y,et al. Preparation and characteristics of magnetic porous starch microspheres[J]. CIESC Joumal,2014,65(s2):299-304.
[3] MEER T A,RITESH F,AJAY S,et al. Porous starch:a novel carrier for solubility enhancement of carbamazepine[J]. AAPS PharmSciTech,2013,14(3):919-926.
[4] 徐忠,王鹏,廖铭,等. 多孔淀粉的生物法制备、改性及应用[J]. 现代化工,2005,25(s1):77-80.
XU Z,WANG P,LIAO M,et al. Research development of biological preparation and properties analysis of porous starch[J]. Modern Chemical Idustry,2005,25(s1):77-80.
[5] 李永平. 多孔淀粉颗粒空腔结构及其晶体结构的研究[J]. 粮食加工,2016,4:44-48.
LI Y P.Research on cavity structure of porous starch and its crystal structure[J]. Grain Processing,2016,4:44-48.
[6] 汪滨,杨仁党. 戊二醛交联淀粉微孔发泡材料(SMCF)的制备及表征[J]. 功能材料,2011,42(23):524-528
WANG B,YANG R D. Journal of functional materials,Preparation and characterization of starch microcellular foam particles crosslinked with glutaraldehyde using a solvent echange technique[J]. Journal of Functional Material,2011,42(23):524-528
[7] PIVALIi J,KISHOR S,TAPAS M,et al. Synthesis of a carboxumethylated guar gum grafted polyethyleneimine copolymer as an efficient gene delivery vehicle[J]. RSC Advances,2016,6(17):13730-13741
[8] 张继国,王艳,张琼,等. 聚乙烯亚胺-羟甲基纤维素的合成及金属离子的吸附性能[J]. 高分子材料科学与工程,2014,30(3):15-20.
ZHANG J G,WANG Y,ZHANG Q,et al. Preparation of polyethyleneimine-carboxymethyl cellulose and its adsorption properties for metal ions[J]. Polymer Materials Science and Engineering,2014,30(3):15-20.
[9] 孙通泽. 在不同温度下用戊二醛交联制备聚乙烯亚胺的纳米结构[J]. 黑龙江医药,2011,6(24):913-914.
SUN T Z. Preparation of PEI nanostructures by glutaraldehyde crosslinking at different temperature[J]. Heilongjiang Medicine Journal,2011,6(24):913-914.
[10] DURA A,BLASZCZALK W,ROSELL C M. Functionality of porous starch obtained by amylase or amyloglucosidase treatments[J]. Carbohydtate Polymers,2014,101:837-845.
[11] 张斌,陈国. 多孔淀粉制备工艺及应用研究进展[J]. 食品工业科技,2012,33(2):399-403.
ZHANG B,CHEN G. Research progress in preparation process and application of porous starch[J]. Science and Technology of Food Industry,2012,33(2):399-403.
[12] GAO F,LI D,CHONG H B. Application of various drying methods to produce enzymatically hydrolyzed porous starch granules[J]. Taylor&Francis Group,2013,31:1627-1634
[13] 张楠,陈海华,王玉生,等. 超声波辅助α-淀粉蜡质玉米微孔淀粉的工艺和性质[J]. 中国粮油学报,2015,30(11):115-119.
ZHANG N,CHEN H H,WANG Y S,et al. Processing technology and properties of microporous waxy maize starch produced by ultrasonic-assisted amylase enzymolysis[J]. Journal of the Chinese Cereals and Oils Association,2015,30(11):115-119.
[14] ZHU D Y ,LI X,LIAO X P,et al. Polyethleneimine-grafted collagen fiber as a carrier for cell immobilization[J]. J. Ind. Microbiol. Biotechnol.,2015,42:189-196.
[15] 刘志军,鲁文胜,钱德胜,等. 磷酸酯化对氨基甲酸酯淀粉凝沉性质的影响[J]. 纺织学报,2015,36(6):60-63.
LIU W J,LU W S,QIAN D S,et al. Influence of phosphorylation on retrogradation of carbamate starch size mixture[J]. Journal of Textile Research,2015,36(6):60-63.
[16] 杨伟春,刘维屏,胡晓捷. Zeta电位法研究除草剂在土壤胶体中的吸附[J]. 中国环境科学,2003,3(1):51-54.
YANG W C,LIU W P,HU X J. Study on the adsorption of herbicide in soil colloids by Zeta potential measurements[J]. China Environmental Science,2003,3(1):51-54.
[17] 梁磊,徐日益,黄向阳,等. 甘蔗渣表面Zeta电位变化特性及其对酶水解效果的影响[J]. 甘蔗糖业,2011,2:20-23.
LIANG L,XU R Y,HUANG X Y,et al. Effect of the surface characterization of bagasse fiber on its enzymatic hydrolysis[J]. Sugarcane and Canesugar,2011,2:20-23.
[18] KUNAL B.S,OLIVIA N,ALEXADER C. Influence of particle/solid surface Zeta potential on partied adsorption kinetics[J]. Journal of Colloid and Interface Science,2014,431:165-175.
[19] 苟林,王泽南,国志坚,等. 乙二酸交联碎米淀粉的工艺研究[J]. 现代食品科技,2012,28(1):74-76.
GOU L,WANG Z N,GUO Z J,et al. Study of hexane diacid-crosslinked broken rice starch[J]. Modern Food Science and Technology,2012,28(1):74-76.
[20] 杨宝,刘亚伟,袁超,等. 交联酯化淀粉研究[J]. 中国粮油学报,2003,18(6):56-58.
YANG B,LIU Y W,YUAN C,et al. Study on cross-linked and acetified starch[J]. Chinese Cereals and Oils Association,2003,18(6):56-58.
[21] 李莹,王泽南,刘鹏,等. 碎米交联多孔淀粉制备工艺的研究[J]. 食品科技,2011,36(5):247-250.
LI Y,WANG Z N,LIU P,et al. Preparation of cross-linked porous broken rice starch[J]. Food Science and Technology,2011,36(5):247-250.
[22] 韩琼洁,张斌,倪群玉. 交联木薯淀粉的制备及性能[J]. 东华大学学报(自然科学),2016,42(1):57-62.
HAN Q J,ZHANG B,NI Q Y. Preparation and properties of cross-linked cassava starch[J]. Journal of Donghua University(Natural Science),2016,42(1):57-62.
[23] 李显,范小平,蒋卓,等. 多孔淀粉的成孔技术及应用研究进展[J].食品工业科技,2016,12:54-360.
LI X,FAN X P,JIANG Z,et al. Review and prospect on pore-forming technology and application of porous starch[J]. Science and Technology of Food Industry,2016,12:54-360.
[24] 刘江红,潘洋,谷璟瑶,等. UASB和微生物固定化反应器降解含聚废水组合工艺[J]. 化工进展,2013,32(7):1712-1716.
LIU J H,PAN Y,GU J Y,et al. Degradation of HPAM-containing wastewater with integrated process of UASB and immobilized microorganism reactor[J]. Chemical Industry and Engineering Progress,2013,32(7):1712-1716.
[25] XING F,XU Q,YUAN M,et al. Effect of porous starch concentrations on the microbiological characteristics of microencapsulated[J]. Food Func.,2014,5:972-983.
Preparation and application of microbe immobilization of the surface modified porous starch
Zhou Yingnan,Qian Siriguleng,CUI Xiaolei,JI Hailong,Wang Hongying
(College of Biologigical Engineering,Dalian Polytechnic Univercity,Dalian 116034,Liaoning,China)
Using corn starch as raw material,the porous starch was prepared by enzymatic hydrolysis. Polyethyleneimine as surface modifier and glutaraldehyde as crosslinking agent were used to modify the surface of porous starch,and the preparation conditions were optimized based on their sedimentation volumes. The charge distribution on the surface of modified porous starch was analyzed by Zeta potential meter,and its external morphology was observed by scanning electron microscope. The results showed that the ideal porous starch was obtained by operating under the conditions as the mixing ratio of α-amylase to glucoamylase,1∶4;the amount of mixture enzyme,5%;the pH of the reaction system,about 6; the enzymatic reaction temperature,45℃ and reaction time,24h. The optimum conditions for the surface modification of porous starch were that the reaction system contained 6% polyethyleneimine,5% glutaraldehyde,and stirred at 35℃ for 8h. The porous starch prepared under those conditions yielded the best shape and more surface charge distribution,and its isoelectric point reached 9.8. The starch immobilized E coli was preparedwhenwere immobilized using the porous starch with the surface modification as the carrier under the acidic condition. .
porous starch;immobilized microorganism;Zeta potential;surface modification;carrier
TS236.9
A
1000–6613(2017)10–3820–06
10.16085/j.issn.1000-6613.2017-0060
2017-01-11;
2017-05-19。
内蒙古自治区科技重大专项项目(222089)。
周英男(1991—),女,硕士研究生。
王红英,副教授,硕士生导师。E-mail:2002wanghongying@163.com。

