淀粉颗粒微观结构及结晶调控技术的研究进展
,,2,,,2,,,2,*
(1.福建农林大学食品科学学院,福建福州 350002;2.福建省特种淀粉品质科学与加工技术重点实验室,福建福州 350002)
淀粉颗粒微观结构及结晶调控技术的研究进展
康昱倢1,贾祥泽1,2,郑少婷1,孙思薇1,2,陈靖妍1,郭泽镔1,2,*
(1.福建农林大学食品科学学院,福建福州 350002;2.福建省特种淀粉品质科学与加工技术重点实验室,福建福州 350002)
淀粉颗粒的微观结构与结晶形态不仅与食品质地、加工特性和消化特性息息相关,还赋予淀粉颗粒极强的可塑造性。淀粉广泛应用于食品、化学工业和医疗等领域,已成为重要的功能性材料。本文综述了近年来淀粉颗粒微观结构的研究进展,概述了其不同晶体与颗粒结构之间的关系,并探讨了晶体之间的相互转化以及不同改性条件对淀粉结构特性的影响。
淀粉颗粒结构,晶体转化,改性
淀粉不仅是自然界中的一种重要的可再生高分子化合物[1],还是人类能量摄入的主要来源,其供能约占西方人群平均能量摄入的50%,发展中国家人群约90%[2]。近年来随着改性大分子技术研究的深入,淀粉工业逐步向着食品添加剂、医药、纺织及化妆品等领域扩展。据了解我国淀粉的年产量高达2000万吨,其中70%以上转化为淀粉衍生物[3]。淀粉复杂的颗粒结构不仅赋予其极强的可塑性能,而且对于食品的质地、加工特性以及营养价值等具有较大的影响。
近年来随着对淀粉颗粒微观结构的深层次研究发现,组成淀粉的基本成分为直链淀粉和支链淀粉,在淀粉颗粒的形成过程中,这两种组分通过复杂的结晶方式堆叠为小体(Blocklets)结构。大量的小体结构以脐点为中心,呈同心环状向外聚集(图1(a)),形成了洋葱状的生长环结构并最终构成了淀粉颗粒[2,4]。研究淀粉内部微观结构不仅可以更精确地指导淀粉改性研究,对于优化食品加工条件、提升大分子科学研究水平具有重要意义。
1 淀粉颗粒微观结构的研究进展
1.1淀粉颗粒及其形状对淀粉理化性质的影响
淀粉颗粒大多为椭圆形、球形、圆饼形、多角形以及其他不规则的形状,淀粉颗粒大小是影响淀粉糊化特性、分散性以及消化性能等理化特性的重要因素[5]。一般而言,同种淀粉颗粒越小,其溶解度越高、糊化温度越低[4]。颗粒尺寸越大的淀粉越难以消化,此外淀粉的消化性质还与其颗粒形状、表面粗糙程度、颗粒面凹痕密集度以及缝隙数量等形貌特征息息相关[5]。
一般而言,同种植物中存在的淀粉结晶类型相同,但在某些作物也常出现不同类型的淀粉,Cai等[6]发现在高直链玉米淀粉中,颗粒尺寸较大的淀粉大多为A-型淀粉,而中小颗粒尺寸大多为C-型淀粉。Cai等[7]和Man等[8]研究者发现分布在玉米胚乳不同区域的淀粉颗粒形态各不相同,而不同形状的淀粉也会呈现不同结晶类型,其中多角形淀粉分布于胚乳中部,呈现A-型结晶;聚集态淀粉存在于亚糊粉层和胚乳中心之间的胚乳细胞中,呈现C-型结晶;条状淀粉主要分散于与亚糊粉层相邻的外围胚乳细胞中,呈现C-型结晶;中空淀粉则分布于亚糊粉层细胞中,其主要由无定型结构组成,因而没有特定的结晶形态。
1.2生长环结构
淀粉的生长环又称壳层结构,其主要分为半结晶生长环和无定型生长环(图1(b)),这两种层状结构以淀粉脐点为中心交替出现[9]。生长环结构中存在着大量的小体,其中存在于半结晶生长环中的小体平均尺寸约50~500 nm,排布紧密有序;而无定型生长环中的小体平均尺寸仅为20 nm左右,且排布较为松弛。TANG等[10]认为,分布在半结晶生长环中的小体结构较为完整,而存在于无定型生长环中的小体结构存在缺陷。在晶体结构方面,半结晶生长环主要呈现出结晶与无定型的混合态层状结构,而无定型生长环结构较不规则,且稳定性差[11]。在壳层深处、淀粉颗粒的中心脐点则附近分布着大量的直链淀粉[2]。
1.3小体结构
小体结构(blocklet)又称为止水塞结构(图1(c)),其由Badenhuizen于1937年首次提出并证实为淀粉颗粒中天然存在的结构单元。类似于生长环结构,小体中同样存在交替排列的结晶区和无定型区,其结晶区主要由支链淀粉双螺旋排列而成的片状结晶构成,其无定型区域中存在着直链淀粉、脂质、磷组分,一般而言,直链淀粉与支链淀粉分支点也呈现出无定型结构[12]。根据国外学者的研究表明,几乎所有淀粉都含有磷元素,然而不同植物淀粉颗粒中存在的磷脂组分也不尽相同,主要为磷脂和磷酸单酯,其中谷物淀粉以磷脂为主,豆类和马铃薯中主要为磷酸单酯,植物根茎中的淀粉几乎不含磷酸单脂以外的磷组分[13-14]。小体中存在的脂质也可以与直链淀粉螺旋结构形成复合物[10]。小体根据其结构又可以分为完整小体和缺陷小体,其中完整小体主要由支链淀粉簇状结晶组成,而缺陷小体中含有较多的直链淀粉和无定型结构。完整小体构成的生长环结构较为硬实,而由缺陷小体构成的生长环质地较软[10]。
研究小体的清晰结构首先要对淀粉颗粒进行预处理来破坏淀粉的外壳结构,目前尚未发现较为完善的小体分离方法,这使得淀粉小体研究具有局限性。使用原子力显微镜(atomic force microscopy,AFM)和扫描电镜(scanning electron microscope,SEM)是常见的淀粉小体观测手段[10]。在AFM观测下,小体展示出了较不对称的球状结构;而在SEM高倍数的成像下,小体常为堆积态,并附着在淀粉壳层结构内表面上[15]。目前而言,关于小体结构的研究大多集中在改性淀粉中小体结构的变化。严青[15]通过不完全糊化法发现小体的尺寸介于30~150 nm之间,其尺寸与淀粉颗粒大小、结晶度以及直链淀粉含量无关。任瑞珍[16]使用酶解法观测淀粉小体结构,发现不同种类淀粉中的小体紧凑程度不同。孙沛然[14]使用高静水压处理对淀粉进行改性并研究了小体结构发生的变化,结果表明随着压力和淀粉浓度的升高,缺陷小体结构先增加后减少,小体结构首先由单体发生团聚,之后团聚结构消失。
1.4小体内片状结晶结构
小体内部片状结晶结构(图1(d))主要由支链淀粉双螺旋簇状结构组成[17],其又可以分为晶体状片层(Crystalline lamella)和无定型片层(Amorphous lamella)。其中晶体状片层含有大量的支链淀粉双螺旋结构,而无定型片层中支链淀粉双螺旋结构较为稀疏,并含有脂质和直链淀粉等其他组分[10]。
支链淀粉双螺旋结构主要有两种结晶排列方式,即单斜结晶和六方结晶,前者被定义为A-型晶体,只含有A-型晶体的淀粉称为A-型淀粉,其主要分布于谷类作物中;后者则称为B-型晶体,只含有B-型晶体的淀粉称为B-型淀粉,主要存在于植物的块根和块茎中;由A-型晶体和B-型晶体均匀混合形成的晶体称为C-型晶体,含有C-型晶体的淀粉主要存在于豆科植物及某些植物种子中[5]。
研究表明,A-型淀粉的小体尺寸较小,其直径在25~100 nm之间,而B-型淀粉小体尺寸较大,约为400~500 nm[18]。导致两种淀粉中小体尺寸不一的原因可能是由于A-型淀粉晶体属于单斜晶系,晶体紧凑而致密,含有的水分子较少;而B-晶体属于六方晶系,晶体中可以容纳较多的水分子[19](图1(e))。Doblado-Maldonado等[20]发现,每个淀粉单斜结晶内含有8个水分子,而每个淀粉六方结晶中容纳了36个水分子。一般而言,A-型晶体较B-型晶体更为稳定,C-型晶体的稳定性介于两者之间,其原因大致是由于A-型晶体中水分较少,结构致密而紧凑;而B-型晶体中水分子含量较高,其结构更容易受热处理等外界条件影响。Wang等[21]发现,分布于山药淀粉中的A-型晶体相比于B-型晶体更耐受酸水解,这与A-型晶体内较少的水分和致密的结构有关。Cai等[22]通过热台显微镜和X-射线衍射对淀粉热糊化过程进行研究,发现在加热至70 ℃时,B-型晶体全部被破坏;当加热至75 ℃时,C-型晶体消失;当温度提升至85 ℃时,A-型晶体被破坏,颗粒成为无定型结构,淀粉完全糊化,表明在糊化过程中,A-型晶体热稳定性最强,其次是C-型晶体,而B-型晶体热稳定性最差。
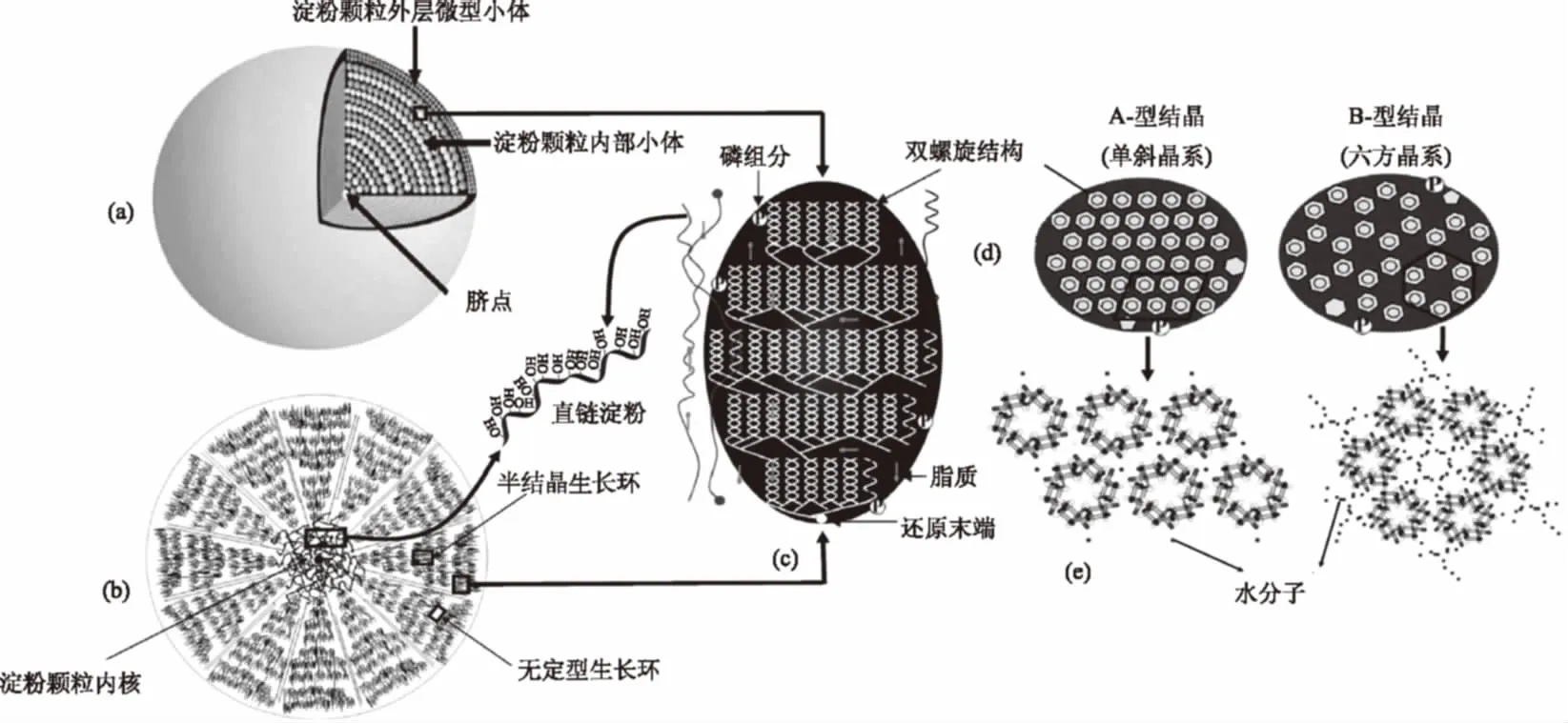
图1 淀粉颗粒结构模型图[2,10,19,26]Fig.1 The architecture of starch granule[2,10,19,26]注:a:淀粉颗粒构造图;b:淀粉颗粒切面示意图;c:小体结构示意图;d:小体及其结晶俯视图;e:单斜晶体与六方晶体示意图。
1.5直链淀粉与支链淀粉
早在1940年,Meyer和Schoch发现直链淀粉和支链淀粉是构成淀粉颗粒有序结构的最基本葡聚糖单元。直链淀粉的平均相对分子质量在1×105~9×106之间[20]。在食品的加工过程中,直链淀粉是导致食品老化的重要因素,然而近年来越来越多的研究表明,直链淀粉所形成的双螺旋老化淀粉具有抗消化甚至增殖肠道菌群的作用,其被定义为RS3型抗性淀粉[2]。直链淀粉还可以与脂质发生复合,形成的直链淀粉-脂质复合物被称为RS5型抗性淀粉[23]。
支链淀粉是自然界中存在的最大的高聚物之一,其分子量在1×107~1×109之间[24]。根据链长与分支度可以将其链状结构分为三种,即A链、B链和C链(图2)。A链(DP 6~12)为最外部不含分支的侧链;B链与其他分支相连,又分为B1链(DP 13~24)、B2链(DP 25~26)和B3链(DP>37);C链在每个支链分子中仅有一条,且含有支链分子中唯一的还原型末端[25]。
2 淀粉颗粒结晶结构与转化
淀粉中的A-、B-和C-型晶体可以在特定条件下发生相互转化,其原因是由于在改性过程中常伴有晶体的形成、转化与破坏[5]。当酸碱及热处理等改性强度较高时,还会导致淀粉结晶消失,形成无定型结构。
在酸碱改性、热台处理以及氧化改性的条件下,淀粉晶体常由C-型结构转变成A-型结构。这样的变化是由于晶体结构稳定性差异所致,B-型晶体对酸碱耐受性低于A-型晶体。Wang等[27]发现C-型山药淀粉随着酸处理时间的延长,淀粉颗粒出现“中空”现象,其内部结构消失并伴随着B-型X-射线衍射峰消失,图谱呈现A-型结构。这表明B-型晶体绝大部分存在于淀粉颗粒内部,A-型晶体主要分布于山药淀粉颗粒外部。Cai等[22]使用热台显微镜结合X-射线衍射图谱研究了C-型莲藕淀粉的结晶分布,发现B-型结晶最先被破坏,其次是A-型结晶,淀粉颗粒最终呈现出无定型结构。Thys等[28]发现B-型结晶对碱的耐受能力不如A-型结晶,碱处理使得C-型结晶中的B-型结晶分解,导致C-型淀粉结晶转变为A-型结晶。C-型结晶同样可以转化为B-型结晶,Wang等[29]的研究表明,使用退火处理可以使C-型淀粉结晶中的A-型结晶转化为B-型晶体,发生这种现象的原因是由于在退火过程中,A-型结晶的双螺旋中渗入了水分子,支链淀粉双螺旋结构发生重排,导致单斜晶体向六方晶体转化,而且B-型晶体较A-型晶体对退火处理耐受性更强[30]。高静水压处理同样可以使C-型结晶和A-型结晶向B-型结晶转化,在高静水压条件下,A-型结晶也会发生结构重排,导致B-型结晶的出现[31-32]。由此可以看出,A-型晶体转变为C-型晶体的过程大致可以概括为A-型晶体向B-型晶体的不完全转化,B-型晶体同样可以向着C-型和A-型晶体发生转变。Jiranuntakul等[33]使用湿热处理法将马铃薯淀粉由B-型结晶转变为C-型结晶,并增强了淀粉的抗消化性。
3 淀粉改性技术对淀粉颗粒结构的影响
3.1糊化与老化过程中淀粉颗粒结构的变化
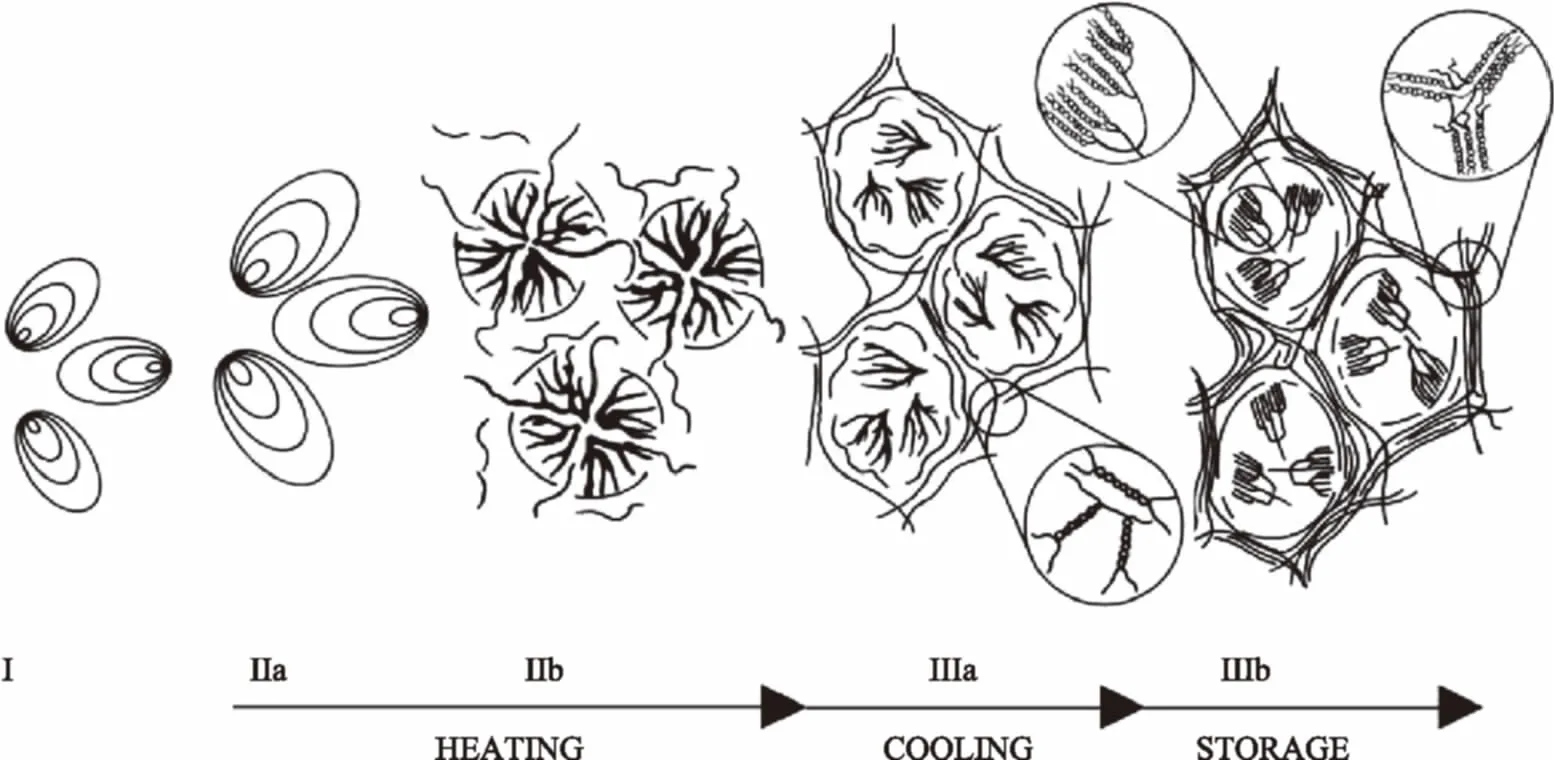
图3 淀粉颗粒从糊化到老化发生的结构变化[2]Fig.3 The transformation of starch granule structure from gelatinization to retrogradation[2]注:Ⅰ:天然淀粉颗粒;Ⅱa:糊化过程中淀粉颗粒膨胀;Ⅱb:淀粉颗粒结构破坏,直链淀粉溢出;Ⅲa:老化阶段,直链淀粉双螺旋网状结构形成;Ⅲb:储藏阶段,支链淀粉形成有序晶体结构。
糊化是淀粉在食品加工中最常见的结构变化之一,在糊化过程中(图3:Ⅱa-Ⅱb),淀粉颗粒结构首先发生膨胀吸水导致体积变大,之后颗粒结构被破坏,分布于无定型结构和颗粒中心的直链淀粉暴露出来,淀粉体系呈糊状液体。在这个过程中淀粉颗粒淀粉失去双折射现象,晶体结构逐渐消失。体系温度的降低以及贮藏阶段常伴随着老化过程(图3:Ⅲa-Ⅲb)。在降温过程中,糊化阶段暴露出来的直链淀粉很容易形成双螺旋网状结构,即老化直链淀粉;长期的贮藏过程则导致支链淀粉中较长的分支形成有序的晶体结构,加剧了淀粉的老化作用[2]。
老化过程在大多淀粉类食品加工中对食品品质造成不良影响,如导致烘焙类食品组织变硬、结构松散、弹性消失等不良变化。在一些特定的食品,如粉条、米线、蒸谷米、土豆泥等食品,淀粉老化在改善食品口感质地方面起到了重要作用。在食品的加工业中,食品的原料和添加物对淀粉老化具有较大的影响,如脂质、蛋白质和酚类等物质常常在食品的糊化过程中与淀粉发生相互作用,一方面阻碍了水分子的渗透作用,从而抑制了直链淀粉的溶出;另一方面,复合体系形成了空间位阻,抑制了直链淀粉的游移和支链淀粉的重结晶作用[2]。适度控制食品体系中的水分含量,对于淀粉老化的抑制也有重要意义[2,20]。
3.2物理改性对淀粉颗粒结构的影响
超高压处理技术最早出现于19世纪末,由于其在非热条件下可以对食品起到杀菌灭酶而被广泛的应用于食品研究中。超高压处理还常被应用在淀粉改性领域中,以静态水为介质传递高压,引起淀粉颗粒、结晶结构以及理化性质的改变。本课题组研究表明,随着静水压力升高,C-型淀粉结晶转变为B-型,淀粉结晶程度下降,颗粒分子量降低但尺寸增加[31,34-36]。Liu等[37]研究发现,随着处理压力的升高,荞麦淀粉颗粒表面变得更为粗糙。使用120~480 MPa处理并不能改变淀粉结晶类型,当压力达到600 MPa时,淀粉由A-型结晶转变为B-型结晶。Yang等[38]使用小角X-射线散射发现超高压处理后淀粉的片状结晶厚度增加,表明超高压作用促使水分进入了淀粉的晶体结构。Li等[39]发现在600 MPa的处理条件下,淀粉完全糊化,结晶结构随着处理压力的升高而消失。
淀粉作为主粮食品的重要成分,在辐射处理过程中很容易导致其结构发生变化。经过γ-射线处理的淀粉表面常出现裂纹[40]。高剂量的γ-射线辐照处理常引起淀粉颗粒内有序结构发生紊乱,偏光十字消失,结晶区域比例下降,而支链淀粉的分支度升高[41-42]。Sofi等[43]使用广角X-射线衍射对辐照处理后的淀粉进行研究,发现γ-射线使淀粉结晶衍射强度明显下降,说明有序的结晶结构发生破坏。
研究表明,超声波处理淀粉可以制得多孔淀粉,Sujka等[44]发现相比于小麦、大米和马铃薯淀粉,超声波导致玉米淀粉产生的孔隙孔径较小。Hu等[45]发现双频超声波可以使淀粉表面产生更多的空穴,甚至导致淀粉表面被破坏。Chang等[46]使用超声波法制得了淀粉纳米颗粒,有效的降低了其生产成本。
湿热法是最常见的淀粉改性方法之一,在湿热改性过程中,淀粉的颗粒形貌、晶体结构以及分子链都会受到影响。Wang等[47]发现湿热改性破坏了淀粉颗粒的完整性,促使淀粉链重排,并提升了慢消化淀粉的含量。Huang等[48]发现脱支-湿热法处理得到的抗性淀粉和慢消化淀粉明显高于脱支处理后的淀粉。Tan等[49]发现湿热法可以降低淀粉分子量,提高直链淀粉含量,降低淀粉结晶度。
3.3化学改性对淀粉颗粒结构的影响
酸处理是最常见的淀粉改性和研究方法之一。在模拟体外消化过程中,酸常用于模拟人体中的胃液,对进入小肠中的淀粉起到部分水解作用。酸水解可以导致淀粉结晶度升高,其原因可能是一方面酸水解促进了淀粉分子链的重排,形成了更为有序的结构;另一方面酸水解导致直链淀粉形成双螺旋结晶结构[9]。酸水解法是研究C-型淀粉颗粒结构的常见方法。Wang等[21]发现酸首先分解山药淀粉中的无定型生长环,当酸处理时间较长时,结晶生长环才开始分解;X-射线衍射结果表明无定型生长环呈B-型结构,而结晶生长环呈A-型结构。
乙酰化淀粉是使用乙酸酐对天然淀粉或水解淀粉进行改性而得到的多功能材料,其广泛应用于食品加工、生物可降解膜以及药品控释等领域。Shah等[50]将淀粉乙酰化制得RS4型抗性淀粉并研究了其结构,发现乙酰化淀粉表面产生较多小孔,有助于对小分子产生包埋作用。García-Tejeda等[51]的研究表明,使用盐酸预处理的蜡质玉米淀粉经乙酰化处理后对花青素的包埋率更高。Hong等[52]发现使用脉冲电场辅助淀粉的乙酰化过程可以节约时间,并提高乙酰基淀粉的取代度。
氧化淀粉因其具有较好的成膜性、稳定性、吸附性和高透光性而常应用于食品加工、纺织、医药和造纸等工业。在工业生产中,次氯酸钠是生产氧化淀粉最为常用的氧化剂。Vanier等[53]发现氧化作用增加了淀粉中羧基和羰基的含量,使得淀粉的水溶性提升,而凝胶强度和相对结晶度降低。Li等[54]的研究表明氧化作用导致淀粉颗粒结构发生破坏,并使淀粉的结晶类型发生转变。Zhang等[55]使用氧化淀粉和甘油制得了一种韧性较强的热塑性淀粉,为绿色环保型材料的发展提供了新思路。
4 展望
我国淀粉产量巨大,淀粉在食品、医药、轻纺、化工等加工领域的应用越来越广泛。研究淀粉颗粒微观结构和晶体构造不仅可以为研究改性淀粉结构提供理论基础,还增强了改性技术的针对性,从微观上指导了变性淀粉的研究方向。目前而言,对于淀粉颗粒中的生长环结构和小体结构研究较少,关于两者之间的构效关系尚不明朗,改性对生长环和小体结构影响的研究较为匮乏。根据淀粉的结晶特性对淀粉进行改性的研究以及改性后淀粉的微观结构的研究也较少。因此,针对淀粉微观结构的研究应更多去探索改性对淀粉微观结构的影响,加强淀粉结晶转化的工业应用研究。总而言之,淀粉作为一种绿色环保的多功能材料,其在改性开发方面具有广阔的前景。
[1]Zhu Y,Romain C,Williams C K. Sustainable polymers from renewable resources[J]. Nature,2016,540(7633):354-362.
[2]Wang S,Li C,Copeland L,et al. Starch Retrogradation:A Comprehensive Review[J]. Comprehensive Reviews in Food Science & Food Safety,2015,14(5):568-585.
[3]金征宇,田耀旗. 淀粉结晶控制与利用技术研究进展[J]. 中国食品学报,2016,16(5):1-9.
[4]Le Corre D,Bras J,Dufresne A. Starch nanoparticles:a review[J]. Biomacromolecules,2010,11(5):1139-1153.
[5]Guo Z,Jia X,Zhao B,et al. C-type starch and its derivatives:Structure and Function[J]. Annals of the New York Academy of Sciences,2017,1398:47-61.
[6]Cai C,Lin L,Man J,et al. Different structural properties of high-amylose maize starch fractions varying in granule size[J]. Journal of Agricultural and Food Chemistry,2014,62(48):11711-11721.
[7]Cai C,Huang J,Zhao L,et al. Heterogeneous structure and spatial distribution in endosperm of high-amylose rice starch granules with different morphologies[J]. Journal of Agricultural and Food Chemistry,2014,62(41):10143-10152.
[8]Man J,Lin L,Wang Z,et al. Different structures of heterogeneous starch granules from high-amylose rice[J]. Journal of Agricultural and Food Chemistry,2014,62(46):11254-11263.
[9]Wang S,Copeland L. Effect of acid hydrolysis on starch structure and functionality:A review[J]. Critical Reviews in Food Science and Nutrition,2015,55(8):1081-1097.
[10]Tang H,Mitsunaga T,Kawamura Y. Molecular arrangement in blocklets and starch granule architecture[J]. Carbohydrate Polymers,2006,63(4):555-560.
[11]Wang S,Yu J,Yu J,et al. Structure characterization of C-type starch granule by acid hydrolysis[J]. Food Hydrocolloids,2008,22(7):1283-1290.
[12]Wang T L,Bogracheva T Y,Hedley C L. Starch:as simple as A,B,C?[J]. Journal of Experimental Botany,1998,49(320):481-502.
[13]Zhu F. NMR spectroscopy of starch systems[J]. Food Hydrocolloids,2017,63:611-624.
[14]孙沛然. 高静压对玉米淀粉颗粒结构的影响[D]. 北京:中国农业大学,2015.
[15]严青. 不完全糊化法研究淀粉颗粒的外壳和小体结构[D]. 西安:陕西科技大学,2015.
[16]任瑞珍. 酶解法研究三种薯类淀粉的壳层和小体结构[D]. 西安:陕西科技大学,2015.
[17]Saibene D,Seetharaman K. Amylose involvement in the amylopectin clusters of potato starch granules[J]. Carbohydrate Polymers,2010,82(2):376-383.
[18]Perez S,Bertoft E. The molecular structures of starch components and their contribution to the architecture of starch granules:A comprehensive review[J].Starch-Stärke,2010,62(8):389-420.
[19]Damager I,Engelsen S B,Blennow A,et al. First principles insight into the alpha-glucan structures of starch:their synthesis,conformation,and hydration[J]. Chemical Reviews,2010,110(4):2049-2080.
[20]Doblado-maldonado A F,Gomand S V,Goderis B,et al. Methodologies for producing amylose:A review[J]. Critical Reviews in Food Science and Nutrition,2017,57(2):407-417.
[21]Wang S,Yu J,Yu J,et al. Granule structure of C-type Chinese Yam(Dioscorea opposita Thunb var. Zhongbowen)starch by acid hydrolysis[J]. Food Hydrocolloids,2008,22(4):538-542.
[22]Cai C,Cai J,Man J,et al. Allomorph distribution and granule structure of lotus rhizome C-type starch during gelatinization[J]. Food Chemistry,2014,142:408-415.
[23]贾祥泽,陈秉彦,赵蓓蓓,等. 直链淀粉-脂质复合物的形成及其结构性质研究进展[J]. 食品与发酵工业,2017,43(3):276-284.
[24]Tester R F,Karkalas J,Qi X. Starch-composition,fine structure and architecture[J]. Journal of Cereal Science,2004,39(2):151-165.
[25]Bemiller J N,Whistler R. L. Starch:chemistry and technology[M]. Amsterdam,Academic Press,2009.
[26]Huang J,Wei N,Li H,et al. Outer shell,inner blocklets,and granule architecture of potato starch[J]. Carbohydrate Polymers,2014,103:355-358.
[27]Wang S,Yu J,Zhu Q,et al. Granular structure and allomorph position in C-type Chinese yam starch granule revealed by SEM,13 C CP/MAS NMR and XRD[J]. Food Hydrocolloids,2009,23(2):426-433.
[28]Thys R C S,Westfahl JR H,Norea C P Z,et al. Effect of the alkaline treatment on the ultrastructure of C-type starch granules[J]. Biomacromolecules,2008,9(7):1894-1901.
[29]Wang S,Jin F,Yu J. Pea starch annealing:New insights[J]. Food and Bioprocess Technology,2013,6(12):3564-3575.
[30]Zhang B,Wu C,Li H,et al. Long-term annealing of C-type kudzu starch:Effect on crystalline type and other physicochemical properties[J]. Starch-Stärke,2015,67:577-584.
[31]Guo Z,Zeng S,Lu X,et al. Structural and physicochemical properties of lotus seed starch treated with ultra-high pressure[J]. Food Chemistry,2015,186:223-230.
[32]Liu H,Fan H,Cao R,et al. Physicochemical properties andinvitrodigestibility of sorghum starch altered by high hydrostatic pressure[J]. International Journal of Biological Macromolecules,2016,92:753-760.
[33]Jiranuntakul W,Puttanlek C,Rungsardthong V,et al. Microstructural and physicochemical properties of heat-moisture treated waxy and normal starches[J]. Journal of Food Engineering,2011,104(2):246-258.
[34]Guo Z,Zeng S,Zhang Y,et al. The effects of ultra-high pressure on the structural,rheological and retrogradation properties of lotus seed starch[J]. Food Hydrocolloids,2015,44:285-291.
[35]Guo Z,Chen B,Lu X,et al. Structural,Pasting,and Thermal Properties of Ultra-High Pressure-treated Lotus Seed Starch[J]. Chinese Journal of Structural Chemistry,2014,33(4):647-653.
[36]Guo Z,Liu W,Zeng S,et al. Effect of Ultra High Pressure Processing on the Particle Characteristics of Lotus-Seed Starch[J]. Chinese Journal of Structural Chemistry,2013,32(4):525-532.
[37]Liu H,Guo X,LI Y,et al.Invitrodigestibility and changes in physicochemical and textural properties of tartary buckwheat starch under high hydrostatic pressure[J]. Journal of Food Engineering,2016,189:64-71.
[38]Yang Z,Swedlund P,Hemar Y,et al. Effect of high hydrostatic pressure on the supramolecular structure of corn starch with different amylose contents[J]. International Journal of Biological Macromolecules,2016,85:604-614.
[39]Li W,Tian X,Liu L,et al. High pressure induced gelatinization of red adzuki bean starch and its effects on starch physicochemical and structural properties[J]. Food Hydrocolloids,2015,45:132-139.
[41]Chung H J,Liu Q. Molecular structure and physicochemical properties of potato and bean starches as affected by gamma-irradiation[J]. International Journal of Biological Macromolecules,2010,47(2):214-222.
[42]Chung H J,Liu Q. Effect of gamma irradiation on molecular structure and physicochemical properties of corn starch[J]. Journal of Food Science,2009,74(5):C353-C361.
[43]Sofi B A,Wani I A,Masoodi F A,et al. Effect of gamma irradiation on physicochemical properties of broad bean(Vicia faba L.)starch[J]. LWT-Food Science and Technology,2013,54(1):63-72.
[44]Sujka M. Ultrasonic modification of starch-Impact on granules porosity[J]. Ultrasonics Sonochemistry,2017,37:424-429.
[45]Hu A,Jiao S,Zheng J,et al. Ultrasonic frequency effect on corn starch and its cavitation[J]. LWT-Food Science and Technology,2015,60(2):941-947.
[46]Chang Y,Yan X,Wang Q,et al. High efficiency and low cost preparation of size controlled starch nanoparticles through ultrasonic treatment and precipitation[J]. Food Chemistry,2017,227:369-375.
[47]Wang H,Wang Z,Li X,et al. Multi-scale structure,pasting and digestibility of heat moisture treated red adzuki bean starch[J]. International Journal of Biological Macromolecules,2017,102:162-169.
[48]Huang T T,Zhou D N,Jin Z Y,et al. Effect of debranching and heat-moisture treatments on structural characteristics and digestibility of sweet potato starch[J]. Food Chemistry,2015,187:218-224.
[49]Tan X,Li X,Chen L,et al. Effect of heat-moisture treatment on multi-scale structures and physicochemical properties of breadfruit starch[J]. Carbohydrate Polymers,2017,161:286-294.
[50]Shah A,Masoodi F A,Gani A,et al. Physicochemical,rheological and structural characterization of acetylated oat starches[J]. LWT-Food Science and Technology,2017,80:19-26.
[51]García-tejeda Y V,Salinas-moreno Y,Martínez-bustos F. Acetylation of normal and waxy maize starches as encapsulating agents for maize anthocyanins microencapsulation[J]. Food and Bioproducts Processing,2014,94:717-726.
[52]Hong J,Chen R,Zeng X A,et al. Effect of pulsed electric fields assisted acetylation on morphological,structural and functional characteristics of potato starch[J]. Food Chemistry,2016,192:15-24.
[53]Vanier N L,Da Rosa Zavareze E,Pinto V Z,et al. Physicochemical,crystallinity,pasting and morphological properties of bean starch oxidised by different concentrations of sodium hypochlorite[J]. Food Chemistry,2012,131(4):1255-1262.
[54]Li X,Gao W,Jiang Q,et al. Physicochemical,crystalline,and thermal properties of native,oxidized,acid,and enzyme hydrolyzed Chinese yam(Dioscorea opposite Thunb)starch[J]. Starch-Stärke,2011,63(10):616-624.
[55]Zhang Y R,Wang X L,Zhao G M,et al. Influence of oxidized starch on the properties of thermoplastic starch[J]. Carbohydrate Polymers,2013,96(1):358-364.
Researchprogressinstarchmicro-architectureandcrystaltransformation
KANGYu-jie1,JIAXiang-ze1,2,ZHENGShao-ting1,SUNSi-wei1,2,CHENJing-yan1,GUOZe-bin1,2,*
(1.College of Food Science,Fujian Agriculture and Forestry University,Fuzhou 350002,China;2.Fujian Provincial Key Laboratory of Quality Science and Processing Technology in Special Starch,Fuzhou 350002,China)
The micro-architecture and crystal structure of starch granule are not only closely related to food texture,processability,and digestibility,but also endow starch with extensive adjustability. The broad-spectrum application in food processing,chemical industry and pharmacy makes starch a critical functional material in various fields. In this review,advances of late years in starch granule micro-structure were introduced. The correlation between crystal type and granular structure was discussed. Transformation amongst different crystals and effects of modifications on granule structure were also investigated.
starch granule architecture;crystal transformation;modification
TS231
A
1002-0306(2017)19-0316-07
10.13386/j.issn1002-0306.2017.19.058
2017-06-09
康昱倢(1996-),女,本科,研究方向:食品营养与化学,E-mail:18965016672@163.com。
*通讯作者:郭泽镔(1986-),男,博士,副教授,研究方向:食品营养与化学,E-mail:gzb8607@163.com。
国家自然科学基金(31501485);福建农林大学杰出青年科研人才计划项目(xjq201618);福建农林大学高水平大学建设项目(612014042)。

