响应曲面法优化鸭肫酶解制备抗氧化肽工艺
, , ,,,,*
(1.贵州大学酿酒与食品工程学院,贵州贵阳 550025;2.贵州大学生命科学学院,贵州贵阳 550025)
响应曲面法优化鸭肫酶解制备抗氧化肽工艺
苏伟1,齐琦2,文飞1,唐素婷1,母应春1,邱树毅1,*
(1.贵州大学酿酒与食品工程学院,贵州贵阳 550025;2.贵州大学生命科学学院,贵州贵阳 550025)
在单因素实验基础上应用响应面法对鸭肫抗氧化肽制备工艺进行优化。在前期筛选酶解鸭肫的最佳蛋白实验中得到木瓜蛋白酶为酶解鸭肫蛋白的最佳作用酶,优化的鸭肫抗氧化肽最佳工艺条件为:酶解时间4.0 h、加酶量0.5%、酶解温度55 ℃、料液比1∶3 g/mL。在此条件下,酶解鸭肫蛋白的水解度可达28.30%,DPPH·清除率为75.10%。结果表明该鸭肫抗氧化肽工艺制备可行,鸭肫蛋白水解度与DPPH自由基清除能力之间不存在相关性。
鸭肫,蛋白质,酶解,响应面实验
三穗鸭原产于贵州省东部低山丘陵河谷地带,以三穗县为中心,分布于镇远、岑巩、天柱、台江、剑河、锦屏等县[1]。目前,对于鸭肫的研究主要是其腌制工艺方面的研究,对于其抗氧化活性等功能特性研究报告较少[2-3]。卿晓红、熊绿芸[4]等人曾对贵州三穗鸭肉及蛋的蛋白质、氨基酸、矿物质、维生素等营养成分做了粗略的研究分析,但关于三穗鸭鸭肫方面的研究目前尚未见报道。鸭肫即鸭胃,形状扁圆,肉质紧密,紧韧耐嚼,不油腻。野鸭肫味甘、性平、咸[5],有健胃之效,上腹饱胀、消化不良者,可多吃鸭肫[6]。鸭肫的主要营养成分有碳水化合物、蛋白质、脂肪、烟酸、维生素C、维生素E和钙、镁、铁、钾、磷、钠、硒等矿物质。鸭肫铁元素含量较丰富,贫血病患者尤其适用。
自由基具有重要的生理学功能,适宜的自由基浓度对人体有益[7]。然而,当机体细胞内自由基的产生和清除机制失去平衡时,会发生氧化应激反应,将会导致血脂紊乱、动脉粥样硬化等一系列疾病的发生[8-9]。因此补充抗氧化剂对于人类健康生活十分重要。人工合成的抗氧化剂虽然能有效地清除自由基,但是有一定的毒副作用。所以,抗氧化肽的制备主要通过食源性蛋白酶解获得,所得的抗氧化肽具有天然的抗氧化活性[10-15]。目前,生物酶解已成为制备抗氧化肽的主要方式[16-17],通过生物酶解,将会提高抗氧化氨基酸的暴露程度[18],从而加大其抗氧化能力,但所采用的蛋白酶种类及其工艺条件在很大程度上影响着酶解产物的抗氧化功效[19-26]。本实验在单因素实验的基础上设计响应面实验优化鸭肫蛋白质的酶解条件,以期为鸭肫的开发利用及深加工提供理论依据。
1 材料与方法
1.1材料与仪器
鸭肫 贵州省三穗县千里山生态食品股份有限公司;木瓜蛋白酶(酶活力80 万U/g) 南宁庞博生物工程有限公司;氢氧化钠、甲醛 成都金山化学试剂有限公司,DPPH 美国Sigma 公司。
BS124S电子分析天平 赛多利斯科学仪器北京有限公司;DK-98-IIA型电热恒温水浴锅 天津市泰斯特仪器有限公司;78-1磁力加热搅拌器 常州澳华仪器有限公司;pHS-3C 上海佑科仪器仪表有限公司;SpectraMax-190酶标仪 美国Molecular Devices公司。
1.2实验方法
1.2.1 鸭肫预处理 取放置于冰箱冷冻的鸭肫,自来水解冻1 h,去筋,剁碎,用粉碎机将其粉碎成浆液。
参照王桂林[27]等的方法对鸭肫进行脱脂。将粉碎后的鸭肫加入石油醚浸泡12 h,倒出石油醚,于通风橱中晾置2 h,让残留石油醚彻底挥发,装袋保藏于冰箱中备用。
1.2.2 水解度测定 水解液中氨基氮含量参照林娈[28-33]等的方法由甲醛电位滴定法测得,样品中总氮由凯氏定氮法测得。水解度计算公式如下:
水解度(hydrolysis degree,DH,%)=水解后生成的氨基氮含量/样品中总氮含量×100
式(1)
1.2.3 DPPH自由基的清除率的测定 将2 mL DPPH自由基溶液(0.2 mol/L,95%乙醇溶液)置于试管中加入2 mL酶解液,振荡混匀,室温避光反应30 min后,在517 nm处测其吸光值(Ai)。对照组为2 mL DPPH自由基容液加上95%乙醇溶液在测定波长下的吸光值(Ac),2 mL酶解液和2 mL 95%乙醇溶液混和后测定波长下的吸光值为(Aj)。DPPH自由基的清除能力用R表示:
R(%)=[1-(Ai-Aj)/Ac]×100
式(2)
1.2.4 酶解工艺流程 原料预处理→加水匀浆→调节pH→恒温酶解→灭酶→冷却→过滤→水解液→测水解度
1.2.5 单因素实验及响应面实验设计
1.2.5.1 单因素实验 本课题由于在前期实验基础上,已进行了酶解鸭肫的最佳蛋白筛选实验,并得到木瓜蛋白酶为酶解鸭肫蛋白的最佳作用酶[3],在此基础上进行有关鸭肫抗氧化肽的响应面设计。
在酶解温度45 ℃、加酶量0.2%、pH为5.5、料液比为1∶3 g/mL的条件下,调节酶解时间1、2、3、4、5、6 h,考察酶解时间对DPPH自由基清除率、水解度的影响。
在酶解时间3 h、加酶量0.2%、pH为5.5、料液比为1∶3 g/mL的条件下,调节酶解温度40、45、50、55、60 ℃,考察酶解温度对DPPH自由基清除率、水解度的影响。
在酶解时间3 h、酶解温度50 ℃、pH为5.5、料液比为1∶3 g/mL的条件下,调节加酶量0.1%、0.2%、0.4%、0.6%、0.8%,考察酶解温度对DPPH自由基清除率、水解度的影响。
在酶解时间3 h、酶解温度50 ℃、加酶量为0.2%、料液比为1∶3 g/mL的条件下,调节pH5.5、6.0、6.5、7.0、7.5、8.0,考察pH对DPPH自由基清除率、水解度的影响。
在酶解时间3 h、酶解温度50 ℃、加酶量为0.2%、pH为5.5的条件下,调节料液比1∶1、1∶2、1∶3、1∶4、1∶5 g/mL,考察料液比对DPPH自由基清除率、水解度的影响。
1.2.5.2 响应面实验设计 在单因素实验的基础之上,以酶解温度A、加酶量B、料液比C、酶解时间D为变量,水解度及DPPH自由基清除率为响应值进行优化,实验因素水平编码表1。

表1 因素水平编码表Table 1 Factors and levels table
1.2.6 数据处理 采用Design Expert.V8.0.6软件进行响应面实验设计及数据分析。
2 结果与分析
2.1木瓜蛋白酶水解鸭肫蛋白单因素实验

图1 木瓜蛋白酶酶解时间对鸭肫蛋白水解度和DPPH·清除率的影响Fig.1 Effect of enzymatic hydrolysis time of papainon hydrolysis degree and DPPH·clearance rate of duck gizzard protein
2.1.1 酶解时间对水解度和DPPH自由基清除率的影响 从图1可以看出,酶解过程中随着水解时间的延长,鸭肫对DPPH·的清除率均呈先上升后下降的趋势。酶解时间>3 h后,水解度基本保持不变,不再随着时间的增加而变化,DPPH·清除率上升趋势变得缓慢,在5 h才达到最大值,两者不呈一致性。依据酶反应动力学可知这是由于在反应初期的酶活力及底物浓度较高,环境中的蛋白质含量较少,有利于水解反应向着正反应方向进行,但随着时间的延长,由于酶的活性部分的损失和底物浓度的下降,使得水解反应变得缓慢,最终水解趋于完全,酶解速率基本不变[34]。酶解时间过长蛋白肽会被水解成更小的肽或氨基酸,会减弱其抗氧化性[35-36],与吴靖娜[37]、何婷[38]等研究结果相似。综合考虑酶解时间为3 h时鸭肫蛋白水解度和DPPH·清除率都较佳。
2.1.2 酶解温度对水解度和DPPH自由基清除率的影响 图2中显示,随着酶解温度的升高,在50 ℃时DPPH·清除率最大,水解度在酶解温度为50~55 ℃时水解度趋于平缓,当酶解温度高于55 ℃时,水解度呈现出下降的趋势。可能是由于蛋白酶本身也是蛋白质,酶解温度是酶活力影响的关键因素,酶解温度对其影响比较敏感,当酶解温度为蛋白酶的最适酶解温度时,其活力最强,对原料的水解作用也最大;当酶解温度超过最适酶解温度时,其结构会发生变化而导致变性,这就导致了水解作用的减弱和终止[31]。故选取50 ℃为最适酶解温度。

图2 木瓜蛋白酶酶解温度对鸭肫蛋白水解度和DPPH·清除率的影响Fig.2 Effect of papain enzyme hydrolysis temperatureon hydrolysis degree and DPPH·scavenging rate of duck gizzard protein
2.1.3 加酶量对水解度和DPPH自由基清除率的影响 加酶量对水解度的影响主要受蛋白酶与底物蛋白的结合位点,还受底物与蛋白酶形成的中间复合物的量的影响,反应初期,由于底物蛋白与酶的结合位点还没被完全占据,形成的中间复合物的量也比较少,随着加酶量的增加,从图3所示,加酶量在0.1%~0.4%之间时水解度和DPPH自由基清除率均呈现出一定的上升趋势。加酶量>0.4%后,随着加酶量的逐渐增大,DPPH·清除率增加趋势变得缓慢,水解度呈现下降的趋势。这是由于随着酶的不断加入,底物的蛋白结合位点被逐渐占据,中间复合物也达到饱和状态[32,40],此时便会导致水解度上升缓慢甚至出现下降的趋势,最后趋于平缓,图3中加酶量超过0.4% 后都出现了这一现象。因此,0.4%为木瓜蛋白酶水解鸭肫最佳的加酶量。

图3 木瓜蛋白酶加酶量对鸭肫蛋白水解度和DPPH·清除率的影响Fig.3 Effect of papain enzyme amounton hydrolysis degree and DPPH·scavenging rate of duck gizzard protein
2.1.4 pH对水解度和DPPH自由基清除率的影响 pH直接影响到酶和底物蛋白分子的某些解离基团的解离状态,从而影响到酶和底物的结合或催化,使蛋白酶的水解效果受到影响[41],只有在最适的pH条件下,酶解作用才能在最佳状态下完成,此时的pH为酶的最适pH。从图4可以看出,木瓜蛋白酶最适pH在6.0左右,在pH为6.0时鸭肫的水解度和DPPH·清除率均达到最大值,这与通常木瓜蛋白酶酶解最适pH在6.0~7.0之间的结论相一致。

图4 木瓜蛋白酶酶解pH对鸭肫蛋白水解度和DPPH·清除率的影响Fig.4 Effect of papain hydrolysis pHon hydrolysis degree and DPPH·clearance rate of duck gizzard protein

图5 不同料液比对木瓜蛋白酶酶解鸭肫蛋白水解度和DPPH·清除率的影响Fig.5 Effects of different liquid ratioon hydrolysis degree and DPPH·scavenging rate of duck gizzard protein

表2 Box-Behnken实验设计及结果Table 2 Box-Behnken experiment design and results
注:p<0.01,为高度显著,用“**”表示;p<0.05,为显著,用“*”表示;p>0.05,为不显著。
2.1.5 不同料液比对水解度和DPPH自由基清除率的影响 酶解反应是在水溶液中进行的,而且这个反应过程是一个酶促反应,水在反应中有利于分子的扩散和运动[42],从图5可以看出,料液比在1∶2~1∶4 g/mL范围内,随着料液比的增大,DPPH·清除率呈现出先增大后减小的趋势,水解度上升的趋势变得缓慢。当料液比较小时,溶液中的分子扩散不仅慢,且分布不均,所以导致在低料液比条件下,水解度较低,但料液比较高时,酶浓度被大大稀释,酶分子与原料蛋白的结合也会受到影响,所以水解度呈现出下降的趋势。另外,也有可能是酶解体系中的中间产物浓度增大,从而降低了酶水解反应的效率[43-44]。
2.2响应面设计优化实验

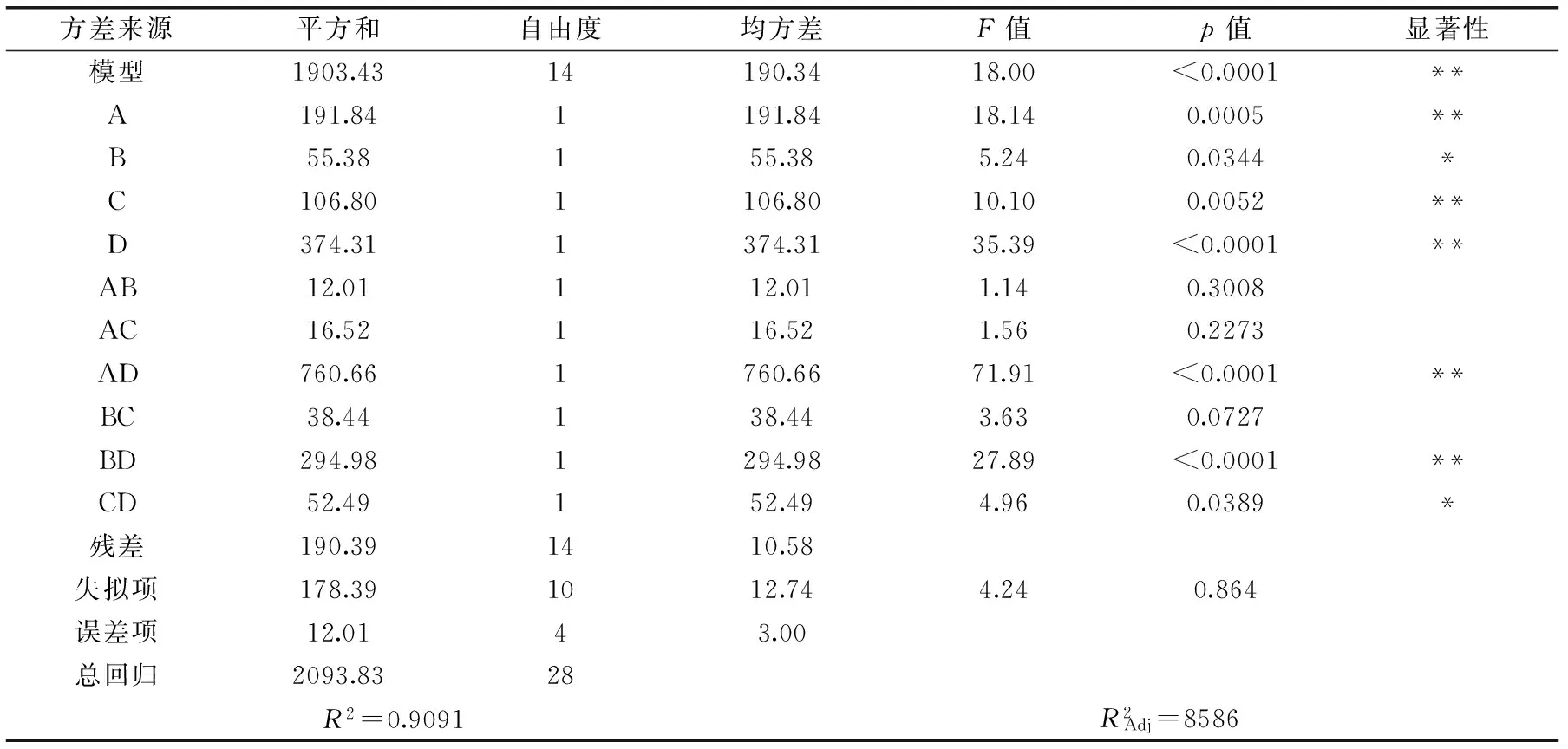
表4 DPPH·清除率回归方程各项的方差分析Table 4 Variance analysis of scavenging ability of DPPH·
注:p<0.01,为极显著,用“**”表示;p<0.05,为显著,用“*”表示;p>0.05,为不显著。
从图6可以看出,BC(加酶量和料液比)、CD(料液比和酶解时间)之间有显著交互作用,并对鸭肫蛋白酶解效果有显著影响,与方差分析表结果一致。

图6 两因素交互作用对鸭肫蛋白酶解水解度的影响Fig.6 Response surface and contour plotsfor the effect of operating parameterson the enzymatic hydrolysis of duck gizzard protein
对响应值(鸭肫蛋白水解度)与各个因素进行回归拟合,四个因素回归拟合得到与鸭肫蛋白水解度(Y)的回归方程如下:
Y(%)=34.88+0.99A+0.77B-2.41C+1.45D-0.68AB-0.18AC-0.59AD+1.20BC+0.25BD+1.00CD-5.95A2-4.45B2-5.11C2-4.66D2
2.2.2 DPPH·清除率响应面优化及结果 对响应值(对DPPH·清除率)与各个因素进行回归拟合,四个因素回归拟合得到与对DPPH·清除率(Y)的回归方程如下:
Y(%)=50.62+4.00A+2.15B-2.98C+5.59D+13.79AD-3.10BC+8.59BD-3.62CD。


图7 两因素交互作用对DPPH·清除效果的影响Fig.7 Response surface and contour plotsfor the effect of scavenging ability of DPPH·
利用Design Expert软件对多元二次方程模型进行酶解工艺条优化,其最佳酶解条件为:酶解时间3.87 h、加酶量0.49%、料液比1∶2.69 g/mL、酶解温度54 ℃,此条件酶解鸭肫蛋白,水解度理论上可达到28.30%,DPPH·清除率可达到75.22%。考虑实际操作的可行性,将上述最佳酶解条件修正为酶解时间4.0 h、加酶量0.5%、酶解温度54 ℃、料液比1∶3 g/mL。为了检验预测模型的准确性,在最佳条件下进行验证实验,实际测得蛋白质的水解度为28.42%,DPPH·清除率为75.1%,预测值和实际值无显著性差异,表明该模型能较好的预测鸭肫蛋白质的酶解条件具有可行性。
2.3鸭肫蛋白水解度与DPPH自由基清除能力的关系

图8 鸭肫蛋白水解度与DPPH自由基清除能力的关系Fig.8 Correlation between the hydrolysis degreeand the DPPH· scavenging rate
如图8所示,鸭肫蛋白水解度与DPPH自由基清除能力之间不存在相关性,体系中酶解程度加深及水解度增大后,产物中具有较强抗氧化活性的肽类部分被水解为具有较弱抗氧化活性或无抗氧化活性的肽类及游离氨基酸,导致DPPH自由基清除率减小。从图8可以看出,R2=0.047,鸭肫蛋白水解度与DPPH自由基清除能力不完全一致,说明两响应值之间不存在相关性。
3 结论
利用响应面设计优化了鸭肫蛋白质的酶解条件,并对水解度及DPPH自由基清除率之间的关系进行分析,结果表明最佳酶解条件为:酶解时间4.0 h、加酶量0.5%、酶解温度54 ℃、料液比1∶3 g/mL,在此条件下酶解鸭肫蛋白质,蛋白质的水解度为28.42%,DPPH·清除率为75.1%,实际值与预测值相符,因此利用响应曲面法优化鸭肫蛋白质的酶解条件是可行的,且酶解条件简便、温和高效。水解度及DPPH·清除率之间不存在相关性。
[1]张福平,林家栋,陈眷华,等. 贵州三穗县鸭产业发展现状及对策[J]. 贵州畜牧兽医,2010,34(4):8-9.
[2]崔震昆,谢宗福,朱琳,等. 汤爆鸭肫制作的工艺探讨[J]. 农产品加工(学刊),2009,(1):35-37
[3]苏伟,文飞,母应春,等. 鸭肫酶解工艺优化及降胆固醇活性研究[J]. 食品科技,2016,(3):144-149.
[4]卿晓红,熊绿芸. 贵州三穗鸭肉蛋的营养成分分析[J]. 贵州农学院学报,1997,16(2):63-65.
[5]邵虎,蔡进进. 五香酱野鸭肫的生产工艺[J]. 肉类工业,2007(12):7-8.
[6]Arulmathi P,Elangovan G,Begum A F,et al. Optimization of Electrochemical Treatment Process Conditions for Distillery Effluent Using Response Surface Methodology[J]. Scientific World Journal,2015(2015):581-463.
[7]Teng D. Optimization of enzymatic hydrolysis parameters for antioxidant capacity of peptide from goat placenta[J]. Food Bioprod Process,2011,89(3):202-208.
[8]Roberts C K,Sindhu K K. Oxidative stress and metabolic syndrome[J]. Life Siences,2009,84(21):705-712.
[9]Zhong S. Antioxidant properties of peptide fractions from silver carp(Hypophthalmichthysmolitrix)processing by-product protein hydrolysates evaluated by electron spin resonance spectrometry[J]. Food Chemistry,2011,126(4):1636-1642.
[10]Wang B,Li Z R,Chi C F,et al. Preparation and evaluation of antioxidant peptides from ethanol-soluble proteins hydrolysate of sphynalewini muscle[J]. Peptides,2012,36(2):240-250.
[11]Gimenez B,Aleman A,Montero P,et al. Antioxidant and functional properties of gelatin hydrolysates obtained from skin of sole and squid[J]. Food Chemistry,209,114(3):976-983.
[12]Bougatef A,Nedjar-Arroume N,Manni L,et al. Purification and identification of novel antioxidant peptides from enzymatic hydrolysates of sardinelle(Sardinellaaurita)by-products proteins[J]. Food Chenmistry,2010,118(3):559-565.
[13]Pinto E Silva M E M,Mazzilli R N,Cusin F. Composition of hydrolysates from meat[J]. Journal of Food Composition and Analysis,1999,12(3):219-225.
[14]Shahidi F,Han X Q,Synowiecki J.Production and characteristics of protein hydrolysates from capelin(Mallotusvillosus)[J]. Food Chemistry,1995,53(3):285-293.
[15]Lahl W J,Braum S D. Enzymatic production of protein hydrolysates for food use[J]. Food Technology,1994,48(10):68-71.
[16]Babini E,Tagliazucchi D,Martini S,et al. LC-ESI-QTOF-MS identification of novel antioxidant peptides obtained by enzymatic and microbial hydrolysis of vege
Table proteins[J]. Food Chemistry,2017(228):186-196.
[17]Castro R J S D,Cason V G,Sato H H. Binary mixture of proteases increases the antioxidant properties of white bean(Phaseolusvulgaris,L.)protein-derived peptides obtained by enzymatic hydrolysis[J]. Biocatalysis & Agricultural Biotechnology,2017(10):291-297.
[18]谢永洪,刘学文,王文贤,等. 鸡肉蛋白酶水解工艺条件的研究[J]. 农业工程学报,2004,20(5):207-210.
[19]杨二刚,童群义. 复合酶水解鸡肉工艺条件的优化[J]. 安徽农业科学,2008,36(14):6083-6084.
[20]卢晓蕊,欧阳杰,鲁军,等. 采用二次回归法确定鸡肉蛋白酶法水解条件[J]. 食品与发酵工业,2007,33(7):85-87.
[21]赵谋明,周雪松. 木瓜蛋白酶水解鸡肉蛋白及其产物氨基酸分析研究[J]. 食品科学,2005,26(增刊1):6-9.
[22]倪国华,宋焕禄. 鸡肉蛋白酶解物的分离[J]. 食品与发酵工业,2002,28(12):48-51.
[23]周雪松,赵谋明. 鸡肉蛋白酶解产物稳定性的研究[J]. 食品研究与开发,2007,28(8):1-4.
[24]曾卓,王金水,付雅丽. 鸡肉蛋白的酶解特性及酶解产物的抗氧化性研究[J]. 食品工业科技,2008,29(6):126-128.
[25]蔡凤英,王金水,史军,等. 鸡肉蛋白酶解物制备天然调味基料的研究[J]. 食品工业科技,2007,28(8):190-193.
[26]王桂林,张桂珍,陈智平,等. 蚕蛹蛋白的提取及应用研究[J].南昌大学学报,1994,16(2):33-37.
[27]林娈. 文蛤肉酶解工艺研究[D]. 福州:福建农林大学,2006.
[28]李侠,张利宽,刘春萌,等. 响应面法优化荞麦蛋白酶解工艺[J].食品科学,2012,33(22):145-148.
[29]熊尉杰. 利用米渣制备大米肽的研究[D]. 长沙:湖南农业大学,2010.
[30]邓楠. 海产品下脚料酶解液制备肉味香精[D]. 青岛:中国海洋大学,2012.
[31]肖文华,方玉桂,常婷婷,等. 鸡可食性组织中癸氧喹酯残留的HPLC检测方法[J]. 扬州大学学报:农业与生命科学版,2014,35(4):41-45.
[32]王慧林. 可控酶解鸽肉蛋白研制寡肽鲜味剂[D]. 南昌:南昌大学,2012.
[33]李漫男. 酶解花生粕蛋白—糖美拉德反应制备呈味基料研究[D]. 郑州:河南工业大学,2010.
[34]苏伟,文飞,母应春,等. 鸭肫酶解工艺优化及降胆固醇活性研究[J]. 食品科技,2016(3):144-149.
[35]邓楠. 海产品下脚料酶解液制备肉味香精[D]. 青岛:中国海洋大学,2012.
[36]周文晓. 单核苷酸的制备及分离[D]. 济南:山东轻工业学院,2011.
[37]温建丰,杨文鸽,徐大伦. 响应面法优化花蟹肉制备抗氧化肽的酶解工艺[J]. 核农学报,2013(12):1881-1886.
[38]何婷,崔春,龙小涛,等. 蓝园鲹制备抗氧化肽酶解工艺的研究[J]. 食品科技,2008(2):70-74.
[39]吴靖娜,许旻,蔡水淋,等. 鲍内脏抗氧化活性肽制备工艺研究[J]. 扬州大学学报(农业与生命科学版),2015(4):58-63.
[40]王镜岩,朱圣庚,徐长法. 生物化学[M]. 北京:高等教育出版社,2002:15-82.
[41]康永锋,康俊霞,吴文惠,等. 响应面法优化超声波-微波协同酶解制备鲑鱼抗氧化肽[J]. 中国油脂,2012(8):25-28.
[42]Saiga A,Tanabe S,Nishimura T. Antioxidant Activity of Peptides Obtained from Porcine Myofibrillar Proteins by Protease Treatment[J]. Journal of Agricultural & Food Chemistry,2003,51(12):3661-7.
[43]程谦伟,刘昭明,孟陆丽,等. 碱性蛋白酶水解制备赤豆蛋白肽的工艺研究[J]. 粮油加工,2010(2):43-45.
[44]于美娟,马美湖,单杨,等. 采用两酶复合水解猪血红蛋白(Hb)制备水解蛋白的研究[J]. 食品科学,2007,28(1):196-200.
Optimizationofenzymatichydrolysisconditionsforduckgizzardantioxidantpeptidepreparationbyresponsesurfacemethodology
SUWei1,QIQi2,WENFei1,TANGSu-ting1,MUYing-chun1,QIUShu-yi1,*
(1.College of Liquor and Food,Guizhou University,Guiyang 550025,China;2.College of Life Sience,Guizhou University,Guiyang 550025,China)
Based on the single factor experiment,the response surface method was used to optimize the preparation process of duck gizzard antioxidant peptide. In the pre-screening of the best protein for enzymatic hydrolysis of duck gizzard,papain was obtained as the best enzyme for enzymatic hydrolysis of duck gizzard protein. The optimum conditions were as follows:the time of enzymolysis was 4.0 h,the amount of enzyme was 0.5%,the enzymolysis temperature was 55 ℃,and the ratio of solid to liquid was 1∶3 g/mL. Under these conditions,the hydrolyzate degree of hydrolyzed duck gizzard protein was 28.30% and the DPPH· clearance rate was 75.10%. The results showed that the duck gizzard antioxidant peptide preparation process was feasible,there was no correlation between the hydrolysis degree of duck gizzard and DPPH· scavenging ability.
duck’s gizzard;protein;enzymolysis;response surface method
TS251.9
B
1002-0306(2017)19-0177-07
10.13386/j.issn1002-0306.2017.19.033
2017-03-24
苏伟(1974-),男,博士,副教授,研究方向:应用生物技术,E-mail:wsu@gzu.edu.cn。
*通讯作者:邱树毅(1963-),男,博士,教授,研究方向:生物工程,E-mail:syqiu@gzu.edu.cn。
贵州省科技厅农业公关项目(黔科合NY[2010]3038号)。

