柚子菊芋果蔬发酵饮料的制备及其抗氧化活性
, ,,
(江南大学生物工程学院,江苏无锡 214122)
柚子菊芋果蔬发酵饮料的制备及其抗氧化活性
管章瑞,田裕,夏小乐*,吴剑荣*
(江南大学生物工程学院,江苏无锡 214122)
以柚子和菊芋为原料,经酒药、酿酒酵母、植物乳杆菌、醋酸杆菌混合发酵制得具有较强抗氧化活性的果蔬发酵饮料。通过正交实验确定果蔬汁澄清工艺,监测发酵过程中理化指标及抗氧化活性物质的变化,并采用DPPH法、超氧阴离子法和还原能力检测果蔬发酵饮料的抗氧化活性。结果表明,果蔬汁中果胶酶浓度0.08%,温度55 ℃,时间50 min,果蔬饮料的透光率最佳达到85.8%。果蔬饮料混合发酵结束时,果蔬汁中添加酒药的总糖和抗氧化活性物质比未添加酒药的含量高,其中添加酒药的果蔬饮料中总糖含量达3.973 g/L,提高28.41%,维生素C的含量达9.454 mg/100 mL,提高23.81%;柚皮苷的含量达0.150 mg/mL,提高23.97%;菊糖的含量达1.229 mg/mL,提高63.65%。果蔬发酵饮料对DPPH自由基的清除率达95.50%,高于谷胱甘肽但低于VC;对超氧阴离子的清除率达73.90%,均高于谷胱甘肽和VC;还原能力明显高于谷胱甘肽但低于VC。
柚子,菊芋,酒药,抗氧化,果蔬发酵饮料
柚子含有较高的VC,可以降低人体内的自由基,促进氨基酸的代谢,延迟寿命。还含有丰富的酚类化合物,这些酚类化合物具有清除自由基抗氧化的作用,对人体的健康有益[1]。菊芋是一种菊科向日葵属宿根性草本植物。菊芋地下块茎含丰富的菊糖,菊糖又名菊粉,具有天然抗氧化特性[2-4]。尚红梅等[5]对菊粉的抗氧化性进行研究,研究表明随着菊粉浓度的增大其清除活性逐渐增强。目前,国内研制的纯天然且具有天然抗氧化活性的果蔬发酵饮料仍存在不足,许晓芳[6]等研制的茉莉柚子复合饮料,虽然风味浓郁、酸甜适中,但略带苦味,并未研究其天然抗氧化活性。李奇[7]等研制的紫甘薯和黑提葡萄复合果蔬饮料具有天然的抗氧化活性,但其复合果蔬饮料酸度不足,通过添加柠檬酸来解决。本研究将柚子和菊芋按一定比例混合以强化其风味,且不添加任何抗氧化剂和酸度调节剂,并且它们拥有良好的体内自由基清除活性,可研发一种具有较强抗氧化活性的新型复合功能饮料。
众所周知,菊芋在搅拌过程中极易发生褐变,严重影响后加工,并给后续处理带来困难[8]。因此在加工过程中添加果胶酶,可显著提高果蔬汁的透光率[9]。传统果蔬发酵工艺是经酿酒酵母、醋酸杆菌、植物乳酸菌混合发酵制得,可以得到风味和口感较好的饮料,但对抗氧化活性的研究少有报道[10],而消费者更加青睐具有天然抗氧化活性的饮料[11]。因此,本文以新鲜的柚子、菊芋为原材料,经酒药、酿酒酵母、植物乳酸菌、醋酸杆菌混合发酵,制得柚子菊芋果蔬发酵饮料。从工艺技术和经济效益出发,研究果蔬加工过程的酶解工艺,提高原料透光率,并监测发酵过程中理化指标及抗氧化活性物质的变化,研究果蔬发酵饮料对DPPH自由基、超氧阴离子、还原能力的清除能力,为柚子和菊芋的综合开发利用提供一定的理论依据。
1 材料与方法
1.1材料和仪器
酒药 江苏南通白蒲黄酒有限公司;酿酒酵母CICIM Y0086(T)、植物乳杆菌CICIM Boo80(T) 江南大学工业微生物资源和信息中心;巴氏醋酸杆菌沪酿1.01菌株CICC 2001 中国工业微生物菌种保藏管理中心;柚子(表皮光滑细致,外形上尖下宽、底部扁圆,分量重)、菊芋(表面无腐烂) 无锡市欧尚超市有限公司;白砂糖 广州福正东海食品有限公司;果胶酶(食品级,酶活力单位3万U/g) 郑州康帆生物科技有限公司;DPPH 上海麦克林生化科技有限公司;菊粉酶(20万U/g) 上海源叶生物科技有限公司;铁氰化钾溶液、三氯乙酸、FeCl3、苯酚、浓硫酸、十二水合磷酸氢二钠、二水合磷酸二氢钠、浓盐酸、三羟甲基氨基甲烷、邻苯三酚,分析纯。
数显恒温水浴锅 上海通特科技仪器厂;多功能搅拌机 好生活电子科技有限公司;立式圆形压力蒸气灭菌器 上海医用核子仪器厂;分析天平 上海精科天美科学仪器有限公司;pH计 德国赛多利斯股份公司;紫外分光光度计 北京普析通用仪器责任有限公司;均质机 上海索廷机电设备有限公司;数显恒温水浴锅 上海通特科技仪器厂。
1.2实验方法
1.2.1 柚子和菊芋果蔬发酵饮料的制备工艺 原料选择→预处理→打浆→酶解→一步发酵→二步发酵→三步发酵→过滤→调配→均质→罐装封口→杀菌→冷却→成品
1.2.2 操作要点 原料选择:选择表皮光滑、外形上尖下宽、分量重且水分充足的柚子及表面无腐烂的菊芋作为原材料;预处理:将柚子、菊芋的皮用干净的水果刀削掉,用饮用水洗净,分别切碎成块;打浆:放入高速搅拌机中打浆,所得浆液备用;酶解:原料中含有大量的果胶,因此在浆液中加入果胶酶,所得溶液备用;一步发酵:在无菌操作台上将上述所得溶液加入200%饮用水、1.5%酒药和5%酿酒酵母,置于28 ℃恒温培养箱中静置培养3 d;二步发酵:在无菌操作台上将上述所得溶液加入5%植物乳杆菌,置于37 ℃恒温培养箱中静置培养2 d;三步发酵:在无菌操作台上将上述所得溶液加入5%醋酸杆菌,置于30 ℃恒温培养箱中静置培养2 d;将上述所得溶液,过滤,滤液用15%白砂糖、10%低聚果糖和10%低聚半乳糖分别加热溶解,待用;均质(8~10 MPa)与灌装封口;杀菌(121 ℃,30 min)、冷却(4 ℃冰箱)。
1.2.3 果蔬加工果胶酶解工艺的研究
1.2.3.1 单因素实验 为了减少果蔬饮料的浊度和黏度等问题,对果蔬原料用果胶酶处理。根据相关文献[12],在55 ℃,30 min条件下,果胶酶浓度采用0.01%、0.02%、0.04%、0.06%、0.08%、0.10%;在30 min,0.08%浓度条件下,温度采用35、40、45、50、55、60 ℃;在55 ℃,0.08%浓度条件下,时间采用10、20、30、40、50、60 min,分别于8000 r/min离心10 min。取上清液以蒸馏水作参比,以不添加果胶酶作为空白对照,在660 nm处测定果汁的透光率T(%),平行实验3次。
1.2.3.2 正交实验 根据影响果蔬汁透光率的果胶酶量、温度、时间三因子的水平范围,采用三因素三水平设计正交优化实验,确定最佳的提取工艺条件。

表1 正交实验因素及水平Table 1 Factors and levels in orthogonal array design
1.2.4 发酵过程中理化指标的检测 发酵整个阶段,每天上午9点取样分析,测定发酵液的pH、总酸、总糖、乙醇、VC、柚皮苷、菊糖含量。pH:pH计;酸度:NaOH滴定法[13];总糖:苯酚硫酸法[14];乙醇:重铬酸钾比色法[15];VC:2,6-二氯靛酚滴定法[16];柚皮苷:HPLC(色谱条件:色谱柱:C18色谱柱;流动相:超纯水+甲醇=65+35;柱温:35 ℃;流速:0.8 mL/min;进样量:10 μL;检测波长:283 nm);菊糖∶菊糖含量(mg/mL)=添加菊粉酶(1‰,55 ℃,48 h)果蔬饮料的还原糖(mg/mL)-发酵时果蔬饮料的还原糖(mg/mL)式(1)。
1.2.5 抗氧化活性研究
1.2.5.1 对二苯代苦味酰基自由基(DPPH)清除能力的测定 将2 mL果蔬饮料及2 mL 20 mmol/L DPPH溶液加同试管中,摇匀,放置30 min后用溶剂作参比测定其吸光度Ai,同时测定20 mmol/LDPPH溶液与2 mL溶剂混合后的吸光度Ac,以及2 mL提取物与2 mL溶剂混合后的吸光度Aj。按照下列公式计算清除率,清除率越大抗氧化能力越强[17]。
DPPH·抑制率(%)=[1-(Ai-Aj)/Ac]×100
式(2)
1.2.5.2 超氧阴离子清除实验 取0.5 mL待测液于10 mL试管中,分别加入4.5 mL Tril-HCL溶液和3 mL蒸馏水,摇匀,25 ℃恒温培养10 min,加0.6 mol/L邻苯三酚0.1 mL,摇匀放置反应3 min,加10 mol/L浓盐酸0.1 mL,测定吸光度值A325 nm,所有测定值均为三次平均值[18]。
抑制率(%)=[(R-W)/R]×100
式(3)中R为蒸馏水做空白;W为含样品。
1.2.5.3 还原能力的测定 取2.5 mL待测液于10 mL试管中,分别加入2.5 mL 1%铁氰化钾溶液,混合均匀,于50 ℃水浴中反应20 min。取出,再加入2.5 mL 10%三氯乙酸,混合后以8000 r/min离心10 min。取上清液2.5 mL,加蒸馏水2.5 mL、0.1% FeCl30.5 mL,混合均匀,静置10 min后,测定700 nm的吸光值A700,所有测定值均为三次平均值[19]。
1.2.6 感官评价标准 采用百分制的评分标准,通过10人组成的评分小组对产品的组织状态、风味、口感、色泽进行评分,通过感官评分来确定最佳组合,感官评分标准见表2。

表2 感官评价标准Table 2 Standard of sensory evaluation
1.2.7 数据统计分析 采用Origin和SAS软件对实验数据进行方差分析。当p<0.05时,表示差异显著,当p>0.05时,表示差异不显著。所有实验重复3次。
2 结果与分析
2.1单因素实验
2.1.1 果胶酶添加量的影响 果胶酶主要用于果蔬饮料的榨汁及澄清,对分解果胶具有良好的作用[20]。由图1可知,随着果胶酶用量的增加柚子菊芋果蔬汁的澄清度呈上升趋势,主要因为果胶酶可以专一性地水解果胶类物质,使体系中其它胶体类物质因失去果胶的保护而沉淀析出,实现汁液澄清,透光率由0.01%果胶酶时的65.50%上升到0.10%果胶酶时的82.10%,在果胶酶用量达到0.06%时透光率增加最快,从经济角度上采用0.06%的酶解浓度为宜。

图1 酶解反应对果蔬汁透光率的影响Fig.1 Enzymatic hydrolysis concentration influenceon fruit and vege Table juices transmittance注:*p<0.05,与对照组相比;图2、图3同。
2.1.2 果胶酶温度的影响 由图2可知,温度在35~55 ℃范围内,澄清度随温度升高而上升,透光率由43.50%上升到82.00%。当温度超过55 ℃后即使温度升高澄清度也无法再提高,反而呈现快速下降的趋势,60 ℃时透光率下降到80.40%,在酶稳定的温度范围内,温度升高有利于酶活力提高,当温度超过一定值时,温度升高将加速酶的钝化,酶被钝化后活性受抑制甚至消失,直接表现为酶促反应速度下降,作用效果降低[21]。本实验的结果也验证了这一点。从实验结果可看出,当酶处理温度为55 ℃时,果胶酶的作用效果最佳。
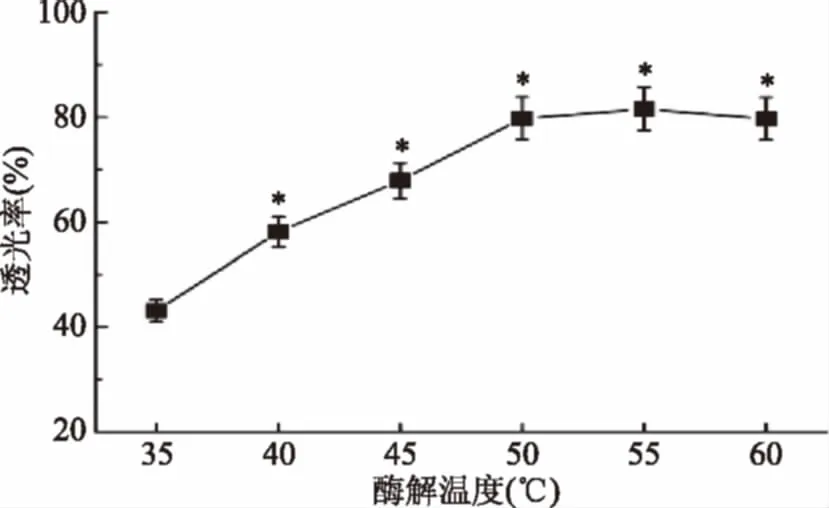
图2 酶解温度对果蔬汁透光率的影响Fig.2 Enzymatic hydrolysis temperature influenceon fruit and vege Table juices transmittance
2.1.3 果胶酶时间的影响 由图3可知,果胶酶对柚子菊芋果蔬汁澄清效果随时间延长呈现上升的趋势,在10~60 min之间,透光率由39.80%上升到83.10%。当酶解时间为40 min时,透光率升高的最快,时间延长会导致生产成本上升及降低生产效率,因此选用40 min为最适处理时间。

图3 酶解时间对果蔬汁透光率的影响Fig.3 Enzymatic hydrolysis time influenceon fruit and vege Table juices transmittance
2.2正交实验
澄清工艺的正交实验结果如表3所示。通过酶解条件的正交实验结果的极差分析可知,各因素对柚子菊芋果蔬汁透光率的影响程度强弱顺序为:B>C>A,即温度对果蔬汁透光率影响最大,其次是酶解时间,影响较小的是果胶酶浓度。得出最佳澄清工艺条件为A3B3C3。

表3 澄清工艺的正交实验结果Table 3 Clarification process results of orthogonal experiment
在正交实验表中并没有用到A3B3C3组合,因此需要在此条件下进行验证。在最佳酶解条件下,即果胶酶浓度0.08%,温度55 ℃,时间50 min。测定三次以验证酶解效果,此条件下柚子菊芋果蔬汁的透光率达85.80%。
2.3发酵过程理化指标分析
2.3.1 柚子和菊芋果蔬发酵饮料发酵过程中pH、总酸、乙醇、总糖的变化 食品中的酸不仅作为酸味成分,而且在食品的加工、贮运及品质等方面起着重要作用。由图4可知,添加酒药等多菌种混合发酵和传统发酵的pH均呈下降趋势,pH从4.19下降至3.85,并最终维持在3.85保持不变,因此酒药的添加对发酵过程的pH无明显影响。添加酒药等多菌种混合发酵和传统发酵的总酸均呈逐渐上升,未添加酒药的发酵液在第5 d上升较快,因为乳酸菌为优势菌群,发酵结束时总酸的含量为25.344 g/L。添加酒药的发酵液在第5 d没有急剧上升是因为酒药中的微生物分担营养物质及利用一部分乳酸,这导致总酸上升缓慢。在第6 d上升较快,这是添加醋酸杆菌所导致的,发酵结束时总酸的含量为23.808 g/L。由此说明酒药的添加,对发酵液的pH和总酸基本无影响。适量的乙醇能为机体提供热量,促进血液循环,有利于健康。由图5可知,发酵过程中乙醇的含量先稳定增加后慢慢下降,醋酸菌的添加导致乙醇含量下降,最终乙醇含量维持在40.525 g/L,酒药的添加对乙醇含量无影响。总糖的含量高低对产品的色、香、味、组织形态、营养价值、成本等有一定影响。发酵过程中添加酒药的发酵液始终比未添加酒药的发酵液总糖含量高,最终发酵完成时高出28.41%。

图4 果蔬饮料发酵过程中pH与总酸的变化Fig.4 pH and total acid change of fruitand vege Table beverage in the fermentation process

图5 果蔬发酵饮料发酵过程中乙醇与总糖的变化Fig.5 Ethanol and total sugar change of fruitand vege Table beverage in the fermentation process

表4 发酵前后抗氧化活性物质的变化Table 4 Antioxidant activity material changesbefore and after fermentation
2.3.2 发酵前后抗氧化活性物质的变化 抗氧化物质以较低的浓度,就能有效抑制自由基的氧化反应。由表4可得,在传统工艺基础上添加酒药发酵剂,发酵结束产生的抗氧化活性物质均有显著提高(p<0.05)。VC是一种抗氧化剂,因为它能够保护身体免于氧化剂的威胁,添加酒药发酵液的VC的含量达9.454 mg/100 mL,比传统发酵的VC含量高23.81%。柚皮苷能够阻断邻苯三酚自氧化的自由基链反应,具有抗氧化作用,添加酒药发酵液的柚皮苷达0.150 mg/mL,比传统发酵的柚皮苷含量高23.97%。菊糖主要通过提高细胞内抗氧化酶的活力发挥其抗氧化作用[22],添加酒药发酵液的菊糖达1.229 mg/mL,比传统发酵的菊糖含量高63.65%。添加酒药发酵液的总糖含量高,产生的营养物质能够被分解成更多的活性物质,结果表明,酒药与多菌种混合发酵能够增加抗氧化活性物质的含量。
对发酵工艺进行优化,能够有效的提高果蔬饮料的抗氧化性。除此之外,酒药作为一种复合发酵剂,富含多种菌种,产生更多的营养物质,常被用为发酵多种传统食品和饮料。本研究中,我们发现在传统工艺的基础上添加酒药发酵,可提高果蔬发酵饮料的抗氧化性。但酒药是一种混菌的发酵剂,导致抗氧化活性提高的具体原因尚未明确,可能是酒药中某个或某些菌的原因,因此具体原因需要再进一步研究。
2.4柚子菊芋果蔬发酵饮料体外抗氧化活性的测定
2.4.1 DPPH自由基清除能力的测定 DPPH自由基有单电子,在517 nm处有一强吸收,其醇溶液呈紫色。当有自由基清除剂存在时,与其单电子配对而使其吸收逐渐消失,其褪色程度与接受的电子数量成定量关系,因而可用分光光度计进行快速的定量分析。由图6可知,果蔬发酵饮料随稀释倍数的减少清除率逐渐上升,果蔬发酵饮料清除率达95.5%,略低于96.76%清除率的VC,远高于67.21%清除率的未发酵液和80.72%清除率的谷胱甘肽,对DPPH自由基就具有很强的清除能力,结果说明柚子和菊芋果蔬发酵饮料具有较强的抗氧化还原能力。

图6 果蔬发酵饮料清除DPPH能力的测定结果Fig.6 Clearing DPPH capacity determination results offermented fruit and vege Table drinks

图7 果蔬发酵饮料超氧阴离子清除测定Fig.7 The ultra oxygen anion removal of determination offermented fruit and vege Table drinks
2.4.3 还原力的测定 还原能力的测定是以样品是否为良好电子供应者为指标的,以特征吸收波长处的吸光度表示总抗氧化能力的强弱,吸光度越高,样品的总抗氧化能力越强。由图8可知,果蔬发酵饮料随稀释倍数的减少吸光度逐渐上升,果蔬发酵饮料的吸光度虽然低于阳性对照组VC,但吸光度明显高于谷胱甘肽。结果表明,柚子菊芋果蔬发酵饮料具有体外抗氧化活性。

图8 果蔬发酵饮料还原力的测定Fig.8 The determination of reducing power offermented fruit and vege Table drinks
2.5感官指标
对柚子菊芋果蔬发酵饮料的感官指标进行分析,结果如表5所示。

表5 柚子菊芋果蔬发酵饮料的感官评价Table 5 Standard of sensory evaluationof fruit and vege Table fermented beverage
3 结论
采用正交法对柚子菊芋果蔬加工过程酶解工艺进行优化,以提高果蔬饮料的透光率,确定最佳澄清条件为果胶酶浓度0.08%,温度55 ℃,时间50 min。在此条件下,柚子菊芋果蔬发酵饮料的透光率达85.80%。通过对果蔬发酵过程中理化指标及对抗氧化活性物质含量的测定,可更好的监测发酵过程中各个因素的变化。改良工艺的果蔬发酵饮料,总糖含量达3.973 g/L,提高28.41%,VC的含量达9.454 mg/100 mL,提高23.81%;柚皮苷的含量达0.150 mg/mL,提高23.97%;菊糖的含量达1.229 mg/mL,提高63.65%,而pH、总酸及乙醇含量无明显变化。抗氧化活性物质含量提高,越有利于人体的健康。对果蔬发酵饮料的体外抗氧化活性进行研究,结果表明:对DPPH自由基的清除率达95.50%、对超氧阴离子自由基的清楚率达73.90%且具有还原能力,因此可得到抗氧化活性较高、口感较佳的柚子菊芋果蔬发酵饮料,但对于抗氧化活性作用的机理尚不明确,有待于继续深入研究其抗氧化机理等,为实现天然抗氧化产品的开发奠定基础。
[1]Xi W,Zhang G,Jiang D,et al. Phenolic compositions and antioxidant activities of grapefruit(Citrus paradisi Macfadyen)varieties cultivated in China[J]. International journal of food sciences and nutrition,2015,66(8):858-866.
[2]乌日娜,朱铁霞,于永奇,等. 菊芋的研究现状及开发潜力[J]. 草业科学,2013,30(8):1295-1300.
[3]刘德萍,吴平. 菊糖抗氧化活性及其机理[J]. 食品与生物技术学报,2015,34(9):1002-1007.
[4]乔月芳,马艳弘,张宏志,等. 菊芋中菊糖的热水浸提工艺优化及抗氧化活性[J]. 江苏农业科学,2016,44(3):291-294.
[5]尚红梅,郭玮,潘丹,等. 干燥方式对菊苣根多酚含量和抗氧化活性的影响[J]. 食品科学,2015,36(1):84-88.
[6]许晓芳,周强,刘蒙佳. 正交优化茉莉柚汁调配工艺研究[J]. 饮料工业,2014,17(6):29-33.
[7]李奇,杨振东,孙芝杨. 紫甘薯黑提复合果蔬汁饮料体外抗氧化性质研究[J]. 食品科技,2013(11):31.
[8]王天博. 鲜切菊芋褐变控制技术研究[D]. 泰安:山东农业大学,2015.
[9]Xu S X,Qin X,Liu B,et al. An acidic pectin lyase from Aspergillus niger with favourable efficiency in fruit juice clarification[J]. Letters in applied microbiology,2015,60(2):181-187.
[10]王磊,陈宇飞,刘长姣. 发酵饮料的开发现状及研究前景[J]. 食品工业科技,2015(10):379-382.
[11]Shahidi F,Ambigaipalan P. Phenolics and polyphenolics in foods,beverages and spices:Antioxidant activity and health effects-A review[J]. Journal of functional foods,2015,18:820-897.
[12]帅希祥,梁瑞红,李俶,等. 果胶酶澄清南酸枣汁的工艺优化[J]. 食品工业科技,2013,34(2):231-234.
[13]GB/T 12456-2008.
[14]赵爱娟,冯彩婷,王娜丽. 苯酚-硫酸显色法测定生菜中的多糖含量[J]. 河南科学,2014,32(6):1006-1009.
[15]魏晓霞. 利用比色法测定葡萄酒的酒精度[J]. 广州化工,2016,44(21):114-116.
[16]周卓娜. 橙汁饮料中维生素C含量的测定[J]. 科技创新导报,2016,13(16):41-42.
[17]Xie J,Schaich K M. Re-evaluation of the 2,2-diphenyl-1-picrylhydrazyl free radical(DPPH)assay for antioxidant activity[J]. Journal of agricultural and food chemistry,2014,62(19):4251-4260.
[18]李洪亮,程齐来,刘涛,等. 赣南黄花倒水莲水提取物体外清除超氧阴离子活性的实验研究[J]. 赣南医学院学报,2016,36(2):176-178.
[19]Chen A,Xiang W,Liu D,et al. Determination of Total Flavonoids and Its Antioxidant Ability in Houttuynia cordata[J]. Journal of Materials Science and Chemical Engineering,2016,4(2):131.
[20]游剑,王飞,王君容. 果胶酶澄清柚子汁工艺条件研究[J]. 中国酿造,2014(9):98-101.
[21]帅希祥,梁瑞红,李俶,等. 果胶酶澄清南酸枣汁的工艺优化[J]. 食品工业科技,2013,34(2):231-234.
[22]刘德萍,吴平. 菊糖抗氧化活性及其机理[J].食品与生物技术学报,2015,34(9):1002-1007.
Fermentedbeverageofshaddockandjerusalemartichokepreparationanditsantioxidantactivityanalysis
GUANZhang-rui,TIANYu,XIAXiao-le*,WUJian-rong*
(Biological Engineering Institue,Jiangnan University,Wuxi 214122,China)
A fruit and vege
Table fermented beverage with strong antioxidant activity was made from raw materials(shaddock and jerusalem artichoke)which mixed fermentation by koji,Saccharomycescerevisiae,LactobacillusplantarumandAcetobacter. The clarification process of fruit and vege
Table juices was determined by orthogonal experiment,and the changes of physical and chemical indexes and antioxidant substances in the fermentation process were monitored. The antioxidant activity of fruit and vege
Table fermented beverage was detected by DPPH method,superoxide anion method and reducing ability respectively. It showed that the light transmittance of fruit and vege
Table beverage reached 85.80% with 0.08% of pectinase concentration of fruit and vege
Table juices,55 ℃ and 50 min. At the end of the mixed fermentation of fruit and vege
Table beverage,the total sugar increased 28.41% to 3.973 g/L,vitamin C was 9.454 mg/100 mL which increased 23.81%,naringin was 0.150 mg/mL,increased by 23.97%,and inulin was 1.229 mg/mL which increased 63.65%,compared to the fruit and vege
Table juices without adding the koji. The clearance rate of DPPH by fruit and vege
Table fermented beverage was 95.50%,which was higher than glutathione but lower than VC. The clearance rate of superoxide cations was 73.90%,which was higher than glutathione and VC. Reducing capacity was significantly higher than glutathione but lower than VC.
shaddock;jerusalem artichoke;Chinese yeast;antioxidant;fruit and vege
Table fermented beverage
TS255.36
A
1002-0306(2017)19-0136-06
10.13386/j.issn1002-0306.2017.19.026
2017-03-27
管章瑞(1993-),男,在读硕士研究生,研究方向:酿造工业研究,E-mail:18811993852@163.com。
*通讯作者:夏小乐(1980-),男,博士,副教授,研究方向:酿造及其微生物研究,E-mail:xiaolexia@jiangnan.edu.cn。
吴剑荣(1976-),男,博士,副教授,研究方向:发酵工程,E-mail:kinowu@jiangnan.edu.cn。
江苏省重点研发计划(现代农业)(BE2016331)。

