亮氨酸氨肽酶的制备及在大米肽脱苦中的协同应用
,,
(江南大学工业生物技术教育部重点实验室,江苏无锡 214122)
亮氨酸氨肽酶的制备及在大米肽脱苦中的协同应用
朱强,吴警涛,田亚平*
(江南大学工业生物技术教育部重点实验室,江苏无锡 214122)
采用絮凝、超滤和冷冻干燥组合的方法制备重组枯草芽孢杆菌亮氨酸氨肽酶,以氨肽酶切除末端疏水性氨基酸为酶解脱苦效果的指标,考察了该氨肽酶与脯氨酸氨肽酶协同水解大米肽的脱苦效果。酶的制备工艺条件如下:加入0.15%±0.008%的絮凝剂,2.5%±0.006%的硅藻土,调节pH8.0进行过滤,采用30 kDa的PES卷式膜,超滤浓缩7倍,氨肽酶的总回收率为64.69%±1.29%;在优化的酶解条件下,大米肽的酶解液中的亮氨酸、精氨酸及游离的疏水性氨基酸总量分别是酶解前的3.39±0.10、16.48±0.49、4.39±0.13倍,酶解后分子量500~1000 Da的肽含量降低了30.63%±0.61%,经双酶协同水解后脯氨酸含量是单酶水解后的1.78±0.07倍。优化后工艺简便,且该酶在大米肽脱苦中有良好的应用。
亮氨酸氨肽酶,提取,回收率,协同水解,疏水性氨基酸
细菌发酵液中实现菌体分离有高速离心法,絮凝法,膜过滤法等,但细菌菌体较小,离心需要较高转速,设备昂贵,不易放大,而膜过滤法虽然容易放大但膜孔也易被细小细菌堵塞,所以细菌发酵液常需选择絮凝法。程璐等[1]人在乳杆菌发酵液中加入硫酸铝进行了絮凝预处理,絮凝率达到68%,絮凝效果良好,更利于后续的提取。曹松龙等[2]利用18%的硫酸铵澄清枯草芽孢杆菌发酵液,使菌体絮凝,再利用超滤法提取氨肽酶,回收率为67.15%。孔峰等[3]利用双水相萃取和超滤法提取枯草芽孢杆菌发酵液中的氨肽酶,其超滤回收率为85.01%,表明超滤法在氨肽酶提取中有较好的应用。
氨肽酶是一种很重要的风味蛋白酶,可解离N末端的疏水性氨基酸而被用于蛋白水解液的脱苦[4-6]。大米肽主要由多种多肽分子混合物所组成,以及其它少量的游离氨基酸、糖类和无机盐等,具有降血压、抗氧化、促脂肪代谢及增强体能和恢复疲劳等作用[7-8]。目前,利用酶法制备活性肽时,蛋白水解液往往产生一些苦味,严重影响其品质[9-11]。T.K.Murry和Baker等[12]证明苦味是由多肽而不是游离氨基酸产生的。K.N.Ney等[13]研究进一步表明了苦味是由于多肽链上疏水性氨基酸引起的。马铁铮等[14]研究发现:除了Leu,Pro等疏水性氨基酸残基对苦味有影响,尤其Arg在N末端的肽是极苦的,去除多肽末端疏水性氨基酸及Arg等碱性氨基酸就可降低苦味,但未研究酶法脱苦效果。魏亚娟等[15]研究了氨肽酶与碱性蛋白酶对大豆分离蛋白的协同水解作用,发现水解液几乎不呈现苦味,未研究多种外切酶协同水解去除酶解液中的苦味。

表1 真空冷冻干燥参数Table 1 Parameters of vacuum freeze drying
本实验建立了絮凝法与超滤法相结合,易于规模化生产的氨肽酶的制备工艺,为工业化生产提供了理论基础,以氨肽酶切除多肽末端疏水性氨基酸为脱苦效果的指标,确定了亮氨酸氨肽酶酶解大米肽脱苦的最适条件,进一步考察了亮氨酸与脯氨酸氨肽酶协同水解大米肽脱苦的效果,为后续研究亮氨酸氨肽酶的复配应用具有一定的意义。
1 材料与方法
1.1材料与仪器
枯草芽孢杆菌发酵液、脯氨酸氨肽酶、亮氨酸氨肽酶 实验室自制;L-亮氨酸-对硝基苯胺(AR) 美国Alfa公司;阳离子絮凝剂、硅藻土 江苏泰州市博立生物制品有限公司。
SHZ-22电热恒温水浴锅 上海医疗器械五厂;2L超滤设备FILTECH-UF101型 上海弗立特实业有限公司;UV-1600PC紫外-可见分光光度计 上海美普达有限公司;不锈钢板框过滤器 温州展博设备制造有限公司;真空冷冻干燥机 宁波新芝生物科技股份有限公司;Delter320pH计 梅特勒-托利多公司;数显恒温磁力搅拌器 江苏科析仪器有限公司。
1.2实验方法
1.2.1 亮氨酸氨肽酶的制备 本课题组原有建立的对氨肽酶的制备工艺为:发酵液低速离心双水相萃取超滤浓缩获得酶液等步骤,由于规模化生产,发酵液离心能耗大,不利于工厂操作,在此基础上建立一种新的制备工艺:发酵液絮凝→板框压滤机过滤→超滤浓缩→真空冷冻干燥→粉碎过筛→获得酶粉。新工艺操作简单,设备投资低,维护及保养成本低,更利于大规模生产。
1.2.1.1 发酵液絮凝单因素实验 固定硅藻土的添加量为1.5%、絮凝剂的添加量为0.15%,考察不同pH对絮凝时氨肽酶回收率的影响;固定硅藻土添加量1.5%、固定pH7.0考察絮凝剂的添加量对絮凝时氨肽酶回收率的影响;固定絮凝剂添加量0.15%、固定pH7.0考察硅藻土添加量对絮凝时氨肽酶回收率的影响。
1.2.1.2 发酵滤液的超滤浓缩 将经过絮凝且过滤的发酵液加入超滤系统中,选择操作压力为0.25 MPa,pH6.5考察浓缩倍数(2、3、4、5、6、7)对氨肽酶回收率和膜通量以及比酶活的影响。
1.2.1.3 浓缩液的冷冻干燥 将1.2.1.2超滤的冷浓缩液进行冷冻干燥,粉碎,过筛(200目),获得亮氨酸氨肽酶酶粉,后置于-4 ℃储存,其冷冻干燥参数如表1所示。
1.2.2 膜通量的测定 发酵液膜通量的测定:在超滤系统中加入预处理的发酵液,待压力稳定后(操作压力0.2 MPa),计时2 min,收集透过液并量体积,计算膜通量。膜通量公式:
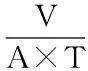
式(1)
式(1)中:J-式中:膜通量(L/(m2·h));V-取样体积(L);T-取样时间(h);A-膜有效面积(m2)
1.2.3 蛋白质含量的测定 利用考马斯亮蓝法[16-18]测定亮氨酸氨肽酶发酵过程中发酵液中的蛋白质含量,以牛血清蛋白作为标准蛋白,标准曲线方程为:
Y=146.43x-1.5000(R2=0.998)
式(2)
式(2)中:Y为波长595 nm 处测定的吸光值;X为蛋白质量浓度(ug/mL)。
1.2.4 亮氨酸氨肽酶酶活力测定 利用LNA法[19]测定亮氨酸氨肽酶酶活力计算公式:

式(3)
式(3)中:X-样品的酶(U/mL);N-于波长405 nm处测得吸光度值;Y-酶液稀释的倍数。
氨肽酶酶活定义:在以上分析测定的基础上,定义一个酶活单位(U)为,在特定条件下(50 ℃,pH8.5),每分钟催化分解L-亮氨酸-对硝基苯胺产生1微摩尔的对硝基苯胺所需要的酶量。
1.2.5 单酶及双酶协同水解在大米肽脱苦中的应用
1.2.5.1 亮氨酸氨肽酶水解大米肽 准确称取大米肽2.5 g,配制成浓度为50 g/L大米肽溶液50 mL,水解温度50 ℃,加入0.5 g亮氨酸氨肽酶(酶活力9000 U/g)于大米肽溶液中,调转速至120 r/min,调节pH,维持在pH8.3~8.5,酶解4 h,沸水浴10 min,灭酶。
1.2.5.2 亮氨酸和脯氨酸氨肽酶协同水解大米肽 准确称取大米肽2.5 g,配制成50 g/L溶液,pH8.5、温度50 ℃、亮氨酸氨肽酶添加量1800 U/g(E/S)、酶解4 h,沸水浴10 min,冷却至50 ℃,加入脯氨酸氨肽酶300 U/g、温度50 ℃、维持pH7.3~7.5、酶解3 h、沸水浴10 min,冷却,15000 r/mim离心30 min,取上清-4 ℃保存。
1.2.5.3 大米肽的酶解液中多肽分子量分布及氨基酸含量测定 酶解液12000 r/min 离心10 min,取上清2 mL测酶解液的多肽分子量分布,取上清1 mL加入等体积的10%的TCA溶液,静置3 h,15000 r/min,离心10 min,取离心后的上清液400 μL利用氨基酸液相色谱仪(Ag1100)进行测定酶解液中游离的氨基酸含量[20]。
1.3数据统计分析
每组实验重复3次,取平均值,采用origin8.5进行数据分析。
2 结果与讨论
2.1发酵液絮凝单因素实验
2.1.1 絮凝时发酵液的pH对氨肽酶回收率的影响 由图1所示,絮凝时的pH对氨肽酶回收率影响显著,随着pH的增加,氨肽酶的回收率先增加后降低,当絮凝体系的pH为8.0时,氨肽酶回收率达到最大,为82.7%±1.65%,由于发酵液中的pH不同,导致蛋白带有不同的电荷,絮凝剂也显示不同的活性,pH8.0时絮凝剂能将杂蛋白和菌体絮凝成团,而对目标蛋白的影响较小,故选择pH8.0为絮凝时体系的最适pH。
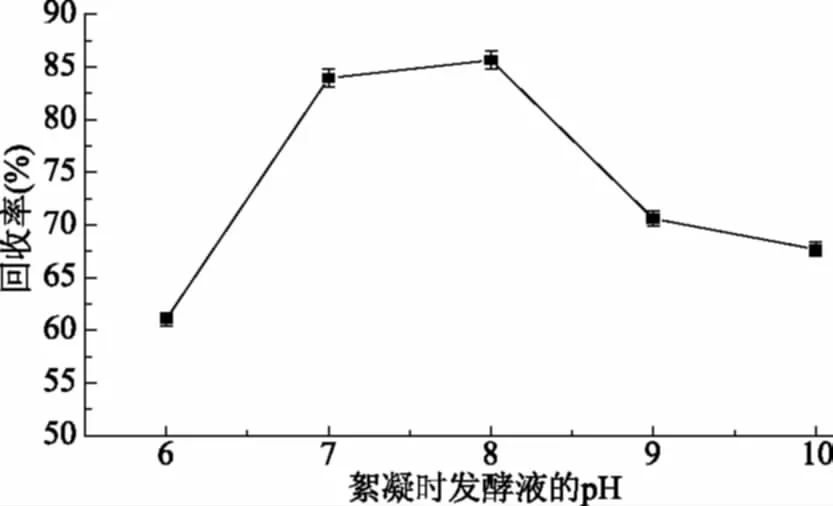
图1 絮凝时的pH对氨肽酶回收率的影响Fig.1 Effect of pH on recovery ofaminopeptidase during flocculation
2.1.2 絮凝剂的添加量对氨肽酶回收率的影响 图2中可以看出发酵液中絮凝剂的添加量影响氨肽酶的回收率,且絮凝剂的添加量为0.15%±0.008%左右时氨肽酶的回收率最好,为79.83%±2.39%。这是因为絮凝作用的原理是絮凝剂上的功能团和不同的蛋白及菌体等胶粒表面通过架桥联结结合,从而产生粗大的絮凝沉淀[21-22]。发酵液中絮凝剂的添加量增加有助于架桥的充分,但是过高反而会引起吸附饱和,在胶粒表面上形成覆盖层,从而使絮凝体系再次趋于稳定,因此发酵液中絮凝剂的添加量偏高或偏低都达不到絮凝的效果。

图2 絮凝剂添加量对氨肽酶回收率的影响Fig.2 Effect of adding amount of flocculanton recovery of aminopeptidase
2.1.3 硅藻土的添加量对氨肽酶回收率的影响 由3中可以看出,随着硅藻土添加量的增加,氨肽酶回收率逐渐降低,当添加量大于2.5%±0.006%时回收率下降迅速,当添加量为3.5%±0.008%时,回收率降至58.36%±1.17%,这是因为硅藻土特有的天然“分子筛”状孔隙结构,具有较强的吸附性能和离子交换性能,可能吸附了目的蛋白,导致氨肽酶含量降低,絮凝中硅藻土的添加只是起到加速过滤的作用,考虑滤速及氨肽酶的回收率选择硅藻土的添加量为2.5%±0.006%。

图3 硅藻土添加量对氨肽酶回收率的影响Fig.3 Effect of adding amount ofdiatomite on recovery of aminopeptidase
2.1.4 发酵液超滤浓缩倍数的选择 采用截留分子量为30 kDa的聚醚砜(PES)膜,操作压力为0.25~0.3 MPa。从表2和图4中可以看出随着浓缩倍数的增加,氨肽酶的回收率与膜通量都有一定幅度的降低,当浓缩倍数由四倍增加到五倍,回收率和膜通量下降较快,主要是开始超滤膜膜孔无堵塞,阻力较小,随着超滤操作进行大分子物质在膜表面沉淀使得阻力增加、浓差极化的现象导致膜通量下降显著。结合表2,考虑减少后续冷冻干燥的处理量,选择发酵滤液的浓缩倍数为7,此时氨肽酶回收率为78.22%±1.41%。由于絮凝后的滤液具有澄清度高等优点,较离心处理的发酵液更有利于超滤操作,节约成本。
2.2单酶及双酶协同水解后多肽分子量分布及疏水性氨基酸含量变化
由图5可以看出,经单酶水解后分子量小于180 Da的含量增加了102.04%±3.06%,180~500 Da的肽含量增加了20.42%±0.49%,500~1000 Da的肽含量降低了30.63%±0.70%,1000~2000 Da的肽含量降低了35.60%±0.36%,2000~5000 Da的肽含量降低了32.80%±0.62%,而双酶协同与单酶水解相比多肽分子量分布变化不大,只有180~500 Da的肽含量略有增幅,这是由于双酶中的脯氨酸氨肽酶具备高特异性,只切除多肽链N端的脯氨酸残基。据文献[23-24]报道:分子量大于5000 Da的肽不具苦味,而介于500~1000 Da的短肽苦味最强。

表2 浓缩倍数对比酶活的影响Table 2 The influence of concentration multiple on comparison enzyme activity

图4 浓缩倍数对氨肽酶回收率及膜通量的影响Fig.4 Effect of concentration multipleon recovery and membrane flux of aminopeptidase

图5 酶解前后多肽分子量分布Fig.5 Molecular weight distribution ofpeptides before and after enzymatic hydrolysis
如图6所示,大米肽经过亮氨酸氨肽酶处理后:Leu、Arg、Lys及游离的疏水性氨基酸含量是酶解前的3.39±0.10、16.48±0.49、22.47±0.67、4.39±0.67倍,表明水解液中游离的疏水性氨基酸含量大幅度提高且其中的Leu、Arg、Lys提高比例最大,符合亮氨酸氨肽酶水解特色;经双酶协同水解后Pro含量是单酶水解后的1.78±0.07倍,其他疏水性氨基酸增幅较小,符合该酶的水解特异性。结合多肽分子量分布和氨基酸含量分析表明,其分子量的改变是亮氨酸氨肽酶将肽链末端的疏水性氨基酸切除下来,从而达到脱苦的效果,而亮氨酸与脯氨酸氨肽酶协同作用更能强化脱苦效果,进一步提升大米肽的风味和品质。

图6 酶解前后疏水性氨基酸及两种碱性氨基酸含量变化Fig.6 Changes of hydrophobic amino acids and two kinds ofbasic amino acids before and after enzymolysis
3 结论
本研究在前期基础上建立了絮凝加超滤后冻干亮氨酸氨肽酶的制备工艺:加入0.15%±0.008%的絮凝剂,2.5%±0.006%的硅藻土,调节pH8.0,过滤,选用30 kDa的超滤膜超滤浓缩7倍,氨肽酶的总回收率为64.69%±1.29%。该制备工艺操作简便,稳定性较好,便于操作和控制,易放大生产;用该工艺制备的亮氨酸氨肽酶水解大米肽通过分析水解产物的情况评价其脱苦效果,结果表明,在优化的酶解条件下酶解液中的亮氨酸、精氨酸、赖氨酸含量及疏水性氨基酸总量分别是酶解前的3.39±0.1、16.48±0.49、22.47±0.67、4.39±0.67倍,酶解后分子量500~1000 Da的肽含量降低了30.63%±0.61%,而亮氨酸与脯氨酸氨肽酶协同作用更能强化脱苦效果,提升大米肽的品质,相对于在多肽中添加苦味掩蔽剂,酶法更加安全可靠,将是今后食品蛋白资源深加工的应用大趋势。
[1]程璐,杨青,缪铭,等. 絮凝法处理苯乳酸发酵液的研究[J]. 食品工业科技,2011(3):256-258.
[2]曹松龙,田亚平. 枯草芽孢杆菌氨肽酶超滤提取技术[J]. 食品与生物技术学报,2013,32(3):293-297.
[3]孔峰,田亚平. 重组枯草芽孢杆菌高产氨肽酶策略与提取工艺优化[J]. 食品与生物技术学报,2015,34(8):864-872.
[4]Gao X,Cui W,Tian Y,et al. Over-expression,secretion,biochemical characterisation,and structure analysis of Bacillus subtilis aminopeptidase.[J]. Journal of the Science of Food & Agriculture,2013,93(11):2810-2815.
[5]Barry C M,O’Cuinn G,Harrington D,et al. Debittering of a tryptic digest of bovine beta-casein using porcine kidney general aminopeptidase and X-prolydipeptidyl aminopeptidase fromLactococcuslactissubsp. cremoris AM2.[J]. Journal of Food Science,2000,65(7):1145-1150.
[6]Yang H,Zhu Q,Zhou N,et al. Optimized expression of prolyl aminopeptidase in Pichia pastoris and its characteristics after glycosylation.[J]. World Journal of Microbiology & Biotechnology,2016,32(11):176.
[7]李佳南,王静,张慧娟,等. 大米蛋白抗氧化肽的活性以及组成鉴定研究[J]. 食品工业科技,2013,34(23):53-57.
[8]代联伶,陈欲云,胡婷婷,等. 大米多肽对D-半乳糖致衰老小鼠抗氧化作用的研究[J]. 食品工业科技,2013,34(18):336-338.
[9]刘达玉,张崟,王卫,等. 响应面法优化骨素酶解制备可溶性肽工艺研究[J]. 食品工业科技,2012,33(14):316-318.
[10]吕志佳. 大米肽酶法制备方法的研究[D]. 天津:天津科技大学,2014.
[11]裴晓惠,张佳程,齐建勋,等. 核桃蛋白肽脱苦及其对ACE抑制活性的影响[J]. 食品工业科技,2012,33(20):236-239.
[12]Murray T K. Studies on protein hydrolysis. 1. Preliminary observations on the taste of enzymic protein-hydrolysates.[J]. Journal of the Science of Food & Agriculture,1952,3(10):470-475.
[13]Ney K H. Voraussage der Bitterkeit von Peptiden aus deren Aminosäurezu-sammensetzung[J]. European Food Research & Technology,1971,147(2):64-68.
[14]马铁铮,王强,周素梅. 蛋白短肽苦味成因与脱苦技术研究进展[J]. 中国粮油学报,2008,23(6):220-226.
[15]魏亚娟,田亚平,须瑛敏. 枯草芽孢杆菌脱苦氨肽酶在水解大豆分离蛋白中的应用研究[J]. 食品工业科技,2008(4):149-151.
[16]Sedmak J J,Grossberg S E. A rapid,sensitive,and versatile assay for protein using Coomassie brilliant blue G250.[J]. Analytical Biochemistry,1977,79(1-2):544.
[17]Chial H J,Thompson H B,Splittgerber A G. A spectral study of the charge forms of Coomassie blue G.[J]. Analytical Biochemistry,1993,209(2):258-266.
[18]秦冬玲,马玉洁,陆国太,等. 大豆乳清蛋白的超滤分离及膜污染分析[J]. 食品工业科技,2016(23):72-76.
[19]Wang K D,Wang K H,Zhou N D,et al. Secretory Expression,Purification,Characterization,and Application of an Aspergillus oryzae,Prolyl Aminopeptidase in Bacillus subtilis[J]. Applied Biochemistry & Biotechnology,2016(2-6):1-13.
[20]高梅娟. 酶法水解蛋白制备风味增强肽的研究[D]. 无锡:江南大学,2009.
[21]程丽,梁金钟. 絮凝法预处理大豆蛋白活性肽发酵液的研究[J]. 大豆科技,2004(2):17-19.
[22]甄斌. ε-聚赖氨酸高效提取工艺构建:固液分离与脱色工艺研究[D]. 无锡:江南大学,2015.
[23]葛文静. 大豆蛋白的低限度酶解改性及其苦味物质分析鉴定[D]. 无锡:江南大学,2014.
[24]邓勇,冯学武. 大豆多肽分子质量分布与苦味的确定[J].中国农业大学学报,2001,6(4):98-102.
Preparationofleucineaminopeptidaseandcollaborativeapplicationofdebitterizinginricepeptides
ZHUQiang,WUJing-tao,TIANYa-ping*
(Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
The combination of flocculation,ultrafiltration,and freeze drying method to extract the recombinant bacillus subtilis leucine aminopeptidase,with aminopeptidase removal terminal hydrophobic amino acids for debittering effect index,debittering effect effects of leucine aminopeptidase and proline aminopeptidase hydrolysis of rice peptide was investigated. The preparation conditions of the enzyme were as follows:adding 0.15%±0.008% flocculant,2.5%±0.006% diatomite,adjusting pH8.0 for filtration,using 30 kDa PES roll membrane,ultrafiltration concentration 7 times,under this condition:the total recovery of aminopeptidase rate was 64.69%±1.29%. In the optimized enzymatic hydrolysis conditions,the total amount of leucine,arginine and free hydrophobic amino acids in the hydrolyzate were 3.39±0.10,16.48±0.49 and 4.39±0.13 times higher than that of the hydrolyzate. After the enzymolysis,the molecular weight was 500~1000 Da was reduced by 30.63%±0.61%,and the content of proline was 1.78±0.07 times higher than that of single enzyme hydrolysis after double enzyme synergistic hydrolysis. The optimized process is simple and the enzyme has good application in the peeling of rice peptides.
leucine aminopeptidase;extraction;recovery rate;synergistic hydrolysis;hydrophobic aminoacid
TS201.21
A
1002-0306(2017)19-0109-05
10.13386/j.issn1002-0306.2017.19.021
2017-03-22
朱强(1991-),男,硕士研究生,研究方向:发酵工学,E-mail:zqll2012@163.com。
*通讯作者:田亚平(1964-),女,博士,教授,研究方向:主要从事生物活性物质方面的研究,E-mail:yapingtian@hotmail.com。
江苏省产学研联合创新资金(BY2014023-22)。

