乳酸乳球菌LLY003的安全性评价
,,
(锦州医科大学食品科学与工程学院,辽宁锦州 121000)
乳酸乳球菌LLY003的安全性评价
苏振博,许云贺*,张莉力
(锦州医科大学食品科学与工程学院,辽宁锦州 121000)
乳酸乳球菌LLY003是分离于老北京酸豆汁中的优势乳酸菌,具有生长周期短,高效产酸,黏附绿豆淀粉使其快速沉降的能力,可用于工业生产乳酸菌饮料和绿豆淀粉絮凝剂。本实验主要评价该株乳酸菌的安全性,为生产应用提供安全保障。通过动物实验,有害代谢产物实验,耐药性实验以及其他评价实验,确定该株菌为食用安全菌。结果表明,小鼠在进行动物实验期间无死亡、一切生命活动正常且主要脏器无病变;有害代谢产物检测结果均为阴性;常见的8种抗生素中对链霉素、万古霉素和诺氟沙星表现为抗性且均不含质粒;不会产生溶血和易位现象。通过对该株菌的安全性评价可知乳酸乳球菌LLY003是安全的,为新型乳酸菌的生产应用奠定基础。
乳酸乳球菌LLY003,动物实验,有害代谢产物,耐药性,安全性
老北京豆汁,是北京地区独具特色的传统风味小吃。是以新鲜的绿豆为原料,将绿豆中淀粉过滤出制作粉条等食品后,用剩余的残渣进行发酵生产出来具有养胃、解毒、清火等功效的优质饮品,是绿豆残渣再次利用的点睛之作[1-3]。传统的乳酸菌比如保加利亚乳杆菌等,有很多年的食用历史其安全性较好[4],但在进行应用的过程中培养条件比较苛刻,所以造成市场中主要以酸奶和发酵乳饮料为主,产品种类较为单一[5]。乳酸乳球菌LLY003来源于植物发酵产品,是老北京酸豆汁中的优势菌株,属于新型研发乳酸菌。虽然来源于自然发酵的食物源,但在纯菌浓度较高的条件下进行发酵应用的安全性尚未了解,并且乳酸菌应用的过程中已经出现安全性问题[6-7],所以对该菌的安全性评价尤为重要。
本实验通过动物实验,有害代谢产物实验,耐药性实验以及其他评价实验,将具有生长周期短(24 h活菌数能达到9.3×1011CFU/mL),高效产酸(24 h后pH下降到3.5左右),黏附绿豆淀粉使其快速沉降作用的自创植物源乳酸菌进行安全性评价。确定该株菌为食用安全菌株,为新型乳酸菌的生产应用奠定基础。
1 材料与方法
1.1材料与仪器
乳酸乳球菌LLY003、大肠杆菌以及金黄色葡萄球菌 锦州医科大学食品科学与工程学院食品微生物实验室;健康KMSPF雄性小鼠 体重16~18 g左右,来源于锦州医科大学SPF级动物培养中心;绿豆汁液体培养基[8-9]用来培养乳酸乳球菌LLY003、牛肉膏蛋白胨培养基、硝酸盐培养基、精氨酸,酪氨酸,赖氨酸,组氨酸和鸟氨酸脱羧酶培养基、蛋白胨水培养基配制方法见文献[10-12];哥伦比亚血琼脂平板购买自无锡赛维商务有限公司;氯化钠、葡萄糖、磷酸氢二钾、乙酸钠、对二甲氨基苯甲醛、95%乙醇、浓盐酸、乙醚、硝酸钾、可溶性淀粉、碘化钾、溴甲粉紫、液体石蜡 天津市风船化学试剂科技有限公司;蛋白胨、乳糖、酵母膏、琼脂糖 北京奥博星生物技术有限公司;L-赖氨酸、L-精氨酸、L-组氨酸、L-酪氨酸、L-鸟氨酸 sigma公司;Tris base、溶菌酶、硼酸、Na2EDTA·2H20、溴化乙锭、1kb DNA marker、质粒提取试剂盒 沈阳天根生化试剂责任有限公司;药敏纸片为杭州微生物试剂有限公司提供。
立式高速冷冻离心机 湖南赫西仪器装备有限公司;立式压力蒸汽灭菌锅 上海博讯实业有限公司医疗设备厂;DYY-4C型电泳仪电源 北京市六一仪器厂;双人单面净化工作台 苏州净化设备有限公司;凝胶成像分析系统 金坛市盛蓝仪器制造有限公司;SCAN300型全自动菌落计数器 Interscience。
1.2实验方法
1.2.1 动物实验
1.2.1.1 适应性喂养 将24只体重为16~18 g左右的健康雄性KM小鼠随机分成6组,每组4只,用于进行动物实验。设置环境温度22 ℃,湿度60%,光照12 h,鼠粮和纯净水每天补足,喂养3 d后进行实验[13]。
1.2.1.2 急性毒性实验 随机选取适应性喂养后的2组小鼠进行分组,分成实验组和对照组。调整活化后菌液浓度至2.0×1010CFU/0.2 mL无菌生理盐水,每天一次定时定量灌胃,剂量为0.2 mL/只,空白对照组灌胃无菌生理盐水[14]。喂养期间保证小鼠自由进食、进水,记录观察小鼠死亡状况、体重等一般生理状态[15-17]。解剖前一天禁食、禁水,第8 d采用颈椎脱臼法处死解剖后,观察心、肝、脾、肺、肾变化并称其质量,计算脏器指数=m1/m2。(式中:m1:脏器质量g,m2:小鼠体重质量g)
1.2.1.3 30 d喂养实验 随机选取适应性喂养后的2组小鼠进行分组,分成实验组和对照组。根据实验1.2.1.2急性毒性实验操作过程,延长喂养时间至30 d。第31 d处死解剖后,观察心、肝、脾、肺、肾变化并称取其质量,计算脏器指数。
1.2.2 有害代谢产物评价实验
1.2.2.1 硝酸盐还原酶检测实验 将活化后的菌悬液按照8%接种量(v/v)接入到灭菌后的硝酸盐培养基中,30 ℃培养48 h后先滴加5%的KI溶液10滴,再滴加5%的淀粉溶液10滴,充分振荡混匀的培养基,最后观察培养基颜色变化。同时制作的空白对照组[18]。
1.2.2.2 氨基酸脱羧酶检测实验 将活化后的菌悬液按照8%接种量(v/v)分别接入到灭菌后的五种氨基酸脱羧酶培养基中,30 ℃培养24 h和48 h,观察培养基颜色变化。同时制作对照组[19]。
1.2.2.3 吲哚实验 将活化后的菌悬液按照8%接种量(v/v)分别接入到灭菌后的蛋白胨水培养基中,30 ℃培养48 h。取出后向培养基中加入2 mL乙醚并充分振荡,然后静止片刻,在乙醚层中滴加10滴吲哚试剂,观察乙醚层颜色变化。同时制作对照组[19]。
1.2.3 耐药性评价实验
1.2.3.1 药敏实验 采用K-B(药敏纸片琼脂扩散法)进行药敏实验[18],取无菌生理盐水稀释后浓度为1.0×109CFU/mL的菌悬液0.1 mL,均匀涂布于绿豆汁固体培养基表面,放置30 min以上待干燥后,将纸片平贴在涂好细菌的琼脂表面。所用的药敏纸片分别为:红霉素、链霉素、卡那霉素、万古霉素、青霉素、诺氟沙星、阿奇霉素和四环素[20-21]。贴好药物纸片的平板放置30 min以上,然后倒置平板30 ℃培养48 h,用游标卡尺测量各药敏纸片的抑菌圈大小。(同时设计金黄色葡萄球菌作为质控菌株进行阳性对照)
1.2.3.2 质粒提取实验 取2 mL活化后的菌悬液,使用质粒提取试剂盒和溶菌酶,按照操作过程提取乳酸乳球菌LLY003的质粒。然后利用琼脂糖凝胶电泳进行鉴别[22],利用图像记录分析系统,在254 nm紫外灯照射下,观察是否有电泳条带。
1.2.4 其他评价
1.2.4.1 溶血实验 在无菌条件下,用灭菌的接种环挑取活化后的菌悬液划线于血琼脂平板中,30 ℃倒置培养48 h后,观察菌落周围是否有明显的溶血圈,拍照记录溶血反应现象[23]。(用金黄色葡萄球菌作为阳性对照组进行比较)
1.2.4.2 细菌易位实验 随机选取适应性喂养后的2组小鼠进行分组,分成实验组和对照组。根据1.2.1.2急性毒性实验操作过程,延长喂养时间至30 d。第31 d无菌条件下解剖处死后,并用灭菌的手术刀将心、肝、脾、肺、肾取出,用无菌生理盐水制备浓度为10%的脏器研磨液,进行平板菌落计数涂布,30 ℃下倒置培养48 h,观察平板上有无菌落生长[18]。
1.3数据处理
使用SPSS 18.0软件中的t检验,对数据进行统计和差异显著性分析。数据的表示方式为平均值±标准差(x±SD;n=4)。
2 结果与讨论
2.1动物实验
本实验,选取7 d(急性毒性实验)和30 d(亚慢性毒性实验)对实验小鼠进行处理。小鼠经过灌胃7 d处理,小鼠无死亡,饮食、饮水正常,精神状态、皮肤状态正常,排泄物无异常且小鼠体重变化随培养天数增多呈现正相关趋势,且实验组小鼠体重与对照组小鼠体重差异不显著(p>0.05)(见表1)。第8 d解剖后,小鼠的心、肝、脾、肺、肾无组织病变,且通过脏器指数比较实验组和对照组差异不显著(p>0.05)(见表2)。小鼠经30 d灌胃处理,在第31 d解剖后,实验结果及现象同急性毒性实验。(见表3、表4)。通过脏器指数的比较,可以较明显的比对出该株菌对小鼠的主要脏器没有毒副作用。所以,本实验通过7 d急性毒性实验和30 d喂养实验对乳酸乳球菌LLY003的动物实验指标进行安全性评价,结果说明急性毒性和亚慢性毒性结果是安全的。

表1 动物体重(g)变化Table 1 The weight(g)change of animals
注:同行肩标小写字母相同者表示差异不显著(p>0.05);表2~表4同。

表3 动物体重(g)变化Table 3 The weight(g)change of animals
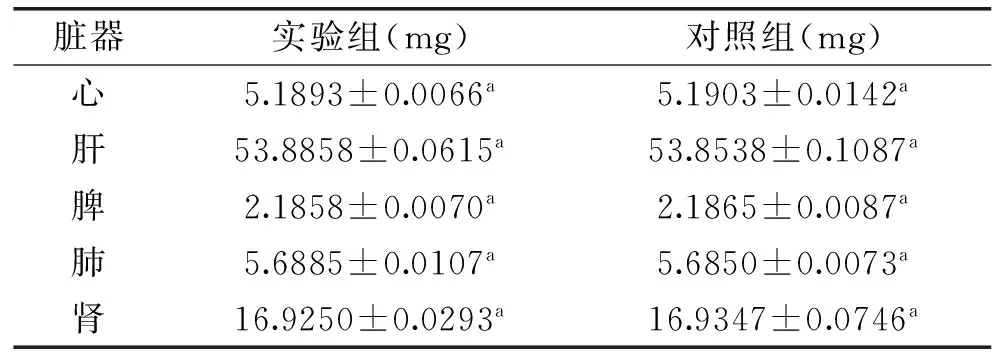
表2 急性毒性实验脏器指数结果Table 2 The index results of acute toxicity organ
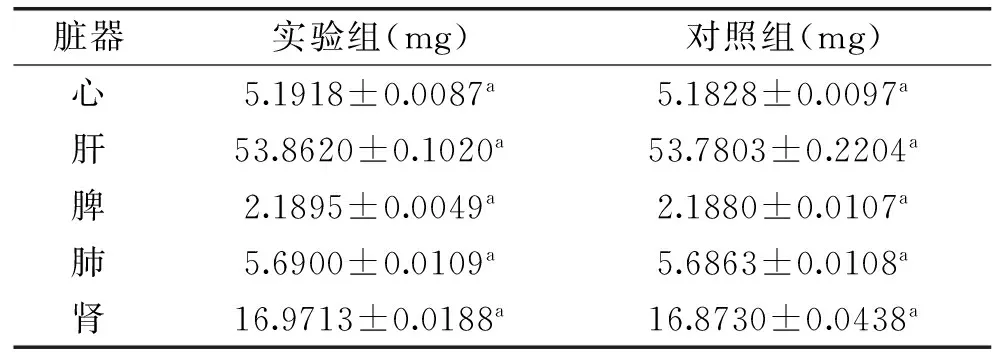
表4 30 d喂养实验脏器指数结果Table 4 The index results of 30 d feeding experiment
2.2有害代谢产物实验
2.2.1 硝酸盐还原酶检测实验 乳酸乳球菌LLY003的硝酸盐还原酶实验结果培养基浑浊且为黄色,说明该菌在增殖过程中表现为阴性反应,乳酸乳球菌LLY003不产生硝酸盐还原酶。有些细菌在增殖过程中会产生硝酸盐还原酶,具有还原硝酸盐的能力,可将硝酸盐还原为亚硝酸盐[18]。硝酸盐类物质是食品中常见的物质,亚硝酸盐更是一种剧毒物质和强致癌物,是食物中毒的主要物质;若乳酸菌发酵产物中有硝酸盐还原酶,摄入后在人体内造成危害。
2.2.2 氨基酸脱羧酶检测实验 乳酸乳球菌LLY003氨基脱羧酶活性检测实验结果培养基浑浊且为黄色,说明该菌在增殖过程中表现为阴性反应,乳酸乳球菌LLY003不产生氨基酸脱羧酶。有些具有氨基酸脱羧酶的细菌,能将食物中的氨基酸发生脱羧反应生成生物胺类物质,使培养基变成碱性[18]。比如毒性较强的组氨酸变成组胺或酪氨酸变成酪胺。作为食品中三大营养物质之一的蛋白质(基本组成单位为氨基酸)是食品中最常见的基本营养物质,游离氨基酸在食品中的存在也是相当普遍,所以氨基酸脱羧酶的检测是非常重要的。摄入过量的生物胺可引起头痛、恶心、呼吸困难、高血压等中毒症状,还会对神经系统造成重大伤害,是重要的食品安全问题。
2.2.3 吲哚实验 乳酸乳球菌LLY003的实验培养基浑浊且乙醚层为无色,说明该菌在增殖过程中表现为阴性反应,乳酸乳球菌LLY003不产生色氨酸酶。细菌含有色氨酸酶,在增殖过程中会生成色氨酸酶,该酶能够分解蛋白胨中的色氨酸生成吲哚(靛基质)[18,27]。色氨酸酶一旦分解人体内的色氨酸,就会造成人体中的色氨酸代谢异常,导致严重疾病发生。
2.3耐药性评价实验
随着抗生素在临床治疗的广泛应用,乳酸菌的耐药性也越来越严重,长期摄入耐药性的乳酸菌会给临床治疗带来很大的困难,所以乳酸菌的耐药性问题成为了研究人员的研究热点[28]。但是对于乳酸菌耐药性的出现并不全是问题,乳酸菌为了较好的适应环境变化而产生的自身耐药性是安全合理的。但是有些乳酸菌可能主动或被动地通过质粒或者转座子将耐药基因转移到宿主基因组中,经过转录、翻译等基因表达过程后发生耐药性表达,就会产生危害[29-30]。耐药性实验结果见表5,常见的8种抗生素中对红霉素、阿奇霉素、四环素和卡那霉素表现为安全的低敏,其他均为抗性且均不含质粒。琼脂糖凝胶电泳实验结果见图1,乳酸乳球菌LLY003的3个样品平行泳道上面均没有条带出现,说明乳酸乳球菌LLY003没有质粒存在,耐药基因不能转移到人基因组上进行表达,食用较安全。

表5 耐药性实验检测结果Table 5 The results of resistance test

图1 质粒提取电泳图Fig.1 Electrophoregram of plasmid extraction注:M:1kb DNA Marker;1、2、3:乳酸乳球菌LLY003。
注:抑菌圈直径:≥15高度敏感(H);10-14中度敏感(I);<10不敏感(L);0为抗性(R)。2.4其他评价实验
2.4.1 溶血实验 有些细菌在增殖代谢过程中会产生一种能与血液中的红血球发生特异性结合的物质,这种物质就是溶血素。在补体的作用下,抗原(红血球)和抗体(溶血素)进行溶解反应,将抗体溶解,进而引发破坏红血球,造成集体严重的溶血反应,导致贫血等一系列反应出现[31-32]。溶血实验结果见图2,乳酸乳球菌LLY003在血平板上培养48 h后长出乳白色菌落且没有溶血圈,属于没有毒性的γ-溶血(金黄色葡萄球菌为阳性对照β-溶血组)。

图2 溶血实验检测结果Fig.2 The results of hemolysis test注:A为实验组乳酸乳球菌LLY003、B为阳性对照组金黄色葡萄球菌。
2.4.2 细菌易位实验 细菌易位现象是肠道微生态系统中存在的一种不正常易位现象。正常情况下,机体除了胃肠之外的主要器官组织不允许检测出细菌,一经发现就会存在潜在危害。可以发生细菌易位的细菌在正常的肠道微生态系统中是没有的,假如摄入的外援菌具有穿越肠道黏膜的功能,就会发生细菌易位现象,增加重大疾病发生的危险系数[33]。细菌易位实验结果见表6,培养31 d的健康小鼠在无菌操作下解剖制成10%匀浆涂布于绿豆汁固体培养基上,倒置培养48 h后没有出现菌落生长的现象,说明乳酸乳球菌LLY003没有发生细菌易位现象,是较安全的食用乳酸菌菌株。
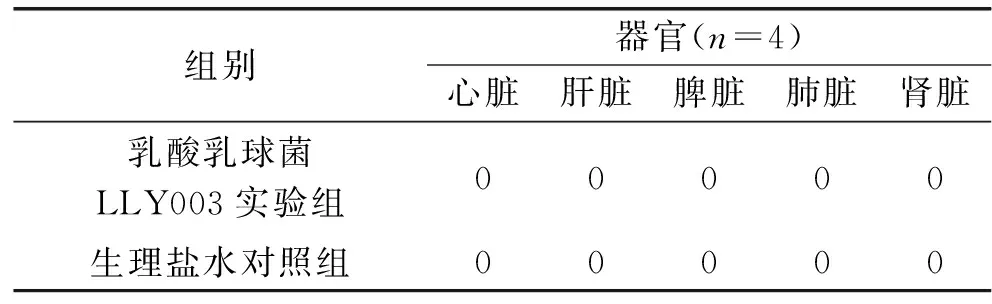
表6 细菌易位实验检测结果Table 6 The results of bacterial translocation test
3 结论
通过对乳酸乳球菌LLY003的安全性评价可知,小鼠在进行动物实验期间无死亡、一切生命活动正常且主要脏器无病变,脏器指数与对照组差异不显著(p>0.05),没有急性毒性和亚慢性毒性现象出现;有害代谢产物检测结果均为阴性;常见的8种抗生素中对链霉素、万古霉素和诺氟沙星表现为抗性且均不含质粒;不会产生溶血和易位现象。所以,乳酸乳球菌LLY003是安全的。
[1]丁玉振,张绍英,梁尽祎,等.北京传统小吃“豆汁”制作工艺研究[J].食品科学,2010,31(02):280-283.
[2]卢晓丹,张敏.豆汁的风味物质分析[J].食品食品学报,2014,(12):174-182.
[3]杨应笑,任发政.清热绿豆饮料配方的优化及功能验证[J].食品科学,2006,27(4):230-232.
[4]Adams MR.Safety of industrial lactic acid bacteria[J]. Biotechnology,1999,68:171-178.
[5]Isolauri E,Kirjavainen PV,Salminen S.Probiotics:a role in the teralment of infection and inflammation[J].Gul,20020:4-9.
[6]方立超,魏泓.益生菌的研究进展[J].中国生物制品学杂志,2007,20(6):463-466.
[7]Pham M,Lemberg D A,Day A S. Probiotics:sorting the evidence from the myths.Medica Journal of Australia,2008,188:304-308.
[8]韩梅,张莉力. 均匀设计优化绿豆酸浆中高淀粉结合性乳酸菌培养基[J]. 饲料研究,2016,(16):33-35.
[9]韩梅,张莉力. 绿豆酸浆的自然发酵及高淀粉结合性乳酸菌培养条件的优化[J]. 饲料研究,2016,(10):28-30,37.
[10]陈天寿.微生物培养基的制造及应用[M].北京:中国农业出版社,1995.
[11]内村泰,岗田早苗.乳酸菌实验手册(日文版)[M].日本東京都新宿区新小川町6-29,朝仓书店,1992,Vol.6:30-73.
[12]张刚.乳酸细菌—基础、技术和应用[M].北京:化学工业出版社,2007.
[13]王雪芹,林海君,鞠世影,等.两株粪肠球菌的安全性评价[J].食品工业科技,2014,(8):166-169.
[14]GB15193.1-2003.食品安全性毒理学评价程序[S].北京:中国标准出版社,2003.
[15]徐丽丹.降血压益生菌的筛选及安全性评价研究[D].哈尔滨市:黑龙江大学,2010.
[16]Nancy J.Szabo.Safety evaluation of Lactobacillus pentosus strain b240.Food and Chemical Toxicology49(2011)251-258.
[17]宋静颐,张明,刘松玲,等. 副干酪乳杆菌L9安全性评价[J].中国奶牛,2015(21):27-31.
[18]顾旭峰,艾连中,宋馨,等.两株干酪乳杆菌的安全性评价[J].食品与发酵科技,2015,51(2):63-65.
[19]王梦姣,李少英,郝苗苗等.分离自马奶及其制品中7株乳酸菌的安全性初步评价[J].微生物学通报,2014,41(5):871-880.
[20]潘露.中国传统发酵食品中乳酸菌的耐药性评估及功能性菌株筛选[D].无锡:江南大学,2011.
[21]秦宇轩,李晶,王秋涯,等.市售酸奶中乳酸菌的鉴定与耐药[J].微生物学报,2013,53(8):889-897.
[22]王梦姣,李少英,李淑芬,等.马奶及其制品中7株肠球菌属乳酸菌的安全性评价[J].食品科学,2014(17):204-208.
[23]Carlolato D,Andrighetto C,Lorabatdi A. Occurrence of virulence factors and antibiotic resistances in Enteroc occus faecalis and Enterococcus faecium collected from Dairy and human samples in North Italy[J]. Food Control,2008,19(9):886-892.
[24]Wassenaar T M,Klein G.Safety aspects and implications of regulation of probiotic bacteria in food and food supplements[J]. Journal of Food Protection,2008,71(8):1734-1741.
[25]Sande rME.Performance of commercial cultures in fluid milk applications[J].Journal of Dairy Science,996,79:943-955.
[26]GB 15193.3-2003.急性毒性实验[S].北京:中国标准出版社,2003.
[27]GB 15193.13-2003.30d和90d喂养实验[S].北京:中国标准出版社,2003.
[28]Shalini M,Rameshwar S.Antibiotic resistance in food lactic acid bactera a review[J]. International Journal of Food Microbiology,2005,105(5):281-295.
[29]贡汉生,孟祥晨.益生菌的安全性评价[M].北京:现代食品科技,2005,21(4):76-79.
[30]解傲,袁杰利.食品用乳酸菌安全性评价方法研究进展[J].中国微生态学杂志,2010,22(8):754-756.
[31]杨宝兰,徐进.益生菌的安全性[J].中国食品卫生杂志,2004,16(3):262-265.
[32]凌代文,乳酸细菌分类鉴定及实验方法[M]. 北京:中国轻工业出版社,1998.
[33]黄丽,李盛钰,赵玉娟.植物乳杆菌c88对小鼠急性毒性和细菌易位实验研究[J].中国食品学报,2012,12(6):9-14.
SafeassessmentofLactococcuslactisLLY003
SUZhen-bo,XUYun-he*,ZHANGLi-li
(College of Food Science and Engineering,Jinzhou Medical University,Jinzhou 121000,China)
LactococcuslactisLLY003 was an advantage of lactic acid bacteria isolated from the old Beijing acid bean juice,with a short growth cycle,efficient acid,adhesion of green bean starch to the ability to quickly settle.It could be used for industrial production of lactic acid bacteria drinks and mung bean starch flocculant.This experiment mainly evaluated the safety of the lactic acid bacteria and provided the security for the production and application.Through the animal experiments,harmful metabolite experiments,drug resistance experiments and other evaluation experiments determined the strains of bacteria as edible safety bacteria.The results showed that mice did not die during the animal experiments and all life activities were normal and the major organs were free of disease.The hazardous metabolites were negative.The common eight antibiotics were resistant to streptomycin,vancomycin and norfloxacin and were free of plasmids. Did not produce hemolysis and translocation.The results showed thatLactococcuslactisLLY003 was safe and laid the foundation for the production and application of new lactic acid bacteria.
LactococcuslactisLLY003;animals experiments;harmful metabolite;drug resistance;security
TS201.3
A
1002-0306(2017)19-0105-05
10.13386/j.issn1002-0306.2017.19.020
2017-03-24
苏振博(1992-),男,硕士研究生,研究方向:食品微生物,E-mail:18741650809@163.com。
*通讯作者:许云贺(1978-),男,博士,副教授,主要从事畜牧微生物应用研究,E-mail:sn_97@126.com。
国家自然科学基金项目(31301499);辽宁省自然科学基金项目(2014022046);辽宁省自然科学基金项目(2014022052)。

