细胞外信号调节蛋白激酶1/2在介导周期性牵张力对牙周膜细胞成骨分化中的作用
宋京 任大鹏 颜世果 蓝菁 袁晓, 郭庆圆 戚向敏
细胞外信号调节蛋白激酶1/2在介导周期性牵张力对牙周膜细胞成骨分化中的作用
宋京1任大鹏2颜世果1蓝菁1袁晓2,3郭庆圆3戚向敏1
1.山东大学口腔医院,山东省口腔生物医学重点实验室,济南 250012;2.青岛大学口腔医学院,青岛大学医学院附属医院正畸科,青岛 266003;3.青岛市立医院口腔医学中心正畸科,青岛 266075
目的 研究周期性牵张力刺激下细胞外信号调节蛋白激酶(ERK)1/2对牙周膜细胞成骨分化的分子调控机制。方法 组织块法培养人牙周膜细胞。采用多通道应力加载系统对细胞施加频率0.5 Hz、振幅10%的周期性牵张力(加力时间1、3、6、12、24 h),以不加力的细胞作为对照,并分别在加力前应用ERK1/2通路特异性抑制剂U0126以及对细胞转染ERK1/2显性负相变异体(DN-ERK1/2)。采用实时荧光定量聚合酶链式反应(real-time PCR)及蛋白质印迹法研究人牙周膜细胞的基因蛋白水平变化。结果 加力后人牙周膜细胞的p-ERK1/2蛋白水平及骨钙蛋白(OCN) mRNA、骨涎蛋白(BSP)mRNA水平均显著升高,Runt相关基因(Runx)2 mRNA及蛋白水平在加力3、6 h均显著升高。加入抑制剂U0126或细胞转染DN-ERK1/2后,Runx2、OCN、BSP mRNA水平以及Runx2、p-ERK1/2蛋白水平均降低。结论 ERK1/2是周期性牵张力刺激下牙周膜细胞成骨分化的重要分子途径,力学刺激下激活的ERK1/2可能通过提高Runx2蛋白的表达水平而参与成骨基因OCN和BSP的转录表达。
牙周膜细胞; 成骨分化; 周期性牵张力; 细胞外信号调节蛋白激酶1/2
牙周膜是位于牙根和牙槽骨之间的纤维结缔组织,主要功能是将牙齿承受的力刺激传递给牙槽骨,以利于牙周组织改建。人牙周膜细胞(human periodontal ligament cells,hPDLCs)是构成牙周膜的主体细胞,在感受力学刺激并将其转化为生物信号过程中起到重要的作用。这种特性决定了牙周膜细胞是牙周组织再生与改建的种子细胞[1]。牙周膜成纤维细胞对力学刺激的感受和反应,以及在不同状态下的基因表达差异和功能变化已经成为学者们关注的焦点。目前,多种力学装置的使用,如压应力、间断性牵张力等,均可不同程度地促使牙周膜成纤维细胞的成骨表型基因表达,如骨钙蛋白(osteocalcin,OCN)、骨涎蛋白(bone sialoprotein,BSP)等[2-4]。
核心结合因子α1(core binding factor α1,cbfα1),即Runt相关基因2(runt-related transcription factor 2,Runx2),是成骨细胞的特异转录因子,对骨组织的形成和重建起重要作用[5-6]。依赖于其特有的结构域runt,Runx2可以与下游靶基因DNA上的特异性位点结合从而发挥其转录激活作用,促使下游成骨表型基因的表达,以及干细胞的成骨细胞分化[7]。细胞外信号调节蛋白激酶(extracellular signal-regulated kinase,ERK)1/2是丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)超家族的重要成员,其在细胞分化、增殖、凋亡及迁移等多种细胞行为中发挥信号传递作用[8-9]。目前已证实ERK1/2与Runx2均是力学信号的刺激靶点之一,但对于其是否参与了周期性牵张力刺激下hPDLCs的成骨分化,以及具体的调控机制仍不清楚。本研究应用细胞多通道应力加载装置对体外培养的hPDLCs施加振幅10%、频率0.5 Hz的周期性牵张力,以模拟口腔生理环境下牙周膜承受的咬合力[3],观察hPDLCs中ERK1/2通路及成骨相关基因的变化,探索ERK1/2参与周期性牵张力刺激下牙周膜细胞成骨分化的分子机制。
1 材料和方法
1.1 主要材料和仪器
α-MEM培养基、双抗(青霉素100 U·mL-1,链霉素100 U·mL-1)(Hyclone公司,美国)、胎牛血清(fetal bovine serum,FBS)、0.25%胰蛋白酶(Gibco公司,美国)、鼠抗人波形丝蛋白抗体、鼠抗人角蛋白抗体、通用型免疫组化检测试剂盒(北京中杉金桥生物技术有限公司)、ERK1/2鼠抗人单克隆抗体、磷酸化ERK1/2鼠抗人单克隆抗体(phospho-ERK1/2,p-ERK1/2)、ERK1/2通路特异性阻断剂U0126(Cell Signaling Technology公司,美国),Runx2兔抗人单克隆抗体(Abcam公司,美国),二甲基亚砜(dimathylsulfoxide,DMSO)、细胞裂解液、辣根过氧化物酶(horse radish peroxidase,HRP)标记的羊抗鼠二抗、羊抗兔二抗(上海碧云天生物技术有限公司)、反转录试剂盒、实时荧光定量聚合酶链式反应(real-time polymerase chainreaction,real-time PCR)试剂盒、引物合成(Takara公司,日本)、ERK1/2显性负相变异体(dominant negative ERK1/2,DN-ERK1/2)重组慢病毒载体LV-dnERK1/2与慢病毒空载体LV-NC(上海吉玛生物技术有限公司)。
MDF-382E型超低温冰箱(-80 ℃)(SANYO公司,日本),Olympus TH4-200倒置显微镜及照相系统、FluoView FV1200荧光共聚焦显微镜(Olympus公司,日本),HERA cell恒温CO2细胞培养箱(Heraeus公司,德国),HDL-1360B型超净工作台(哈尔滨市东联电子技术开发有限公司),多通道应力加载系统(哈尔滨工业大学研制),ioFlex弹性细胞培养板(Flexcell公司,美国),Light Cycler Roche 480 real-time PCR扩增仪(Roche公司,瑞士),电泳槽、电泳仪、电转仪、制胶器(Bio-Rad公司,美国)。
1.2 hPDLCs的原代培养和鉴定
取11~16岁青少年因正畸而拔除的健康前磨牙,并签署患者知情同意书。采用组织块法原代培养hPDLCs,使用α-MEM培养液(含15%FBS,100 U·mL-1青霉素,100 U·mL-1链霉素)进行原代培养。取第3代细胞爬片,对其进行波形丝蛋白和角蛋白的免疫组织化学染色,鉴定细胞来源。
1.3 hPDLCs体外培养——力学刺激模型的构建
选择传至第3代的牙周膜细胞进行胰酶消化和细胞计数,将接种密度调整到1×105·mL-1后接种至BioFlex培养板,放置于37 ℃、5%CO2培养箱内培养1~2 d,待细胞达80%以上融合时,用低血清浓度(含体积分数为3%的胎牛血清)的培养液继续培养24 h。利用多通道应力加载系统对细胞分别施加1、3、6、12、24 h频率为0.5 Hz、振幅为10%的张应力,每一循环包括1 s拉伸和1 s松弛,以此作为加力组;对照组(不加力组)细胞放在同一培养箱内不加力(即加力0 h)。收集2组细胞用于后续检测实验。
1.4 ERK1/2通路特异性抑制剂U0126的应用
将hPDLC分为3组,对照组采用只添加DMSO的培养液进行培养,不加力;加力组用只添加DMSO的培养液培养1 h后,加力3 h;加力抑制组,首先将U0126抑制剂溶解于DMSO中,制备成浓度为100 mmol·L-1的U0126储存液,然后将U0126储存液按照一定比例加入到细胞培养液中,使其终浓度为20 μmol·L-1,放入培养箱中孵育1 h后,加力3 h。收集各组细胞用于后续检测实验。
1.5 DN-ERK1/2的转染
hPDLC以每孔1×105个接种于六孔板,分为3组:感染慢病毒空载体组(LV-NC组)、感染DNERK1/2重组病毒组(LV-dnERK1/2组)、正常细胞组。
LV-NC组、LV-dnERK1/2组:分别取LV-NC和LV-dnERK1/2慢病毒原液1 mL,按感染复数(multiplicity of infection,MOI)值为100的比例加入细胞中,12 h后弃掉病毒液更换新鲜培养液,每隔2 d换一次培养液。正常细胞组加入培养液作为对照。1周后利用荧光共聚焦显微镜观察细胞转染情况。
转染成功后LV-NC组、LV-dnERK1/2组再各分为2个小组,一组加力3 h(LV-NC/加力组,LV-dnERK1/2/加力组),另一组不加力(LV-NC/静止组,LV-dnERK1/2/静止组)。收集各组细胞用于后续检测实验。
1.6 real-time PCR检测成骨基因Runx2、OCN和BSP的表达水平
收集各组细胞,提取RNA并进行反转录,按照TAKARA公司的说明书提取细胞总RNA,分光光度计测量RNA的浓度和纯度,利用TAKARA公司的反转录试剂盒将RNA反转录为cDNA,将得到的反应液加入到real-time PCR的反应体系中,再利用各个基因的引物进行PCR扩增反应,检测Runx2、OCN和BSP mRNA的表达情况。GAPDH作为管家基因。结果采用2-ΔΔCt方法计算目的基因各自的相对表达量。各因子的引物序列见表1。
1.7 蛋白质印迹法(Western blot)检测目的蛋白表达水平
每组蛋白样本来源的细胞约为3×106个,每组细胞样本加入200 μL细胞裂解液冰上裂解细胞,低温离心,获取全蛋白上清,-80 ℃保存备用。采用二辛可酸(bicinchoninic acid,BCA)蛋白检测试剂盒测定蛋白浓度。各组取等量蛋白样品上样,进行聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),将电泳分离后的蛋白带转移到PVDF膜上,封闭液室温封闭1 h,然后分别加入稀释的Runx2(1∶500)、ERK1/2(1∶1 000)、p-ERK1/2(1∶1 000)的单克隆抗体4 ℃过夜孵育,漂洗后加入TBS稀释的辣根酶标记的二抗(1∶5 000),室温下摇动反应2 h。实验以GAPDH作为内参照,对图像进行分析并计算相对灰度值。

表1 reaI-time PCR各基因引物序列Tab l Primers of genes used in real-time PCR
1.8 统计学分析
采用SPSS 19.0软件进行分析,对数据进行单因素方差分析和配对t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 人牙周膜干细胞的体外培养与鉴定
培养的组织块约10 d有hPDLCs从组织块边缘爬出,3~4周爬满瓶底。传代培养的hPDLCs呈长梭形或纺锤形,胞核为圆形或卵圆形,具有成纤维细胞特性。hPDLCs免疫组织化学结果为波形丝蛋白染色阳性,角蛋白染色阴性,证实所获的细胞来源于中胚层(图1)。
2.2 牙周膜细胞体外培养——力学刺激模型的构建
不同加力时间下各组蛋白表达的Western blot检测结果见图2、3。与不加力组相比较,加力组的p-ERK1/2蛋白水平均显著升高(P<0.05),其中以加力1 h和3 h最高(P<0.01);ERK1/2蛋白总量(t-ERK1/2)无显著变化(P>0.05);Runx2蛋白水平在加力3 h和6 h时显著升高(P<0.01),12 h时显著降低(P<0.05)。这表明,周期性牵张力作用下可以激活牙周膜成纤维细胞内的ERK1/2通路。

图1 hPDLCs的体外培养与鉴定 倒置显微镜Fig 1 The culture and identification of hPDLCs inverted microscope
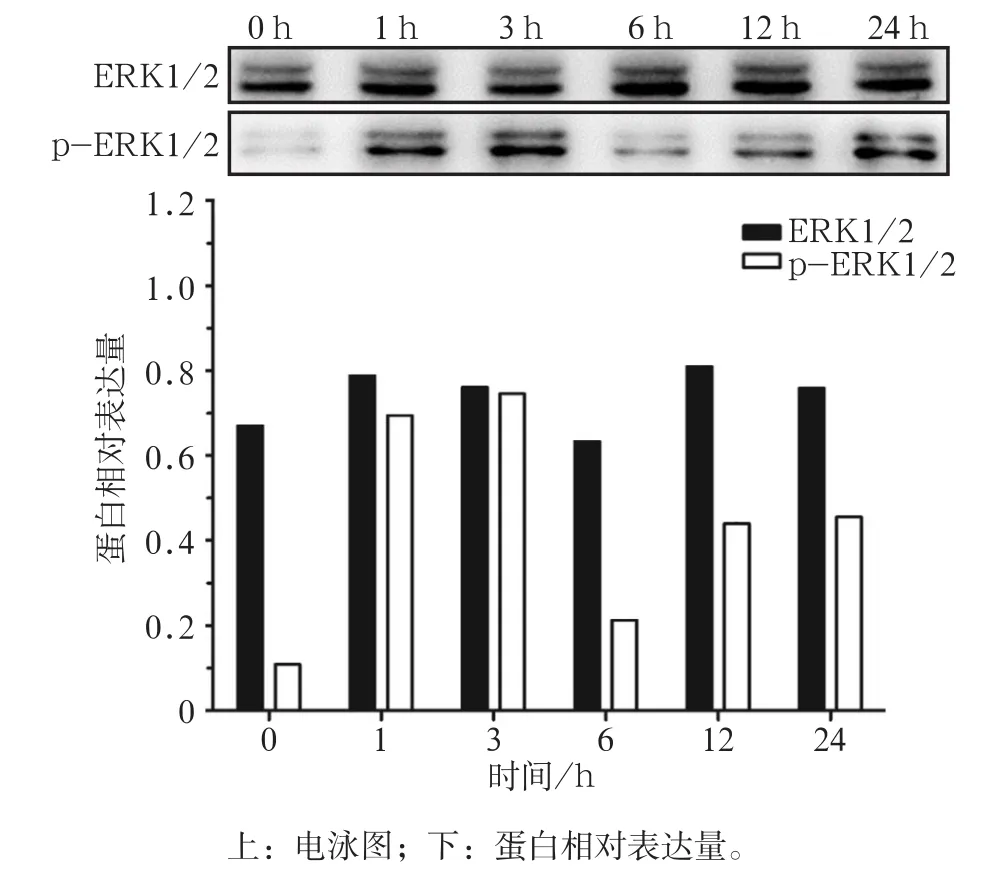
图2 Western blot检测不同加力时间下各组ERK1/2和p-ERK1/2蛋白表达Fig 2 Western blot detected the protein level of ERK1/2 and p-ERK1/2 in every group for different time points

图3 Western blot检测不同加力时间下各组Runx2蛋白表达Fig 3 Western blot detected the expression of Runx2 protein in every group for different time points
不同加力时间下各组基因表达的real-time PCR检测结果见图4。Runx2 mRNA水平在加力1 h后即开始升高,在加力3 h后达到峰值,随后开始下降,12 h后表达低于对照组,24 h再次呈现升高趋势。OCN mRNA表达在1~6 h期间升高缓慢,12 h达到峰值,24 h有所下降。BSP mRNA表达随加力时间延长而增加,具有明显的时间正相关性。
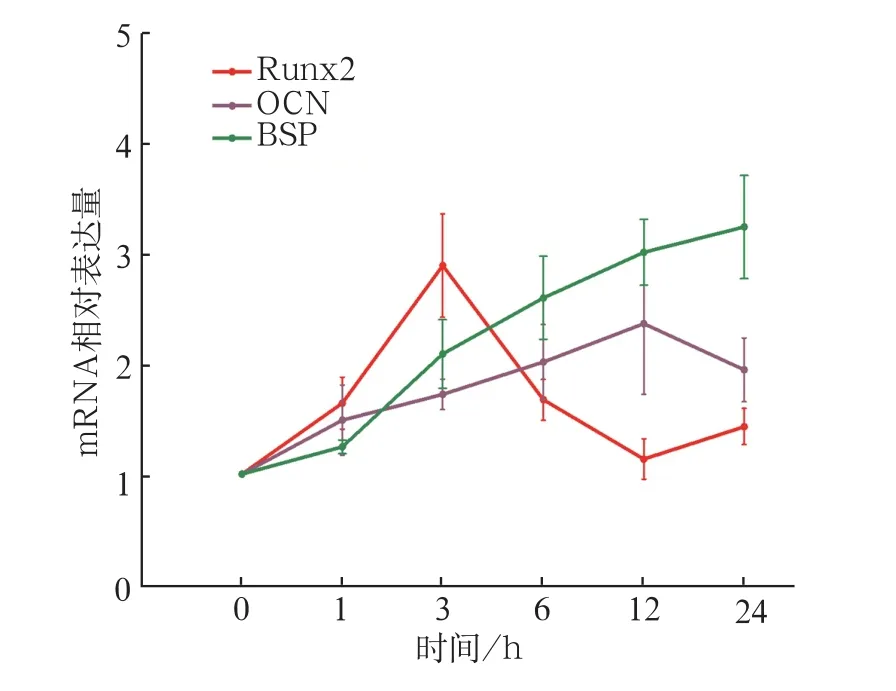
图4 real-time PCR检测不同加力时间下各组Runx2、OCN和BSP mRNA表达Fig 4 real-time PCR detected the mRNA level of Runx2, OCN and BSP in every group for different time points
2.3 U0126阻碍hPDLC在周期性牵张力下的成骨分化
Western blot及real-time PCR检测结果(图5)显示,加力抑制组和对照组的Runx2、OCN、BSP基因水平及Runx2、p-ERK1/2蛋白水平低于加力组(P<0.01);加力抑制组的Runx2基因水平高于对照组(P<0.05),OCN、BSP基因水平与对照组无显著差异(P>0.05)。这表明,U0126阻碍牙周膜成纤维细胞在周期性牵张力下的成骨分化。
2.4 DN-ERK1/2转染抑制牙周膜成纤维细胞在周期性牵张力下的成骨分化
hPDLCs转染慢病毒空载体LV-NC和重组慢病毒载体LV-dnERK1/2 1周后,荧光显微镜下可见阳性转染的细胞胞浆发出绿色荧光,阳性转染比例为70%~80%(图6)。

图5 U0126对hPDLC周期性牵张力作用下成骨分化的影响Fig 5 Effect of U0126 on the osteogenic differentiation of hPDLCs under stretch stimulation

图6 LV-NC和LV-dnERK1/2转染hPDLCs × 100Fig 6 hPDLCs transfected by LV-NC and LV-dnERK1/2 × 100
Western blot及real-time PCR检测结果(图7)显示,LV-NC/加力组的Runx2、OCN、BSP基因水平以及Runx2、p-ERK1/2蛋白水平均高于LV-dnERK1/2/加力组、LV-NC/静止组、LV-dnERK1/2/静止组(P<0.05),而其他三组之间均无显著差异(P>0.05)。

图7 DN-ERK1/2转染对hPDLC周期性牵张力作用下成骨分化的影响Fig 7 Effect of DN-ERK1/2 transfected on the osteogenic differentiation of hPDLCs under stretch stimulation
3 讨论
牙周组织的改建离不开机械力的刺激作用。hPDLCs具有一定程度的成骨细胞的特征,在诱导培养条件下具有矿化能力,可形成矿化的细胞外基质。作为牙周膜的主要成分,hPDLCs在感受外界的力学刺激信号并将其转化为生物信号的过程中发挥重要的作用[4,10]。关于机械力学信号的传导一直是学者们关注的重点。关于细胞对力学信号的感受方式存在两种观点[11]:1)机械力作用于细胞膜表面的蛋白质,导致蛋白质空间构象发生变化,激活细胞膜表面的黏附蛋白、整联蛋白和钙离子通道等,并形成级联反应,将信号逐级向下游传递;2)机械力使细胞骨架发生变化,促使细胞对细胞骨架内的张力重新分布,从而实现了力信号向化学信号的转化。目前学者们一致认为,力学信号的胞内转导方式在很大程度上依赖于组织细胞的种类和力学刺激的类型。
丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)是一类具有丝氨酸和酪氨酸双重磷酸化能力的蛋白激酶超家族[12]。ERK1/2作为MAPK的成员之一,在力学信号的传递中起着重要作用。研究[11,13]表明,机械力刺激可以通过整联蛋白和钙离子通道途径激活ERK1/2通路,促使成骨细胞分化。本研究应用Western blot技术检测ERK1/2激活后的磷酸化形式p-ERK1/2,发现其表达水平在加力后显著升高,尤其以1 h和3 h加力组更为明显。这一研究结果提示,hPDLCs在应力刺激下ERK1/2通路被激活。
目前,对ERK1/2功能的研究主要是通过加入干预因素过度激活或者抑制ERK1/2的磷酸化,从而研究其下游靶基因的相应变化[14]。本实验通过分别使用ERK1/2通路的阻断剂U0126和过表达显性负相基因DN-ERK1/2从而达到对ERK1/2通路活化的抑制[15-16]。DN-ERK1/2是ERK1/2的基因变异体(T192A或Y194F),可以永久性抑制ERK1/2在T192和Y194位点上发生磷酸化而成为活化的p-ERK1/2,因而被广泛应用于ERK1/2的功能研究中[17]。
real-time PCR结果显示在不同的加力时间下,成骨细胞表型基因OCN和BSP的mRNA水平也有升高,提示机械力刺激激发了hPDLCs成骨分化的潜力。通过使用抑制剂U0126对ERK1/2通路实施特异性的阻断后,发现以上基因的表达均下降;而过表达ERK1/2的显性负相基因DN-ERK1/2也相应地阻断了上述基因的表达在应力刺激下的升高,这进一步证实ERK1/2通路的活化参与了应力刺激下hPDLCs的成骨分化。Miraoui等[18]研究认为,成纤维细胞生长因子(fibroblast growth factor,FGF)促进间充质细胞的成骨分化也是通过ERK1/2通路介导的,并且DN-ERK1/2过表达抑制了FGF对成骨分化的促进作用,这与本研究结果相一致。另外,韩悦等[19]发现ERK1/2通路还参与了张应力刺激下牙周膜细胞的增殖。结合当前研究结果,笔者推测ERK1/2是牙周膜细胞感受应力刺激、发生增殖和分化的重要分子激酶途径。
Runx2是骨发育和骨改建的重要调控基因,参与了间充质细胞系向成骨细胞系的定向分化,并抑制其向软骨细胞系的分化[20]。Ziros[21]研究证实,具有成骨样特征的hPDLCs中Runx2是力学信号的靶蛋白,在机械力的刺激下可以显著提升Runx2的基因和蛋白的表达,并通过凝胶滞留移动实验(electrophoretic mobility shift assay,EMSA)发现,在机械拉伸30 min后能探测到Runx2与成骨细胞特异性元件OSE2的结合,6 h后达峰值。本研究结果也显示:Runx2的基因水平在1 h加力组即有升高,并在3 h达到峰值,而相应的Runx2蛋白在3 h和6 h表达最高。在加力3 h组的细胞进行U0126预处理后,Runx2的基因和蛋白水平较单纯加力组下降,提示ERK1/2通路可能参与了对Runx2的调控过程。综上所述,笔者推测在周期性牵张力作用下,hPDLCs的成骨分化过程可能是通过ERK通路的激活,继而引起下游靶基因Runx2表达的升高,并促使Runx2与成骨基因(BSP,OCN)上的启动子结合,激活这些基因的转录过程。
临床上由于牙齿缺失导致的牙槽骨萎缩是牙周组织在缺乏咬合力刺激下发生退行性改变的重要表现。本研究利用振幅10%、频率0.5 Hz的周期性牵张力模拟口腔环境中的咬合力,对体外培养的hPDLCs施加力学刺激,初步证实ERK1/2通路参与了张应力作用下牙周膜细胞的成骨分化,并且可能由其下游因子Runx2介导,但其确切的分子机制尚需要进一步的深入研究。
[1] Matsuda N, Yokoyama K, Takeshita S, et al. Role of epidermal growth factor and its receptor in mechanical stressinduced differentiation of human periodontal ligament cells in vitro[J]. Arch Oral Biol, 1998, 43(12):987-997.
[2] Li L, Han M, Li S, et al. Cyclic tensile stress during physiological occlusal force enhances osteogenic differentiation of human periodontal ligament cells via ERK1/2-Elk1 MAPK pathway[J]. DNA Cell Biol, 2013, 32(9):488-497.
[3] Fujihara C, Yamada S, Ozaki N, et al. Role of mechanical stress-induced glutamate signaling-associated molecules in cytodifferentiation of periodontal ligament cells[J]. J Biol Chem, 2010, 285(36):28286-28297.
[4] 李小彤, 张丁, 傅民魁, 等. 机械牵张力对人牙周膜细胞成骨样细胞功能的影响[J]. 中华口腔医学杂志, 2002, 37(2):65-68.
Li XT, Zhang D, Fu MK, et al. Effects of mechanical stretching force on osteoblast-like function of human periodontal liga-ment cells in vitro[J]. Chin J Stomatol, 2002, 37(2):65-68.
[5] Ducy P, Zhang R, Geoffroy V, et al. Osf2/Cbfa1: a transcriptional activator of osteoblast differentiation[J]. Cell, 1997,89(5):747-754.
[6] Sato M, Morii E, Komori T, et al. Transcriptional regulation of osteopontin gene in vivo by PEBP2alphaA/CBFA1 and ETS1 in the skeletal tissues[J]. Oncogene, 1998, 17(12):1517-1525.
[7] Ducy P, Karsenty G. Two distinct osteoblast-specific cisacting elements control expression of a mouse osteocalcin gene[J]. Mol Cell Biol, 1995, 15(4):1858-1869.
[8] Zhang W, Liu HT. MAPK signal pathways in the regulation of cell proliferation in mammalian cells[J]. Cell Res,2002, 12(1):9-18.
[9] Chambard JC, Lefloch R, Pouysségur J, et al. ERK implication in cell cycle regulation[J]. Biochim Biophys Acta,2007, 1773(8):1299-1310.
[10] 李永明, 杨磊, 丁寅, 等. 周期性牵张力调节人牙周膜细胞成骨相关基因表达的研究[J]. 中华口腔医学杂志, 2007,42(6):368-372.
Li YM, Yang L, Ding Y, et al. Effect of cyclic-tension force on the expression of osteogenesis genes in human periodontal ligament cells[J]. Chin J Stomatol, 2007, 42(6):368-372.
[11] Kanno T, Takahashi T, Tsujisawa T, et al. Mechanical stressmediated Runx2 activation is dependent on Ras/ERK1/2 MAPK signaling in osteoblasts[J]. J Cell Biochem, 2007,101(5):1266-1277.
[12] Tang K, Wu H, Mahata SK, et al. A crucial role for the mitogen-activated protein kinase pathway in nicotinic cholinergic signaling to secretory protein transcription in pheochromocytoma cells[J]. Mol Pharmacol, 1998, 54(1):59-69.
[13] Fan X, Rahnert JA, Murphy TC, et al. Response to mechanical strain in an immortalized pre-osteoblast cell is dependent on ERK1/2[J]. J Cell Physiol, 2006, 207(2):454-460.
[14] Futran AS, Link AJ, Seger R, et al. ERK as a model for systems biology of enzyme kinetics in cells[J]. Curr Biol,2013, 23(21):R972-R979.
[15] Li L, Wang L, Li TT, et al. ERK signaling pathway regulates embryonic survival and eye development in goldfish,Carassiusauratus[J]. Curr Mol Med, 2013, 13(6):959-967.
[16] Yeh CC, Horng HC, Chou H, et al. Dectin-1-mediated pathway contributes to fusariumproliferatum-induced CXCL-8 release from human respiratory epithelial cells[J]. Int J Mol Sci, 2017, 18(3). pii: E624. doi: 10.3390/ijms18030624.
[17] Pagès G, Lenormand P, L’Allemain G, et al. Mitogen-activated protein kinases p42mapk and p44mapk are required for fibroblast proliferation[J]. Proc Natl Acad Sci USA, 1993, 90(18):8319-8323.
[18] Miraoui H, Oudina K, Petite H, et al. Fibroblast growth factor receptor 2 promotes osteogenic differentiation in mesenchymal cells via ERK1/2 and protein kinase C signaling[J].J Biol Chem, 2009, 284(8):4897-4904.
[19] 韩悦, 潘劲松, 陈丹鹏, 等. ERK信号通路参与调控周期性张应变诱导的人牙周膜细胞增殖[J]. 医用生物力学,2009, 24(3):211-215.
Han Y, Pan JS, Chen DP, et al. Proliferation of human periodontal ligament cells promoted by cyclic strain via ERK signaling pathway[J]. J Med Biomech, 2009, 24(3):211-215.
[20] Hartmann C. Transcriptional networks controlling skeletal development[J]. Curr Opin Genet Dev, 2009, 19(5):437-443.
[21] Ziros PG. The bone-specific transcriptional regulator Cbfa1 is a target of mechanical signals in osteoblastic cells[J]. J Biol Chem, 2002(26):23934-23941.
(本文编辑 李彩)
The role of extracellular signal regulated kinase 1/2 in mediating osteodifferentiation of human periodontal ligament cells induced by cyclic stretch
Song Jing1, Ren Dapeng2, Yan Shiguo1, Lan Jing1, Yuan Xiao2,3, Guo Qingyuan3, Qi Xiangmin1. (1. Stomatology Hospital of Shandong University, Shandong Provincial Key Laboratory of Oral Biomedicine, Jinan 250012, China; 2. Stomatology College of Qingdao University; Dept. of Orthodontics, The Affiliated Hospital of Qingdao University Medical College, Qingdao 266003, China; 3. Dept. of Orthodontics, Stomatological Center, The Affiliated Qingdao Municipal Hospital, Qingdao 266075, China)
Supported by: National Natural Science Foundation of China (31170891); Key Fund of Shandong Provincial Health Bureau(2011HD001). Correspondence: Qi Xiangmin, E-mail: qidoc105@sdu.edu.cn.
Objective This study aimed to investigate the mechanism of cyclic stretch that promotesthe osteogenic differentiation of human periodontal ligament cells (hPDLCs) through the mediation of extracellular-signal-regulated kinase 1/2(ERK1/2). Methods hPDLCs were isolated throughthe explant method and cultured in vitro. hPDLCs were mechanically stimulated by a multi-channel cell-stress-loading system for 1, 3, 6, 12, and 24 h. The magnitude of stretch was 10% deformation, and the frequency was 0.5 Hz. Nonloaded cells were used as control group. ERK1/2 activation was blocked by U0126,a specific ERK1/2 pathway inhibitor. Additionally, hPDLCs were transfected with adenoviral vector encoding dominant negative ERK1/2 (DN-ERK1/2) to continuouslyinhibit ERK1/2 activation. The mRNA and protein levels of target geneswere detected through real-time polymerase chain reaction and Western blot. Results Cyclic stretching promoted the expression of ERK1/2, osteocalcin (OCN) mRNA, and bone sialoprotein(BSP) mRNA. The expression of runt-related transcription factor (Runx) 2 protein and mRNA also increased at 3 and 6 h of cyclic stretching. The inhibition of ERK1/2 by U0126 and DN-ERK1/2 suppressed the expressionof Runx2 mRNA,OCN mRNA, BSP mRNA, Runx 2 protein, and p-ERK1/2 protein relative to that in stretched cells without the ERK1/2 inhibitor. Conclusion ERK1/2 is a critical molecule in the mediation ofthe osteogenic differentiation of hPDLCs under mechanical stimulation. ERK1/2 activation induced the elevation of Runx2 protein levels, which may be involved in the stretch-induced expressions of OCN and BSP.
periodontal ligament cells; osteogenic differentiation; cyclic stretch; extracellular signal regulated kinase 1/2
Q 254
A
10.7518/hxkq.2017.05.015
2016-08-11;
2016-12-09
国家自然科学基金(31170891);山东省卫生厅重点基金(2011HD001)
宋京,住院医师,硕士,E-mail:jinglydentist@163.com
戚向敏,教授,硕士,E-mail:qidoc105@sdu.edu.cn

