稳定过表达成纤维细胞激活蛋白的口腔鳞状细胞癌细胞株的构建
赵萌 邵婷如 黄佳欣 陈跃川 吕晓智
稳定过表达成纤维细胞激活蛋白的口腔鳞状细胞癌细胞株的构建
赵萌 邵婷如 黄佳欣 陈跃川 吕晓智
南方医科大学南方医院口腔-头颈外科,南方医科大学口腔医学院,广州 510515
目的 构建人成纤维细胞激活蛋白(FAP)过表达慢病毒载体,转染口腔鳞状细胞癌(OSCC)细胞株SCC9,构建稳定过表达FAP的OSCC细胞株。方法 采用聚合酶链反应(PCR)技术获得FAP片段,利用基因重组技术构建过表达FAP的慢病毒载体,包埋病毒并收集上清液感染SCC9细胞株,通过流式细胞荧光分选技术(FACS)进行筛选,获得稳定过表达FAP的SCC9细胞株。结果 对阳性克隆进行酶切鉴定和基因测序证明FAP的慢病毒载体构建成功,实时荧光定量PCR和Western blot检测结果证明成功构建稳定过表达FAP的SCC9细胞株。结论 本研究有助于获得纯化FAP蛋白,为进一步研究FAP在OSCC发生发展过程中的机制奠定基础。
成纤维细胞激活蛋白; 慢病毒载体; 过表达; 口腔鳞状细胞癌
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是口腔颌面部最常见的恶性肿瘤,约占颌面部恶性肿瘤的90%[1],严重影响患者的生活质量,危及患者生命。然而,以手术、放疗和化疗为主的传统疗法治疗OSCC的效果尚不能令人满意,需要寻找新的治疗方法和手段[2]。人类成纤维细胞激活蛋白(fibroblast activation protein,FAP)是一种丝氨酸蛋白酶,为细胞表面Ⅱ型跨膜糖蛋白。作为肿瘤相关成纤维细胞(cancer associated fibroblast,CAF)的表面标记蛋白之一,FAP已证实与肿瘤的发生发展密切相关[3]。
本课题组前期实验证实,FAP不仅在OSCC组织中高表达,在OSCC细胞中的表达水平也明显增高,且FAP表达水平与OSCC患者的预后负相关,FAP能促进OSCC细胞增殖、侵袭和转移[4-5]。然而,FAP促进OSCC发生发展过程中的确切机制尚不清楚。本实验构建了野生型pCDH-FAP,并进一步包埋病毒,感染OSCC细胞,获得稳定过表达FAP的SCC9细胞株,为进一步研究FAP在OSCC中的作用及其机制奠定基础。
1 材料和方法
1.1 细胞株、质粒、菌种及主要试剂
从南方医科大学南方医院口腔-头颈外科获取新鲜OSCC组织样本;293T细胞、舌鳞状细胞癌细胞株SCC9、慢病毒表达载体pCDH-CMV-MCS-EF1-copGFP和病毒辅助载体psPAX2、pMD2.G由南方医科大学细胞生物教研室提供。
RNA保存液和混合蛋白酶抑制剂(北京康为世纪生物科技有限公司);感受态大肠杆菌DH5α(广州慧研生物科技有限公司);Trizol和逆转录试剂盒(TAKARA公司,日本);Pfu酶、限制性内切酶、T4连接酶、聚合酶链反应(ploymerase chain reaction,PCR)回收试剂、琼脂糖凝胶回收试剂盒(Thermo Scientific公司,美国);质粒小提试剂盒(北京天根生化科技有限公司);Hilymax(日本同仁公司);实时荧光定量PCR剂盒(北京康润诚业生物科技有限公司);His抗体(CST公司,美国);FAP抗体(Santa公司,美国);RIPA(上海碧云天生物技术有限公司)。
1.2 引物
FAP序列引物根据基因库NM_001291807.1(Homo sapiens fibroblast activation protein,alpha,transcript variant 2,mRNA,complete cds)信息,利用Primer Premier 6.0和Gene Codes软件设计,在上下游分别加入NheⅠ和BamHⅠ酶切位点,由上海生工生物技术有限公司合成。FAP上游引物为:GCTAGCGCCACCATGAAGACTTGGGTAAAAATCGTA,带His-6标签的下游引物为:CGCGGATCCTTAGTGGTGGTGGTGGTGGTGGTCTGACAAAGAGAAACACTGC。
1.3 扩增目的编码区
Trizol法提取OSCC组织总RNA,逆转录为cDNA链,以逆转录产物为模板,采用高保真Pfu酶构成的PCR体系50 μL扩增目的编码区。PCR程序为:94 ℃预变性2 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸4 min,30个循环,72 ℃延伸5 min。反应后取5 μL PCR产物进行1%琼脂糖凝胶电泳检测,获得野生型FAP序列。
1.4 重组载体pCDH-FAP的构建与鉴定
利用PCR产物回收试剂盒得到纯化FAP序列,将纯化产物以及病毒表达载体pCDH-CMV-MCS-EF1-copGFP进行NheⅠ和BamHⅠ双酶切后回收。按照载体和目的基因摩尔比1∶8的比例经T4连接酶16 ℃过夜连接,转化到DH5α感受态大肠杆菌,涂板后37 ℃孵箱过夜后挑取单克隆菌落,抽提质粒后进行双酶切验证,将含有插入基因的阳性克隆送至广州艾基生物技术有限公司测序鉴定。
1.5 慢病毒的包装与病毒上清液收集
选择生长状态良好的293T细胞,收集并计数后按照每孔5×105个细胞接种于6孔板,37 ℃,5%CO2孵箱中培养。24 h后,细胞汇合度达70%~80%可进行转染。采用Hilymax试剂为介导的瞬时转染的方法,转染工具细胞293T,转染比例:DNA载体总量(μg)和Hilymax体积(μL)比例为1∶3,以35 mm 6孔细胞培养板为例,总的质粒转染量需小于4 μg,其中重组病毒载体pCDH-FAP为1 μg,辅助载体psPAX2和pMD2.G分别为2 μg和0.5 μg[6]。转染后8 h换液,以含有1%胎牛血清(fetal bovine serum,FBS)的DMEM继续培养72 h,每天换液收集病毒上清,4 ℃,2 500 g离心10 min,再通过0.45 μm滤器过滤掉细胞碎片,4 ℃保存备用。
1.6 病毒上清液感染SCC9细胞及稳定细胞株的筛选
选择生长状态良好的SCC9细胞,收集并计数后按照每孔5×105个细胞接种于6孔板,24 h后取病毒上清液与F12培养基(10%FBS)(比例为1∶1),加2 mL培养基到6孔板。37 ℃,5%CO2孵箱中培养,次日去除1 mL培养基之后添加1 mL病毒上清,连续培养,备用。
扩大培养细胞到107个,然后通过流式细胞荧光分选技术(fluorescence activated cell sorting,FACS)进行筛选。用胰酶将细胞消化,制备细胞悬液,PBS清洗2遍之后,轻柔吹打细胞至单细胞悬液。流式细胞仪筛选得到绿色荧光阳性的细胞,F12培养基(10%FBS,3%双抗),逐渐降低双抗浓度,扩大培养。
1.7 实时荧光定量PCR检测FAP在稳定转染细胞株中的表达
Trizol法提取细胞总RNA,按照试剂盒说明行mRNA逆转录,根据genestar试剂盒说明配制实时荧光定量PCR体系,将混合好的反应液加入96孔板中,封膜、离心并上机,然后进行实时荧光定量PCR检测。
1.8 Western blot检测FAP在稳定转染细胞株中的表达情况
采用RIPA裂解法(1∶100加入混合蛋白酶抑制剂)提取空白对照组和FAP过表达组的细胞总蛋白,BCA法测定蛋白浓度,取等量蛋白进行Western blot检测。
1.9 统计学分析
采用SPSS 20.0统计软件对结果进行分析,组间比较采用student-t检验,P<0.05为组间比较具有显著性差异。
2 结果
2.1 FAP基因片段克隆以及pCDH-FAP的构建和双酶切验证
通过提取细胞总RNA,逆转录和PCR获得的FAP片段,琼脂糖凝胶电泳可见明亮的条带,目的基因长度与预期长度一致(图1)。对固体LB培养皿上的单克隆进行质粒提取和双酶切验证,琼脂糖凝胶电泳得到预期条带(图2)。将阳性重组克隆菌落挑于液体LB培养基中扩大培养,提取质粒后进行测序分析,对比得到完全一致结果。阳性菌扩增并保存。
2.2 慢病毒的包装与病毒感染并筛选稳定过表达FAP的SCC9细胞株
2.2.1 慢病毒包装 利用Hilymax包装病毒的方法转染工具细胞293T,获得过表达FAP的293T细胞(图3)。
2.2.2 病毒上清液感染SCC9细胞 收集上清液感染SCC9细胞,扩大培养,获得绿色荧光阳性SCC9细胞(图4)。
2.2.3 FACS筛选绿色荧光阳性细胞 通过流式细胞仪的分选获得绿色荧光阳性标记的SCC9细胞,接种于24孔板中,F12(10%FBS,3%双抗)继续扩大培养(图5)。
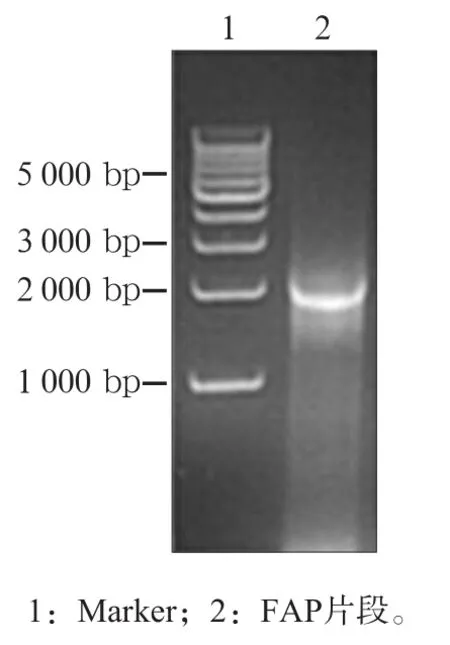
图1 PCR扩增FAP片段Fig 1 The FAP fragment was amplified by PCR
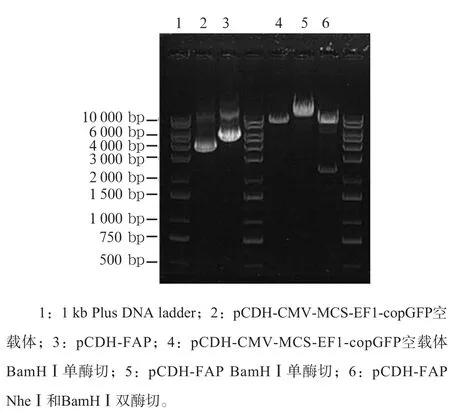
图2 FAP过表达重组病毒载体的鉴定Fig 2 Confirmation of the pCDH-FAP clones by enzyme

图3 包装重组病毒载体到工具细胞Fig 3 Packaging the recombinant viral vector into the tool cells
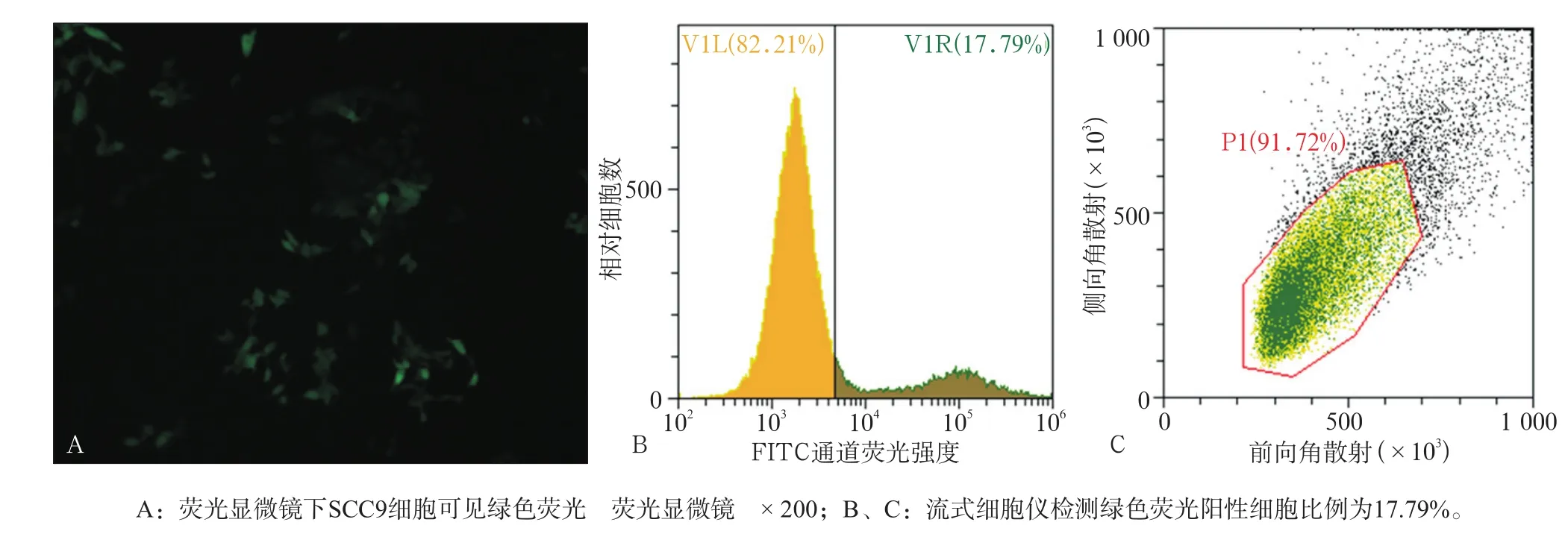
图4 病毒上清感染SCC9细胞的荧光表达Fig 4 Fluorescent expression was detected after infected SCC9 cell line with virus supernatant
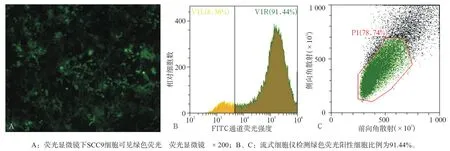
图5 FACS后细胞的荧光表达Fig 5 Fluorescent expression was detected after FACS
2.3 实时荧光定量PCR和Western blot检测FAP在稳定细胞株中的表达
实时荧光定量PCR和Western blot检测SCC9细胞株中FAP的表达情况见图6、7。实时荧光定量PCR和Western blot检测结果显示,与空白对照组相比,稳定过表达FAP的SCC9细胞系中FAP的表达量明显增高,二组间比较差异有统计学意义(P<0.05)。
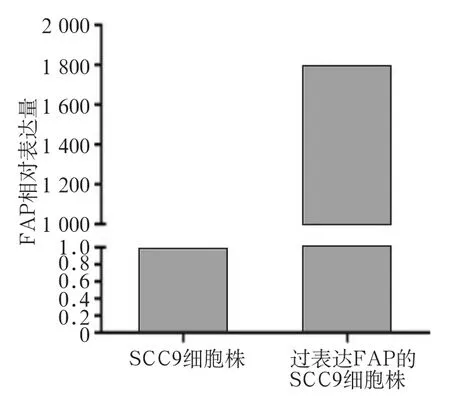
图6 实时荧光定量PCR检测SCC9细胞株中FAP的表达水平Fig 6 The expression of FAP in SCC9 cell line detected by realtime PCR
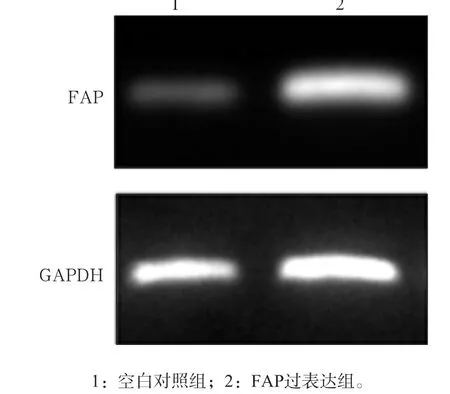
图7 Western blot检测SCC9细胞株中FAP的表达水平Fig 7 The expression of FAP in SCC9 cell line detected by Western blot
3 讨论
FAP是广泛存在于CAF表面的标记蛋白,属丝氨酸蛋白酶家族。FAP在超过90%的乳腺癌、结肠癌、肺腺瘤的肿瘤基质中高表达[7],并且FAP的高表达与多种肿瘤恶性程度呈正相关。Lee等[8]证实,过表达FAP的成纤维细胞能产生一种基质,能增强胰腺癌细胞的侵袭能力,而肿瘤间质高表达FAP的结肠癌患者更容易出现病灶转移及复发的可能性[9],且FAP高表达与非小细胞肺癌患者预后负相关[10]。前期研究[5]证实FAP在OSCC过表达,并与OSCC患者的预后负相关。进一步研究发现,FAP不仅高表达于上皮肿瘤反应性成纤维细胞中,在胰腺癌细胞[8]、乳腺癌细胞[11]、胃癌细胞[12]、宫颈癌细胞[13]、卵巢癌细胞[14]以及OSCC[5]等上皮来源的恶性肿瘤细胞中同样高表达。研究[5]证实,抑制FAP表达可通过磷脂酰肌醇3激酶/丝氨酸激酶信号通路抑制OSCC的生长、侵袭和转移。这些研究提示FAP可能是OSCC预后判断的重要指标以及OSCC治疗的靶点。进一步研究FAP在OSCC发生发展过程的作用机制,将为OSCC的发病机制提供新的思路,为靶向FAP治疗OSCC提供理论依据。
既往关于FAP的研究较难模拟FAP在真核细胞中的真正代谢;同样瞬时转染过表达FAP,在细胞中作用时间过短,无法更好地研究FAP的互作蛋白。因此,本实验选择病毒表达载体pCDH-CMVMCS-EF1-copGFP,利用病毒更易整合到基因组上的特质,进行FAP过表达的SCC9稳定株的构建。其中,SCC9细胞株为舌鳞状细胞癌细胞株,是适合转染的OSCC宿主细胞;而pCDH-CMV-MCS-EF1-copGFP是以CMV为启动子的慢病毒表达载体,可在真核细胞中进行高拷贝和过表达,并且copGFP作为改造过的绿色荧光蛋白,亮度是增强绿色荧光蛋白亮度的1.3倍以上,有利于更好观察其荧光。同时,在重组质粒中设计了His-6标签,有利于下一步进行免疫共沉淀等实验,以探寻FAP互作蛋白。
综上所述,本研究成功构建了野生型pCDHFAP,并获得稳定过表达FAP的SCC9细胞株,有助于获得纯化FAP蛋白,为进一步研究FAP在OSCC发生发展过程中的分子机制奠定基础。
[1] Rivera C, Venegas B. Histological and molecular aspects of oral squamous cell carcinoma (Review)[J]. Oncol Lett,2014, 8(1):7-11.
[2] Scott SE, Grunfeld EA, Main J, et al. Patient delay in oral cancer: a qualitative study of patients’ experiences[J]. Psychooncology, 2006, 15(6):474-485.
[3] Rettig WJ, Garin-Chesa P, Beresford HR, et al. Cell-surface glycoproteins of human sarcomas: differential expression in normal and malignant tissues and cultured cells[J]. Proc Natl Acad Sci U S A, 1988, 85(9):3110-3114.
[4] 吕晓智, 冯元勇, 张萍, 等. 口腔鳞癌与正常黏膜中FAPA基因mRNA的表达[J]. 中国口腔颌面外科杂志, 2008, 6(4):270-273.
Lü XZ, Feng YY, Zhang P, et al. Expression FAPA gene in oral squamous cell carcinoma and paired normal tissue[J]. Chin J Oral Maxillofac Surg, 2008, 6(4):270-273.
[5] Wang H, Wu Q, Liu Z, et al. Downregulation of FAP suppresses cell proliferation and metastasis through PTEN/PI3K/AKT and Ras-ERK signaling in oral squamous cell carcinoma[J]. Cell Death Dis, 2014, 5:e1155.
[6] Ye Z, Yu X, Cheng L. Lentiviral gene transduction of mouse and human stem cells[J]. Methods Mol Biol, 2008, 430:243-253.
[7] Rettig WJ, Chesa PG, Beresford HR, et al. Differential expression of cell surface antigens and glial fibrillary acidic protein in human astrocytoma subsets[J]. Cancer Res, 1986,46(12 Pt 1):6406-6412.
[8] Lee HO, Mullins SR, Franco-Barraza J, et al. FAP-overexpressing fibroblasts produce an extracellular matrix that enhances invasive velocity and directionality of pancreatic cancer cells[J]. BMC Cancer, 2011, 11:245.
[9] Henry LR, Lee HO, Lee JS, et al. Clinical implications of fibroblast activation protein in patients with colon cancer[J].Clin Cancer Res, 2007, 13(6):1736-1741.
[10] Liao Y, Ni Y, He R, et al. Clinical implications of fibroblast activation protein-alpha in non-small cell lung cancer after curative resection: a new predictor for prognosis[J]. J Cancer Res Clin Oncol, 2013, 139(9):1523-1528.
[11] Kelly T, Kechelava S, Rozypal TL, et al. Seprase, a membrane-bound protease, is overexpressed by invasive ductal carcinoma cells of human breast cancers[J]. Mod Pathol,1998, 11(9):855-863.
[12] Mori Y, Kono K, Matsumoto Y, et al. The expression of a type Ⅱ transmembrane serine protease (Seprase) in human gastric carcinoma[J]. Oncology, 2004, 67(5/6): 411-419.
[13] Jin X, Iwasa S, Okada K, et al. Expression patterns of seprase,a membrane serine protease, in cervical carcinoma and cervical intraepithelial neoplasm[J]. Anticancer Res, 2003, 23(4):3195-3198.
[14] Yang L, Ma L, Lai D. Over-expression of fibroblast activation protein alpha increases tumor growth in xenografts of ovarian cancer cells[J]. Acta Biochim Biophys Sin, 2013,45(11):928-937.
(本文编辑 杜冰)
Construction of a eukaryotic expression vector of fibroblast activation protein and establishment of its stable over- expression in the oral squamous cell carcino
Zhao Meng, Shao Tingru, Huang Jiaxin, Chen Yuechuan, Lü Xiaozhi.
(Dept. of Head and Neck Oncology, Nanfang Hospital, Southern Medical University; College of Stomatology, Southern Medical University, Guangzhou 510515, China)
Supported by: National Natural Science Foundation of China (81472536); Science and Technology Planning Project of Guangdong Province (2014A020212440). Correspondence: Lü Xiaozhi, E-mail: lxzsurgeon@126.com.
Objective This study aimed at constructing fibroblast activation protein (FAP) over-expression lentivinus vectors to investigate transfection in SCC9 cell lines and establish a stable FAP over-expression oral squamous cell line.Methods The cDNA of FAP gene from an oral squamous cell carcinoma (OSCC) tissue was amplified by polymerase chain reaction (PCR) and subcloned into eukaryotic expression vector pCDH-CMV-MCS-EF1-copGFP. The recombinant plasmid was sequenced and then transfected into an SCC9 cell line. Subsequently, the SCC9 cell line that over-expressed FAP stably was established by fluorescence activated cell sorting (FACS). The expression of green fluorescent protein (GFP) was detected with fluorescence microscopy, and the over-expression of FAP was identified by real-time PCR and Western blot. Results The FAP gene was amplified by PCR and then cloned into the vector, whose sequence was identical to that in the GenBank.GFP was expressed in the transfected cells. Furthermore, FAP over-expression in the transfected cells was detected by realtime PCR and Western blot. Conclusion The recombinant eukaryotic expression vector pCDH-FAP was constructed successfully. This result provides a foundation for further studies on the function of FAP in vitro.
fibroblast activation protein; lentivinus vectors; over-expression; oral squamous cell carcinoma
Q 78
A
10.7518/hxkq.2017.05.004
2017-04-23;
2017-07-12
国家自然科学基金(81472536);广东省科技计划项目(2014A020212440)
赵萌,硕士,E-mail:zhuanzhuanquanen@sina.com
吕晓智,主任医师,博士,E-mail:lxzsurgeon@126.com

