具有抗农作物病原真菌活性链霉菌Iβ1菌株的筛选鉴定及其聚酮合酶基因分析
李晓华,马婷婷,郭 佳,黄 粤,梅 枫,皮 婷
(中南民族大学 生命科学学院 生物技术国家民委重点实验室,武汉 430074)
具有抗农作物病原真菌活性链霉菌Iβ1菌株的筛选鉴定及其聚酮合酶基因分析
李晓华,马婷婷,郭 佳,黄 粤,梅 枫,皮 婷
(中南民族大学 生命科学学院 生物技术国家民委重点实验室,武汉 430074)
从土壤中筛选出一株具有抗农作物病原真菌活性链霉菌,命名为Iβ1.根据生理生化特性对其进行了鉴定及16S rRNA基因序列同源性比对,分析了该菌株的发酵滤液抑菌稳定性和聚酮合酶基因.结果表明: 该菌株初步鉴定为链霉菌属,Iβ1菌株发酵滤液在温度为-20~55℃,紫外线照射10~30 min,pH为1.0~9.0条件下均较稳定,聚酮合酶基因在其系统分类上与StreptomycesnourseiATCC 11455制霉菌素生物合成基因簇的聚酮合酶基因分枝较近.
链霉菌;抗真菌活性;发酵液;聚酮合酶基因
AbstractA bacterial strain (named as Iβ1) resistant to crop pathogenic fungi was screened from field soil. The strain was identified according to physiological and biochemical characteristics and its sequence homology with 16S rRNA gene. The antifungal stability of the fermentation broth and ketoacyl synthase gene of strain Iβ1 were also analyzed. The results showed that strain Iβ1 was classified asStrepomyces. It was stable in the temperature range from -20 to 55℃, under UV light for 10-30 min and pH 1.0-9.0. The ketoacyl synthase gene of Iβ1 strain was close to the ketoacyl synthase gene of S. noursei ATCC 11455 Nystatin biosynthesis gene cluster in phylogenetic classification.
KeywordsStreptomyces;antifungal activity;fermentation broth;ketoacyl synthase gene
放线菌是自然界中广泛存在的一种微生物[1,2].以放线菌代谢产物开发研究的抗生素,广泛应用于医疗、农业领域,如医疗领域的红霉素、氯霉素、四环素和克拉维酸等[3,4],农业领域的井冈霉素、阿福菌素、农用链霉素和多效霉素等[5,6],解决了因病原真菌引起农作物减产的部分问题.
非核糖体多肽合成酶(NRPS)和多聚酮合酶(PKS)基因是产生活性次级代谢产物的功能基因[7],I型PKS由几个携带有活性结构域的多肽组成,其中酮基合成酶(KS)结构域基因高度保守. KS基因分析研究不仅可预知代谢产物类型,还是一种发现新药的便捷、低成本手段,对其进行基因工程改造可产生新的代谢产物.本研究从神农架地区土壤中筛选出了1株具有抗农作物病原真菌活性的链霉菌,研究了菌株发酵滤液稳定性,并对其KS基因克隆和分析,拟为生物防治和基因簇的异源表达奠定基础.
1 材料和方法
1.1材料和仪器
从湖北省神农架地区取土壤样品,装入无菌袋中,分类标记带回实验室,对微生物进行分离. 棉花黄萎病菌(Verticilliumdahliaekleb)、禾谷镰刀病菌(Fusariumaminearum) 、腐霉病菌(Botrytiscinerea)、稻瘟病菌168菌株(Magnaporthegrisea168 strain)和立枯丝核病菌(Rhizoctoniasolani) 5株农作物病原真菌指示菌,均由中南民族大学生命科学学院分子微生物实验室保存.
实验采用PDA 培养基、高氏 I 号培养基和菌丝体发酵培养基[8]. 16S rRNA基因 和KS基因引物(北京三博远志),PCR反应试剂、克隆载体pMD19-Tvector(大连 TaKaRa),其余试剂均为国产分析纯试剂.凝胶成像仪(TFL-40,Synoptics公司),PCR仪(PTC-200,Bio-Rad公司).
1.2抗农作物病原真菌放线菌的筛选
称取10 g土样置于含90 mL无菌水的三角瓶中,于30℃,180 r/min下振荡2 h,混匀后制成10-1,10-2,10-3,10-4,10-5的土壤悬浮液,分别涂布在含有不同浓度重铬酸钾的高氏I号培养基上,在30℃的生化培养箱中倒置培养4 d,经过多次挑单菌纯化后,收集孢子至20%甘油中,-20℃保存.
采用杯碟法[8,9],以棉花黄萎病菌、禾谷镰刀病菌、腐霉病菌、稻瘟病菌168菌株和立枯丝核病菌等5株农作物病原真菌为指示菌,对分离到的放线菌进行抗菌活性筛选,用十字交叉法测定抑菌圈直径.
1.3菌种鉴定
对筛选到的菌种进行形态结构观察和生理生化鉴定[10,11],提取菌株总DNA[12],采用通用引物F1(5′-AGAGTTTGATCCTGGCTCAG-3′)和F2(5′-AAGGAGGTGATCCAGCC-3′)进行扩增.PCR反应体系:10×PCR缓冲液1.5 μL,模板DNA 1.0 μL,dNTP 1.0 μL,一对引物各1.0 μL,Taq酶0.5 μL,用超纯水定容至15.0 μL.扩增条件:94℃预变性5 min,94℃变性1 min,55℃退火1 min,72℃延伸1.5 min,循环30次,最后72℃延伸10 min.测序结果通过Blast在GenBank基因库中与相关菌株的16S rRNA基因序列进行同源性比对分析.利用MEGA 6.0对Iβ1菌株的16S rRNA基因序列比对构建系统发育树(采取N-J法,bootstrap value为1000).
1.4 Iβ1菌株发酵滤液稳定性检测
[8]制备链霉菌Iβ1菌株发酵液,0.22 μm滤膜过滤备用.以稻瘟病菌168菌株为指示菌,取100 μL发酵滤液,采用杯碟法[8]测定发酵液的抑菌活性.
将Iβ1菌株发酵滤液分别在-20, 4, 37, 55℃的温度下处理2 h,测其抑菌活性.将Iβ1菌株发酵滤液在紫外线下分别处理10,20,30 min,测其抑菌活性.用酸度计将Iβ1菌株发酵滤液的起始pH值分别调至1.0,3.0,5.0,7.0,9.0,11.0,13.0,室温放置12 h后,调至原始pH值,测其抑菌活性.
1.5 Iβ1菌株KS基因扩增和序列分析
以总DNA为模版,采用引物KSF/KSR[15],对KS基因进行扩增,PCR扩增条件: 95℃预变性5 min,95℃变性45 s,60℃退火1 min,72℃延伸2 min,循环35次,最后72℃延伸7 min.测序结果通过Blast在GenBank基因库中比对分析.利用MEGA 6.0对KS基因序列比对构建系统进化树(采取N-J法,bootstrap value为1000).
2 结果和分析
2.1抗农作物病原真菌Iβ1菌株的筛选
以禾谷镰刀病菌、腐霉病菌、稻瘟病菌168菌株、立枯丝核病菌和棉花黄萎病菌5株农作物病原真菌为指示菌,筛选出一株具有抗农作物病原真菌活性的Iβ1菌株.菌株对5种农作物病原真菌有不同程度的抑菌活性(见表1),其中对禾谷镰刀病菌、腐霉病菌、稻瘟病菌168菌株、立枯丝核病菌的抑菌圈直径大于14 mm,表明Iβ1菌株对禾谷镰刀病菌、腐霉病菌、稻瘟病菌168菌株、立枯丝核病菌具有较强的抑菌活性.
表 1 Iβ1菌株对5株农作物病原真菌的抑菌效果
Tab.1 Inhibition effect of Iβ1 strain against five plant pathogenic fungal strains

农作物病原真菌抑菌直径d/mm稻瘟病菌168菌株40.0立枯丝核病菌32.0棉花黄萎病菌12.0腐霉病菌14.0禾谷镰刀病菌14.0
2.2抗农作物病原真菌Iβ1菌株鉴定
在高氏I号培养基上培养Iβ1菌株,观察其菌落形态特征,光镜显示气生菌丝发达,丰富的孢子链呈圆球形,基内菌丝粗壮、多分枝.如表2所示,在供试的7种培养基上,Iβ1菌株的气生菌丝均较浅,除在甘油天门冬素培养基上是浅灰色,其他都是白色;而基内菌丝和产生的可溶性色素颜色较深.
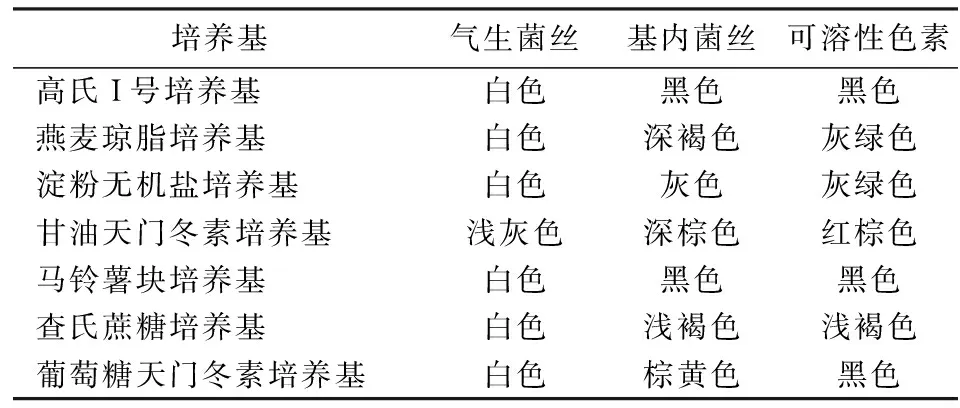
表2 Iβ1菌株的培养特征Tab.2 Cultural characteristics of Iβ1 strain
Iβ1菌株的生理生化特性如表3所示,Iβ1菌株产生H2S,伏-普实验、甲基红实验和吲哚实验为阴性,不能使纤维素分解,可使明胶液化,产生淀粉酶,可利用葡萄糖、乳糖和甘露醇.

表3 Iβ1菌株的生理生化特性
将菌株Iβ1的16S rRNA基因序列进行扩增,长度为1066 bp,通过Blast与GenBank 中相关菌株的基因序列进行比对,发现菌株Iβ1与链霉菌属(Streptomyces)的同源性达到99%.进一步采用MEGA6.0 中的 Neighbor-Joining 法构建系统发育树,Bootstrap值为1000,如图1所示,Iβ1菌株的16S rRNA基因序列与S.noboritoensisCSSP695的16S rRNA基因序列相似性较高.结合形态特征和生理生化特性,初步鉴定Iβ1菌株属于链霉菌属.

图1 Iβ1菌株16S rRNA基因的系统发育树Fig.1 Phylogenetic tree of Iβ1 strain 16S rRNA gene
2.3 Iβ1菌株发酵滤液的稳定性
Iβ1菌株发酵滤液经不同温度处理2 h后,抑菌活性无显著变化(见图2),对稻瘟病菌168菌株的抑菌直径均大于36 mm,说明Iβ1菌株发酵滤液在-20,4,37,55℃温度下有良好的稳定性,仍能保持较高的抑菌活性,可在此温度下短暂保存.
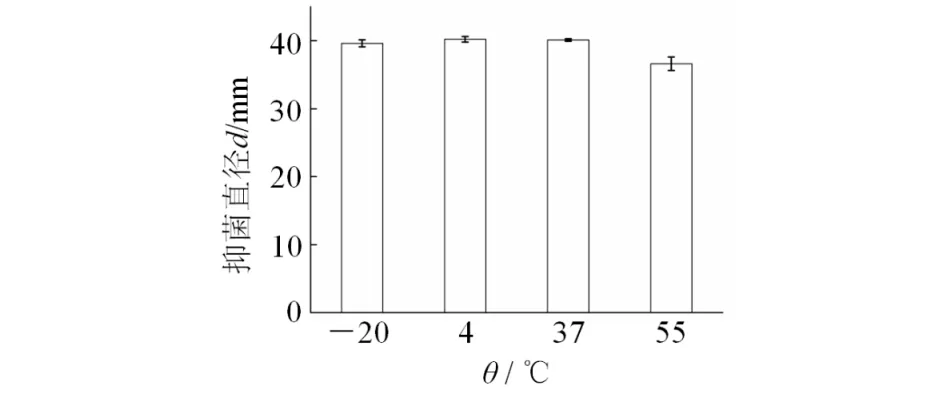
图2 温度对Iβ1菌株发酵滤液抑菌稳定性的影响Fig.2 Effect of temperature on the antifungal stability of fermentation broth in Iβ1strain
Iβ1菌株发酵滤液经紫外线照射10, 20 min后,抑菌活性无显著变化;照射30 min后,抑菌活性较对照组降低了12.3%,但发酵滤液对稻瘟病菌168菌株的抑菌直径仍在36 mm以上(见图3),说明Iβ1菌株发酵滤液在紫外线下能保持较强的抑菌活性,对紫外线不敏感,稳定性好.
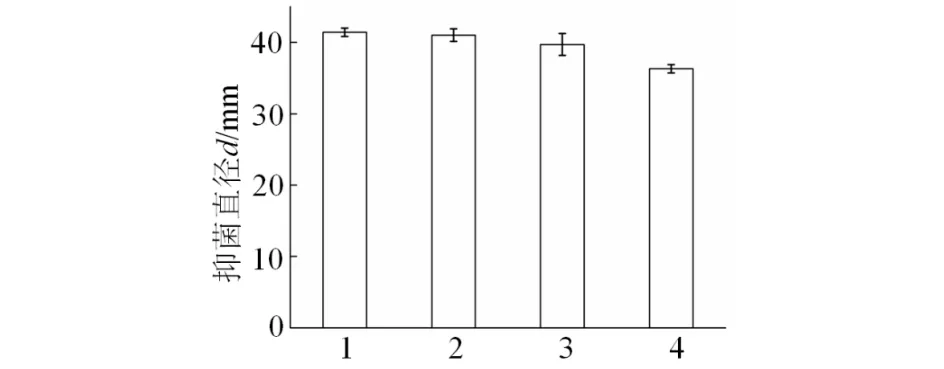
1) 对照组CK; 2~4) 紫外线照射10, 20, 30 min图3 紫外线照射对Iβ1菌株发酵滤液抑菌稳定性的影响Fig.3 Effect of UV irradiation on the antifungal stability of fermentation broth in Iβ1strain
Iβ1菌株发酵滤液经不同pH处理后,抑菌活性有变化(见图4),pH为1~7时,抑菌圈直径随pH值增加而增加;pH为7时,抑菌圈直径最大,稳定性最好;pH为7~11时,抑菌圈直径随pH值增加而减小;pH为11或13时,Iβ1菌株发酵滤液无抑菌活性.说明发酵滤液在酸性和中性条件下有一定稳定性,在强碱下会失去抑菌活性.
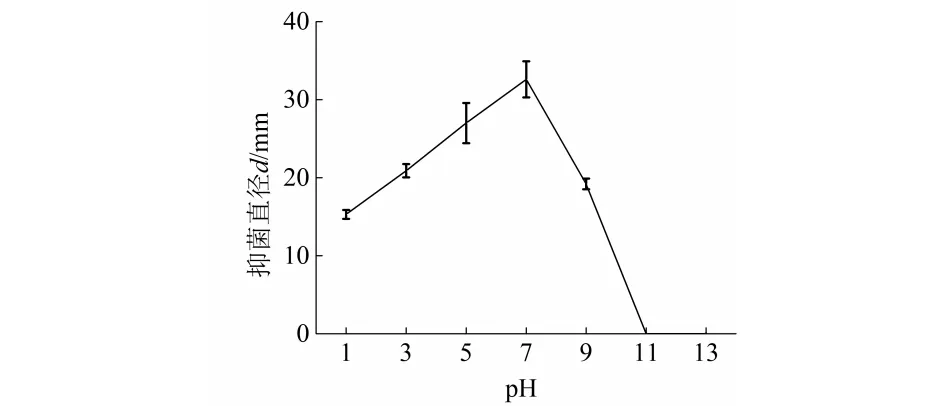
图4 pH对Iβ1菌株发酵滤液抑菌稳定性的影响Fig.4 Effect of pH on the antifungal stability of fermentation broth in Iβ1strain
2.4 Iβ1菌株中KS基因的扩增与分析
聚酮类化合物是微生物的次级代谢产物,是抗生素的重要来源.合成聚酮类化合物的基因成簇排列,其中PKS基因簇中KS基因编码区的同源性很高.扩增得到的Iβ1菌株的KS基因序列长度为727 bp,通过Blast对KS基因与NCBI 上的相关序列进行比对,采用MEGA6.0 中的 Neighbor-Joining 法对序列比对结果构建系统进化树(Bootstrap值为1000).如图5所示,Iβ1菌株的KS基因与S.nourseiATCC 11455制霉菌素生物合成基因簇(AF263912.1)的聚酮合酶基因nysA分枝较近,相似性为77%.
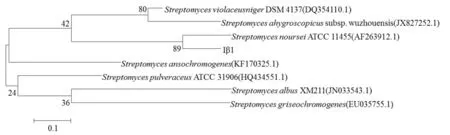
图5 Iβ1菌株KS基因的系统进化树Fig.5 Phylogenetic tree of Iβ1 strain KS gene
3 讨论
据统计,每年植物因病害造成的减产量为总产量的10%~15%,病原真菌是农作物减产的主要原因.近年来,以放线菌次级代谢产物开发的农用抗生素来防治农作物病害已较为普遍,目前国际上的生物农药已超过100多种,多数来自链霉菌.
本研究从土壤中筛选得到1株具有抗农作物病原真菌活性Iβ1菌株.通过形态、生理生化特征以及16S rRNA基因序列同源性比对分析,初步鉴定该菌株为链霉菌属.发酵滤液稳定性测定发现Iβ1菌株有较强的热稳定性和紫外线稳定性,在酸性和中性条件下稳定,强碱条件下易失活.PCR扩增获得727 bp 的KS基因与StreptomycesnourseiATCC 11455制霉菌素生物合成基因簇的聚酮合酶基因nysA同源性最高,可为农作物的生物防治和遗传工程操作奠定基础.
参考文献
[1] Salcedo R G, Olano C, Gome C, et al. Characterization and engineering of the biosynthesis gene cluster for antitumor macrolides PM100117 and PM100118 from a marine actinobacteria: generation of a novel improved derivative[J]. Microb Cell Fact, 2015, 15(1): 1-19.
[2] 赵淑莉, 任飞娥, 刘金亮, 等. 玉米大斑病生防放线菌的筛选鉴定及发酵条件优化[J]. 微生物学报, 2012, 52(10) : 1228-1236.
[3] Goomeshi Nobary S, Jensen S E. A comparison of the clavam biosynthetic gene clusters inStreptomycesantibioticus Tü1718 andStreptomycesclavuligerus[J]. Can J Microbiol, 2012, 58(4): 413-425.
[4] Salcedo D E, Kim S. Fate of tetracycline resistance in synthetic livestock carcass leachate for two years[J]. J Environ Manage, 2016, 187: 220-228.
[5] Li W, Feng J, Liu Y,et al. Novel spectrophotometric approach for determination of validamycin A in fermentation ofStreptomyceshygroscopicus[J]. J Biosci Bioeng, 2016, 122(6): 736-739.
[6] 李明海, 杨迎青, 杨 媚, 等. 井冈霉素对水稻纹枯病菌细胞壁降解酶活性和可溶性蛋白的影响[J]. 华中农业大学学报, 2010, 29(3): 272-276.
[7] Hopwood D A. Genetic contributions to understanding polyketide synthases[J]. Chem Rev, 1997, 97(7): 2465-2497.
[8] 郭 佳, 吴金龙, 唐颜苹, 等. 抗农作物病原真菌微生物的筛选及其聚酮合酶基因的分析[J]. 华中师范大学学报(自然科学版), 2014, 48(3): 399-403.
[9] 李晓华, 吴金龙, 郭 佳, 等. 具有抗农作物病原真菌活性的链霉菌IIR21菌株中attB位点的分析[J]. 中南民族大学学报(自然科学版), 2016, 35(2): 19-22.
[10] Boudjella H, Bouti K, Zitouni A, et al. Taxonomy and chemical characterization of antibiotics ofStreptosporangiumSg 10 isolated from a Saharan soil[J]. Microbiol Res, 2006, 161(4): 288-298.
[11] Shirling E B, Gottlieb D. Methods for characterization ofStreptomyces[J]. Int J Syst Bacteriol, 1966, 16(3): 313-340.
[12] Kieser T, Bibb M J, Chater K F, et al. PracticalStreptomycesgenetics: a laboratory manual[M]. Norwich: John Innes Foundation, 2000.
[13] Ostash B E, Ogonian S V, Luzhetski A N, et al. The use of PCR for detecting genes that encode type I polyketide synthases in genomes of actinomycetes[J]. Genetika, 2005, 41(5): 595-600.
ScreeningandIdentificationofStreptomycessp.Iβ1StrainResistanttoCropPathogenicFungiandAnalysisofPolyketoneSynthaseGene
LiXiaohua,MaTingting,GuoJia,HuangYue,MeiFeng,PiTing
(Key Lab for Biotechnology of the State Ethnic Affairs Commission, College of Life Science, South-Central University for Nationalities, Wuhan 430074, China)
Q939
A
1672-4321(2017)03-0022-05
2016-12-12
李晓华(1968-),男,教授,博士,研究方向:微生物学,E-mail:lixiaohua@mail.scuec.edu.cn
国家自然科学基金资助项目(31070087,30570046);湖北省自然科学基金重点资助项目(2011CDA079,2008CDB076);中央高校科研基本业务费专项资助项目(CZW16005,YCZW15104)

