利用ISSR分子标记的指纹图谱对内蒙古6个苜蓿品种的鉴定初报
刘胜男,石凤翎,闫 伟,张雨桐,张 玥
(内蒙古农业大学草原与资源环境学院,内蒙古 呼和浩特 010019)
利用ISSR分子标记的指纹图谱对内蒙古6个苜蓿品种的鉴定初报
刘胜男,石凤翎,闫 伟,张雨桐,张 玥
(内蒙古农业大学草原与资源环境学院,内蒙古 呼和浩特 010019)
以内蒙古农业大学培育注册的6个苜蓿品种(草原1号、草原2号、草原3号、草原4号、准格尔苜蓿和敖汉苜蓿)为试验材料,利用ISSR分子标记技术筛选出适宜的10条引物,建立各品种的指纹图谱,根据同一引物的图谱差异将各品种加以鉴定区分。结果表明,利用10条引物中的4条引物的图谱绘制了2套苜蓿品种的鉴定图,根据各品种在图谱中不同位置特异条带的有无,可将全部6个苜蓿品种准确区别开。
苜蓿;指纹图谱;品种鉴定;ISSR分子标记
Abstract:Use Inner Mongolia Agricultural University fostered and registered six Alfalfa varieties (M.varia Martin.cv.Caoyuan No.1,M.varia Martin.cv.Caoyuan No.2,M.varia Martin.cv.Caoyuan No.3,M.sativa L.cv.Caoyuan No.4,M.sativa L.cv.Zhungeer,M.sativa L.cv.Aohan) as the experimental material, using ISSR molecular marker technology to choose suited 10 primers, to establish the fingerprint of each variety , according to differences in fingerprint of the same primer to distinguish each variety. The results show that, use 4 primers in suited 10 primers can draw 2 sets of alfalfa varieties identification figure, according to with or without specific bands at different location in the fingerprint of each variety , all six alfalfa varieties can be distinguish.
Keywords:Alfalfa;Fingerprint;Identification of Varieties;ISSR Molecular Marker
1 引言
至2015年,我国注册登记苜蓿品种80个〔1〕,但由于我国市场上苜蓿品种混乱、真假难辨、真正的优良苜蓿品种得不到有效的保护。许多生产者往往不能辨别出各品种之间的差异,造成播种后损失惨重〔2〕。因此快速准确地检测出送检样品与标签所示品种是否名实相符,品种是否一致,有无相互掺杂是解决当前生产问题中非常重要的一项技术。
传统的苜蓿品种鉴定方法主要是形态鉴定法,但各苜蓿品种间在形态特征上相似,同时该方法需结合常规种植鉴定,在一个生长季节内完成。鉴定过程所需时间较长。随着生化技术的发展,可以从蛋白水平上对具有不同遗传特性的种子予以鉴别,例如同工酶电泳技术、蛋白质电泳技术,该方法发展快、应用面广、准确性较高,弥补了常规形态鉴定法的不足,并且在苜蓿品种纯度鉴定中得到了应用。国内外学者利用种子贮存蛋白和同工酶电泳技术分别对苜蓿品种间差异进行了研究〔3-5〕,证明了不同苜蓿品种间谱带差异明显,说明该技术用于鉴定苜蓿品种是有效可行的。目前,已有30多种同工酶用在作物品种鉴定中,最常用的是酯酶同工酶和过氧化物同工酶,但其也存在一些不足。贮藏蛋白鉴定法(PAGE方法)和同工酶谱带鉴定法,均存在检测过程长、技术较复杂、成本较高,对某些遗传背景相似的品种鉴别也较难,且由于蛋白质、同工酶是基因控制产生的,多态性较少,在相似品种的鉴定上具有一定的局限性。
ISSR分子标记技术是近年来快速发展起来的一种DNA分子遗传标记技术,DNA分子标记技术即是通过对品种DNA的多态性即DNA碱基序列的差异进行分析,从而鉴别不同品种。其检测对象是品种的DNA片段(基因),没有器官的特异性,不受环境的影响,有较高的准确性和重复性〔6〕。ISSR为随机引物,引物长度在20bp左右,采用与常规的PCR相同的条件,其稳定性比RAPD好,ISSR标记为显性标记,可以揭示整个基因组的一些特征,符合孟德尔遗传规律,具有稳定性好,多态性高,试验操作简单、快速、用时少等优点。因此,本试验采用ISSR分子标记技术对6个苜蓿品种进行初步鉴定,为苜蓿品种真实性鉴定提供依据。
2 材料与方法
2.1供试材料
6个苜蓿品种材料及其来源详见表1。

表1 试验材料及来源
2.2 DNA提取
室内盆栽育苗,当长至10片真叶时,随机抽取30个单株,每株分别取4片幼叶混合提取DNA,使用植物基因组DNA试剂盒提取DNA〔7〕。检测DNA浓度,稀释到10~20ng/μl,分装于20℃冰箱中保存。
2.3 ISSR引物筛选、PCR反应体系的建立及扩增产物的检测
利用上海生物工程技术公司提供的30条ISSR引物,从中筛选出10条条带清晰、多态性丰富的引物,对6个苜蓿品种进行扩增。ISSR-PCR反应体系参照前人的试验结果〔8〕:20μl总反应体系中含有模板DNA1μl、引物1μl、2×Taq PCR Master Mix 10μl、ddH2O 8μl。PCR扩增条件为94℃预变性3min,94℃变性30s,53~60℃退火45s,72℃延伸1.5min,循环35次,之后72℃延伸10min,4℃保存。扩增产物用1%琼脂糖凝胶在1×TBE电泳缓冲液中电泳,电压为100V,用2 000bpDNA Marker做标准分子量对照,电泳时间为1h,在紫外凝胶仪下成像。
2.4条带统计分析及苜蓿品种鉴定图的绘制
根据不同引物的扩增结果,建立不同苜蓿品种的ISSR标记的DNA指纹图谱,观测其特征性谱带的有无,然后分类鉴别。参照孙欣等人的研究方法〔9〕绘制苜蓿品种鉴定图(CID)。
3 结果与分析
3.1多态性引物和退火温度筛选
从30条引物中筛选出可扩增出条带的10条引物,其长度为15~18 bp;每条引物的最佳退火温度略有差异(52.2℃~60.2℃)。其中引物813的最佳退火温度较低,而引物866的最佳退火温度较高(表2)。

表2 引物序列和最佳退火温度
3.2各引物的扩增结果与品种指纹图谱
10条引物对6个苜蓿品种的PCR扩增结果显示,均能扩增出条带清晰、多态性好的谱带。同一引物在不同品种间扩增的谱带位置、数目或明亮度均有一定的差异(图1)。
3.3品种鉴定图
依据10条引物的扩增结果及6个品种的指纹图谱,绘制出2套(图2和图3)6个苜蓿品种的鉴定图(CID)。
由图2可知,在引物846的图谱中,在1550bp和1300bp处,为4号品种的特异性条带;在1000bp处,为5号品种的缺失条带,因此,首先将4号品种和5号品种鉴别出来;在1500bp处为2号品种和3号品种的特异性条带,因此将2号、3号与1号、6号区别开。进一步筛选引物855图谱,在1300bp处,为3号品种特异性条带;在270bp处为2号品种的特异性条带,因此将2号品种和3号品种区别开。利用引物848的图谱在2000bp处1号品种有特异性条带,将1号和6号品种鉴别开。
由图3可看出,利用引物881可将6个苜蓿品种中的4个区分开,在2000bp处,为3号品种的特异性条带,可把3号鉴定出来;在1700bp处,为2号、4号、6号品种的特异性条带,由此可将1号、5号与2号、4号、6号区别开;1号材料在1000bp处,为5号品种的特异性条带;在1600bp处,为1号品种的特异性条带,因此将1号与5号区分开;1000bp处为4号的特异性条带,可把4号材料从中区分出来;筛选引物848,在450bp处,为2号品种的特异性条带,可把2号与6号区分开。利用这种方法为构建材料的指纹图谱奠定了基础。
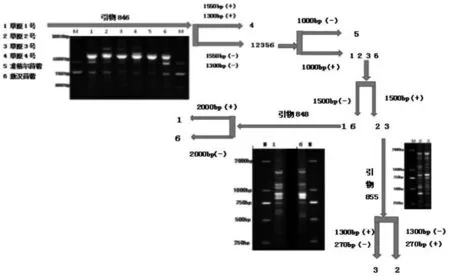
图2 利用引物846、855、848鉴别6个苜蓿品种的CID示意图

图3 利用引物881和848鉴别6个苜蓿品种的CID示意图
4 讨论
由于ISSR分子标记技术结合了SSR和RAPD的优点,具有多态性丰富、稳定性高,重复性好的特点,现已广泛应用于植物品种纯度鉴定、基因定位、遗传作图、进化和系统发育等各方面的研究中。在苜蓿品种鉴定的研究分析中,魏瑧武就曾经利用SSR、ISSR和RAPD分子标记技术构建55个国内外苜蓿品种的DNA指纹图谱,并且表明:苜蓿品种ISSR指纹图谱多态性丰富,稳定性比RAPD强;可以通过2~3个引物鉴别我国主要苜蓿品种和引进品种,SSR和ISSR指纹图谱可以更好地用于苜蓿品种鉴定和遗传多样性分析〔10〕。本试验也证实可利用2~3条引物将内蒙古培育的6个苜蓿品种鉴别开,其方法简单快速。
在利用ISSR标记技术进行品种鉴定时,引物的筛选、合适的PCR参数、品种间特异性条带的有无等都会影响该技术的应用及品种鉴定结果的准确性。
苜蓿为异花授粉牧草,同一品种的个体间也有一定的差异,如何鉴定品种纯度,即当某一品种内混有其他品种的种子时如何将其鉴别出来,还需从单株图谱分析上进一步探讨适宜的鉴定方法。建议在新品种登记注册后应及时建立原种的分子指纹图谱,以作为生产应用中出现混杂或以假乱真等现象的甄别依据。
〔1〕杨青川,康俊梅,张铁军,刘凤歧,龙瑞才,孙彦.苜蓿种质资源的分布、育种与利用〔J〕.科学通报,2016,(02):261-270.
〔2〕毛培胜,王颖.指纹图谱技术在紫花苜蓿品种鉴定中的发展与应用〔J〕.草业科学,2005,(02):26-29.
〔3〕Joan E. Krochko,J.Derek BewleySeed storage proteins in cultivars and subspeciesof alfalfa( Medicago sativa L.)〔J〕.Seed Science Research,2000,104:.
〔4〕朱大鸣,王仁忠,葛滢.同功酶电泳技术在牧草鉴定上的初步探讨〔J〕.中国草业科学,1988,(05):35-38.
〔5〕张明先,郝润鲜.苜蓿品种生态型及其演变的同功酶电泳数据分析〔J〕.中国草地,1993,03:49-55.
〔6〕韦晓霞,熊月明,宋瑞琳.果树品种鉴定方法概述〔J〕.福建果树,2002,04:11-13.
〔7〕王瑜,袁庆华.紫花苜蓿ISSR-PCR反应体系的建立与优化〔J〕.草地学报,2007,03:212-215.
〔8〕石凤玲,石凤翎,高翠萍,薛晓兰,刘旭艳.人工老化紫花苜蓿种子活力变化与ISSR标记〔J〕.中国草地学报,2015,06:30-34.
〔9〕孙欣,王梦琦,张超博,崔力文,房经贵.MCID-DNA分子标记应用于植物品种鉴定的助推器〔J〕.第二届农作物种业科技创新与产业发展论坛暨新《种子法》专题培训会
〔10〕魏臻武.利用SSR、ISSR和RAPD技术构建苜蓿基因组DNA指纹图谱〔J〕.草业学报,2004,03:62-67.
APreliminaryStudyonSixInnerMongoliaAlfalfaVarietiesIdentificationUsingISSRMarkersFingerprint
LiuShengnan,ShiFengling,YanWei,ZhangYutong,ZhangYue
(CollegeofGrassland,ResourceandEnvironmental,InnerMongoliaAgriculturalUniversity;Hohhot010019,China)
S54
A
2095—5952(2017)03—0046—05
2017-07-21
内蒙古自治区应用技术研究与开发资金计划“内蒙古草品种认证与鉴定及溯源管理研究与示范”、“优质生态牧草新品种选育与良种繁育关键技术研究”、内蒙古自治区草原英才“内蒙古高原乡土草种质资源遗传改良与利用”创新团队。
刘胜男(1992- ),女,内蒙古包头人,硕士研究生,主要研究方向为牧草遗传育种,E-mail:973011156@qq.com。
石凤翎 E-mail:sfl0000@126.com

