海带内生真菌的分离鉴定及其抑制乙酰胆碱酯酶活性的发酵工艺优化
, ,, ,,*
(1.青岛农业大学食品科学与工程学院,山东青岛 266109;2.浙江经贸职业技术学院应用工程系,浙江杭州 310018;3.青岛农业大学海洋科学与工程学院,山东青岛 266109)
海带内生真菌的分离鉴定及其抑制乙酰胆碱酯酶活性的发酵工艺优化
田淑娟1,阙斐2,侯竹美3,李飞1,王凤舞1,*
(1.青岛农业大学食品科学与工程学院,山东青岛266109;2.浙江经贸职业技术学院应用工程系,浙江杭州310018;3.青岛农业大学海洋科学与工程学院,山东青岛266109)
本文以青岛海域的海带为原料,对其进行内生真菌的分离纯化,共得到7株内生真菌,采用改良Ellman法对其乙酰胆碱酯酶(AChE)抑制活性进行筛选,并对其中一株活性最高内生真菌ML-X进行形态学和18S rDNA 分子生物学鉴定,通过单因素实验和正交实验筛选出最适合该菌进行液体生长发酵的培养条件。结果表明,分离获得的菌株ML-X为白地霉属,序列号为KY977411,与遗传距离最近的Galactomycesgeotrichumstrain LMA-21株(JQ668739)同源性达99%。最佳发酵条件为:PS培养基,培养基的初始pH6.0,接种量5%,装瓶量150 mL/500 mL,培养温度31 ℃,发酵8 d,当发酵液粗浸膏为5 mg/mL时,对乙酰胆碱酯酶的抑制率可达28.91%±0.25%。
内生真菌,鉴定,乙酰胆碱酯酶,抑制活性,条件优化
Abstract:In this study,Laminariajaponicafrom Qingdao sea area was used to isolate and purify endophytic fungus. A total of seven strains of endophytic fungi were isolated. Using modified Ellman method to determine the inhibitory rate of AChE and active strains were identified. Strain ML-X showed the highest AChE inhibitory activity and was identified,by physiological-biochemical characteristics and molecular biological techniques of 18S rDNA sequencing. Based on single factor and orthogonal test,the culture conditions of liquid fermentation of the endophytic fungi were screened out. The results showed that the strain ML-X was confirmed asGeotrichumcandidum,and the optimal fermentation conditions were as follows:PS medium was the suitable medium for the strain at pH6.0,incubated with 5% inoculum and 150 mL/500 mL culture volume at 31 ℃ for 8 days. Under these conditions,the strain ML-X exhibited a higher AChE inhibitory activity,the inhibition ratio of AchE was 28.91%±0.25% when the concentration of crude extract from fermentation broth was 5 mg/mL.
Keywords:endophytic fungi;strain identification;acetylcholinesterase;inhibitory activity;conditions optimization
阿尔茨海默病(Alzheimer’s disease,AD)是一种常见的老年性脑神经退行性病变,已成为现代社会严重威胁老年人生命的疾病之一[1]。关于AD的病理较为接受的为“胆碱能缺失学说”,认为大脑内神经递质——乙酰胆碱的缺失是导致AD的关键原因[2],造成乙酰胆碱缺失的因素可能是β-淀粉样斑块内及周围的乙酰胆碱酯酶(AChE)活性增加,激活了其细胞毒性,或者是AChE糖基化异常及其各分子型表达水平的变化[3-4]。目前临床治疗主要是采用乙酰胆碱酯酶抑制剂,如他克林、加兰他敏、石杉碱甲等,这些药物可以提高患者体内的乙酰胆碱的水平,具有一定的疗效,但是化学药物副作用比较明显,不利于患者长期服用[5]。因此科学家们将研究的方向转向了特境微生物次生代谢产物。
特境微生物作为新的药物来源已经显示出巨大的开发潜力。作为一种特境微生物,植物内生菌是指寄生于宿主体内并且不引起宿主致病症状的一类微生物,在与宿主长期共进化的过程中进行“基因重组”,既有可能产生与宿主相同或相似的活性成分,也有可能产生与宿主完全不同的活性成分[6-8]。
海带(Laminariajaponica)是一种大型海生褐藻植物,在我国海域分布非常广泛。海带不仅能防止肥胖、胆结石、便秘、肠胃炎等代谢性疾病,还具有防癌抗癌、降血压、降血糖、预防动脉硬化和血栓形成、排出体内铅毒等功效,素有“长寿菜”的美誉。而与海带共生并可以产生如抗生素、毒素等物质以利于海带生长代谢或增强海带的抵御能力的内生真菌必然会产生可加以利用的功能活性成分。因此,本论文基于内共生理论,从海带内生菌中寻找抗老年痴呆活性成分,发现活性成分的可能性极大。目前国内外关于海带内生菌的研究报道仅见于海带内生菌DNN6蛋白对小黄鱼的保鲜效果[9-10],DNN7蛋白的分离及抗肿瘤研究[11]以及HSN2胞外蛋白对粉红单端孢霉的影响[12],未发现关于海带内生菌的抗老年痴呆相关活性报道。因此本文从青岛海域海带中分离纯化出内生菌,并对菌株进行体外AChE抑制活性的筛选,对活性菌株进行鉴定和发酵条件的优化,以期获得更多高活性的次生代谢产物。
1 材料与方法
1.1 材料与仪器
海带 采自青岛海域,新鲜的海带;Na2HPO4、NaH2PO4、二甲基亚砜(DMSO)、十二烷基磺酸钠 均购自莱阳康德化工有限公司,分析纯;乙酰胆碱酯酶(优级纯) 北京索莱宝科技有限公司;乙酰胆碱碘代物AchI、3,5-二硫二硝基苯甲酸(DTNB) 购自北京博奥拓达科技有限公司,分析纯;他克林 Sigma公司;SK8229真菌基因组DNA快速抽提试剂盒 上海生工生物工程有限公司;琼脂糖凝胶回收试剂盒 Omega 公司。
DU-800紫外/可见分光光度计 美国贝克曼库尔特有限公司;SW-CJ-1F超净工作台 苏州安泰空气技术有限公司;DPH-9032电热恒温培养箱 龙口市先科仪器公司;YXQ-LSS全自动电热压力蒸汽灭锅 上海博讯实业有限公司;旋转蒸发仪 上海亚荣生化仪器厂;ISRDH1恒温振荡器 苏州麦可旺志生物技术有限公司;电子分析天平 美国奥豪斯电子天平公司;移液枪 法国GILSON公司。
1.2 培养基
WA抗生素培养基(水+琼脂+青霉素+链霉素),种子液培养基(PD),改良察氏培养基(CzapeK’s),马铃薯葡萄糖PD培养基,马铃薯蔗糖PS培养基,以上培养基配方见参考文献[5]。
SP培养基:2%蔗糖,0.3% KH2PO4,0.15% MgSO4·7H2O,0.0005%维生素B1,土豆浸出液,蒸馏水溶解,分装灭菌。
SP′培养基:2%蔗糖,0.3% KH2PO4,0.15% MgSO4·7H2O,0.0005%维生素B1,土豆浸出液,海水溶解,分装灭菌。
1.3 实验方法
1.3.1 海带内生菌的分离和纯化 取海带样品,用自来水冲洗干净表面的泥沙,将其顺次置于75%的乙醇溶液、1%的NaClO溶液和75%的乙醇溶液进行表面消毒3、5和1 min,然后用无菌水冲洗2次,用消毒的手术剪和手术刀将其分割成1 cm×1 cm的小块,将处理好的样品置于加有青霉素和链霉素的WA培养基上,于28 ℃的培养箱中倒置培养。待平板中长出菌体时,采用菌丝尖端切割法对其进行分离纯化;将获得的纯培养物置于4 ℃冰箱保存备用[4]。
对照实验:冲洗干净的海带样品片段,按照上述步骤进行表面消毒,但不进行切割,完整置于分离培养基上,倒置培养。对照如无真菌生长,说明表面消毒彻底。
1.3.2 液体发酵培养 将分离得到的菌株在无菌的条件下接种到PD液体培养基中,于28 ℃,140 r/min恒温振荡培养3 d,作为种子液。然后将其接种到SP培养基中,接种量为10%、培养温度为28 ℃继续培养10 d。
1.3.3 发酵液浸提及乙酰胆碱酯酶抑制活性的测定 发酵结束后,将发酵液于离心机10000 r/min离心8~10 min,取上清液,用乙酸乙酯萃取3次,合并萃取相,经旋转蒸发仪浓缩得浸提物。将浸提物用二甲基亚砜(DMSO)溶解,配制成浓度为5 mg/mL的溶液。AChE活性抑制率的测定参照改良过的Ellman法[13]。
1.4 菌株的鉴定
1.4.1 形态学鉴定 参考《真菌鉴定手册》对该真菌菌株进行形态学鉴定,主要观察该真菌菌落的形状、颜色、大小、质地、表面光泽、是否隆起等[14]。
1.4.2 分子生物学鉴定
1.4.2.1 真菌基因组DNA的提取 采用改良的CTAB[15]法对真菌的基因组DNA进行提取:取200 mg菌体,加液氮研磨3~4次,迅速用药匙转入装有3 mL 3% CTAB提取缓冲液的5 mL离心管中(65 ℃预热),65 ℃水浴45 min,并不时轻轻转动离心管,室温4000 r/min离心20 min;取上清液转入新离心管中,加入4 μL 10 mg/L蛋白酶K,37 ℃水浴1 h;加入800 μL Tris饱和酚,摇匀,12000 r/min离心10 min取上清,加入等体积氯仿/异戊醇,摇匀,12000 r/min离心10 min;取上清,加入2 μL 10 mg/L核糖核酸酶RNase溶液,37 ℃水浴1 h,加入800 μL氯仿/异戊醇,摇匀,12000 r/min离心10 min;取上清,加入2倍体积的乙醇或0.7倍体积的异丙醇(-20 ℃预冷),-20 ℃沉淀30 min,12000 r/min离心15 min,回收DNA沉淀;弃上清取沉淀,用70%乙醇清洗两次,超净工作台中吹干,将收集得到的DNA溶于灭菌超纯水或者0.1×Tris-EDTA缓冲液(TE)中,-20 ℃保存备用。
1.4.2.2 18S rDNA的扩增 PCR反应体系的建立:DNA模版2 μL,正、反向引物各10 pmol,dTNP 1 μL,Taq DNA聚合酶5 U,10×PCR buffer 5 μL,ddH2O补足至50 μL。
PCR程序的设定:98 ℃预变性5 min;95 ℃变性35 s,55 ℃退火35 s,72 ℃延伸40 s,共进行30个循环;72 ℃修复延伸8 min,回收产物。
PCR产物检测:用1%的琼脂糖凝胶电泳进行检测,确定为单一条带后,切下DNA目的条带送往上海生工进行测序。
1.4.2.3 基于18S rDNA的系统发育树构建 将测序得到的DNA序列提交到NCBI的GenBank数据库,通过BLAST与已有的序列进行比对,从而确定菌株的种属。同时,利用MEGA 6软件将与菌株序列相关性最高的菌株序列进行类比,并构建其系统进化树。
1.5 海带内生真菌发酵流程
接种针挑取小块菌株→转接至500 mL锥形瓶(150 mL培养基)→摇床发酵3 d(28 ℃)→转到1 L的锥形瓶(400 mL培养基)继续摇床发酵10 d→过滤→乙酸乙酯萃取发酵液→旋转蒸发后得粗浸膏。
1.6 单因素实验
1.6.1 培养基的筛选 分别选取CzapeK’s培养基、PD培养基、SP培养基、PS培养基、SP′培养基作为该菌株的发酵培养基。其他条件:接种量为10%,培养温度为28 ℃,500 mL三角瓶装液量为150 mL,发酵时间为10 d,每组实验设定3个平行实验。采用1.3.3中的方法测定AChE抑制率。
1.6.2 温度的筛选 以PS培养基为发酵培养基,培养温度分别为22、25、28、31、34 ℃,500 mL三角瓶装液量为150 mL,接种量为10%,发酵时间为10 d,每组设定3个平行实验,采用1.3.3中的方法测定AChE抑制率。
1.6.3 初始pH的筛选 以PS培养基为发酵培养基,将培养基的初始pH分别调至4.0、5.0、6.0、7.0、8.0,培养温度为28 ℃,500 mL三角瓶装液量为150 mL,接种量为10%,发酵时间为10 d,每组实验设定3个平行,采用1.3.3中的方法测定AChE抑制率。
1.6.4 接种量的筛选 以PS培养基为发酵培养基,pH为6.0,培养温度为28 ℃,500 mL三角瓶装液量为150 mL,接种量分别为1%、5%、10%、15%和20%,发酵时间为10 d,每组设定3个平行实验,采用1.3.3中的方法测定AChE抑制率。
1.6.5 发酵时间的筛选 以PS培养基为发酵培养基,培养温度为28 ℃,pH为6.0,500 mL三角瓶装液量为150 mL,接种量为10%,发酵时间分别为6、8、10、12、14 d,每组设定3个平行实验,采用1.3.3中的方法测定AChE抑制率。
1.6.6 装液量的筛选 以PS培养基为发酵培养基,培养温度为28 ℃,接种量为10%,培养基初始pH为6.0,500 mL三角瓶装液量分别为50、100、150、200 mL和250 mL,发酵时间为10 d,每组设定3个平行实验,采用1.3.3中的方法测定AChE抑制率。
1.7 正交实验
在单因素实验的基础上,选择接种量、温度、初始pH和时间四个因素进行四因素三水平的正交实验,因素水平见表1。

表1 菌株发酵条件正交因素水平Table 1 Factors and levels of fermentation conditions of orthogonal
1.8 数据处理
实验中每个处理重复三次,采用正交助手软件对四个单因素进行分析,并采用SPSS 17.0软件进行数据的显著性分析,应用GraphPad Prism 4.0软件进行作图。
2 结果与分析
2.1 海带内生菌的分离纯化
从海带中共分离得到7株内生真菌,并对分离得到的菌株进行了体外抑制AChE活性的筛选。结果显示:菌株ML-X发酵液萃取的乙酸乙酯相AChE抑制率达25%以上,其他6株菌株发酵液乙酸乙酯萃取相的AChE抑制率均低于10%(表2),因此,本实验选择真菌菌株ML-X进行进一步的研究。
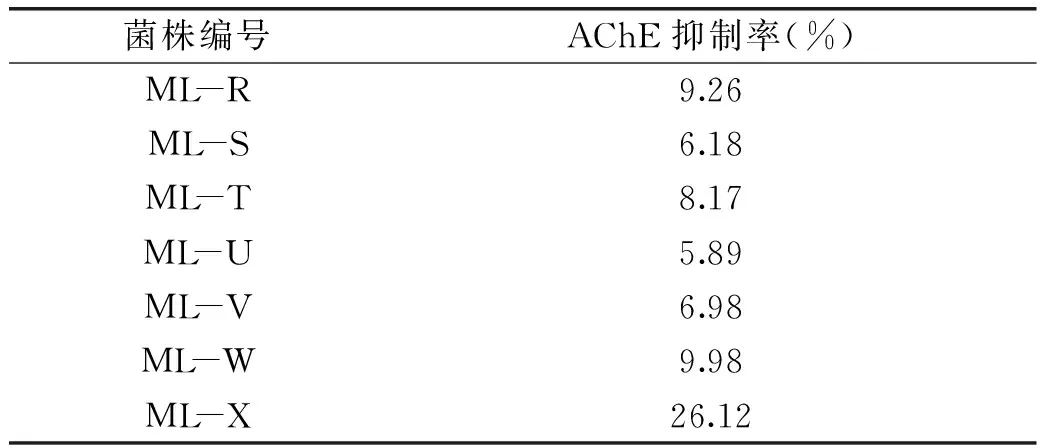
表2 7株菌的AChE抑制率Table 2 The inhibition ratio of AChE of 7 strains
2.2 菌株鉴定结果
2.2.1 形态学鉴定 菌株ML-X为丝状白色真菌,生长快速。菌丝为有横隔的真菌丝,有的分支。在PDA培养基平板中,该菌落呈平面扩散,生长快,扁平且规则,不透明白色,短绒状或近于粉状(图1)。

图1 菌株的培养形态Fig.1 Morphogenesis of strains
2.2.2 分子生物学鉴定

图3 菌株的系统发育树Fig.3 Phylogenetic tree of strains
2.2.2.1 PCR扩增结果 通过图2可以看出,菌株的PCR产物的片段长度在1000~3000 bp之间。电泳图示条带清晰,没有杂质,可用于菌株18S rDNA的分析。

图2 菌株PCR凝胶电泳图Fig.2 PCR gel electrophoresis of strain注:1-样品,M-mark。
2.2.2.2 菌株的18S rDNA基因序列 将菌株ML-X的18S rDNA(1401bp)基因序列提交到NCBI的GenBank数据库,获得序列号KY977411。在NCBI数据库中进行Blast同源比对,序列比对采用Clustal X软件,MEGA 6软件构建系统发育树采用邻连接法,系统发育树的构建进行重复设定为1000次的自检(Bootstrap)。菌株ML-X,利用18S rDNA建立的系统进化树见图3。结果表明分离的菌株ML-X为白地霉属,与遗传距离最近的Galactomycesgeotrichumstrain LMA-21株(JQ668739)同源性达99%。
2.3 菌株ML-X液体发酵条件的优化
2.3.1 培养基的确定 本实验研究了5种发酵培养基对该海带内生菌株次生代谢产物乙酸乙酯萃取的浸提物AChE抑制率的影响,由图4可知,采用5种发酵培养基所获得的次生代谢产物的乙酸乙酯相对AChE抑制率有着很明显的差异。其中采用PS培养基的生长代谢产物的浸提物对AChE抑制率最高,达到了28.9%,其对AChE抑制率显著大于SP、SP′和CzapeK’s(p<0.05),而与PD培养基中的菌株生长代谢产物的浸提物对AChE的抑制率差异不显著(p>0.05)。SP培养基和察氏培养基中的菌株生长代谢产物的浸提物对AChE的抑制率都比较低。因此,根据以上数据可知PS培养基是最适合该海带内生真菌菌株的生长和产生次级代谢产物的培养基,说明该菌株利用蔗糖比其他的碳源生长的更好。

图4 不同培养基对菌株代谢产物AChE抑制率的影响Fig.4 Effect of different media on AChE inhibition rate of metabolic products注:不同字母代表不同培养基之间存在显著性差异(p<0.05)。图5~图9同。
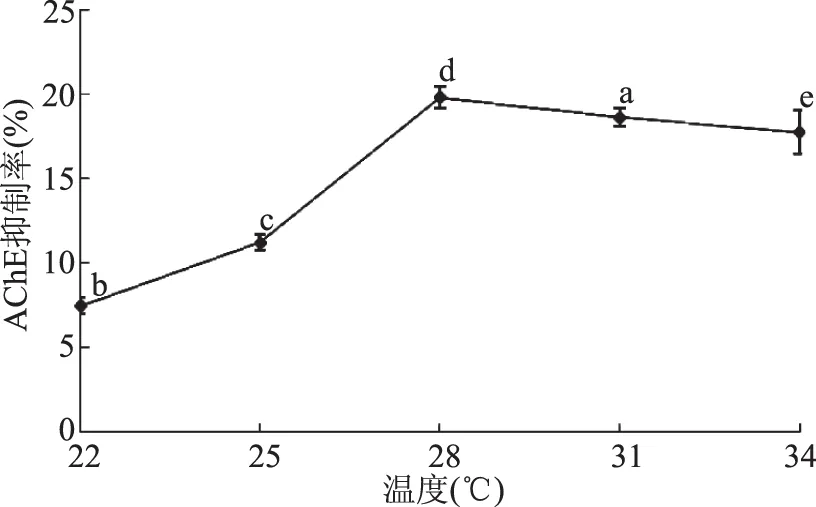
图5 温度对菌株代谢产物AChE抑制率的影响Fig.5 Effects of temperatures on AChE inhibition rate of metabolic products
2.3.2 温度的确定 从图5中的数据可以看出随着培养温度的升高浸提物对AChE的抑制率也不断上升,从22 ℃开始到28 ℃时,AChE的抑制率不断升高,而且升高的幅度比较大。当培养温度达到28 ℃左右时,菌株生长代谢产物的浸提物对AChE的抑制率达到最高,且与其他几个温度下AChE的抑制率存在显著性差异(p<0.05)。当培养温度从28 ℃继续升高时,菌株生长代谢产物的浸提物对AChE的抑制率开始下降但是下降幅度不大。说明28 ℃最适合该菌株分泌和合成具有抑制AChE活性的次生代谢产物。
2.3.3 培养基初始pH的确定 培养基的初始pH对于菌株的生长代谢会产生直接的影响,合适的初始pH会使菌株快速生长。在图6的曲线中可以看出初始pH对于菌株代谢产物浸提物AChE的抑制率影响比较大。在培养基初始pH=4时,AChE的抑制率比较低,随着培养基的初始pH的不断升高,AChE的抑制率开始不断升高,最后在培养基初始pH=6左右时,AChE的抑制率达到最高值,且与其他pH下AChE的抑制率存在显著性差异(p<0.05)。在pH=6之后,随着培养基初始pH的不断升高,AChE的抑制率开始下降,这说明过酸或者过碱的培养环境都会对菌株的生长代谢浸提物产生抑制。而pH=5时AChE的抑制率与pH=8时AChE的抑制率差异不显著(p>0.05)。
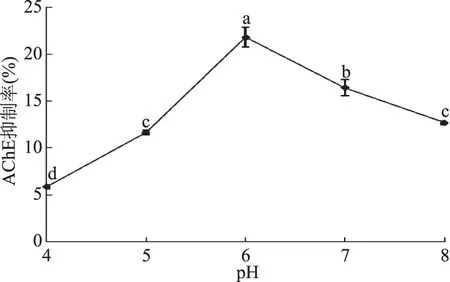
图6 初始pH对菌株代谢产物AChE抑制率的影响Fig.6 Effect of initial pH on AChE inhibition rate of metabolic products
2.3.4 适宜接种量的确定 由图7可以看出当接种量处于1%到10%区间时,随着接种量的增加,该菌株的生长代谢产物的浸提物对AChE的抑制率随之增强。当接种量达到10%时,AChE的抑制率达到最高,为23%±0.45%,且与其他几个接种量下AChE的抑制率存在显著性差异(p<0.05)。从10%接种量后随着接种量的继续增加,菌株发酵液产生的乙酸乙酯对AChE的抑制率出现下降趋势,可能因为接种量过大,导致菌丝体在发酵前期生长过于旺盛,培养基中的营养成分被大量的消耗,致使后期的生长空间和资源相对匮乏,进而影响到菌株发酵后期生长代谢产物的形成和分泌。

图7 接种量对菌株代谢产物AChE抑制率的影响Fig.7 Effect of inoculation on AChE inhibition rate of metabolic products
2.3.5 适宜发酵时间的确定 在菌株的液体发酵过程中,生长分为不同的阶段,因此其次级代谢产物产生的时间会有所不同。由图8可以看出,在发酵初期,随着发酵时间的延长,菌株具有抑制AChE活性的代谢产物逐渐增多。第10 d时,代谢产物量达到最大值,此时AChE的抑制率为25.6%±1.35%,且与其他发酵时间下AChE的抑制率存在显著差异(p<0.05)。此后,随着发酵时间的延长,菌株次生代谢产物对AChE的抑制率开始明显下降,而14 d与6 d的AChE抑制率差异不显著(p>0.05)。这主要是因为在发酵初期菌丝体以初级代谢为主,次生代谢为辅,在初期进行大量的生长繁殖,产生少量次生代谢产物并且没有及时排出到胞外;到了发酵的中后期是以次级代谢为主,产生大量次生代谢产物并且排到胞外;到了后期,培养基中的营养物质被消耗殆尽,有一部分菌丝体发生自溶,并且培养基的粘度增大,影响了氧气传递速率,从而影响到次生代谢产物的产生或者次生代谢的途径[5,16]。

图8 发酵时间对菌株次生代谢产物AChE抑制率的影响Fig.8 Effect of time on ACh inhibition rate of metabolic products

图9 装液量对菌株发酵代谢产物AChE抑制率的影响Fig.9 Effect of liquid volume on AChE inhibition rate of metabolic products
2.3.6 适宜装液量的确定 由图9可以看出,随着装液量的增加,菌株发酵代谢产物AChE抑制率呈现出先增大后减小的趋势。装液量50~150 mL/500 mL时,代谢产物的浸提物对AChE的抑制率升高,但是差异不显著。当装液量为150 mL/500 mL时,发酵液的提取物对AChE的抑制率达到最大值,与200、250 mL下AChE的抑制率存在显著性差异(p<0.05);装液量150 mL以后,随着装液量的增加,AChE的抑制率开始下降,而且下降幅度比上升幅度大,这说明该菌株的发酵为需氧型发酵,但在本实验范围内,装液量不会影响菌株的正常发酵。
2.3.7 正交实验结果 结果见表2。由K值可得最优组合为A2B3C1D1,即培养基的初始pH=6,培养温度为31 ℃,接种量为5%,发酵时间为8 d。3次验证实验表明,在该发酵条件下菌株发酵次级代谢产物浸提物对AChE的抑制率可达28.91%±0.25%。

表2 正交实验结果Table 2 Results of orthogonal test
3 结论
从海带里共分离纯化出7株内生真菌,其中菌株ML-X发酵液的乙酸乙酯相对AChE的抑制率较高,被选作进一步的研究对象。结合形态学及分子生物学鉴定,可确定菌株ML-X为白地霉属。通过正交实验确定海带内生菌ML-X液体发酵的最佳条件:PS培养基、接种量5%、装液量为150 mL/500 mL、培养基初始pH为6.0,在31 ℃,培养8 d。在上述条件下,该菌株发酵液乙酸乙酯相的AChE抑制率达到28.91%±0.25%。
[1]Snokusare S K,Kaul C L,Ramarao P. Demential of Alzheimer’s disease and other neurodegenerative disordersmemantine,a new hope pharmacological[J].Pharmaco-logical Research,2005,51(1):1-17.
[2]Terry R. D,Masliah E. Physical basis of cognitive alterationsin Alzheimer’s disease synapse loss is the major cor-relate of cognitive impairment[J]. Ann Neurol,1991,30:572-580.
[3]李前,朱振霞.乙酰胆碱酯酶与老年性痴呆关系的研究进展[J].中国老年志,2002,4:325-326.
[4]秦云,王凤舞.裙带菜内生菌的分离鉴定及其抑制AChE活性的研究[J].现代食品科技,2015,31(1):53-58.
[5]王凤舞,孟丽媛. 1株具有抑制乙酰胆碱酯酶活性的牡蛎共生真菌的鉴定及发酵条件的优化[J]. 食品与发酵工业,2014,9:78-84.
[6]陈道金,刘慧敏,杨静,等.植物内生菌活性成分研究进展[J].时珍国医国药,2013,24(7):1730-1732.
[7]Strpbel G A. Endophytes as sources of bioactive products[J]. Microbes Infect,2003,5(6):535-544.
[8]Wang F W,Ye Y H,Ding H,et al. Benzophenones fromGuignardiasp. IFB-E028,an Endophyte on Hopea hainanensis[J]. Chemistry & Biodiversity,2010,7(1):216-220.
[9]赵宇,张付云,于清铭,等. 海带内生菌DNN6蛋白对小黄鱼保鲜作用的研究[J].食品工业科技,2014,35(1):321-325.
[10]李雪. 海带内生菌DNN6代谢产物的分离纯化及其对小黄鱼保鲜的研究[D].沈阳:沈阳农业大学,2016.
[11]赵宇. 海带内生菌DNN7蛋白的分离及抗肿瘤活性研究[D].大连:大连海洋大学,2015.
[12]赵宇,刘浩舶,李振,等. 海带内生菌HSN2胞外蛋白对粉红单端孢霉的影响[J]. 食品与机械,2014,(6):31-34,114.
[13]Ellman G L,Courtney K D,Featherstone RM,et al.Anew and rapid colorimetric determination of acetylcho-linesterase activity[J].Biochemical Pharmacology,1961,7(2):88-95.
[14]WANG Y,XU L,REN W. Bioactive metabolites fromChaetomiumglobosumL18,an endophytic fungus in themedicinal plant Curcuma wenyujin[J].Phytomedicine,2012,19(3):364-368.
[15]孟丽媛. 牡蛎共生真菌的分离鉴定及其抑制AChE次生代谢产物的研究[J].青岛农业大学,2013,1:65-68.
[16]王广慧,戴明,魏雅冬. 真菌液态发酵产漆酶的培养条件优化研究进展[J]. 食品工业,2012,33(4):130-134.
Isolation,identificationandfermentationprocessoptimizationofacetylcholinesteraseinhibitoryactivityofendophyticfungusfromLaminariajaponica
TIANShu-juan1,QUEFei2,HOUZhu-mei3,LIFei1,WANGFeng-wu1,*
(1.College of Food Science and Engineering,Qingdao Agricultural University,Qingdao 266109,China;2.The Department of Applied Technology, Zhejiang Economic & Trade Polytechnic, Hangzhou 310018,China;3.College of Marine Science and Engineering,Qingdao Agricultural University,Qingdao 266109,China)
TS201.3
A
1002-0306(2017)18-0111-06
2017-03-20
田淑娟(1992-),女,硕士研究生,研究方向:天然产物分离,E-mail:376211311@qq.com。
*通讯作者:王凤舞(1979-),女,博士,副教授,研究方向:天然产物分离,E-mail:wangfengwude@126.com。
山东省自然科学基金面上项目(ZR2015BM016)。
10.13386/j.issn1002-0306.2017.18.022

