热处理对乳铁蛋白-β-胡萝卜素/大豆多糖-DHA乳状液微流变特性的影响
, ,玮克,,
(北京食品营养与人类健康高精尖创新中心,北京工商大学食品学院,北京市食品添加剂工程技术研究中心,食品添加剂与配料北京高校工程研究中心,北京市食品风味化学重点实验室,食品质量与安全北京实验室,北京 100048)
热处理对乳铁蛋白-β-胡萝卜素/大豆多糖-DHA乳状液微流变特性的影响
李昕,王旭,李玮克,许朵霞*,曹雁平*
(北京食品营养与人类健康高精尖创新中心,北京工商大学食品学院,北京市食品添加剂工程技术研究中心,食品添加剂与配料北京高校工程研究中心,北京市食品风味化学重点实验室,食品质量与安全北京实验室,北京100048)
蛋白质功能因子乳状液体系巴氏杀菌受热时易改变其流变性,从而影响其品质。本研究基于乳状液异型聚集效应,构建多重功能因子乳状液微聚集体,以期改善其耐热性。选用大豆多糖(SSPS)和乳铁蛋白(LF)为乳化剂,DHA和β-胡萝卜素为功能因子,分别制备了SSPS-DHA乳状液和LF-β-胡萝卜素乳状液,二者以不同比例异型聚集,形成不同的乳状液微聚集体。考察不同加热方式25~80 ℃程序加热30 min(加热过程)和80 ℃加热30 min(模拟巴氏杀菌)对乳状液的物理稳定性与流变特性的影响。结果表明:单一LF-β-胡萝卜素乳状液加热后完全变性成凝胶状固体;SSPS-DHA/LF-β-胡萝卜素乳状液微聚集体在加热条件下,流变学特性明显改善;90 wt% LF-β-胡萝卜素-10 wt% SSPS-DHA乳状液微聚集体的流动性、粘弹性均表现为流体特征。因此,通过SSPS-DHA乳状液的添加可以显著改善蛋白乳状液的热变性与热凝固特性,从而保障巴氏杀菌等热处理不改变功能因子乳状液的质构。
乳铁蛋白(LF),大豆多糖(SSPS),β-胡萝卜素,DHA,乳状液,热处理,微流变
Abstract:The rheological properties of protein emulsion system was easy to be changed when it was heated,thus affecting its quality. In order to improve the heat resistance of the emulsion,a new multi-functional emulsion microaggregate was constructed based on the heteroaggregation effect of emulsion. Soybean polysaccharide(SSPS)and lactoferrin(LF)as emulsifier,DHA andβ-carotene as functional components were prepared to SSPS-DHA emulsion and LF-β-carotene emulsion. Then,heteroaggregation forming emulsions of different micro-clusters occurred in different proportions. The effects of 25~80 ℃ programmed heating 30 min(heating process)and 80 ℃ heating 30 min(simulated pasteurization)on the physical stability and rheological properties of the emulsion were investigated. The results showed that the single LF-β-carotene emulsion was completely denatured and exhibited solid after heating. The rheological properties of the SSPS-DHA/LF-β-carotene emulsion micro-aggregates were significantly improved under heating condition,the fluidity and viscoelastic of the 90 wt% LF-β-carotene-10 wt% SSPS-DHA emulsion micro-aggregates showed fluid characteristics. Therefore,the addition of SSPS-DHA emulsion significantly improved the thermal denaturation and thermal coagulation characteristics of the protein emulsion,thus ensuring that the heat treatment of pasteurization did not change the texture of the functional compound emulsion.
Keywords:lactoferrin(LF);soybean polysaccharide(SSPS);β-carotene;DHA;emulsions;thermal treatment;microrheological
乳铁蛋白(LF)是一种优良的乳化剂,可吸附到油-水界面产生阳离子乳状液,具有增强铁的传递和吸收等多种生物活性功能,是一种较理想的功能性食品配料[1-4]。大豆多糖(SSPS)在pH3~7时可以形成稳定的乳状液,具有较强的乳化稳定性、抗黏结性等功能特性[5-6]。
β-胡萝卜素是一种重要的脂溶性维生素,常被作为营养强化剂应用在食品和保健品领域[7-8]。但是,β-胡萝卜素对pH、氧敏感,光和热会导致颜色和生物活性损失[9-13]。DHA具有重要营养功能,被称为“脑黄金”[14-15]。然而,DHA易氧化产生不可接受的颜色、气味和味道[16-17]。
研究结果表明,乳状液可以将食品功能性成分包埋在乳化剂(多糖、蛋白质)中,改善被包埋营养成分的颜色、溶解度、外观等物理性质,提高营养成分的稳定性,提高其利用率[18-20],因此,乳状液在食品领域利用越来越广泛。但是,蛋白乳状液在加热过程中易变性,导致其流变学特性发生变化,出现乳析和相分离的现象。
近年来研究发现,在蛋白质作为乳化剂稳定的乳状液体系中,添加多糖可以增强乳状液的流变学特性和连续相的网状结构,从而在一定程度上提高乳状液的稳定性,防止相分离和乳析现象的发生[21-24]。因此,本研究制备了SSPS-DHA乳状液和LF-β-胡萝卜素乳状液,二者以不同比例异型聚集形成乳状液微聚集体。通过微流变技术,全面、系统追踪乳状液体系结构与布朗运动轨迹,考察不同加热方式25~80 ℃程序加热30 min(加热过程)和80 ℃加热30 min(模拟巴氏杀菌)对乳状液的物理稳定性与流变特性的影响,以期提高LF-β-胡萝卜素乳状液的稳定性,延长货架期。
1 材料与方法
1.1 材料与仪器
大豆多糖(SSPS) 纯度>70%,不二富吉(北京)科技有限公司;藻油DHA 嘉必优生物工程(武汉)有限公司;乳铁蛋白(LF) 纯度99.3%,美国Hilmar公司;β-胡萝卜素 纯度>97%,百壹星辰(北京)生物科技有限公司;中链甘油三酸酯(MCT,C8-C10) 奎斯特(上海)国际有限公司;NaOH、HCl、NaH2PO4、Na2HPO4国药集团化学试剂有限公司。
剪切仪(B25model) 上海贝而特流体设备有限公司;微射流纳米均质机(M-110P) 加拿大Microfluidics公司;Zetasizer Nano-ZS90动态激光光散射仪 英国Malvern公司;微流变仪(Rheolaser Master) 法国Formulaction公司;Eutech pH700 pH计 梅特勒-托利多仪器(上海)有限公司;LUMiSizer快速稳定性分析仪 德国LUM公司;集热式恒温加热磁力搅拌器(DF-101S) 河南省予华仪器有限公司;分析天平(BSA124S-CW) 赛多利斯科学仪器(北京)有限公司。
1.2 实验方法
1.2.1 磷酸盐缓冲液的制备 准确称取一定量的NaH2PO4和Na2HPO4溶解于超纯水中,配制成1 mmol/L NaH2PO4和Na2HPO4溶液,两者按一定比例混合(w/w)形成粗磷酸盐缓冲溶液,再用1 mol/L HCl或NaOH调节至pH为6.0。
1.2.2 乳状液制备
1.2.2.1 LF-β-胡萝卜素乳状液的制备 准确称取一定量的LF,溶解于1 mmol/L pH6.0磷酸盐缓冲溶液中,40 ℃中等速度搅拌2 h,溶胀过夜,使用前40 ℃中等速度搅拌30 min,确保LF充分溶解,制备出LF溶液(3.5%,w/w),形成水相。将β-胡萝卜素(0.1%,w/w)溶解于MCT中,140 ℃加热搅拌至完全溶解,形成油相(10%,w/w)。在高速乳化均质机19000 r/min剪切5 min,边剪切边缓慢地将油相倒入水相中,形成粗乳状液;粗乳状液通过微射流进一步均质得到LF-β-胡萝卜素乳状液,均质压力为50 MPa,均质3次。
1.2.2.2 SSPS-DHA乳状液的制备 准确称取一定量的SSPS,溶解于1 mmol/L pH6.0磷酸盐缓冲溶液中,50 ℃中等速度搅拌2 h,溶胀过夜,使用前50 ℃中等速度搅拌30 min,确保SSPS充分溶解,制备出SSPS溶液(3.5%,w/w),形成水相。准确称取一定量的DHA(10%,w/w),作为油相。在高速乳化均质机19000 r/min剪切 5 min,边剪切边缓慢地将油相倒入水相中,形成粗乳状液;粗乳状液通过微射流进一步均质得到SSPS-DHA乳状液,均质压力为50 MPa,均质3次。
1.2.2.3 LF-β-胡萝卜素/SSPS-DHA微聚集体制备及热处理 将LF-β-胡萝卜素乳状液和SSPS-DHA乳状液按不同比例(0∶10,1∶9,2∶8,3∶7,4∶6,5∶5,6∶4,7∶3,8∶2,9∶1,10∶0;w/w)均匀混合制成混合O/W乳状液,形成聚集体。乳状液分成三份,分别不加热、25~80 ℃程序加热30 min(1.83 ℃/min持续升温)、模拟巴氏杀菌80 ℃加热30 min,快速冷却至室温。实验重复三次。
1.2.3 LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体粒径分析 采用动态激光光散射仪测定乳液平均粒径,测试温度为25 ℃,折射率比为1.45。为减小多重光散射对测量的误差,样品在分析测试前用1 mmol/L pH6.0磷酸盐缓冲液稀释400倍。每个样品分析重复3次,结果以平均值表示。
1.2.4 LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体Zeta-电位(Zeta potential)分析 采用Zetasizer Nano-ZS90测定乳状液Zeta-电位,测试温度为25 ℃。为减小多重光散射对测量的误差,样品在分析测试前用1 mmol/L pH6.0磷酸盐缓冲液稀释400倍。每个样品分析重复3次,结果以平均值表示。
1.2.5 LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体物理稳定性分析 应用LUMiSizer稳定性分析仪,通过加速分层和量化沉淀、悬浮的方法(STEP-Technology)快速测定乳状液的稳定性。实验过程中,取约0.4 mL乳状液,均匀注射至样品试管底部,温度设定为25 ℃,离心转速为2500 r/min,样品的透射率的特征线每30 s记录一次,共255次。
1.2.6 LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体微流变分析 采用Rheolaser Master微流变仪,分析乳状液微聚集体微流变特性。微流变仪通过多散斑扩散波光谱学理论,分析软物质的微流变特性,通过专利运算法可以计算出对应相关时间的粒子均方根位移(MSD)[25]。本实验中,将三组20 mL不同组成的LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体倒入样品池内,分别25 ℃不加热、25~80 ℃程序加热30 min(1.83 ℃/min持续升温)、模拟巴氏杀菌80 ℃加热30 min,放入仪器内进行30 min测试。通过广义的斯托克斯爱因斯坦关系式,可以计算出对应频率下的宏观粘度因子(MVI)、弹性因子(EI)和流动因子(FI)。
MSD曲线平台区后的斜率表征样品的MVI。平台区后的斜率越低,粒子在给定的去相关时间内运动的均方位移越小,运动速度越慢,表明样品的粘度就越大。反之,粒子运动的越快,样品的粘度较小。宏观粘度因子指数是MSD平台区后斜率值的倒数,它的变化与粘度的变化一致的。公式如下:
MVI=1/(MSD Slope)-η
式(1)
MSD曲线平台区的高度,表征样品弹性的大小。平台区高度降低,说明样品结构“笼”尺寸减小,粒子运动受到束缚。减小“笼”体积,所对应的样品弹性增加。EI是计算平台区高度的倒数值,它的变化幅度是和弹性变化一致的。EI与样品的最终流变特征相关,如凝胶网络尺寸、硬度、凝胶化过程的速度、剪切后恢复速度等[26]。软件自动采集样品在去相关时间2.5 ms和1.5 s之间的数据计算,公式如下:
式(2)
FI是去相关时间的倒数,流动因子越大,样品的流动性越好,表明具有很强的液体特征,反之具有很强的固体特征。
1.3 数据分析
采用SPSS软件进行数据方差分析,所有乳状液制备实验平行三次,实验测定重复三次。
2 结果与讨论
2.1 加热对不同组成的LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体粒径、Zeta-电位的影响
不同组成的LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体通过不同加热方式的粒径如图1(a)所示,随着LF-β-胡萝卜素微滴含量的增加,乳状液粒径逐渐减少。LF-β-胡萝卜素微滴含量为0%~60%时,粒径大小顺序为:模拟巴氏杀菌80 ℃加热30 min>25~80 ℃程序加热30 min>未加热的样品;当LF-β-胡萝卜素微滴含量为60%~100%时,不同加热方式与对照(未加热样品)的粒径无显著性差异。模拟巴氏杀菌80 ℃加热30 min比25~80 ℃程序加热30 min对乳状液的破坏性更大。
不同组成的LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体通过不同加热方式的Zeta-电位如图1(b)所示,随着LF-β-胡萝卜素微滴含量的增加,LF-β-胡萝卜素/SSPS-DHA微聚集体的Zeta-电位值逐渐增大,由负值变为正值,当LF-β-胡萝卜素微滴含量为0%~80%时,LF-β-胡萝卜素/SSPS-DHA微聚集体Zeta-电位呈负值;当LF-β-胡萝卜素微滴含量为90%时,LF-β-胡萝卜素/SSPS-DHA微聚集体Zeta-电位值接近0;当LF-β-胡萝卜素微滴含量为100%时,Zeta-电位值为20 mV左右。乳状液的Zeta-电位随着LF-β-胡萝卜素微滴含量增加而逐渐增大,这是因为pH=6时,LF-β-胡萝卜素乳状液微滴带正电与带负电的SSPS-DHA微滴通过静电相互作用形成微聚集体。不同加热方式对LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体的Zeta-电位无显著影响。

图1 不同加热方式对不同组成乳状液粒径(a)和Zeta-电位(b)的影响Fig.1 Effect of different heating methods on the particle size(a) and Zeta-potential(b)of different composition emulsions
2.2 LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体物理稳定性分析
采用LUMiSizer稳定性分析仪,通过不稳定性指数分析不同组成的LF乳状液微滴对LF-β-胡萝卜素/SSPS-DHA微聚集体稳定性的影响(图2)。不稳定性指数越小,表示乳状液越稳定。未加热时,LF-β-胡萝卜素微滴含量为10%~90%时,乳状液的不稳定性指数差别不显著。
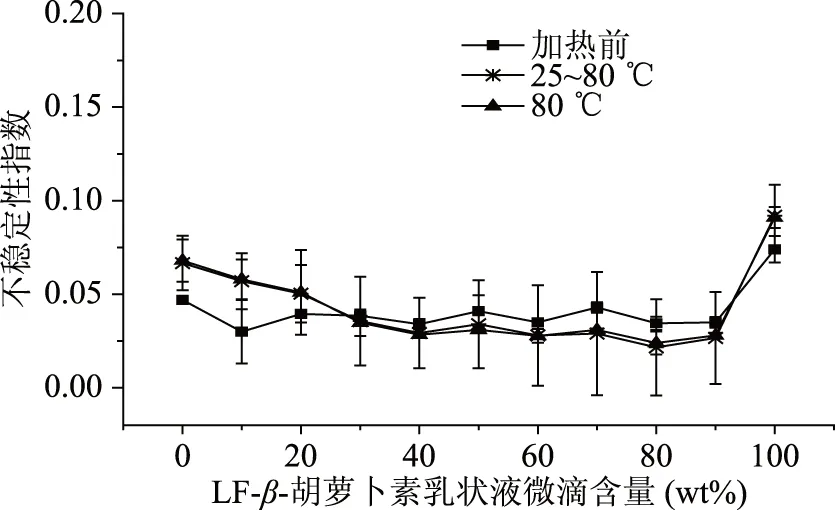
图2 不同加热方式对不同组成乳状液稳定性的影响Fig.2 Effect of different heating methods on the physical stability of different composition emulsions
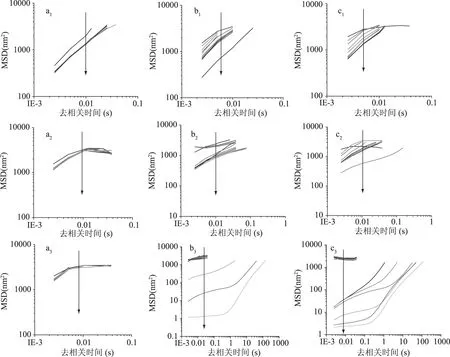
图3 不同加热方式对不同乳状液MSD的影响Fig.3 Effect of different heating methods on the MSD curves of different emulsions注:SSPS-DHA乳状液(a1:未加热;b1:25~80 ℃程序加热30 min;c1:模拟巴氏杀菌80 ℃加热30 min);LF-β-胡萝卜素乳状液∶SSPS-DHA乳状液=9∶1(a2:未加热;b2:25~80 ℃程序加热30 min;c2:模拟巴氏杀菌80 ℃加热30 min)和LF-β-胡萝卜素乳状液(a3:未加热;b3:25~80 ℃程序加热30 min;c3:模拟巴氏杀菌80 ℃加热30 min)。
25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min时,当LF-β-胡萝卜素微滴含量小于30%时,25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min的乳状液不稳定性指数明显高于未加热乳状液的不稳定性指数,表明加热降低乳状液的稳定性,这是由于LF-β-胡萝卜素微滴含量小于30%时,微滴与微滴间静电作用力较弱,从而对乳状液的稳定性影响较小;而当LF-β-胡萝卜素微滴含量为30%~90%时,25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min的乳状液稳定性明显优于未加热样品,这是因为乳状液微滴-微滴间相互作用较强,形成特定空间网络结构,从而对乳状液的稳定性起到保护作用。总之,25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min对单一乳状液物理稳定性均有不同程度的破坏作用,但LF-β-胡萝卜素乳状液微滴和SSPS-DHA乳状液微滴通过静电相互作用,形成微聚集体可对乳状液起到一定程度的热保护作用。
2.3 LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体热微流变分析
2.3.1 LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体MSD分析 本研究采用Formulation微流变分析仪,通过MSD分析不同加热方式对不同组成LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体微流变特性的影响。由于LF-β-胡萝卜素乳状液∶SSPS-DHA乳状液=9∶1微聚集体热处理后的微流变特性变化显著,因此选用LF-β-胡萝卜素乳状液∶SSPS-DHA乳状液=9∶1与SSPS-DHA乳状液和LF-β-胡萝卜素乳状液对照分析。颗粒的布朗运动是由MSD与去相关时间关系曲线来表征的,MSD曲线反应的是体系颗粒的运动轨迹。通过研究颗粒的运动轨迹,可以感知样品结构的变化。同时,MSD曲线反应样品的粘弹性与流体特征。
由图3可知,LF-β-胡萝卜素乳状液未加热时,MSD曲线分布比较密集,说明LF-β-胡萝卜素微滴的布朗运动范围比较固定;25~80 ℃程序加热30 min或模拟巴氏杀菌80 ℃加热30 min,使得乳状液微滴发生聚集并凝结成可以流动的块状物质(半固体特征),LF-β-胡萝卜素乳状液微滴的MSD曲线随着时间的变化分成了两部分,开始加热时MSD曲线分布密集,说明微滴的布朗运动范围较窄,随着加热时间的延长MSD曲线分布开始变得稀疏,表明微滴的运动范围变宽,LF-β-胡萝卜素乳状液微滴在加热的过程中结构发生变化,微滴的运动轨迹发生变化。SSPS-DHA乳状液在25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min后,与对照样品(未加热)相比,MSD曲线范围有所变大,说明微滴的布朗运动范围变大。与单一的LF-β-胡萝卜素乳状液和SSPS-DHA乳状液相比,LF-β-胡萝卜素∶SSPS-DHA=9∶1的微聚集体在25~80 ℃程序加热30 min,MSD曲线范围明显变窄;模拟巴氏杀菌80 ℃加热30 min后,LF-β-胡萝卜素乳状液MSD曲线明显比LF-β-胡萝卜素∶SSPS-DHA=9∶1的微聚集体MSD曲线范围变宽,说明微聚集体受热后布朗运动轨迹范围减小,表明通过异型聚集效应,加热对乳状液结构的破坏作用有所抑制,在一定程度上可保护功能因子乳状液的稳定性与结构。模拟巴氏杀菌80 ℃加热30 min后,LF-β-胡萝卜素∶SSPS-DHA=9∶1的微聚集体MSD曲线与SSPS-DHA乳状液MSD曲线差别不大,可能是由于巴氏杀菌80 ℃加热30 min能量较大,对乳状液微聚集体结构有一定程度的破坏作用。与对照样品(未加热)相比,乳状液的MSD曲线模拟巴氏杀菌80 ℃加热30 min比25~80 ℃程序加热30 min变得更加稀疏,表明模拟巴氏杀菌80 ℃加热30 min 比25~80 ℃程序加热30 min对乳状液的破坏性更大。
2.3.2 LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体MVI分析 不同加热方式对单一乳状液与LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体MVI的影响如图4所示,SSPS-DHA乳状液经未加热、25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min,MVI变化不大,说明加热未改变SSPS-DHA乳状液粘度,可能是因为加热对单一SSPS乳状液体系结构影响不大(图4a)。
LF-β-胡萝卜素∶SSPS-DHA=9∶1微聚集体(图4b),经过25~80 ℃程序加热30 min,在加热20~27 min时,MVI明显增加,但是随着加热时间的延长,MVI逐渐减小(与未加热样品的MVI持平),可能由于加热使微聚集体形成特定的空间结构,导致乳状液粘度增加,而后随着加热时间的增加,特定空间结构发生崩解,乳状液粘度又降低到最初值。微聚集体乳状液在模拟巴氏杀菌80 ℃加热30 min过程中,在加热3~15 min时,MVI稍有降低,而后与未加热样品的MVI持平,可能由于微聚集体存在特定的空间网络结构,模拟巴氏杀菌80 ℃加热能量较大,开始加热时存在加热不均匀现象,导致乳状液粘度稍有降低,而后随着加热时间的增加,微聚集体受热均匀,乳状液粘度恢复至最初。MVI的变化与乳状液的稳定性密切相关,当乳状液不稳定发生絮凝时,会提高其粘度。单一LF-β-胡萝卜素乳状液经过加热后,MVI发生明显的变化,而通过异型聚集效应形成的LF-β-胡萝卜素/SSPS-DHA微聚集体经过加热后,MVI变化明显变小。
LF-β-胡萝卜素乳状液25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min与未加热样品相比,MVI均发生明显的变化,25~80 ℃程序加热30 min的LF乳状液在加热20 min左右时,MVI值发生明显增大;模拟巴氏杀菌80 ℃加热30 min的LF乳状液在加热3 min左右时,MVI值明显增大。表明单一LF乳状液经过25~80 ℃程序加热30 min或模拟巴氏杀菌80 ℃加热30 min,乳状液的粘度均发生明显增加,微滴颗粒运动速度明显降低,加热使得单一蛋白乳状液体系结构发生变化,从而提高其粘度(图4c)。
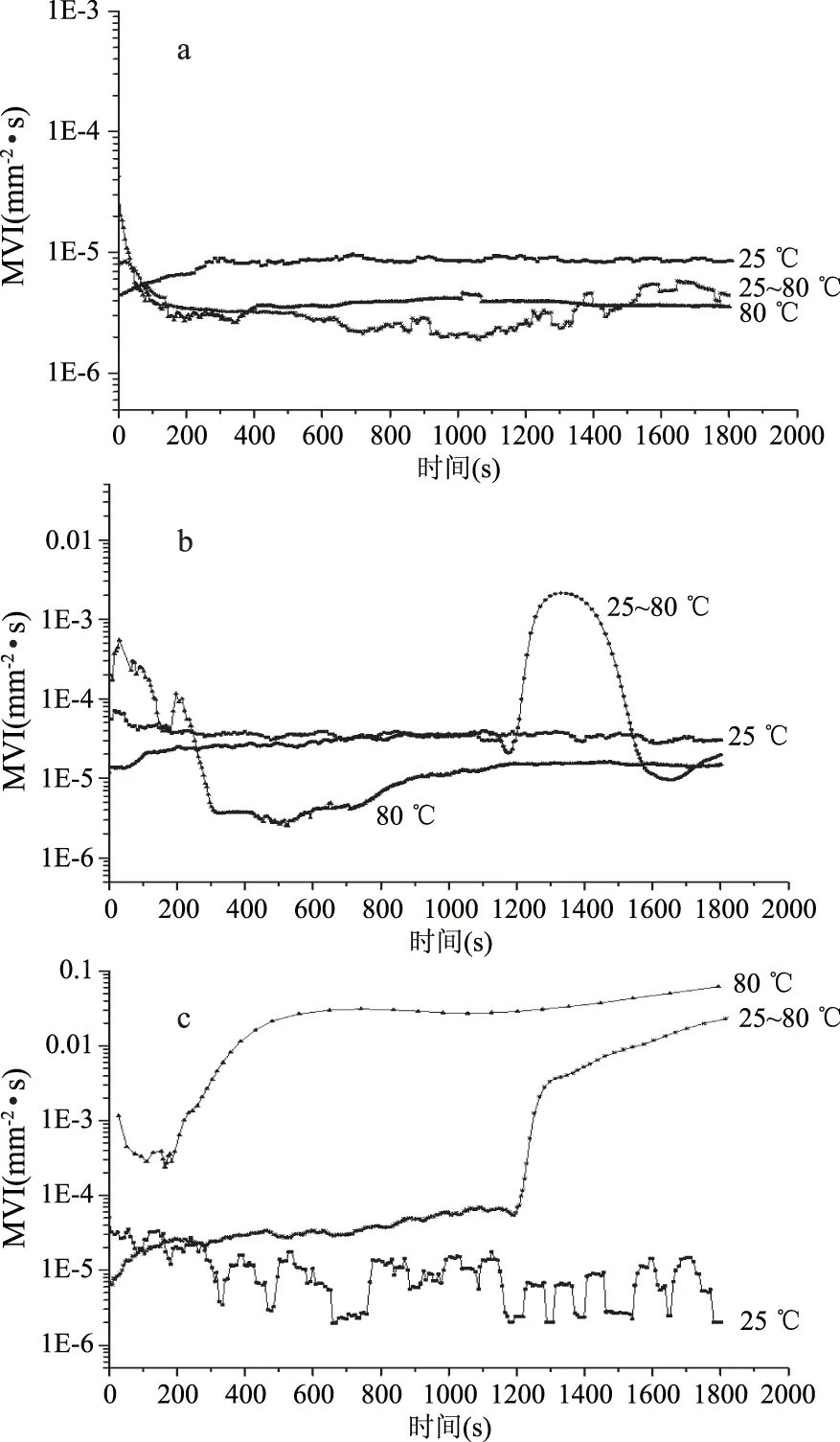
图4 不同加热方式对不同乳状液MVI的影响Fig.4 Effect of different heating methods on the MVI curves of different emulsions注:SSPS-DHA乳状液(a),LF-β-胡萝卜素乳状液∶SSPS-DHA乳状液=9∶1(b)和LF-β-胡萝卜素乳状液(c);图5、图6同。
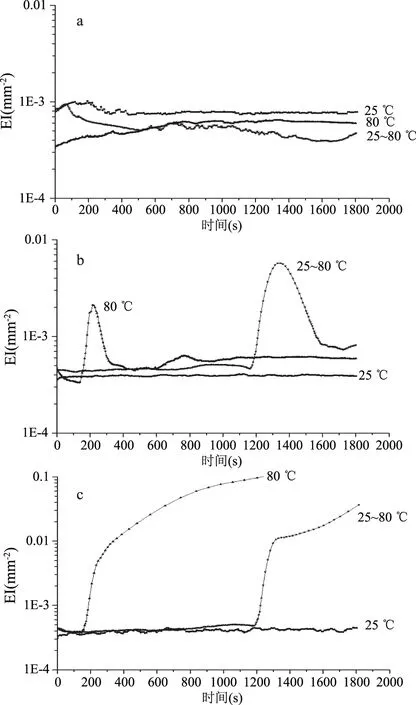
图5 不同加热方式对不同乳状液EI的影响Fig.5 Effect of different heating methods on the EI curves of different emulsions
2.3.3 LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体EI分析 不同加热方式对单一乳状液与LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体EI的影响如图5所示,SSPS-DHA乳状液(图5a)在未加热、25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min,EI变化不大,说明加热没有使SSPS-DHA乳状液弹性发生变化。
LF-β-胡萝卜素∶SSPS-DHA=9∶1微聚集体(图5b),经过25~80 ℃程序加热30 min过程中,在加热20~27 min时,EI发生明显的增加,但是随着加热时间的延长,EI逐渐降到与未加热样品的EI持平,乳状液微聚集体在模拟巴氏杀菌80 ℃加热30 min过程中,在加热3~5 min时,EI有所增加,而后与未加热样品的EI持平。EI的变化跟乳状液的结构有很大的关系,EI增大表明乳状液形成了致密的结构,而随着加热时间的延长,乳状液的EI值降低,表明乳状液致密的结构发生崩解。
LF-β-胡萝卜素乳状液(图5c)25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min与未加热的乳状液相比,EI均发生很大的变化,25~80 ℃程序加热30 min的LF-β-胡萝卜素乳状液在加热20 min左右时,EI值明显增大;模拟巴氏杀菌80 ℃加热30 min的LF-β-胡萝卜素乳状液在加热3 min左右时,EI值明显增大。表明LF-β-胡萝卜素乳状液经过25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min,乳状液的弹性明显增加,乳状液微滴结构发生明显的变化。
LF-β-胡萝卜素乳状液经过加热后,EI发生明显的变化,而LF-β-胡萝卜素-SSPS-DHA微聚集体经过加热后,EI先增大后降低到与未加热样品的EI一致,表明微聚集体样品受热过程存在可逆的结构变化,最终与未加热样品的弹性“笼”结构一致。
2.3.4 LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体FI分析 不同加热方式对LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体与单一乳状液FI的影响如图6所示,SSPS-DHA乳状液(图6a)在25~80 ℃程序加热过程中,在加热3 min开始FI开始明显增大;模拟巴氏杀菌80 ℃加热30 min的SSPS-DHA乳状液,在加热1.5 min开始FI明显增大。表明经过25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min SSPS-DHA乳状液流动性明显增加。
LF-β-胡萝卜素∶SSPS-DHA=9∶1微聚集体(图6b),经过25~80 ℃程序加热30 min过程中在加热20~27 min时,FI发生明显的降低,但是随着加热时间的延长,FI逐渐与未加热样品持平;乳状液微聚集体在模拟巴氏杀菌80 ℃加热30 min过程中,在加热3~5 min时,FI有所降低,而后与未加热样品持平。表明微聚集体在受热过程中由液体变为类固体,而后又变为液体状态,可很好地保护乳状液体系在受热过程中的质构稳定性。

图6 不同加热方式对不同乳状液FI的影响Fig.6 Effect of different heating methods on the FI curves of different emulsions
LF-β-胡萝卜素乳状液(图6c)25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min与未加热样品相比,FI均发生很大的变化,LF-β-胡萝卜素乳状液在25~80 ℃程序加热30 min过程中,加热20 min左右时,FI值发生明显的降低;模拟巴氏杀菌80 ℃加热30 min的LF-β-胡萝卜素乳状液在加热3 min时,FI值明显降低。表明LF-β-胡萝卜素乳状液经过25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min,乳状液均具有很强的固体特征,且持续加热形成类固体特征时的热效应更明显。
3 结论
研究结果表明,通过异型聚集效应,LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体经过25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min,乳状液的稳定性有所改善。微流变数据表明,LF-β-胡萝卜素乳状液经过25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min,乳状液粘度明显增大,具有很强的固体特征。LF-β-胡萝卜素/SSPS-DHA乳状液微聚集体经过25~80 ℃程序加热30 min和模拟巴氏杀菌80 ℃加热30 min由液体变为类固体,而后又变为液体状态,可很好地保护乳状液体系在受热过程中的质构稳定性,防止巴氏杀菌过程中乳状液体系的凝固,保护乳状液体系的受热稳定性。
[1]Baker E N,Baker H M. Molecular structure,binding properties and dynamics of lactoferrin[J]. Cellular and Molecular Life Sciences,2005,62(22):2531-2539.
[2]Steijns J M,Van Hooijdonk A C M. Occurrence,structure,biochemical properties and technological characteristics of lactoferrin[J]. British Journal of Nutrition,2000,84(1):11-17.
[3]Tokle T,McClements D E. Physicochemical properties of lactoferrin stabilized oil-in-water emulsions:Effects of pH,salt and heating[J]. Food Hydrocolloids,2011,25(5):976-982.
[4]Ye A,Singh H. Adsorption behaviour of lactoferrin in oil-in-water emulsions as influenced by interactions withβ-lactoglobulin[J]. Journal of Colloid and Interface Science,2006,295(1):249-254.
[5]Nakamura A,Yoshida R,Maeda H,et al. Soy soluble polysaccharide stabilization at oil-water interfaces[J]. Food Hydrocolloids,2006,20:277-283.
[6]Nakamura A,Yoshida R,Maeda H,et al. Study of the role of the carbohydrate and protein moieties of soy soluble polysaccharides in their emulsifying properties[J]. Journal of Agricultural and Food Chemistry,2004,52:5506-5512.
[7]Kiokias S,Gordon M H. Antioxidant properties of carotenoidsinvitroandinvivo[J]. Food Reviews International,2014,20:99-121.
[8]Grabowski J A,Truong V D,Daubert C R. Nutritional and rheological characterization of spray dried sweetpotato powder[J].LWT-Food Science and Technology,2008,41:206-216.
[9]Marty C,Berset C. Factors affecting the thermal degradation of all-transbeta-carotene[J]. Journal of Agricultural and Food Chemistry,1990,38:1063-1067.
[10]Ribeiro H S,Cruz R C D. Biliquid foams containing carotenoids[J]. Engineering in Life Sciences,2005,5:84-88.
[11]许朵霞. 乳清分离蛋白-甜菜果胶不同相互作用对β-胡萝卜素乳状液稳定机理及体外释放特性研究[D]. 北京:中国农业大学,2012.
[12]Henry L K,Puspitasari-NienaberN L,Jaren-Galan M,et al. Effects of ozone and oxygen on the degradation of carotenoids in an aqueous model system[J]. Journal of Agricultural and Food Chemistry,2010,48:5008-5013.
[13]Rascon M P,Beristain C I,Garcia H S,et al. Carotenoid retention and storage stability of spray-dried encapsulated paprika oleoresin using gum Arabic and soy protein isolate as wall materials[J]. LWT-Food Science and Technology,2011,44:549-557.
[14]Alamed J,McClements D E,Decker E A. Relationships between free radical scavenging and antioxidant activity in foods[J]. Food Chemistry,2009,57:2969-2976.
[15]Tanmoy K D,Santinath G,Mahua G,et al. Comparative study of gastrointestinal absorption of EPA & DHA rich fish oil from nano and conventional emulsion formulation in rats[J]. Food Research International,2012(49):72-79.
[16]Leclerc L,Zhao X,Simpson B K,et al. The effect of a-tocopherol on the oxidation of mackerel oil[J]. Food Chemistry,2007,100:800-807.
[17]Salariya A M,Rehman Z. Effect of synthetic antioxidants on storage stability of Khoa-asemi-solid concentrated milk product[J]. Food Chemistry,2006,96:122-125.
[18]毛立科.β-胡萝卜素纳米乳液的制备及其理化性质研究[D]. 北京:中国农业大学,2008.
[19]Liu F,Wang D,Sun C. Influence of polysaccharides on the physicochemical properties of lactoferrin-polyphenol conjugates coatedβ-carotene emulsions[J]. Food Hydrocolloids,2016,52:661-669.
[20]梁蓉. 以OSA变性淀粉为乳化剂的纳米乳液制备及特性研究[D]. 无锡:江南大学,2013.
[21]Bouyer E,Mekhloufi G,Le Potier I,et al. Stabilization mechanism of oil-in-water emulsions byβ-lactoglobulin and gum Arabic[J]. Journal of Colloid and Interface Science,2011,354(2):467-477.
[22]Guzey D,McClements D E. Formation,stability and properties of multilayer emulsions for application in the food industry[J]. Advances in Colloid and Interface Science,2006,128:227-248.
[23]Yang N,Hutter J L,Bruyn J R. Microrheology,microstructure and aging of physically cross-linked poly(vinyl alcohol)/poly(ethylene glycol)blends[J]. Journal of Rheology,2012,56:797-822.
[24]Dickinson E. Hydrocolloids as emulsifiers and emulsion stabilizers[J]. Food Hydrocolloids,2009,23(6):1473-1482.
[25]Mason T. Particle tracking microrheology of complex fluids[J]. Physical Review Letters,2007,79:3282-3285.
[26]Ambrosio L. Rheological study on hyaluronic acid and its derivative solutions[J]. Journal of Macromolecular Science,2009,36:991-1000.
Effectofheattreatmentonthemicrorheologicalpropertiesoflactoferrin-β-carotene/soybeanpolysaccharide-DHAemulsion
LIXin,WANGXu,LIWei-ke,XUDuo-xia*,CAOYan-ping*
(Beijing Advanced Innovation Center for Food Nutrition and Human Health,College of Food and Chemical Engineering,Beijing Engineering and Technology Research Center of Food Additives,Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients,Beijing Key Laboratory of Flavor Chemistry,Beijing Laboratory for Food Quality and Safety,Beijing Technology and Business University,Beijing 100048,China)
TS201.2
A
1002-0306(2017)18-0001-08
2017-03-20
李昕(1993-),女,硕士研究生,研究方向:食品添加剂与功能性配料,E-mail:1016903505@qq.com。
*通讯作者:许朵霞(1986-),女,博士,副教授,研究方向:食品添加剂与功能性配料,E-mail:xdxbtbu@126.com。 曹雁平(1961-),男,博士,教授,研究方向:食品化学与安全,E-mail:caoyp@btbu.edu.cn。
北京市自然科学基金三元联合资助项目(1550003);国家自然科学基金项目(31501486);十三五国家科技计划项目申报中心重点研发计划(2016YFD0400802);北京市优秀人才培养资助项目(2014000020124G032);北京市属高等学校创新团队建设与教师职业发展计划项目(IDHT20130506)。
10.13386/j.issn1002-0306.2017.18.001

