扦插环境对平欧杂种榛黄化萌条生根效果的影响
田雪邻,宋锋惠,古丽米热·卡克什,史彦江,马合木提·阿不来提,李嘉诚,张晋
(1.新疆农业大学林学与园艺学院,新疆乌鲁木齐,830052;2.新疆林业科学院经济林研究所,新疆乌鲁木齐,830000)
扦插环境对平欧杂种榛黄化萌条生根效果的影响
田雪邻1,2,宋锋惠2,古丽米热·卡克什2,史彦江2,马合木提·阿不来提2,李嘉诚1,张晋1
(1.新疆农业大学林学与园艺学院,新疆乌鲁木齐,830052;2.新疆林业科学院经济林研究所,新疆乌鲁木齐,830000)
目的研究平欧杂种榛黄化萌条扦插的适宜环境及管理方式,为简化扦插环境及田间管理提供理论依据。方法采用方差分析、相关性分析等方法,将黄化萌条置于3个环境下扦插管理,分析比较萌条抽梢生长、根系生长及根系质量等指标的差异。结果在不同环境下,扦插生长根系指标存在差异性;3个环境条件下以塑料大棚(A)叶绿素含量及根系综合指标最佳,其次为榛子示范园行间(B),长山核桃大树行间(C)最低,说明扦插管理对根系生长影响较大。B环境因光照充足,综合根系指标高于C环境,但C环境抽梢生长及生根率指标较高,证明扦插中期土壤湿度增加可促进扦插生长,且土壤肥力同样影响根系生长力;此外,黄化萌条与嫩枝扦插相比较,管理复杂度降低50%,且生根速率、生根率、根系质量等均提高。结论生产中应以A环境扦插生长为参考,扦插管理前期严格控温控湿,后期逐步加大与外界环境的接触面,大幅度降低了黄化萌条的扦插管理复杂度。
平欧杂种榛;黄化萌条;扦插环境;管理模式
0 引 言
【研究意义】平欧杂种榛(CorylusheterophyllaFisch.×CorylusavellanaL.)是平榛和欧洲榛杂交培育而成的高效栽培种,集双亲优势基因,具果大丰产出仁率高,果实口味佳,抗寒适应性强等特点[1]。其榛仁富含蛋白质、脂肪、氨基酸、维生素、微量元素等,且钙、磷、铁含量高于其他坚果[2],为世界四大干果之一,此外,部分品种被广泛作为植被恢复及荒坡绿化树种[3],木材坚硬,纹理色泽美观,具极大的经济价值和生态效益。我国作为重要的榛属资源国,在长江以北至N42°地区均可栽培,自1999年选育出平榛与欧洲榛的杂交品系(平欧杂种榛),全国多省区开展了不同规模的引种栽培区域试验,现栽培面积已超2.67×104hm2,深受广大生产者、消费者欢迎,成为农业种植结构调整的生态经济林首选树种。【前人研究进展】黄化萌条即是指萌条在生长发育过程中长时间未见光的当年生枝条,因缺乏光照而茎部泛黄且无叶片,不能合成叶绿素,故根茎端薄壁细胞含量增多[4],生根促进因子水平上升,生长素活性增大[5]。平欧杂种榛黄化萌条为绿枝压条繁苗后在锯末基质中根部萌生的弱势苗,生长发育形成半木质化黄化萌条,萌条内因内源生长素运输和外源生长素的吸收转化水平提高,生长素在基部积累较多,进而生根率较高[4,6]。【本研究切入点】相关生根试验发现,黄化萌条作为育苗扦插繁殖材料,较传统嫩枝扦插生根率提高35%[6],生根能力升高。利用平欧杂种榛的黄化萌条扦插不仅能充分利用消耗母株营养而形成的萌条资源,为生产提供品种苗木。【拟解决的关键问题】研究管理简易、低成本的平欧杂种榛黄化萌条扦插方法,采用3个不同扦插环境,统一扦插种植黄化萌条,采取全人工及半人工两种方式管理,探究最佳扦插管理方式,并分析比较不同扦插环境下插条生长的差异,筛选最优种植及管理方式,为扦插管理提供有效科学依据。
1 材料与方法
1.1 材 料
试验地位于新疆伊犁察布查尔县榛子示范基地(E:81°8′,N:43°45′),年均温10.3 ℃,年日照2 712 h,相对湿度较低,降雨量250 mm,昼夜温差大。试验设立3点扦插环境:塑料大棚(A)、榛子示范园行间(B)、长山核桃大树行间(C)。A环境为人工搭建的3.0 m高的简易塑料拱棚,面积约64 m2,拱棚覆盖1层塑料膜和2层遮阳网;B环境为竹片搭建的高1.0 m简易塑料小棚,处于榛子树行间,榛子树高1.3~1.8 m,冠幅0.7~1.2 m,光照充足;C环境与B环境搭建方式相同,于长山核桃树行间,长山核桃树高3~3.5 m冠幅1.5~2.5 m,遮荫度高于B环境,土壤湿度相对较大。
以2015年秋季统一剪取并贮藏于地下的平欧杂种榛新榛1号(84~254#)品种的半木质化黄化萌条为材料,于2016年4月12日挖出,于阴凉处剪取中段10~12 cm、粗度0.35~0.45 mm、规格一致的萌条为扦插条,3个环境分别扦插300株插穗。
1.2 方 法
1.2.1 塑料大棚(A)
2016年4月16日进行扦插,扦插基质为壤土。先用800倍高锰酸钾溶液消毒基质,然后清水冲洗2遍。以株行距10×30 cm打孔扦插,插条用100 mg/L的IBA(吲哚丁酸)生长激素中浸泡10 min,扦插深度为3~4 cm,并压实周围土壤,插后即刻浇水。
1.2.2 榛子示范园行间(B)、长山核桃大树行间(C)
2016年4月15日B、C环境同时进行扦插,扦插基质为翻耕后的大田土壤。插行内地面铺设滴灌带、覆盖黑色地膜。插条用100 mg/L的IBA(吲哚丁酸)浸泡10 min,株行距10 cm×30 cm,打孔扦插,扦插深度3~4 cm,并压实周围土壤,即刻浇水。之后以软竹片搭建宽0.6 m,长20 m的东西走向简易长型拱棚,棚上覆盖一层塑料膜和两层遮荫网,固定。
1.2.3 管理
A环境条件下:采用全人工式管理,插后每日清晨08:00正门通风10 min,控制棚温在20~30 ℃,湿度85%以上;午间棚内温度≥25 ℃时,掀开棚正门塑料膜及南北方塑料膜通风,若温度≥30 ℃时增加喷水降温;30 d后,随气温上升加大棚内通风量,掀开棚内东西方向塑料膜通风,床面喷水次数逐步改为加量减次,基质渗透深度5 cm为宜;60 d后,去除大棚上部塑料薄膜,逐步过渡至棚内湿度趋于外界空气湿度时,依次摘除遮阳网。
B、C环境条件下:采用半人工式管理,自扦插之日起,每日当棚温 ≥25 ℃时打开棚东西两端塑料膜通风,温度降低立即关闭,当棚内平均湿度小于60%滴灌(8 h);15 d后棚内温度≥30 ℃时,将棚南北两端塑料膜每隔2 m固定掀开30 cm高度通风,遮荫网保持覆盖状态;随气温上升,棚内温度>33 ℃时,在塑料棚顶部两侧,每隔2 m将塑料膜割直径20 cm的圆孔,加大棚内通风力度;55 d后去除塑料膜,60 d后摘除遮荫网。
插后60 d,插条平均展叶数量达3片以上,每隔7 d喷施(2 g/L尿素+1.5 g/L磷酸二氢钾+0.375 g/L氨基酸)叶面肥;待130 d扦条叶片自然脱落时起苗,调查插条生根效果。
1.3 数据处理
自扦插之日起,棚外及3个环境试验棚内分别挂简易的温湿度观测仪、扦插基质地表放地温表,每日08:00、14:00、20:00定时观察记录棚外常温及棚内温湿度、地温。扦插10 d起,选择10株定苗,每5 d用直尺测量插条生根及抽梢长度;插条叶片脱落时,起苗调查统计插穗的一级根系数量指标:
扦插生根率=生根插条/插条总数量;根长≥0.5 cm为生根;
生根保存率=起苗后成活苗数量/插条总株数;
直尺测量根长、游标卡尺测量根茎;
生根范围为插条生根面的最长截距;
饱满芽数量即生根成活插条上饱满芽数量;
采集3个环境0~30 cm深度的纵向土壤,梅花形采样,每环境采5个点土样,测定pH值、速效氮、速效磷、速效钾含量。
用Microsoft Office Excel 软件进行数据整理和绘图,SPSS 19.0软件进行数据统计,通过方差分析比较不同处理间的差异,并对各根系性状指标做相关分析。
2 结果与分析
2.1 不同环境中温度对根系生长的的影响
自扦插后,控制各环境遮荫度在75%~85%,湿度≥85%,温度20~30 ℃。研究表明,随时间推移,扦插后3个黄化萌条扦插环境的棚温、地温趋于一致。扦插初期,以A环境的棚温、地温最高,其次为B、C环境;6月后逐渐降低遮荫度及湿度,而3种环境的棚温、地温表现为快速接近趋势,7~8月,不同环境皆去除塑料棚膜,插穗于外界环境条件下生长,而地温高于外界1~2 ℃。图1
研究表明,扦插10~15 d出现愈伤,20~25 d开始生长;扦插初期,处于愈伤组织和生根的初期,适于根系生理活动的最适范围(20~25 ℃),此时根系吸收水分和矿质营养能力较弱,而穗条在高温环境下,不能保证植株对水分和矿质营养的需求[7]。3个环境根系长度30 d前差异不显著(P>0.05),30 d后A环境根系生长加快,B、C则保持原速率,B环境于50 d生长速率加快。结合温度分析,不同环境的温度对插穗初期生根影响较小,30 d后随温度的升高各环境插穗生长速率加快,由此说明温度变化与根生长呈正比,适宜的温度差有利于根系的生长。图2
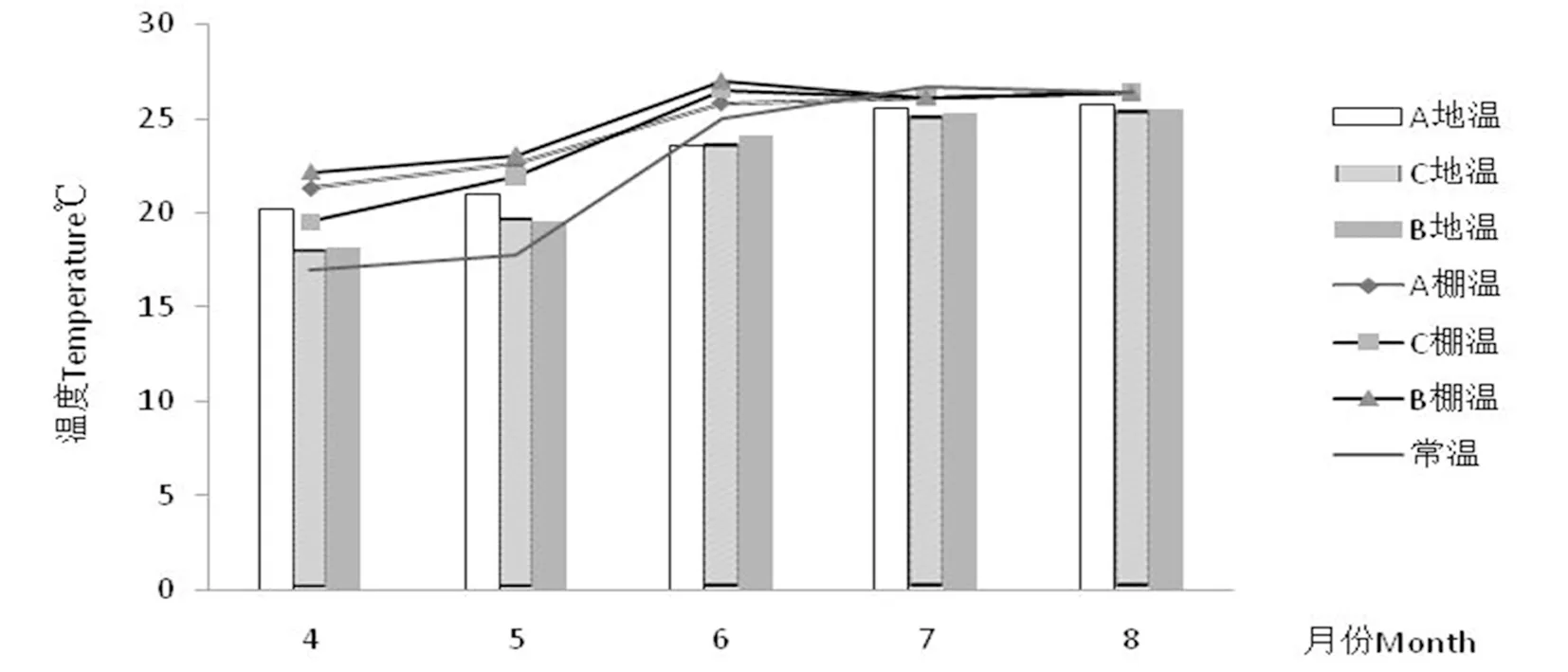
图1 3种环境温度差异
Fig.1 Analysis the three environmental temperature’s difference
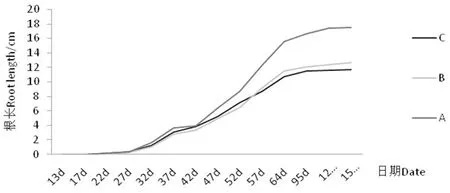
图2 3种环境根系生长动态
Fig.2 Root dynamic growth of three environments
2.2 不同种植环境对新梢生长的影响
研究表明,插后55~60 d抽梢生长,115 d停止。3个环境新梢生长量呈显著差异(P<0.05),60 d后以A环境(5.0 cm)抽梢长度最佳,70 d(5.8 cm)速率降低,而C环境梢长升至最高(6.4 cm),结合C环境可知遮荫环境下土壤湿度升高促进梢生长;至90 d,B环境生长量(5.95 cm)生长量超过A(5.9 cm),A环境在80 d后抽梢生长接近停止,可见B环境根系供养较多以致新梢生长时间较长,说明统一环境下土壤肥力同样影响根系的活力,此外,B插条后期抽梢率较大,此现象可能与该环境半人工式管理灌水频率低相关,相关研究发现,灌水力度对根系适应性存在较强相关性[8-9]。图3,表1
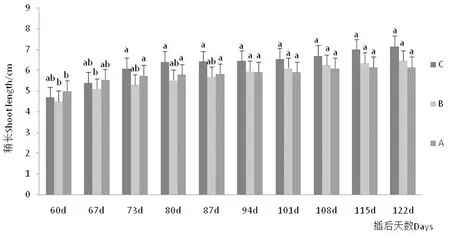
图3 3种环境新梢生长动态
Fig.3 Branch growth dynamics of the three environments
表1 3个试验地概况
Table 1 Soil specific profiles in three experimental sites

环境EnvironmentalpH土壤养分Soilnutrient(mg/kg)速效氮Availablenitrogen速效磷Availablephosphorus速效钾AvailablepotassiumA7 6773 3319 0694 00B7 9160 8319 07135 17C7 6343 3319 22105 10
2.3 不同种植环境下叶绿素含量的差异
叶绿素含量是作为监测植被生长健康状况的重要标志之一。叶绿素含量的高低是光合作用能力和植被发育阶段的指示器[10],研究表明,3种环境在60、90和120 d三个时期叶绿素含量差异达极显著水平,以A环境含量最高(32.4 mg/g),与最低含量(24.8 mg/g)差异达7.0 mg/g,6~7月外界温度(图1)及光照强度不断上升,B、C环境叶绿素含量显著增加,B环境增加达4 mg/g,A环境变化则较小,可见光照及温度的增加可促进叶绿素含量的升高,有关研究发现,温度通过影响叶片叶绿素含量而使内部碳同化酶活性降低,限制因素影响叶片光合作用[11]。7~8月,除C环境外各环境均增加2 mg/g,与该环境土壤环境结合分析,C环境土壤速效氮(43.33 mg/kg)含量最低,土壤中氮能促进蛋白质和叶绿素的形成[12],该环境土壤速效氮含量最低,故对叶绿素增长促进较小,加之遮荫环境降低了植被发育阶段增长速率。表2
2.4 不同扦插环境根系生长指标的差异
研究表明,生根数量、根长、根粗均显著(P<0.05)或极显著(P<0.01)正相关。其中,生根数量和根长、根粗的相关系数分别为0.69和0.67,根长和根粗的相关系数为0.73,三者变化趋势一致,说明根据某一指标的高低,可以在一定程度上预测另外2种指标的情况;饱满芽数是第二年插条成活率及苗木壮苗的重要指标[13],饱满芽数与各指标均表现显著正相关,可见根系的质量直接影响第二年的苗木生长,根系生根范围对于生根密度的增加起推动效果,生根范围的值增加,生根数量则显著增加,且生根粗度小幅度增加,但对根长、根部地径、饱满芽数影响则较小。可见,随生根数量增加,根系指标表现为显著提升,而各指标的增加进一步促进饱满芽数的增加,从而促进苗木第二年的长势。表3
表2 3个不同环境叶绿素含量差异
Table 2 Analysis of chlorophyll contents in three difference environments (mg/g)

环境Environmental60d90d120dA30 2±0 17a30 5±0 23a32 4±0 52aB23 2±0 12bc27 0±0 35b28 6±0 35bC24 8±0 29b25 3±0 35c25 7±0 23bc
注:不同小写字母分别表示差异显著(P<0.05)
Note: The small and capital letters represent significant difference at 0.05
表3 根系指标间相关性
Table 3 Correlation analysis of root index
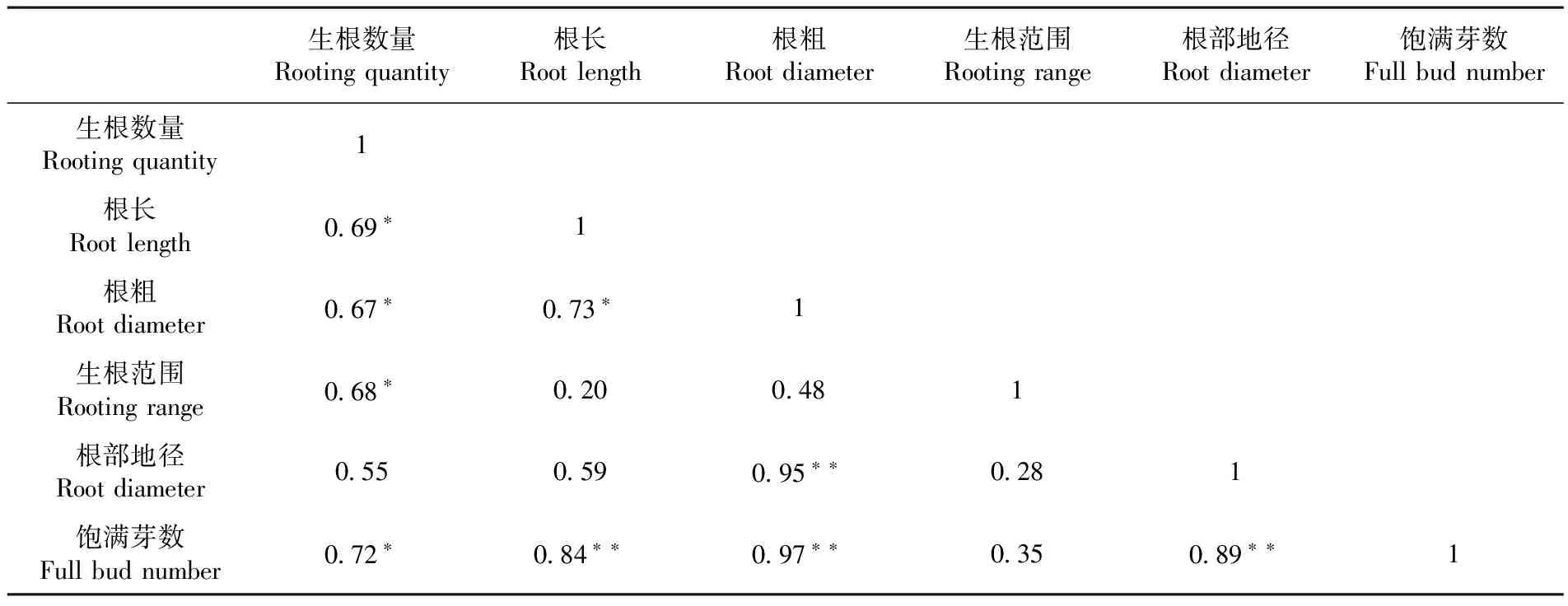
生根数量Rootingquantity根长Rootlength根粗Rootdiameter生根范围Rootingrange根部地径Rootdiameter饱满芽数Fullbudnumber生根数量Rootingquantity1根长Rootlength0 69∗1根粗Rootdiameter0 67∗0 73∗1生根范围Rootingrange0 68∗0 200 481根部地径Rootdiameter0 550 590 95∗∗0 281饱满芽数Fullbudnumber0 72∗0 84∗∗0 97∗∗0 350 89∗∗1
注:表中*表示相关性达0.05显著水平;**表示相关性达0.01显著水平
Note:*Correlation is significant at 0.05 level(2-tailed);**Correlation is significant at 0.01 level(2-tailed)
研究表明,3个不同环境间各根系指标除根部地径外其余指标存在极显著差异(P<0.05);其中,3环境生根率以A环境较高(90.86 %),半人工管理则以C环境较高(77.92 %),由此可推知控制管理湿度对生根率影响较大;生根条数、根长、根粗均以A环境最佳,分别为3.21 条、17.51 cm、1.41 mm,C环境最低,分别为2.63 条、11.61 cm、1.21 mm,从环境角度分析,前期的温湿度管理对根系质量影响较大,气温通过地温间接地影响植物的生长发育特性,而后期若土壤湿度较大会抑制根系生长。不同环境指标仅根部地径差异不显著,可见不同环境插条根部粗度变化量较小;饱满芽数作为根系繁殖力的重要指标,不仅能增强枝力,在根系生长中产生激素促进根的生长[14-15],3环境以A环境饱满芽数最适宜(2.77 个),且与根系各指标呈正相关,其最大值高达其余环境的2倍,A环境根系繁殖力显著高于其他环境,其次为B环境,但其成活率较低,说明提高成活率仍然需要高度控温控湿;C环境各项指标均较低,该环境因具一定遮荫,温度均值低于其他环境,而扦插后期根系的发展需要充足光照,地温则直接影响植物的根部,从而影响到整个植株的生长发育,与B环境产生差异原因可能是光照。表4
表4 3环境根系生长指标的差异性分析
Table 4 Analysis of the growth index difference of the three environments

环境Environ-mental生根率Rootingpercentage(%)生根数量Rootingquantity(条)根长Rootlength(cm)根粗Rootdiameter(mm)生根范围Rootingrange(cm)根部地径Rootdiameter(mm)饱满芽数Fullbudnumber(个)A90 86±0 63a3 21±0 13a17 51±0 53a1 41±0 04a1 59±0 03b4 75±0 11a2 77±0 2aB77 39±0 27b2 97±0 15ab12 70±0 31b1 31±0 04ab1 86±0 08a4 52±0 11ab1 88±0 14bC76 92±0 22bc2 63±0 05b11 66±0 78b1 21±0 02ab1 31±0 07c4 43±0 03ab1 36±0 04c
注:不同小写字母分别表示差异显著(P<0.05)
Note: The small and capital letters represent significant difference at 0.05
3 讨 论
与该品种嫩枝扦插相比较,平欧杂种榛黄化萌条扦插生根速率、生根率、根系质量均较高,嫩枝扦插因留有叶片,管理前期叶片表面须保持一层水膜,喷水力度大频率高,即使生根后叶面水分须保持有1/3,此外管理期间温度低生根慢,温度太高致叶片失水脱落,死亡率增加,管理复杂度较高,而黄化萌条扦插管理湿度仅控制在85 %以上,温度25 ℃左右即可,管理复杂度直线降低[6]。
黄化萌条统一规格扦插于A、B、C环境,抽梢生长、叶绿素含量、生根率、根系指标等呈显著差异。相关研究发现,不同土壤湿度对根系生长速度的影响非常显著[16]。一定范围内,根系生长与土壤水分状况呈正相关[17],且侧根发生部位受不同深度土壤含水量的影响[18-19],但水分量过高时,根系活力反而下降,进而影响根系生长,3环境以B环境具遮荫土壤湿度较高,新梢生长及生根率指标偏高,但因树下插条的吸光度降低,致其叶绿素含量及根系生长评价指标降低,光照对扦插尤为重要,但扦插中期增加土壤湿度可促进生根及梢生长。
对3环境根系比较发现,3环境以塑料大棚(A)环境条件下根系综合指标最佳,其次为B环境,C环境最低,由此说明扦插管理模式对根系生长影响较大,此结论与之前多数扦插生根管理结论一致[20-21]。A环境因全程人工控温控湿,环境条件为萌条扦插最适值,生根率及成活率达其余两环境1/3倍;B环境与C环境管理方式相同,但B环境因光照充足,综合根系指标高于C环境;相关研究发现,当环境日均温小于18 ℃时不适插条生根,日均温最利于根系生长,故温度过低或过高均不利生长。
4 结 论
4.1 黄化萌条扦插与传统嫩枝扦插生根(30 d)相比,很大程度上降低了管理复杂度。该萌条生根条件前期要求较高,温湿度过低或过高则影响其生长,且土壤养分同为重要影响因子。
4.2 3个环境以A环境下严格人工调控光强、空气湿度、温度等因素插条的根系生长最快,生根效果最佳。
4.3 生产实践中应以A环境为参照,插后0~55 d于塑料大棚环境条件下,人工管理控温控湿,55~60 d后仅控制土壤湿度,逐步通风透光,增加光照面积,转移至外界环境,减少人工管理时间,由此可大幅度降低平欧杂种榛黄化萌条扦插的管理成本,实现黄化萌条的合理利用。
References)
[1] 赵娣. 我国东北野生榛子种质资源调查及选优[D]. 北京: 北京林业大学硕士学位论文, 2013.
ZHAO Di. (2013).InvestigationandselectionofwildhazelnutgermplasmresourcesinNortheastChina[D]. Master Thesis. Beijing Forestry University, Beijing. (in Chinese)
[2] 赵明慧, 姜子涛, 刘韬, 等. 平榛叶中黄酮类化合物成分的研究[J]. 现代食品科技, 2014, 30(12): 235-240.
ZHAO Ming-hui, JIANG Zi-tao, LIU Tao, et al. (2014). A study on flavonoids from leavrs of Corylus heterophylla Fish.[J].ModernFoodScienceandTechnology, 30(12):235-240. (in Chinese)
[3] 王艳梅, 马天晓, 翟明普. 榛子遗传改良研究进展[J]. 经济林研究, 2007, 25(1): 70-74.
WANG Yan-mei, MA Tian-xiao, ZHAI Ming-pu. (2007). Research progress on genetic improvement of hazelnut [J].ForestResearch, 25(1):70-74. (in Chinese)
[4] 孙文全. 黄化作用与插条生根[J]. 植物生理学通讯, 1990,(4): 77-80.
SUN Wen-quan. (1990). Yellowing and rooting of cuttings [J].PlantPhysiologyNewsletter, (4):77-80. (in Chinese)
[5] Muir RM,Zhu L. (1983).Physiolplant[M]. (57): 407.
[6] 董宁光, 齐建勋, 陈永浩, 等. 沙藏埋枝处理对促进平欧杂种榛绿枝扦插生根的机制分析[J]. 果树学报, 2016, 33(12): 1 510-1 516.
DONG Ning-guang, QI Jian-xun, CHEN Yong-hao, et al. (2016). Physiological and biochemical basis of hazelnut rhizogenesis promoted by embedded stock etiolation [J].JournalofFruitScience, 33(12):1,510-1,516. (in Chinese)
[7] 朱瑞宏, 丁永川, 郭琪玖. 日光温室冬茬黄瓜冷冻害及其防治[J]. 中国蔬莱, 2000,(1): 42-43.
ZHU Rui-hong, DING Yong-chuan, GUO Qi-jiu. (2000). Prevention and control the Cold damage of Winter Cucumber in solar greenhouse [J].Chinesevegetable.(1): 42-43. (in Chinese)
[8] 杨小林, 张希明, 李义玲, 等. 塔克拉玛干沙漠腹地几种植物根系分形特征[J]. 干旱地理, 2009, 32(2): 249-254.
YANG Xiao-lin, ZHANG Xi-Ming, LI Yi-ling, et al. (2009). Root fractal characteristics at the hinterland of Taklimakan Desert [J].AridLandGeography, 32(2): 249-254. (in Chinese)
[9] 杨传杰, 罗毅, 孙林, 等. 水分胁迫对覆膜滴灌棉花根系活力和叶片生理的影响[J]. 干旱区研究, 2012, 29(5): 802-810.
YANG Chuan-jie, LUO Yi, SUN Lin, et al. (2012). Effect of water stress on root vigor and leaf physiology of cotton under mulch drip irrigation [J].AridRegionStudies, 29(5): 802-810. (in Chinese)
[10] Minohac L. ChlorophyⅡ SPAD-502 Instruction Manual [A]. Tokyo: Radiometric Instruments Operations, 1989:17.
[11] 冯玉龙, 姜淑梅. 根系温度对甜椒生理特征的影响[J]. 植物生理学通讯, 2000, 36(4): 308-311.
FENG Yu-long, JIANG Shu-mei.(2000)Effects of root temperature on physiological characteristics of sweet pepper [J].PlantPhysiologyNewsletter, 36(4): 308-311. (in Chinese)
[12] 戴静, 康宇. 氮磷钾配施对玉米主要性状和产量的影响及其施肥规律[J]. 山西农业科学, 2007, 35(10): 62-64.
DAI Jing, KANG Yu. (2007). Influence of matching phosphate fertilizer with potash fertilizer on corns main property and output [J].JournalofShanxiAgriculturalSciences, 35(10): 62-64. (in Chinese)
[13] 郭俊杰, 李红玉.核桃芽接育苗技术[J]. 河南林业科技, 2007, 27(1): 51-52.
GUO Jun-jie, LI Hong-yu. (2007). Walnut budding seedling technology [J].JournalofHenanForestryScienceandTechnology, 27(1): 51-52. (in Chinese)
[14] 樊庆忠. 树形改造对红富士苹果生长和结果的影响[D]. 泰安: 山东农业大学硕士论文, 2005.
FAN Qing-zhong. (2005).Effectsoftreeremodelingongrowthandoutcomeofredfujiapple[D]. Master Thesis. Shandong Agricultural University, Tai'an. (in Chinese)
[15] 何志祥. 油茶树体调控模式与技术的研究[D]. 长沙: 中南林业科技大学硕士学位论文, 2013.
HE Zhi-xiang. (2013). Study on the regulation model and technology ofCamelliaoleifera[D]. Master Thesis. Central South University of Forestry and Technology, Changsha.
[16] 胡晓棠, 陈虎, 王静, 等.不同土壤湿度对膜下滴灌棉花根系生长和分布的影响[J]. 中国农业科学, 2009, 42(5): 1 682-1 689.
HU Xiao-tang, CHEN Hu, WANG Jing, et al. (2009). Effects of soil water content on cotton root growth and distribution under mulched drip irrigation [J].ScientiaAgriculturaSinica, 42(5): 1,682-1,689. (in Chinese)
[17] Turner, N. C., & Begg, J. E. (1981). Plant-water relations and adaptation to stress.Plant&Soil, 58(1-3): 97-131.
[18] Taylor, H. M., & Klepper, B. (1974). Water relations of cotton. i. root growth and water use as related to top growth and soil water content.AgronomyJournal, 66(4):584-588.
[19] 胡守林, 郑德明, 邓成贵, 等. 不同耕作方式棉花根系发育能力的研究[J]. 水土保持研究, 2006, 13(6): 115-119.
HU Shou-lin , ZHENG De-ming, DENG Cheng-gui, et al. (2006). Study on root system development ability of cotton with different cultivation way [J].ResearchofSoilandWaterConservation, 13(6): 115-119. (in Chinese)
[20] 张永清. 谷类作物根系生长与调控研究[M]. 北京:中国农业科学技术出版社, 2006.
ZHANG Yong-qing. (2006).Studyonrootsystemgrowthandregulationincerealcrops[M]. Beijing: China Agricultural Science and Technology Press. (in Chinese).
[21] 王育梅. 榛子绿枝扦插繁殖技术[J]. 中国林副特产, 2013, 123(2): 49-50.
WANG Yu-mei. (2013). Hazel Twig Cutting Propagation Technology [J].ChineseForestProducts, 123(2): 49-50. (in Chinese)
Abstract:【Objective】 To study etiolation coppice shoot cutting sui
Table environment and management ofCorylusheterophyllaFisch ×CorylusavellanaL. in the hope of providing theoretical basis for simplifying cutting environment and field management.【Method】In this study, variance analysis and correlation analysis were used to analyze the differences among the indexes such as shoot growth, root growth and root quality of the seedlings under 3 environments.【Result】There were differences in growth and root indexes in different environments; Under 3 environmental conditions, chlorophyll content and root system index were best in plastic greenhouse (A), followed by hazelnut demonstration garden (B), and pecan trees between rows (C) were lowest, which showed that cutting management mode had a great effect on root growth. Because of the sufficient illumination of B environment, the comprehensive root index was higher than that of C, but C environment had higher rooting rate and faster branch growth. This could be seen that the increase of soil moisture could promote the growth of cuttings in the medium stage soil moisture; in addition to that, soil fertility could also affect root growth. Furthermore, compared softwood cuttings with etiolation coppice shoot management complexity reduced 50%, and the root growth rate, rooting rate and root quality were improved.【Conclusion】The results preliminary responded to the importance of etiolation coppice shoot cutting environment and management model. In view of the future production work, we should take the whole artificial arch shed (A) as reference, strictly control the temperature and humidity in the early stages, and gradually increase the contact surface with the external environment, greatly reduce the management complexity of a yellow bud for the future cutting work in the late stage.
Keywords:CorylusheterophyllaFisch. ×CorylusavellanaL.; etiolation coppice shoot; cutting environment; management mode
EffectsofEtiolationCoppiceShootCuttingEnvironmentonRootingofCorylusheterophyllaFisch. ×CorylusavellanaL.
TIAN Xue-lin1,2, SONG Feng-hui2, Gulimire Kakeshi2, SHI Yan-jiang2,Mahemuti Abulaiti2,LI Jia-cheng1, ZHANG Jin1
(1.CollegeofForestryandHorticulture,XinjiangAgriculturalUniversity,Urumqi830052,China;2.XinjiangAcademyofForestryEconomicForestResearchInstitute,Urumqi830000,China)
10.6048/j.issn.1001-4330.2017.09.009
S664.4
A
1001-4330(2017)09-1636-08
2017-06-23
2015年中央财政林业科技推广项目“平欧杂种榛优良品种高效栽培示范推广”
田雪邻(1991-),女,新疆奎屯人,硕士研究生,研究方向为经济林栽培,(E-mail)1002756818qq.com
史彦江(1961-),男,山西人,研究员,研究方向为林木遗传育种,(E-mail) syj504@126.com
Supported by: The Central Government Forestry Science and Technology Extension Project of 2015 "Efficient Cultivation and Demonstration ofCorylusHeterophyllaFisch. ×CorylusAvellanaL Varieties in Flat Europe"
Corresponding author: Shi Yan-jiang (1961-), male, Shanxi, researcher, research field: forest heritage breeding. (E-mail)syj504@126.com

