超级电容器混合型电解液(EMIES+LiClO4)的热力学和电化学性质
张庆国,兰亚林,张鑫源,王 兵,张学磊
超级电容器混合型电解液(EMIES+LiClO4)的热力学和电化学性质
张庆国1,2,兰亚林2,张鑫源1,王 兵2,张学磊2
(1. 渤海大学 新能源学院,辽宁 锦州 121000;2. 渤海大学 化学化工学院,辽宁 锦州 121000)
介绍了一种新型离子液体混合电解质(液),由离子液体1-乙基-3-甲基咪唑硫酸乙酯盐(EMIES)与高氯酸锂盐按照不同配比混合制备而成。测定了这种新型混合电解质(EMIES+LiClO4)的一系列热力学性质,如:电导率、密度、表面张力等,发现其黏度和电导率随温度的变化呈相反趋势。锂盐的加入带来了混合电解液电导率的非线性变化,而当其中高氯酸盐的摩尔比为0.05时,电解液具有最佳电导率和黏度。进而,用此浓度的混合电解液与活性炭电极组装成超级电容器,采用交流阻抗、恒流充放电及循环伏安等测试手段对其性能进行测试与研究。结果表明:这种离子液体混合电解液电化学窗口达到5.1 V,单电极比电容为458.65 F·cm–3,充放电测试1000次以后,比电容只下降了1.9 %。表明该混合电解液具有良好的电容特性、可逆性及循环特性,具备成为高性能超级电容器电解液的应用潜力。
离子液体;混合电解质;物化性质;超级电容器;循环伏安;EMIES;高氧酸锂盐
超级电容器作为新兴的一类“绿色”高性能储能器件在近十几年的发展中逐渐成熟,然而,如何大幅提高超级电容器的能量密度一直是超级电容器研究的重点和难点[1]。影响超级电容器储能性能的因素为电极材料和电解液。其中,电解液主要分为三种:有机电解液,水系电解液以及离子液体类电解液。其中水系电解液的电化学窗口窄(≤1 V)、能量密度低;有机电解液虽然窗口较大(2.5~3 V),但在长时间和大电流使用的条件下会出现挥发、可燃等问题[2]。
离子液体是具有低熔点的有机熔融盐,由于其良好的溶解性、较高的离子导电性等优势,目前成为传统电解液的理想替代品之一。据报道,纯离子液体的电化学窗口可高达6 V左右[3],而且其具有的功能设计性,使其作为电解液的适用范围大大拓宽。
本文选用具有良好耐氧化、耐热以及电导性质的高氯酸锂盐(LiClO4)[4]作为混合电解液电解质,并且选择了溶解性能好、黏度适宜、电化学性质稳定的离子液体EMIES作为溶剂和支撑电解质[5]。将LiClO4和离子液体按照摩尔比0.01:1,0.02:1,0.03:1,0.04:1,0.05:1,0.06:1,0.07:1,0.08:1,0.09:1,0.1:1十种配比进行混合,得到新型EMIES+LiClO4混合型电解质(液)。通常,热力学性质是评估一种电解质(液)性能优劣的重要一环。所以,首先对混合电解液的热力学性质进行了研究,探讨了性质随温度、组成的变化关系,并以活性炭作为电极,组装成超级电容器,测试了混合电解液的电化学性能。对超级电容器进行评价时,文献中主要是以比电容、电化学窗口以及循环性能为主[6],本文通过对这些参数的对比和讨论,说明了这类环境友好的新型电解质(液)在超级电容器中应用所体现出的一定优势,也为高性能电解质的选择和开发提供了新的参考。
1 实验
1.1 离子液体的合成与表征
取一定量的N-甲基咪唑(纯度99 %,北京华威锐科化工研究所)和甲苯(分析纯,天津光复精细化工研究所)于三口瓶中混合,将硫酸二乙酯(分析纯,天津光复精细化工研究所)逐滴加入到等物质的量的N-甲基咪唑的甲苯溶液中,在冰水浴、氮气保护下,控制反应温度不超过313 K。伴随离子液体的生成,反应液很快由澄清变成浑浊,随后分为两层,静置后,取下层离子液体用甲苯洗涤三次,使用旋转蒸发仪减压蒸馏30 min[7]。最后,纯化后的产物经真空干燥,用卡尔费休水分仪ET08测定水分小于0.01%,置于保干器中备用,离子液体的结构采用美国安捷伦公司Scimitar 2000傅里叶红外光谱和日本株式会社JNM-ECA 300核磁光谱仪进行表征。合成路线如图1所示。
1.2 混合电解液的配制
对高氯酸锂盐(纯度99.9 %,阿拉丁)进行干燥,按照LiClO4与离子液体的摩尔比0.01:1,0.02:1,0.03:1,0.04:1,0.05:1,0.06:1,0.07:1,0.08:1,0.09:1,0.1:1(分别为2=0.01,0.02,0.03,0.04,0.05,0.06,0.07,0.08,0.09,0.10)进行混合,室温搅拌24 h,以上操作均在手套箱中干燥的氮气气氛下进行。将制得的混合电解液(EMIES+LiClO4)放入真空干燥箱中进行干燥除水,水分的测定采用卡尔费休水分仪(ET08)测试,得到水分值小于0.05%,密封备用。混合后的电解液稳定性良好,静置100 d后,10个混合体系均呈现均一稳定的透明液体状态,如图2所示。

图2 静置100 d后的混合电解液体系
1.3 离子液体及混合电解液的热力学性质测定
密度的测定采用梅特勒-托利多DM45型密度计,在288.15~353.15 K范围内,每隔5 K进行测量;采用梅特勒-托利多SG3型电导率仪以及适配电极InLabR738测量电导率,控温采用上海比朗有限公司生产的低温恒温循环器,温度范围[(288.15~ 353.15)±0.02] K;黏度的测量采用Anton Paar Lovis 2000M型黏度计。
1.4 超级电容器的组装和电化学测试
以质量相同的两个活性炭电极片分别作为电池的正负极,选用HO12U5-OCS型号的聚丙烯微孔膜作为隔膜纸,纽扣电池外壳选用2032型,按照正极极片、电解液、隔膜纸、负极极片、垫片、弹簧片的装配顺序在氮气手套箱中进行电池组装,组装好之后用扣式液压封口机封口,得到纽扣式超级电容器。各部件如图3所示。所有的电化学测试均在上海辰华660E工作站上进行。

图3 扣式超级电容器的组成部件
2 结果与讨论
2.1 离子液体的表征
经一步法合成的1-乙基-3-甲基咪唑硫酸乙酯离子液体(EMIES)用红外光谱测定结构[8],如图4所示,具体数值参看表1。图5表示核磁氢谱的检测,采用内标法,选用四甲基硅烷为参考,得到纯离子液体的H化学位移值总结于表2,与之前的文献结果一致[9]。
2.2 离子液体及混合型电解液的热力学性质
纯离子液体EMIES和混合电解液(EMIES+LiClO4)在室温下均呈现无色透明液态,测量后,由图6(b)可知,随着温度的升高,密度和黏度呈下降趋势,而电导率(图7)则随温度的升高而上升。由图6(a)得到组分与密度之间的关系,当温度为298.15 K时,随着锂盐组分增加,混合体系的密度增大,这应该是由于锂盐的加入增大了此混合体系中的离子浓度,使得单位体积内的粒子数目增加所致。从图6(b)中可以得到体系密度与温度的变化关系,温度增大导致密度减小,一般说来,这是由于温度的升高增加了分子的运动性,即增加了迁移离子和数目并提高了离子迁移速率,从而引起密度下降。

图4 纯EMIES的红外谱图
表1 纯离子液体EMIES的红外数据统计表
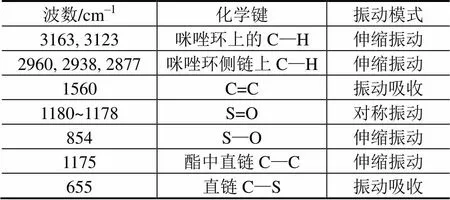
Tab.1 Infrared statistics of pure ionic liquids EMIES
表2 纯离子液体EMIES的核磁数据统计表
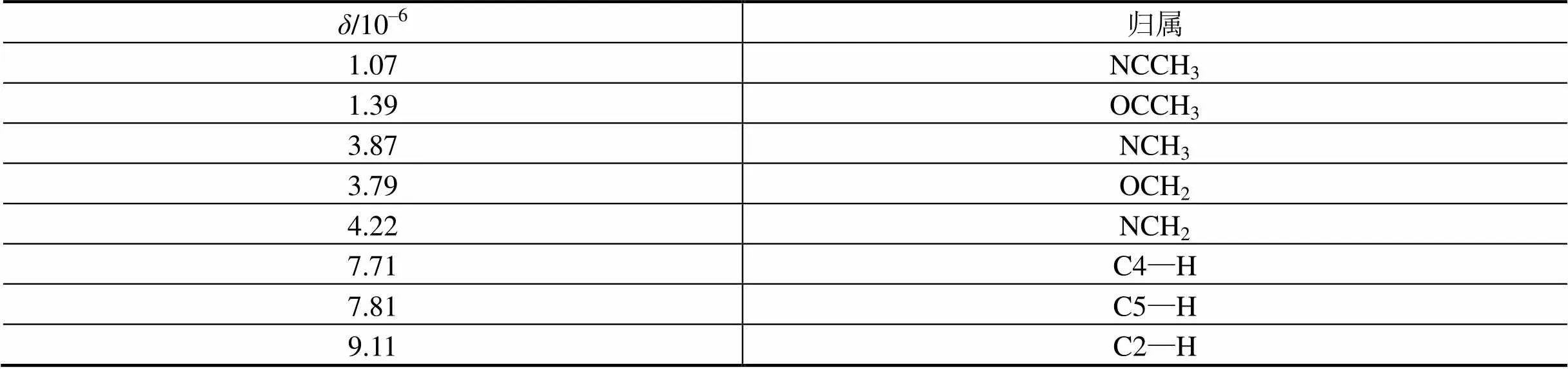
Tab.21HNMR statistics of pure ionic liquids EMIES

图6 (a)298.15 K下,离子液体混合电解质体系(EMIES+LiClO4)密度随组成的变化趋势;(b)固定组成,不同温度下的离子液体混合电解质体系(EMIES+LiClO4)的密度变化趋势
图7和图8分别表示了电导率的两种变化情况。首先,由图7可知温度与电导率之间的关系,随着温度的升高,离子液体和混合体系的电导率呈现上升趋势,这是由于咪唑阳离子是一个平面结构,在共轭效应下,电荷在整个咪唑环上分布均匀,使得周围的阴离子与阳离子的库仑作用较低,进而增高了离子解离度,传导质子的能力加强,最终导致离子液体的黏度降低,离子的运动速度加快,电导率随之增大[10]。然而,图8中表示组分、黏度和电导率之间的关系,在2=0.05时,混合体系的电导率达到最大值(电导率达到8.3×10–3S·cm–1,相同温度下,纯离子液体电导率为6.7×10–3S·cm–1),这是由于体系内添加了电解质盐,就会在一定程度上提高体系的电导率,然而,随着体系内盐浓度的进一步加大,阴阳离子的数目增多,黏度增大,氢键等相互作用加强,限制了离子的迁移速率,从而导致电导率的降低。

图7 离子液体混合电解质体系(EMIES+LiClO4)电导率随温度的变化关系
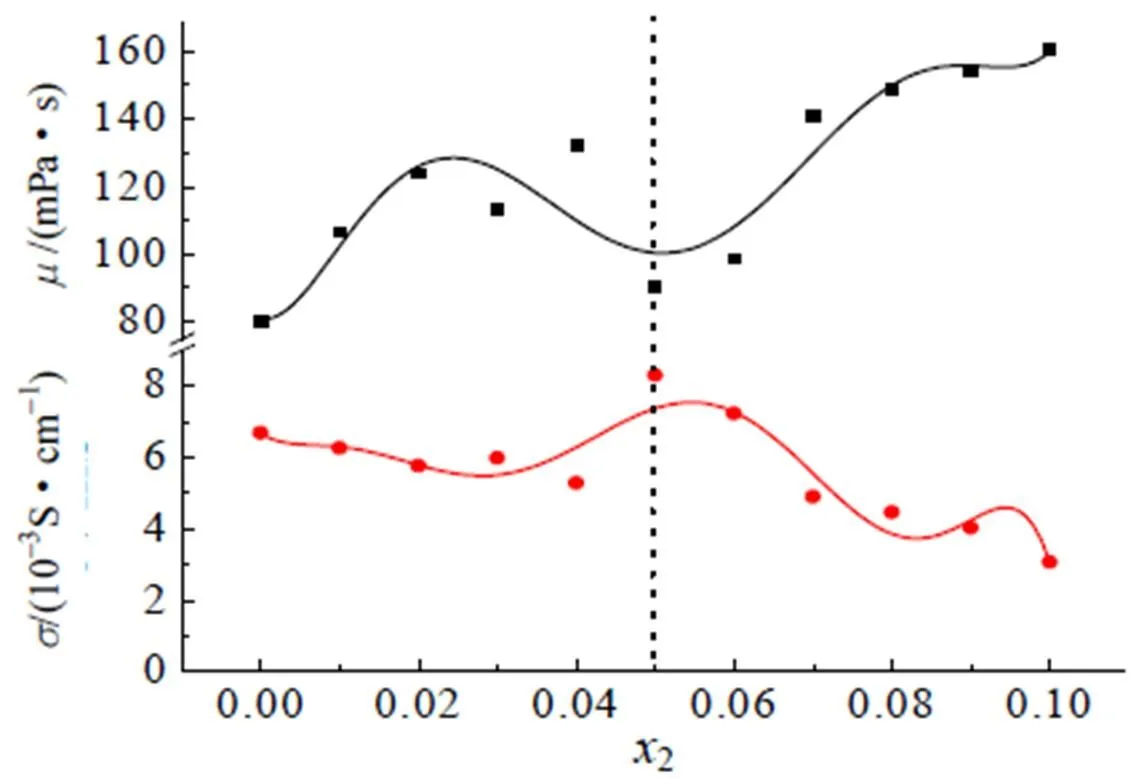
图8 在298.15 K下,离子液体混合电解质体系(EMIES+LiClO4)电导率和黏度随组分的变化关系
黏度与温度之间的关系如图9所示,由图可得,温度的升高导致黏度的降低。电导率的大小主要受锂盐浓度和混合电解液体系的黏度影响,这两个因素的影响下,电导率的大小通常会在锂盐组分的增加过程中出现极值,正如图8中虚线所示,当温度为298.15 K,2=0.05时,混合电解液体现为黏度最小(= 90.3 mPa·s),电导率最大(= 8.3×10–3S·cm–1)。Kazutaka等[11]在实验中获得在电解液浓度为0.778 mol/L时,电导率达最大值6.4×10–3S·cm–1,与本文的变化趋势很类似。
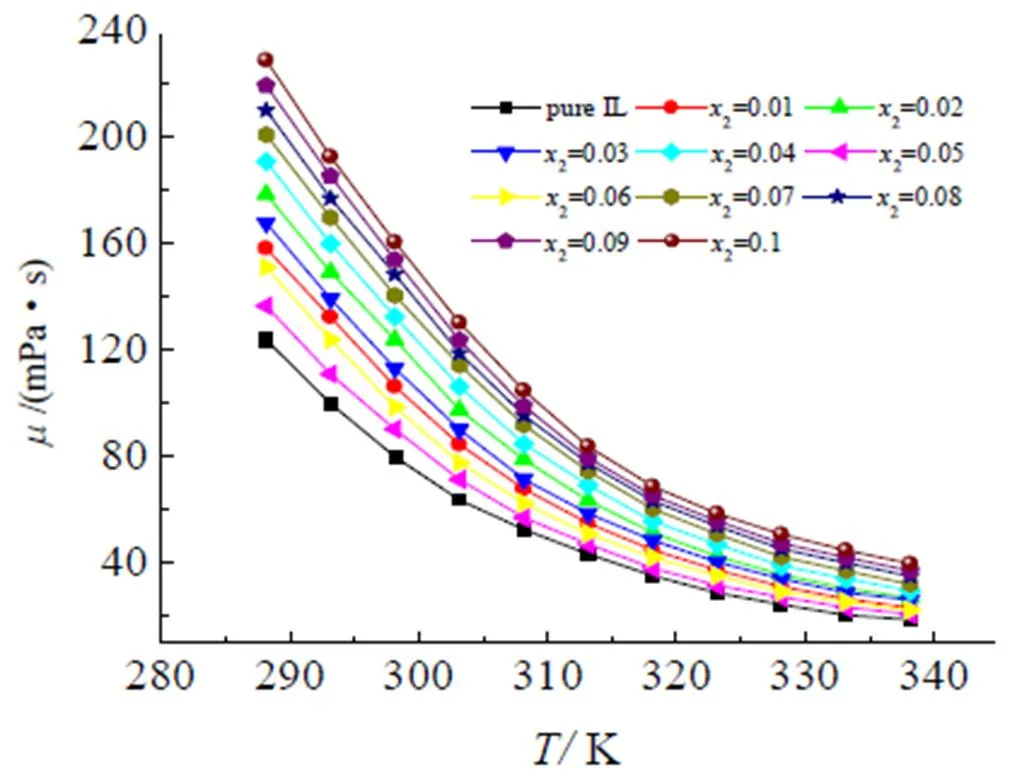
图9 离子液体混合电解质体系(EMIES+LiClO4)黏度随温度的变化
2.3 电化学性质测试
2.3.1 循环伏安测试
由以前的[BMIM][CF3COO]与[(C4H8)2N][BF4]混合体系的性质研究得到[12-13],浓度为2.06 mol/L的体系,电导率最大,电化学性能也最优,从而得到具有最优电导性质的组分,一般说来,电化学性质也最好[14],因此,选取电导率最优的配比(2=0.05)进行电容器的组装并进行电化学性质的测定,常温下,采用上海辰华660E电化学工作站,在扫速为20 mV/s,对组装的电容器进行电化学测试。图10(a)为纯离子液体的窗口,(b)为2=0.05时,混合电解液的电化学窗口,从图中发现,无论是纯离子液体还是混合电解液的CV曲线均没有明显的氧化还原峰,这说明在此电压范围内,电解液无法拉第过程发生,相对稳定。然而在图10(b)中,锂盐的加入使曲线呈现了类似矩形的超级电容特征,更重要的是,混合电解液的窗口将近5.1 V,明显大于纯组分的4.1 V,这充分说明混合电解液具有很好的稳定性和电化学特性。
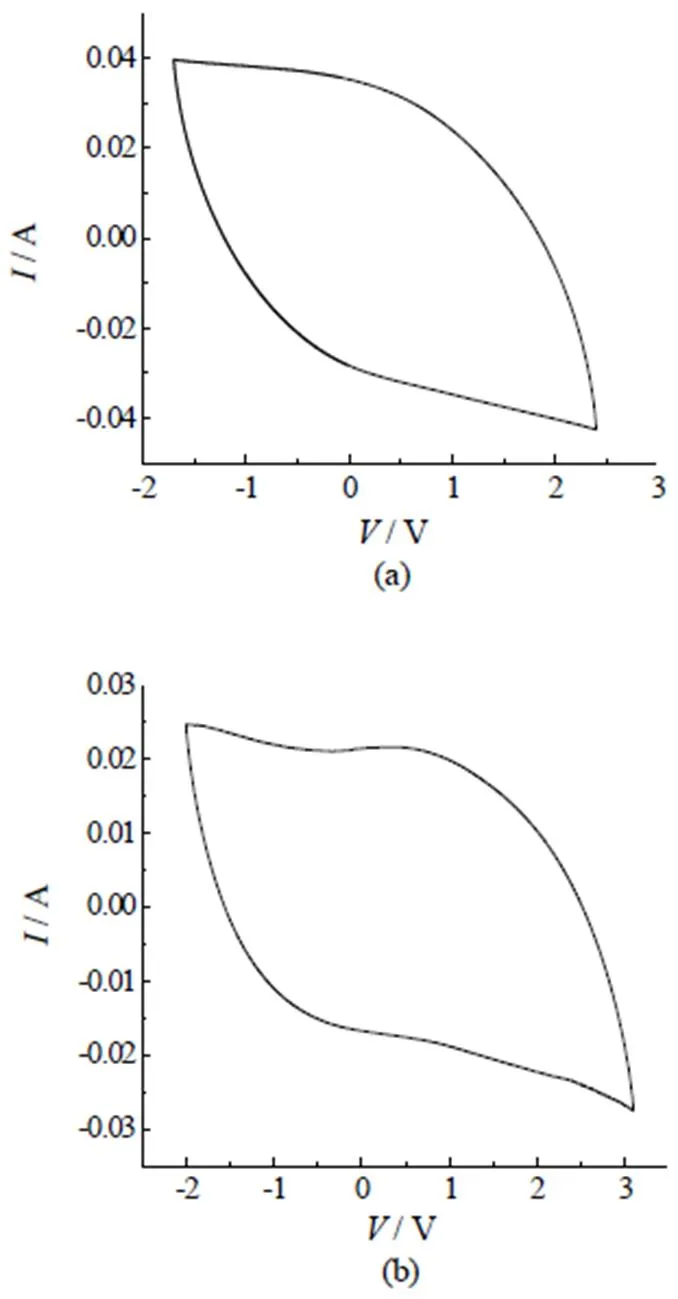
图10 (a)纯离子液体EMIES循环伏安图;(b)混合电解液(EMIES+LiClO4)(x2=0.05)循环伏安图,扫速: 20 mV/s
2.3.2 交流阻抗测试
阻抗测试在室温下进行,扫描频率为200 kHz~50 MHz,振幅为10 mV。图11为混合电解液(2=0.05)的交流阻抗图,混合电解液的电阻为图中高频区阻抗环起点与实轴交点值,体系的法拉第阻抗为阻抗环半径大小[15],产生的法拉第电流的阻抗值大小与阻抗环半径大小成正比,半径越小、阻抗值越小,代表电荷穿过电极和电解液的过程越容易。中频区的直线斜率接近于1,与高频区的圆弧形成了一种典型的电容器特征。由图可知,2=0.05时,混合电解液的内阻为0.58 Ω,明显低于常用的超级电容器离子液体电解液([Bmim][BF4]内阻为1.05 Ω,[Bmim][PF6]内阻为1.43 Ω,以三氟乙酸离子液体和四氟硼酸四乙基铵作为超级电容器的电解液,内阻为0.96 Ω[11]),这说明[EMIES]与高氯酸锂盐摩尔比为1:0.05制成的超级电容器电解液有较好的电容特性。
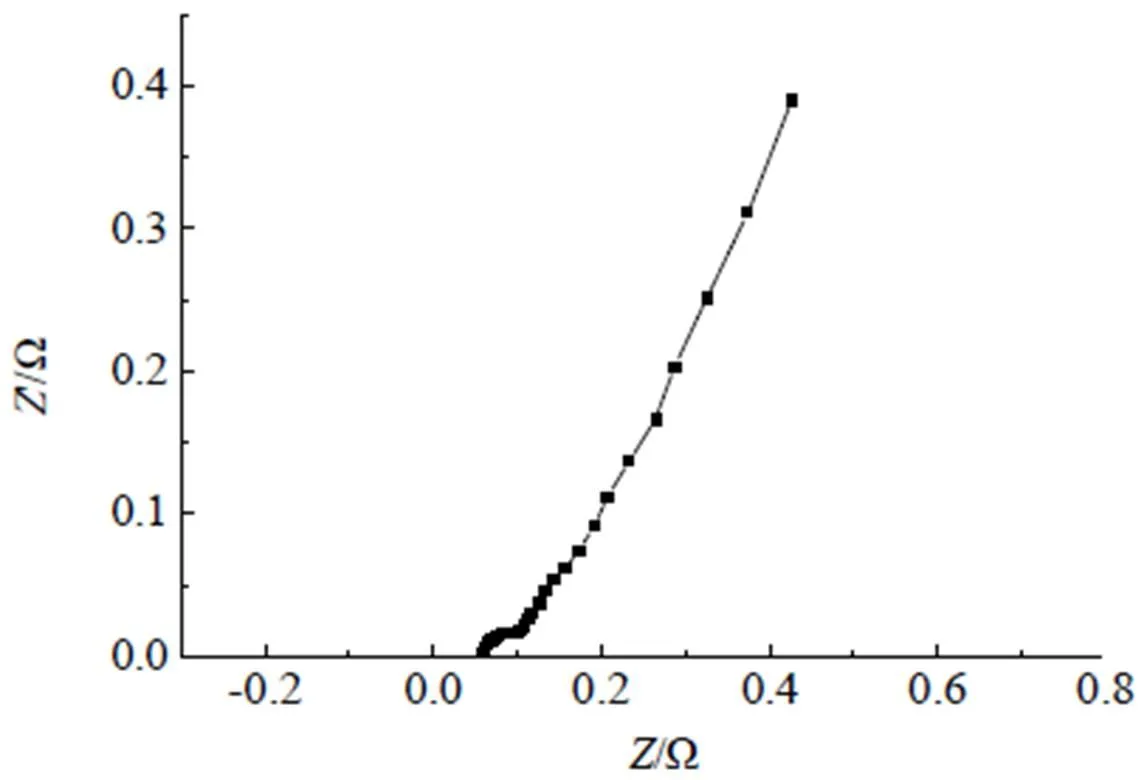
图11 混合电解液(EMIES+LiClO4)(x2=0.05)的Nyquist图
2.3.3 充放电测试
采用2=0.05混合电解液组装的超级电容器,在100 mA的恒流电流,0~3 V电压范围下进行恒流充放电测试,图12是充放电曲线。从图中可以观察到,电压随时间的变化呈线性关系,由于该组份黏度低、内阻小从而带来了良好的电压范围,并且在测试范围内,充放电曲线呈现近似等腰三角形的对称分布,这些都证明混合电解液有良好的循环性、可逆性和双电容特性。并且在这个测试过程中,没有明显的电压变化情况,没有出现过放电等情况,充、放电曲线均呈线性状态[16],这也充分证明了混合电解液的内阻没有明显变化,进一步证明混合电解液的稳定性极佳。
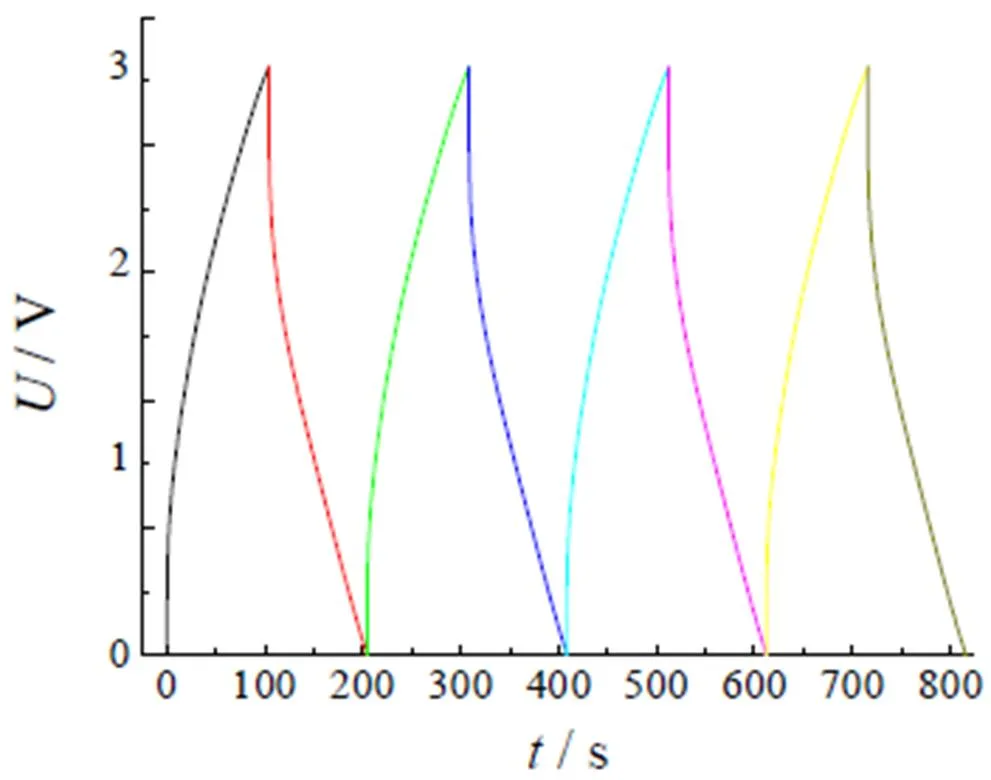
图12 混合电解液(EMIES+LiClO4)(x2=0.05)的恒流充放电曲线
根据恒流充放电曲线及相关公式:
charge=△charge(1)
discharge=△discharge(2)
discharge/charge(3)
S=discharge/(4)
式中:为电量,C;为恒流充放电电流,A;为时间,s;为效率;s为比电容,F/cm3;为电压,V。
表3是通过上式计算得到的超级电容器的充放电效率、比电容等性能参数,其中比电容是评价超级电容器性能好坏的一个重要指标[17]。由表3可知,当充放电电流为100 mA时,工作电压可以达到3 V,单电极比电容为446.04 F·cm–3,其充放电效率为96.53%,而以1-丁基-3-甲基咪唑六氟磷酸盐作为超级电容器电解液的充放电效率只有90.9%[18]。
表3 超级电容器恒流充放电电化学性能

Tab.3 The electrochemical performance of supercapacitor in constant current charging and discharging
2.3.4 循环性能测试
图13是超级电容器电解液为EMIES+LiClO4混合体系(2=0.05)的循环寿命曲线。由图可知,经过1000次的循环后,比电容仅下降了1.9%,具有稳定的充放电特性,表明混合电解液具备优良的循环寿命和充放电性能。
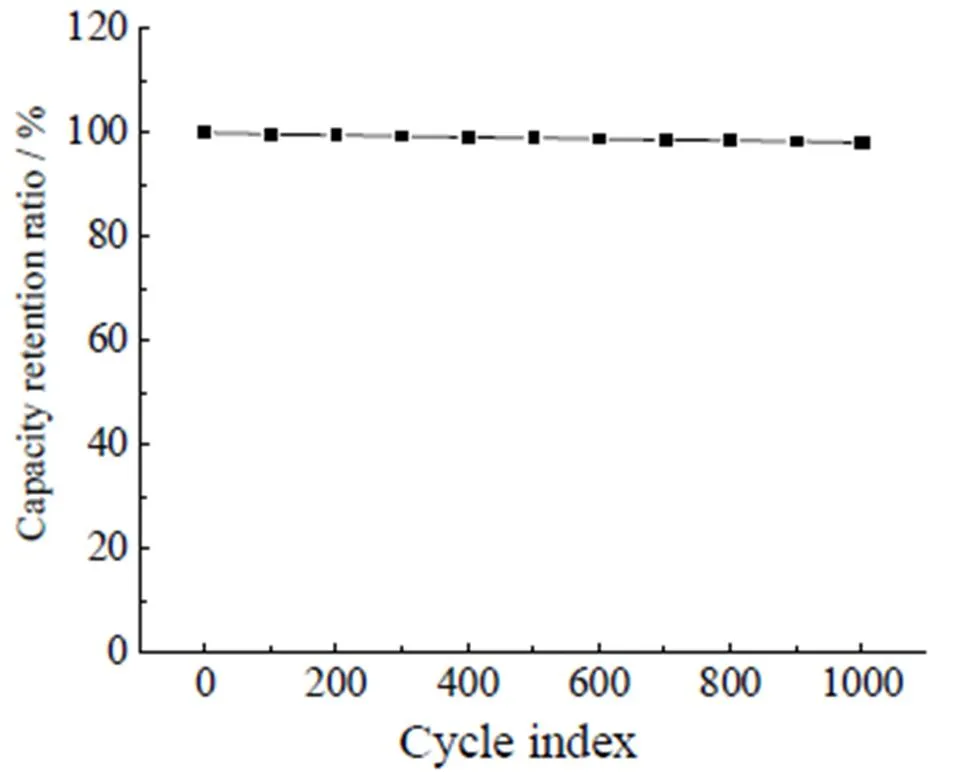
图13 混合电解液(EMIES+LiClO4)(x2=0.05)超级电容器的容量变化曲线
3 结论
用一步法合成了离子液体EMIES,以高氯酸锂盐与EMIES摩尔比0.01:1,0.02:1,0.03:1,0.04:1,0.05:1,0.06:1,0.07:1,0.08:1,0.09:1,0.1:1进行混合,分别测量了纯离子液体和混合体系在不同温度下的密度、电导率和黏度等热力学性质,测试结果表明,当高氯酸盐与EMIES的摩尔比为0.05:1时,该混合体系的黏度最小且电导率最高(298.15 K,= 90.3 mPa·s,= 8.3×10–3S/cm)。采用此最优配比的混合电解液,组装成的超级电容器,体现出如下电化学性能,电化学窗口为5.1 V,内阻为0.58 Ω,放电容量为2.791 mAh,经过1000次的充放电循环后仍保持98.1%的起始比电容,这些结果表明,EMIES+LiClO4混合电解液在超级电容器中的具备规模应用的潜力。
[1] 张庆国, 张鑫源, 李美超, 等. 功能性离子液体[Cmim][SCN]的超电容性质研究 [J]. 电子元件与材料, 2014, 33(6): 20-23.
[2] 李凡群, 赖延清, 高宏权, 等. 超级电容器用离子液体电解质的研究进展 [J]. 电池, 2008, 38(1): 63-65.
[3] 齐灿灿, 华一新, 徐存英, 等. 离子液体电化学窗口的研究进展 [J]. 过程工程学报, 2014, 14(6): 694-707.
[4] 庄全超, 武山, 刘文元, 等. 锂离子电池电解质锂盐研究进展 [J]. 化学世界, 2002, 12(2): 667-670.
[5] Zheng J P, Goonetilleke P C, Pettit C M, et al. Probing the electrochemical double layer of an ionic liquid using voltammetry and impedance spectroscopy: a comparative study of carbon nanotube and glassy carbon electrodes in [EMIM]+[EtSO4]−[J]. Talanta, 2010, 81(1): 1045-1055.
[6] 廖振华, 徐永进, 陈建军, 等. 电解电容器用超低电阻率工作电解液 [J]. 电子元件与材料, 2006, 25(7): 15-16.
[7] 武宣宇, 李美超, 张鑫源, 等. [Pmim][ClO4]电解质的物化性质及其在超级电容器中的性能研究 [J]. 渤海大学学报(自然科学版), 2015, 36(1): 68-74.
[8] Johannes K, Juergen F, Alfred L, et al. Experimental vibrational study of imidazolium-based ionic liquids: raman and infrared spectra of 1-ethyl-3-methylimidazolium bis(trifluoromethylsulfonyl) imide and 1-ethyl-3-methylimidazolium ethylsulfate [J]. Appl Spectrosc, 2007, 61(12): 1306-1311.
[9] Zhang Q G, Wang N N, Yu Z W, et al. The hydrogen bonding interactions between the ionic liquid 1-ethyl-3-methylimidazolium ethyl sulfate and water [J]. J Phys Chem B, 2010, 114(14): 4747-4754.
[10] 白静. 离子液体及其电解液的研究[D]. 南京: 南京理工大学, 2007.
[11] Kazutaka K, Mitsuru S, Akio H, et al. Conductivity and solvation of Li+ions of LiPF6in propylene carbonate solutions [J]. J Phys Chem B, 2000, 104(20): 5040-5044.
[12] 魏颖, 张学磊, 张鑫源, 等. 三氟乙酸离子液体/四氟硼酸盐混合电解液的超级电容性质研究 [J]. 电子元件与材料, 2016, 35(6): 35-39.
[13] Judith S M, Yuki D, Stefania P, et al. N-Alkyl-N-ethylpyrrolidinium cation-based ionic liquid electrolytes for safer lithium battery systems [J]. Electrochim Acta, 2016, 191(10): 624-630.
[14] 刘洋, 张学磊, 张鑫源, 等. 四氟硼酸螺环季铵盐混合型离子液体电解液的制备和电化学性质研究 [J]. 渤海大学学报(自然科学版), 2015, 36(4): 342-348.
[15] LI M T, YANG L, FANG S H, et al. Polymer electrolytes containing guanidinium-based polymeric ionic liquids for rechargeable lithium batteries [J]. J Power Sources, 2011, 196(20): 8662-8668.
[16] 徐进. 锂电池充放电特性分析和测试 [J]. 中国西部科技, 2011, 10(266): 3-4.
[17] 米娟. 不同测试技术下超级电容器比电容值的计算 [J]. 电源技术, 2014, 38(7): 1393-1398.
[18] 徐利群. 基于离子液体的电化学电容器以及影响因素的研究 [D]. 上海: 上海师范大学, 2009.
(编辑:曾革)
Thermodynamics and electrochemistry properties of supercapacitor mixed electrolyte (ethylsulfate ionic liquids + lithium perchlorate)
ZHANG Qingguo1,2, LAN Yalin2, ZHANG Xinyuan1, WANG Bing2, ZHANG Xuelei2
(1. College of New Energy, Bohai University, Jinzhou 121013, Liaoning Province, China; 2.College of Chemistry and Chemical Engineering, Bohai University, Jinzhou 121013, Liaoning Province, China)
A series of new ionic liquid-based electrolytes were prepared by mixing ionic liquid 1-ethyl-3-methylimidazole ethylsulfate (EMIES) and lithium perchlorate salt (LiClO4) with different molar ratios. The thermodynamic properties of the mixed electrolyte systems (EMIES+LiClO4) were determined like conductivity, density, and viscosity. The viscosity and conductivity of the system show an opposite trend with the temperature change. There is a nonlinear change of the conductivity with the addition of LiClO4for the system, and when the molar ratio of perchlorate is 0.05, the electrolyte has a optimal conductivity and viscosity performances. Further, the activated carbon electrode was used to assemble the supercapacitor with the mixed electrolyte. The performances of the assembled supercapacitor were tested and studied by AC impedance, constant current charge-discharge, and cyclic voltammetry methods. The results are as follows: the electrochemical window of the mixed electrolyte reaches 5.1 V; the single electrode capacitance ratio is 458.65 F·cm–3; specific capacitance after 1000 times charge-discharge test decreases only 1.9%. Those indicate that the new mixed ionic liquid-based electrolyte can provide excellent capacitance, good reversibility and cycling characteristics. The mixed electrolyte system has great potential in high performance supercapacitor applications.
ionic liquid; mixed electrolyte; physical and chemical properties; supercapacitor; cyclic voltammetry; EMIES; LiClO4
10.14106/j.cnki.1001-2028.2017.04.013
TM53
A
1001-2028(2017)04-0064-07
2017-01-12
张庆国
国家自然基金项目(No. 21003081,21373002,21503020);辽宁省自然科学基金(No. 201602016)
张庆国(1977-),男,辽宁锦州人,教授,主要从事离子液体热力学性质与储能器件的研究,Email: zhangqingguo@bhu.edu.cn;兰亚林(1991-),女,辽宁丹东人,研究生,研究方向为离子液体材料性质与应用研究,E-mail: lan071710@163.com。
网络出版时间:2017-04-11 10:49
http://kns.cnki.net/kcms/detail/51.1241.TN.20170411.1049.013.html

