青稞根腐病对根际土壤微生物及酶活性的影响
李雪萍,李建宏,漆永红,郭 炜,李 潇,李敏权,*
1 甘肃农业大学草业学院, 兰州 730070 2 甘肃省农业科学院, 兰州 730070
青稞根腐病对根际土壤微生物及酶活性的影响
李雪萍1,2,李建宏1,漆永红1,2,郭 炜1,李 潇1,李敏权1,2,*
1 甘肃农业大学草业学院, 兰州 730070 2 甘肃省农业科学院, 兰州 730070
选取甘肃省卓尼县青稞种植区为研究地点,调查青稞根腐病的发病情况,并分别采集其健康植株和发病株根际的土壤,对比分析其土壤微生物生物量(碳、氮、磷)、微生物数量(细菌、真菌、放线菌)以及过氧化氢酶、蔗糖酶、脲酶、碱性磷酸酶、纤维素酶5种酶活性。结果发现,研究区10个采样点均有青稞根腐病的发生,发病率在5%—20%之间,不同地点发病率不同。根腐病的发生,会显著影响青稞根际微生物生物量,导致微生物生物量碳、氮、磷的含量发生变化,其中微生物生物量氮和磷含量整体降低,且不同采样点微生物量不同。土壤微生物数量总体呈现细菌>放线菌>真菌的趋势,但不同微生物对根腐病发病的响应不同,细菌和放线菌数量因根腐病的发生而减少,真菌的数量则增多;不同采样点土壤微生物数量不相同,细菌和真菌呈现区域性特征,放线菌的数量不呈现地域性。根腐病的发生还造成土壤酶活性的改变,其中蔗糖酶、脲酶、磷酸酶的含量因根腐病的发生而降低,而纤维素酶则升高,过氧化氢酶的变化没有规律。总而言之,根腐病的发生会使青稞根际土壤微生物组成发生改变,碳、氮、磷等物质代谢受到抑制,而能量代谢发生紊乱。因此,研究和防治青稞根腐病就必须重视土壤微生物及土壤酶的作用。
青稞;根腐病;土壤微生物量;细菌;真菌;放线菌;土壤酶
Abstract: Naked barley is one of the major crops of western China. Root rot causes a serious reduction in naked barley. However, study of the rhizosphere soil microorganisms and enzyme activity of naked barley experiencing root rot may yet find ways to mitigate the damage. This study selected a naked barley growing area in Zhuoni county of the Gannan state in Gansu Province as its research site. Naked barley root rot was chosen as the object of study. Rhizosphere soil samples from healthy naked barley and naked barley infected with root rot were collected separately. Then microbial (bacteria, actinomyces, fungi) quantity was determined using the plate count method. Microbial biomass carbon was determined using the potassium dichromate sulfuric acid heating method. Microbial biomass nitrogen was determined using the Kjeldahl method. Microbial biomass phosphorus was determined using the molybdenum blue colorimetric method. Catalase activity was determined using the volumetry method. Sucrase and cellulase activity were determined using 3, 5-dinitrosalicylic acid colorimetry. Urease activity was determined using the indophenol blue colorimetric method. Alkaline phosphatase was determined using the phenyl phosphate disodium colorimetric method. Finally, we analyzed rhizosphere soil sampled from healthy naked barley and from naked barley infected with root rot to compare microbial biomass, microbial numbers in soil, and soil enzyme activity. The results showed that root rot occurred in naked barley at all 10 of the sampled areas with an incidence of 5% to 20%, though the morbidity differed between plots. The presence of root rot dramatically affected the microbial biomass of naked barley rhizosphere soil, which led to changes in the carbon, nitrogen, and phosphorus levels of the microbial biomass. The reduction in microbial biomass nitrogen and phosphorus levels and in microbial biomass differed between sampling sites. The total number of microorganisms varied, but showed a general population trend of bacteria>actinomyces>fungi. Different microorganisms have different responses to naked barley root rot, as the number of bacteria and actinomyces decreased when root rot was present, while the number of fungi increased. The total number of microorganisms varied between different sample areas, with bacteria and fungi showing rationality, while actinomyces did not. The presence of naked barley root rot also changed the enzyme activity of rhizosphere soil. Enzyme activity around sucrose, urease, and alkaline phosphatase decreased in the presence of root rot, while enzyme activity around cellulose increased. Changes in catalase activity did not appear to be correlated with the presence of root rot. Enzyme activity differed between samples of naked barley rhizosphere soil different samples to a significant degree. Correlation analysis showed a significant positive correlation between soil microbial biomass carbon and soil microbial biomass nitrogen levels. The number of soil bacteria and actinomyces showed a significant positive correlation with both soil microbial biomass carbon and biomass nitrogen levels. Soil fungi numbers showed significant positive correlation with both soil microbial biomass phosphorus and sucrose levels, and with enzyme activity around cellulose. Alkaline phosphatase activity showed significant positive correlation with both soil microbial biomass carbon and actinomyces numbers, but also showed significant negative correlation with catalase activity. In general, the presence of naked barley root rot was found to influence various factors of rhizosphere soil. These various factors are connected to and influence each other. The root rot changed the soil microbial flora composition of naked barley rhizosphere soil by restricting the presence of materials such as carbon, nitrogen, and phosphorus, and by disrupting energy metabolism. Therefore, research into the control of naked barley root rot must take the role of soil microorganisms and enzymes into account.
KeyWords: naked barley; root rot; soil microbial biomass; bacteria; fungi; actinomyces; soil enzyme
青稞 (HordeumvulgareL. var. nudum Hook.f.) 即裸大麦,是栽培大麦(HordeumvulgareL.) 的变种。在我国,青稞主要分布在西藏、甘肃、青海、云南、四川等省区的高海拔地区,具有耐寒性强、成熟期短等特点,在海拔超过4200m的高寒地区,青稞是唯一能够正常成熟的谷物[1],成为该地区人民的主食,藏区人民经常将其做成糌粑食用。因此,青稞对于我国藏区的经济发展和社会安定具有无可替代的作用。但是,根腐病等植物病害给该地区的青稞种植带来了很大的困难,有调查显示,根腐病造成了大麦类作物减产近10%[2]。笔者在甘肃省甘南州青稞种植区调查发现,在该地区,青稞根腐病的发生十分普遍,且近些年来有加重之势。然而,限于该地区较为落后的经济和科技条件,青稞根腐病未得到应有的重视,对其的研究很少见诸报道。
传统上对于根腐病的防治多是利用农艺措施或化学农药进行防治[3],但农艺措施防治效果有限;而化学农药防治多用多菌灵、百菌清、敌克松、代森锰锌、咪鲜胺、苯醚甲环唑、恶霉灵与甲基托布津等有毒性的药物[4],这些化学农药不仅会造成农作物农药残留,危害人畜健康,还会影响土壤生态平衡,造成土壤质量下降甚至土壤退化,对于农业的可持续发展带来很不利的影响,尤其在高寒地区,农药降解过程缓慢,其造成的危害也更大。20世纪80年代我国陈延熙教授提出“植物微生态学”概念,从此,学者们注意到了微生物在植物病害防治方面的巨大作用,并于1986 年5月在北京召开的中国植物病理学会第三次全国代表大会上首次提出了“植物生态病理学”,以微生态学为依据,土壤微生物在植物病害防治方面的作用才逐渐被人们所认识[5]。
微生物是土壤生态系统最重要的组成部分,在土壤有机质转化、养分循环、肥力形成、污染物降解以及能量流动方面具有重要的作用[6- 8],是土壤的活性部分。土壤微生物系统是长期适应土壤环境的结果,因此,与土壤其他成分相比,微生物对土壤环境的变化更为敏感,能较早的表征土壤质量和生态功能的变化。Arancon等研究表明土壤微生物的数量和活性与植物发病率之间有很密切的关系[9]。李红丽等[10]分析认为调节土壤微生态可以很好的防治烟草青枯病的发生;而吕恒等[11]研究发现,植物根际的某些真菌对黄瓜土传病害有防治作用。而土壤酶也可以作为土传病害预测的一个重要指征[12]。如何川等[13]对植烟土壤酶活性与土传病害的关系研究表明,烟草青枯病和黑胫病的病情指数与土壤有机碳量、土壤淀粉酶、蔗糖酶、纤维素酶活性呈负相关。廖梓良等[14]研究表明,脱氢酶和磷酸酶可以作为设施栽培土传病害预测预报指征。
综上,研究土壤酶和土壤微生物对于了解根腐病的发生和危害机理,进而提出防治措施具有重要的意义,但目前青稞根腐病方面,尚没有此方面的报道。因此,我们通过研究甘肃青稞主要分布区甘南州卓尼县青稞根腐病病健植株根际土壤理化性质及酶活性,明确根腐病发生与青稞根际土壤酶活性及土壤微生物的变化规律,为青稞的生产及进一步研究提供良好的理论基础。
1 材料与方法
1.1 研究区概况
研究区位于甘肃省甘南藏族自治州卓尼县,域内地貌大部分为中低山地形,地势西南高,东北低。海拔在4920—2000 m之间,年均气温4.6 ℃,年均降水量580 mm,无霜期119 d,属高原性大陆气候,寒冷湿润,四季不明。玉米、小麦等常规粮食作物无法成熟或产量及品质较低,青稞为其主要粮食作物之一,种植面积约占境内粮食作物种植总面积的48.5%。
1.2 调查采样
于2015年6月5日至6月7日在研究区选取木耳镇塔古村和七车村、柳林镇上卓尼村和官磊村、申藏乡小沟村、申藏村和左拉村、阿子滩乡麻乍村、上阿子滩村和下阿子滩村等4个乡镇10个村青稞种植地为调查采样点,参考《植病研究法》[15]对该区域青稞根腐病发病率进行调查统计,并采用多点采样法采集根腐病发病特征典型的青稞植株和同一样地健康植株及其根际土壤,共采得苗期青稞根腐病发病株和健康株样品各10份,然后将各样品低温运输至实验室并尽快进行实验。
1.3 土壤样品预处理
收集青稞样品根际土壤,一部分直接用于三大微生物的计数,另一部分风干后过2mm筛,再将其置于25℃的生化培养箱中培养7d,待测[16]。
1.4 土壤酶活性研究
1.4.1 过氧化氢酶活性的测定
土壤过氧化氢酶活性采用容量法测定[17],结果用1 g土壤消耗的0.02 mol/L KMnO4的毫升数表示。
1.4.2 蔗糖酶活性的测定
蔗糖酶活性的测定采用3,5-二硝基水杨酸比色法[18],结果以24 h后1 g土壤葡萄糖的毫克数表示。
1.4.3 脲酶活性的测定
脲酶活性测定采用靛酚蓝比色法[18],结果用24 h后1 g土壤中NH3-N的毫克数来表示。
1.4.4 碱性磷酸酶活性的测定
碱性磷酸酶采用磷酸苯二钠比色法测定,结果用24 h后1 g土壤中释出的酚的毫克数来表示。
1.4.5 纤维素酶活性的测定
纤维素酶采用3, 5-二硝基水杨酸比色法,结果用1 g土壤所生成葡萄糖的质量来表。
1.5 土壤微生物数量测定
1.5.1 细菌数量
细菌数量测定采用平板涂布计数法,用牛肉膏蛋白胨琼脂培养基在30℃培养箱中培养24h后计数。
1.5.2 真菌数量
真菌数量测定采用平板涂布计数法,用马丁-孟加拉红培养基在25℃培养箱中培养72h后计数。
1.5.3 放线菌数量
放线菌数量测定采用平板涂布计数法,用改良高氏一号培养基在28℃培养箱中培养96h后计数。
1.6 土壤微生物生物量测定
1.6.1 土壤微生物生物量碳(SMBC)测定
先用氯仿熏蒸法[19]处理土样,然后用0.5 mol/L K2SO4溶液提取,采用重铬酸钾硫酸外加热法测定浸提液中的碳,计算公式[20]如下:
土壤微生物生物量碳 (mg/kg)=(Ec-Ec0)/0.38
式中,Ec为熏蒸土壤浸提液中有机碳量;Ec0为不熏蒸土壤浸提液中有机碳量;0.38为校正系数。
1.6.2 土壤微生物生物量氮(SMBN)测定
先用氯仿熏蒸法[19]处理土样,然后用0.5 mol/L K2SO4溶液提取,浸提液中氮采用凯氏定氮法测定,计算公式[20]如下:
土壤微生物生物量氮 (mg/kg)=(Ec-Ec0)/0.54
式中,Ec为熏蒸土壤浸提液中有机氮量;Ec0为不熏蒸土壤浸提液中有机氮量;0.54为校正系数。
1.6.3 土壤微生物生物量磷(SMBP)测定
先用氯仿熏蒸法[19]处理土样,然后用0.5 mol/L NaHCO3溶液提取,提取液中磷测定采用钼蓝比色法,计算公式[20]如下:
土壤微生物生物量磷 (mg/kg)=(Ec-Ec0)/0.40
式中,Ec为熏蒸土壤浸提液中有机磷量;Ec0为不熏蒸土壤浸提液中有机磷量;0.40为校正系数。
1.7 数据处理与分析
实验数据整理与处理采用Excel 2007完成,统计分析采用DPS 15.10进行,并采用Duncan新复极差法进行差异显著性分析(P<0.05表示差异显著,图中用字母表示),Pearson相关进行相关性分析。
2 结果与分析
2.1 调查结果
如表1所示,研究区卓尼县的木耳镇、柳林镇、申藏乡、阿子滩乡等乡镇的各样点青稞都有根腐病发生,发病率在5%—20%之间,说明在该地区根腐病是青稞种植中普遍发生的一种病害。但不同样点的发病率不同,如柳林镇官磊村发病率高达20%,而申藏乡申藏村和阿子滩乡上阿子滩村则仅为5%,发病率没有明显的地域性规律。

表1 青稞根腐病发病率
2.2 土壤微生物生物量
土壤微生物生物量是土壤中活性养分的储存库,能非常灵敏的反应环境因子对土壤的影响,如图1—3所示,不同样地土壤微生物生物量不同,根腐病发病与否对土壤微生物生物量碳也有明显的影响,此外,不同种类的微生物生物量对环境因子响应的规律也不同。
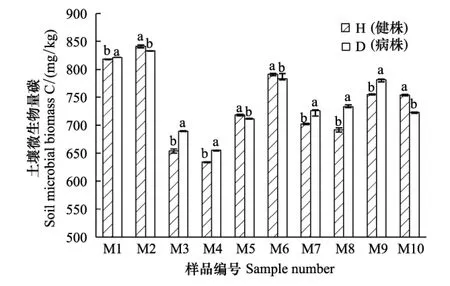
图1 各样品土壤微生物生物量碳含量Fig.1 Each sample soil microbial biomass carbon 图中“a,b”表示差异显著性,字母相同则表示差异不显著
如图1所示,土壤微生物生物量碳会随青稞根腐病的发生而改变,但其变化没有明显的规律,如M2、M5、M6、M10等4个样地的样品是随发病株根际土壤样品微生物生物量碳显著高于健康株根际土壤样品,而其余6个样地样品则是发病株样品的微生物生物量碳低于健康株,显著性分析的结果显示,各样品健康株和发病株都有明显差异,说明青稞根腐病的发生对青稞根际土壤微生物碳代谢有影响。不同样地样品土壤微生物生物量碳含量不同,且地理位置上相近的采样点其土壤微生物生物量碳含量相近,如木耳镇的塔古村和七车村,地理位置接近,小气候相似,其微生物生物量碳含量也很接近,整体较高。还有如柳林镇的上卓尼村和官磊村也是如此,略偏低。其余申藏和阿子滩两个乡地理位置相邻,气候条件相似,其土壤微生物生物量碳含量也接近。
如图2所示,青稞根腐病的发生会显著影响其根际土壤微生物生物量氮的含量,各样品都是健康株根际土壤微生物生物量氮高于发病株,健康株根际样品比发病株样品高出2%—8%,且除M5、M7、M10外都存在显著差异,说明根腐病的发生会影响青稞根际土壤微生物的氮代谢,降低土壤微生物量氮的含量。就样地间的差别来看,不同样地样品土壤微生物氮含量不同,与微生物生物量碳的分布规律相似,都是木耳镇七车村和塔古村的样品数值居高,柳林镇上卓尼村和官磊村的样品数值较低,而阿子滩、申藏两个乡的样品数值居中,说明土壤微生物氮代谢和碳代谢具有统一性。
如图3所示,青稞根际土壤微生物生物量磷的含量也会随根腐病的发生而改变,与微生物生物量氮的变化规律相似,根腐病的发生会使土壤中微生物生物量磷的含量下降,下降幅度在2.75%—11.54%,10份样品都呈下降趋势,且均差异显著,说明根腐病的发生会抑制青稞根际土壤微生物磷代谢。不同样地样品之间对比发现其规律与微生物生物量碳氮的不相同,含量最高的是柳林镇两个样地的样品(M3、M4)以及申藏乡小沟村的样品(M5),而较低的是阿子滩乡3个样地的样品(M8、M9、M10),但是,地理位置上接近的样地间微生物生物量磷的数值也较为接近。
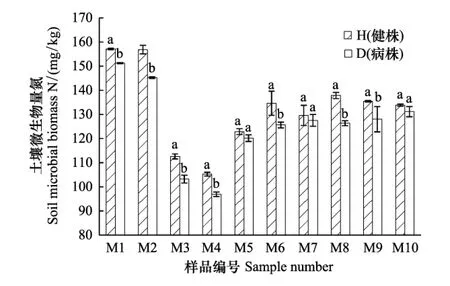
图2 各样品土壤微生物生物量氮含量Fig.2 Each sample soil microbial biomass nitrogen
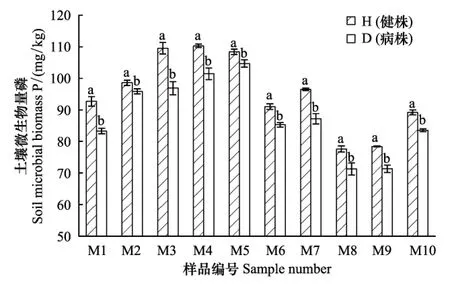
图3 各样品土壤微生物生物量磷含量Fig.3 Each sample soil microbial biomass phosphorus
2.3 土壤三大微生物数量
土壤中细菌、真菌、放线菌等三大微生物的数量是反应土壤活性和土壤健康的重要指标。如图4—图6所示,不同微生物在土壤中的分布规律不同,总体而言,土壤中的微生物数量呈细菌>放线菌>真菌的规律。无论是细菌、真菌还是放线菌,其数量都受根腐病发生的影响,不同的微生物受到的影响不同。

图4 各样品土壤细菌数量Fig.4 Each sample soil bacterial numbers
如图4所示,根腐病的发生会导致青稞根际土壤细菌数量发生变化,10份样品中,除M8外,其余9份样品的土壤细菌数量因根腐病的发生而减少,减少幅度为0.9%—8.8%,且除M2外,均差异显著。不同样地土壤细菌数量不同,但地理位置相近的采样点,细菌数量较为接近,如木耳镇塔古村和七车村的样品(M1、M2)数量较高,而柳林镇的上卓尼和官磊两地的样品(M3、M4)中细菌的数量则较低。因此,土壤细菌的数量具有地域性。
如图5所示,除M6、 M8和M10外,其余7份样品都是根腐病发病植株根际土壤真菌数量高于健康植株根际土壤真菌数量,这一现象与土壤细菌相反。但不同样地样品发病后土壤真菌数量的增加幅度不同,如M4增幅较大,统计分析表明差异显著,而M1和M5则增幅很小,差异不显著。另外,不同样地土壤真菌数量也各不相同,但地理位置相近的采样点,土壤真菌数量也较为接近,呈现地域性,这一规律与土壤细菌数量的规律类似。
如图6所示,土壤放线菌数量的变化规律与土壤细菌的变化规律类似。除M5外,发病植株根际土壤中的数量低于健康植株根际土壤中的数量,且均差异显著。而不同采样地点样本其数量没有明显的规律,不呈现地域性,与细菌和真菌有差别。
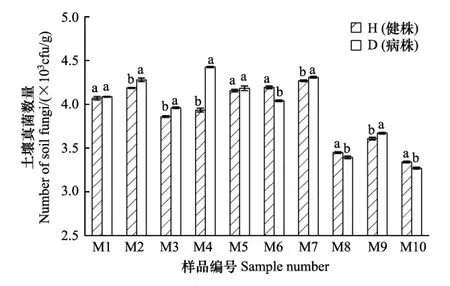
图5 各样品土壤真菌数量Fig.5 Each sample soil fungus numbers
2.4 土壤酶活性
土壤过氧化氢酶与土壤氮素循环和有机质转化等过程有着密切的关系,并直接反应着土壤能量代谢过程的强弱。
如图7所示,根腐病的发生会显著改变青稞根际土壤过氧化氢酶的活性,10份样品过氧化氢酶活性都有不同程度的改变。但不同样品对其响应不同,10份样品中,有5份样品表现为发病株根际过氧化氢酶活性高于健康株,而另5份则相反。这说明根腐病的发生会导致土壤能量代谢过程的改变或紊乱。分析不同样地样品的情况可以发现,土壤过氧化氢酶随根腐病的改变方式在一定程度上与采样地点相关,如木耳镇的两份样品(M1、M2)都是发病后活性降低,而阿子滩乡的3份样品(M8、M9、M10)则是发病后升高。
如图8所示,根腐病的发生会显著影响青稞根际土壤碱性磷酸酶的活性。除M3外,其余9份样品都是发病后植株与健康植株相比根际土壤的碱性磷酸酶活性有所下降,但不同样品下降幅度不同, M1、M4、M6、M10等样品下降幅度较大,差异显著,M5、M7、M8下降幅度较小,差异不显著。这一结果与土壤微生物量磷的结果是一致的,说明根腐病的发生会影响青稞根际土壤磷代谢。就不同样地来看,不同样地土壤碱性磷酸酶活性差别很大,如M3和M6相比,相差超过2倍。
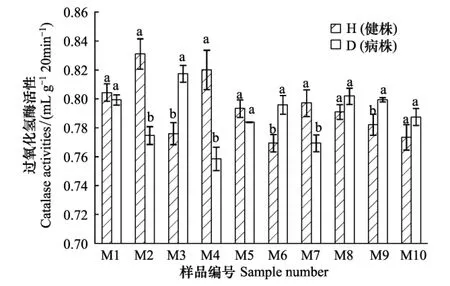
图7 各样品土壤过氧化氢酶活性Fig.7 Each sample soil catalase activities
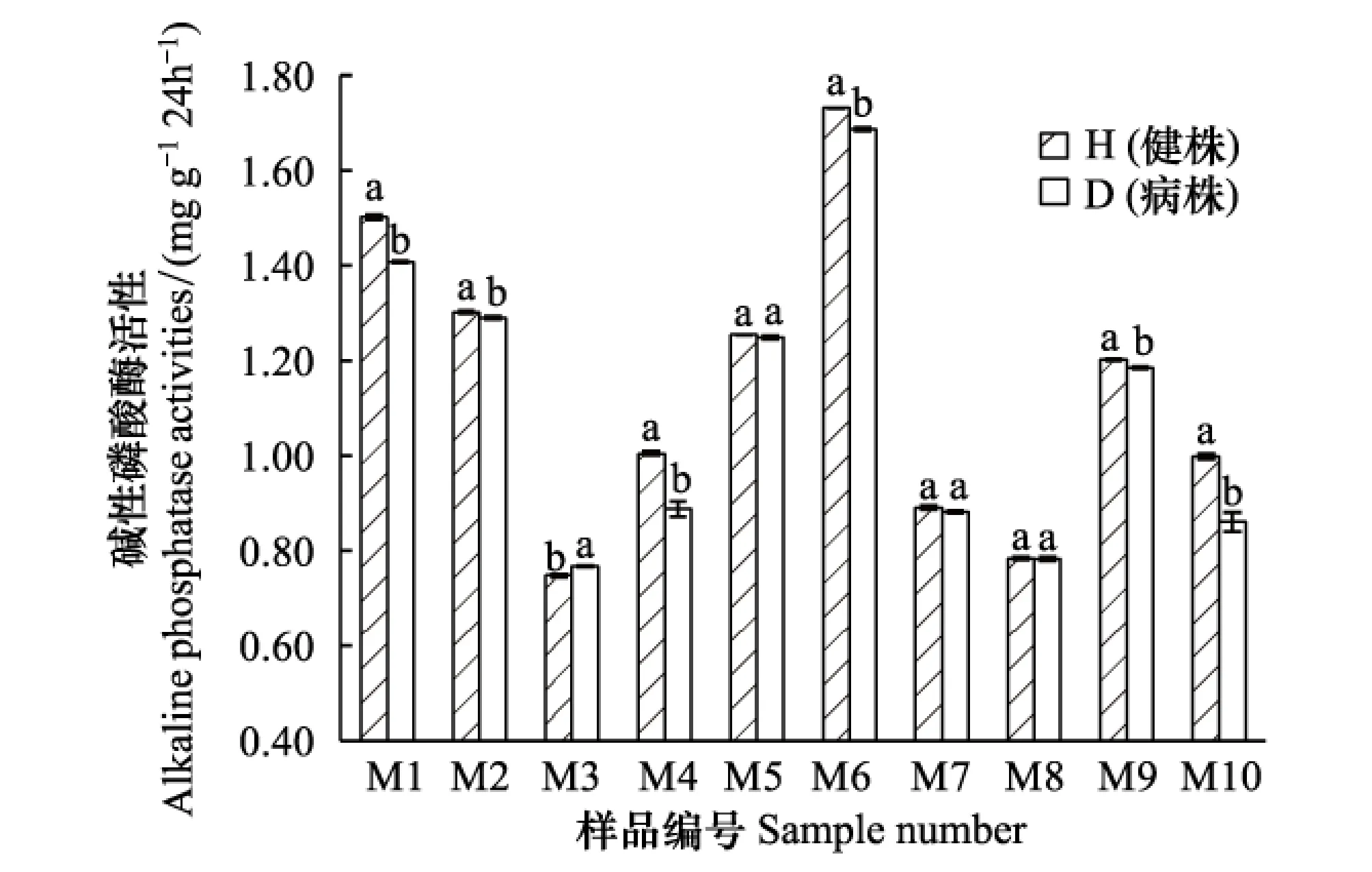
图8 各样品土壤碱性磷酸酶活性Fig.8 Each sample soil alkaline phosphatase activities
如图9所示,青稞根际土壤蔗糖酶活性受根腐病发病与否的影响显著,不同样地土壤蔗糖酶活性不同,下降幅度也不一。除M3外,试验采集的其余9份样品都是健康植株的根际土壤蔗糖酶活性高于发病株根际土壤蔗糖酶活性,与健康植株相比,根腐病发病植株根际土壤蔗糖酶活性普遍下降2%—7%,差异均显著。说明根腐病的发生会显著影响青稞根际土壤碳代谢。
脲酶是反应土壤氮素代谢水平的一种酶,如图10所示,根腐病的发生会显著影响青稞根际土壤脲酶的活性,10份样品中,除M2、M4、M10份样品外,其余7份样品都是健康植株根际土壤脲酶活性高于发病植株,且差异显著,说明根腐病的发生会改变土壤氮代谢,这一结果与土壤微生物生物量氮的测定结果是相一致的。就样地间来看,不同样地土壤脲酶活性不同。从整体而言,土壤脲酶的活性不仅因采样地点的不同而不同,还因青稞根腐病的发生与否而不同。

图9 各样品土壤蔗糖酶活性 Fig.9 Each sample soil invertase activities
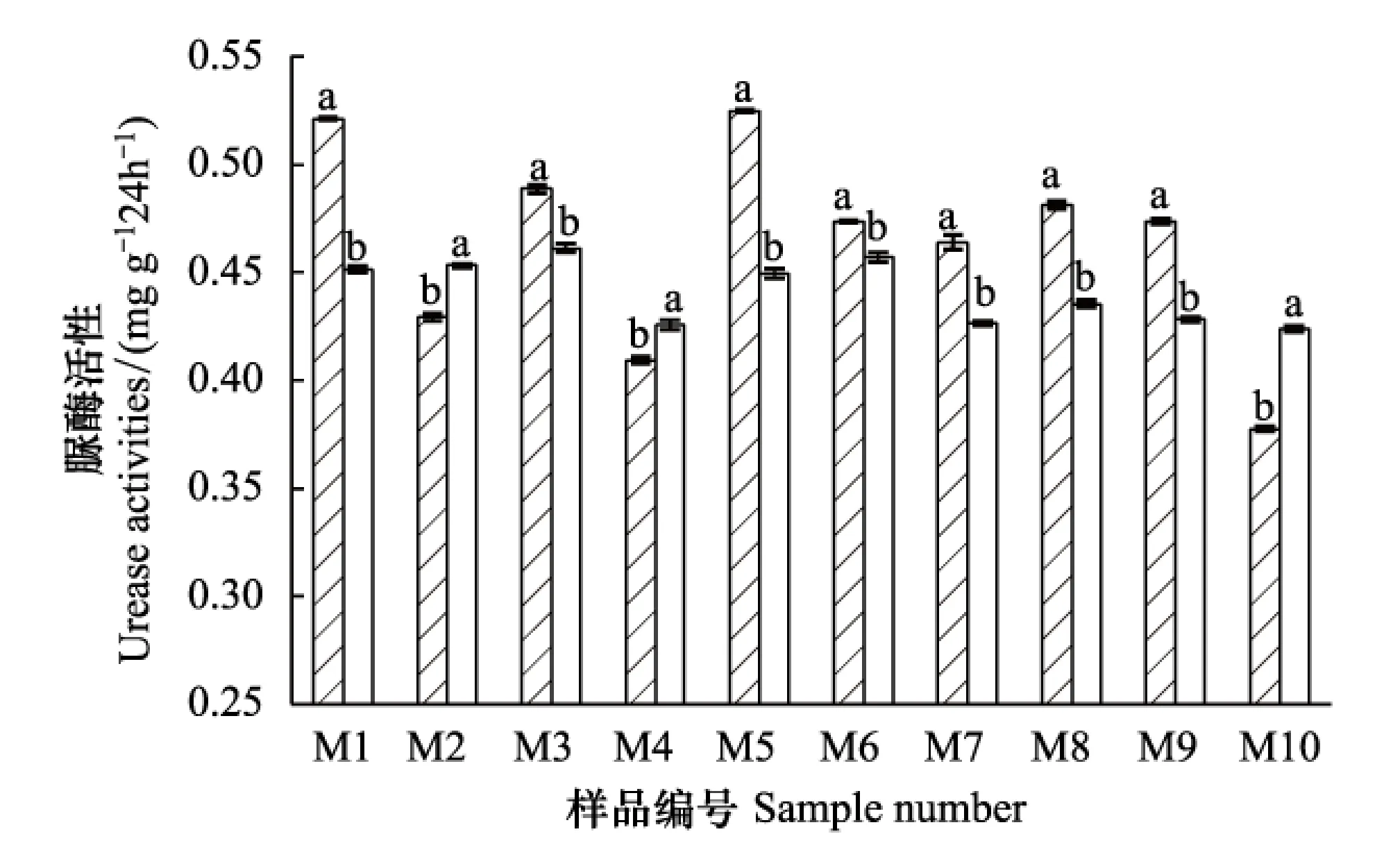
图10 各样品土壤脲酶活性Fig.10 Each sample soil urease activities

图11 各样品土壤纤维素酶活性Fig.11 Each sample soil cellulase activities
如图11所示,青稞根际土壤纤维素酶的变化规律与其他4种酶相反,除M1外,与健康植株相比,青稞根腐病的发生使其根际土壤纤维素酶的活性上升,且除M2和M5外均差异显著。不同样地青稞健康植株根际土壤样品纤维素酶活性各不相同,且存在显著差异。
2.5 土壤微生物数量、微生物量及酶活性的相关性
对甘南州卓尼县青稞发病株与健康株根际土壤微生物量、三大微生物数量和土壤酶活性进行相关性分析结果如表2所示,微生物量碳、氮、磷之间相关性分析表明,微生物量碳和微生物量氮呈极显著相关,说明碳代谢和氮代谢具有关联性,碳元素在微生物体内通常是为其提供能源和有机质合成过程中的碳架,而氮素则是合成蛋白质和核酸的必须物质,因此,碳素和氮素的代谢具有关联性;而对土壤微生物数量和微生物量之间的相关性分析表明,土壤细菌和放线菌数量与微生物生物量碳和微生物生物量氮呈显著或极显著相关,土壤真菌数量与微生物生物量磷呈显著相关。细菌和放线菌是土壤中最为重要的两类微生物,而碳和氮则是生物体最重要的两种元素,因此,土壤中细菌和放线菌的数量决定着土壤微生物生物量碳、氮的含量;土壤酶纤维素酶和蔗糖酶与土壤真菌的数量呈显著相关,碱性磷酸酶的活性与土壤微生物生物量碳和放线菌数量呈显著相关。发病率和各因子的相关性分析表明,发病率与土壤过氧化氢酶的活性呈极显著负相关,过氧化氢酶是土壤中与能量代谢相关的酶,与土壤氧含量关系紧密,这一说明在本研究区,土壤的氧含量和土壤的能量代谢影响着青稞根腐病的发病率。综上,结合表2及图1—图11的结果可以看出,青稞根腐病的发生与其根际土壤各因子都有一定的关系,各因子之间也相互关联、相互影响。
表2青稞根际土壤微生物量、三大微生物数量、土壤酶活性与根腐病发生率的相关性分析
Table2Barleyrhizospheresoilmicrobialbiomass,microbialnumbers,soilenzymeactivityandthecorrelationanalysisofincidenceofrootrot

相关系数Correlationcoefficient微生物量碳MicrobialbiomassC微生物量氮MicrobialbiomassN微生物量磷MicrobialbiomassP细菌Bacteria真菌Fungus放线菌Actinomyces过氧化氢酶Catalase碱性磷酸酶Alkalinephosphatase脲酶Urease纤维素酶Cellulase蔗糖酶Invertase发病率Morbidity微生物量碳1.00000.94**-0.48000.63*-0.02000.81**0.19000.69*0.36000.0900-0.0100-0.4700微生物量氮1.0000-0.54000.74**-0.16000.79**0.15000.50000.2200-0.16000.0300-0.3500微生物量磷1.0000-0.35000.71*-0.4200-0.3400-0.10000.33000.4300-0.38000.5100细菌1.0000-0.18000.40000.29000.13000.3200-0.14000.0700-0.1900真菌1.0000-0.1400-0.55000.30000.29000.63*-0.63*0.3500放线菌1.00000.26000.66*0.3200-0.1000-0.0600-0.4400过氧化氢酶1.00000.04000.5000-0.14000.4800-0.80**碱性磷酸酶1.00000.51000.65*-0.0100-0.4800脲酶1.00000.5200-0.1500-0.5300纤维素酶1.0000-0.0700-0.1600蔗糖酶1.0000-0.3100发病率1.0000
*P<0.05,**P<0.01
3 讨论
3.1 青稞根腐病植株根际土壤微生物量的变化特征
土壤微生物生物量(碳、氮、磷)虽在土壤营养(碳、氮、磷)中所占的比例较小(10%以下),但其是土壤营养中最为活跃的部分,调节土壤养分的生物有效性和利用率,能较早的反应出土壤系统生态功能的变化,是土壤质量评价的指示性和先导性指标[21]。近年来,越来越多的研究者用微生物生物量来作为指标评价土壤质量及土壤抗病能力[20,22- 23],但对土壤微生物生物量与根腐病发生率之间的研究尚不多见。本研究结果显示,青稞根腐病的发生与土壤微生物量具有密切的关系,根腐病的发生会使土壤微生物生物量氮和磷下降,微生物生物量碳含量也发生改变。蔡燕飞等[21]的研究也支持这一结论。这显示根腐病的发生会使土壤的物质循环发生变化,尤其是降低了氮代谢和磷代谢的效率,而氮元素和磷元素恰好是我国北方土壤中缺少的元素,氮、磷元素的缺乏会使植物生长受到抑制,这又进一步导致了植物抗病能力的降低,根腐病进一步加重,形成恶性循环。因此,要防治植物的根腐病,就必须重视土壤微生物生物量,土壤微生物生物量也可以作为预测根腐病发生的指标。
3.2 青稞根腐病植株根际土壤微生物的变化特征
植物土传病害发生后,其根际土壤的微生物组成和优势微生物会发生一定程度的改变[24- 25],从而使得土壤微生态发生变化。一般而言,植物感染土传病害后,根际土壤放线菌和细菌的数量会减少,真菌数量会增加。本研究结果显示,青稞根腐病发病植株与健康株相比,其根际土壤细菌、放线菌的数量有所下降,而真菌的数量上升。这一结果与前人在其他作物上得出的结论吻合,甄文超等[26]的研究表明草莓根际病害发生后,根际真菌增加,细菌和放线菌数量减少。另有Benizri等[27]对桃树根部病害的研究也表明其发病与根际土壤中拮抗细菌的数量和种类降低、病原真菌的种类和数量提高有密切关系。导致植物土传病害发生的特殊土壤环境为病原菌提供了较为适宜的生存空间,从而使病原菌的数量增多,引起土传病害发生。Shin和Lee等[28-29]研究表明,正常土壤放线菌数量多,真菌数量少,从而使真菌孢子萌发受抑制,而发病土壤则真菌数量多,细菌和放线菌数量少。因此,要全面的认识植物根腐病发生的机理,就必须深入到土壤微生物的角度。
3.3 青稞根腐病植株根际土壤酶活性的变化特征
土壤酶反应土壤生化反应的强度和方向,是土壤生态系统的重要组分[30]。本研究发现,青稞根腐病的发生与其根际土壤酶活性有显著的相关性,具体为,根腐病发生后,土壤蔗糖酶、脲酶、碱性磷酸酶活性降低,而纤维素酶活性升高,过氧化氢酶活性变化没有明显规律。蔗糖酶的作用主要是增加土壤中可溶性营养物质的含量,是与土壤碳代谢相关的酶,也是表征土壤肥力的指标;而脲酶的作用主要是促进氮素的循环与转化,表征土壤的氮素水平;磷酸酶的作用是促进磷素的循环和转化,表征土壤磷素的水平[12]。本研究中,蔗糖酶、脲酶、碱性磷酸酶的下降说明根腐病的发生会阻碍土壤营养元素的流动与循环,这一结果与土壤微生物量的结果是相对应的,其他一些研究者在不同作物的研究中也得出了相似的结论,如寻路路[31]、姜飞[32]、游春梅[12]、廖梓良[14]及何川[13]等人的报道。这说明碱性磷酸酶、脲酶、蔗糖酶等四种酶与植物土传病害的响应规律具有普遍性,在不同植物上都是相同的。本研究的纤维素酶与部分研究者的研究结果相反[12-14],但与Shin和Lee等[28-29]人的结果相似,推测其可能的原因是不同试验区的土壤状况不同,且不同作物对土壤酶活性的影响也不同。综上,土壤酶是表征土壤健康水平,预测病害发生的重要指标,但不同的土壤环境中土壤酶的变化规律会有所不同。
4 结论
通过对甘肃省甘南州卓尼县青稞根腐病发病率的调查,以及对发病植株与健康植株根际土壤微生物生物量、三大微生物数量和土壤酶活性的研究得出:研究区内青稞根腐病的发生具有普遍性,发病率在5%—20%之间。不同样地发病率不同。根腐病的发生会导致青稞根际土壤微生物生物量发生变化,微生物生物量氮和磷含量整体降低,微生物生物量碳含量也有变化但没有一定的规律;不同样地微生物生物量不同,地理位置相近的样地微生物生物量接近。土壤微生物数量总体呈现细菌>放线菌>真菌的趋势,不同微生物对根腐病发病的响应不同,细菌和放线菌数量因根腐病的发生而减少,真菌的数量则增多;不同样地之间土壤微生物数量不相同,细菌和真菌呈现区域性特征,放线菌的数量不呈现地域性。根腐病的发生还造成土壤酶活性的改变,其中蔗糖酶、脲酶、磷酸酶的含量因根腐病的发生而降低,纤维素酶则升高,过氧化氢酶的变化没有规律。
[1] 龚凌霄. 青稞全谷物及其防治代谢综合征的作用研究[D]. 杭州: 浙江大学, 2013.
[2] Zhong S B, Ali S, Leng Y Q, Wang R, Garvin D F.Brachypodiumdistachyon-CochliobolussativusPathosystem is a new model for studying plant-fungal interactions in cereal crops. Phytopathology, 2015, 105(4): 482- 489.
[3] 穆向荣, 马逾英, 杨枝中, 马羚, 蒋运斌. 药用植物根腐病防治的研究进展. 中药与临床, 2014, 5(2): 5- 8, 52- 52.
[4] 何晨. 宁夏黄芪根腐病病原鉴定及药剂防治研究[D]. 银川: 宁夏大学, 2015.
[5] 李宝聚, 王莉, 陈捷. 植物病害微生态防治研究. 北方园艺, 2005, (6): 89- 91.
[6] Pratscher J, Dumont M G, Conrad R. Ammonia oxidation coupled to CO2fixation by archaea and bacteria in an agricultural soil. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(10): 4170- 4175.
[7] Kluge B, Peters A, Krüger J, Wessolek G. Detection of soil microbial activity by infrared thermography (IRT). Soil Biology and Biochemistry, 2015, 57: 383- 389.
[8] Petersen D G, Blazewicz S J, Firestone M, Herman D J, Turetsky M, Waldrop M. Abundance of microbial genes associated with nitrogen cycling as indices of biogeochemical process rates across a vegetation gradient in Alaska. Environmental Microbiology, 2012, 14(4): 993- 1008.
[9] Arancon N Q, Edwards C A, Bierman P, Welch C, Metzger J D. Influences of vermicomposts on field strawberries: 1. Effects on growth and yields. Bioresource Technology, 2004, 93(2): 145- 153.
[10] 李红丽, 李清飞, 郭夏丽, 王岩, 刘国顺, 郭桥燕. 调节土壤微生态防治烟草青枯病. 河南农业科学, 2006, (2): 57- 60.
[11] 吕恒, 牛永春, 邓晖, 林晓民, 金春丽. 根际真菌对黄瓜土传病害的抑制作用. 应用生态学报, 2015, 26(12): 3759- 3765.
[12] 游春梅, 陆晓菊, 官会林. 三七设施栽培根腐病害与土壤酶活性的关联性. 云南师范大学学报: 自然科学版, 2014, 34(6): 25- 29.
[13] 何川, 刘国顺, 李祖良, 乔保明, 董宁禹, 蒋士君. 连作对植烟土壤有机碳和酶活性的影响及其与土传病害的关系. 河南农业大学学报, 2011, 45(6): 701- 705.
[14] 廖梓良, 孙世中, 刘建香, 贾秋鸿, 杨泮川, 官会林. 设施栽培香石竹根际土壤酶活与土传病害相关性研究. 云南师范大学学报: 自然科学版, 2009, 29(3): 59- 63.
[15] 方中达. 植病研究方法(第三版). 北京: 中国农业出版社, 1998.
[16] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000.
[17] 关松荫. 土壤酶及其研究法. 北京: 农业出版社, 1986.
[18] 姚槐应, 黄昌勇. 土壤微生物生态学及其实验技术. 北京: 科学出版社, 2006.
[19] 许光辉, 郑洪元. 土壤微生物分析方法手册. 北京: 农业出版社, 1986.
[20] 王理德, 姚拓, 王方琳, 魏林源, 郭春秀, 吴春荣, 李发明. 石羊河下游退耕地土壤微生物变化及土壤酶活性. 生态学报, 2016, 36(15), 4769-4779.
[21] 蔡燕飞, 廖宗文, 罗洁, 李锋. 不同质地土壤抑病性和微生物特征. 农业环境科学学报, 2003, 22(5): 553- 556.
[22] 谭宏伟, 杨尚东, 吴俊, 刘永贤, 熊柳梅, 周柳强, 谢如林, 黄国勤, 赵其国. 红壤区桉树人工林与不同林分土壤微生物活性及细菌多样性的比较. 土壤学报, 2014, 51(3): 575- 584.
[23] 马文文, 姚拓, 靳鹏, 王国基, 张玉霞. 荒漠草原2种植物群落土壤微生物及土壤酶特征. 中国沙漠, 2014, 34(1): 176- 183.
[24] Laurent A S, Merwin I A, Fazio G, Thies J E, Brown M G. Rootstock genotype succession influences apple replant disease and root-zone microbial community composition in an orchard soil. Plant and Soil, 2010, 337(1/2): 259- 272.
[25] Aranda S, Montes-Borrego M, Jiménez-Díaz R M, Landa B B. Microbial communities associated with the root system of wild olives (OleaeuropaeaL. subsp.europaeavar.sylvestris) are good reservoirs of bacteria with antagonistic potential againstVerticilliumdahliae. Plant and Soil, 2011, 343(1/2): 329- 345.
[26] 甄文超, 曹克强, 代丽, 胡同乐. 利用药用植物源土壤添加物控制草莓再植病害的研究. 中国农业科学, 2005, 38(4): 730- 735.
[27] Benizri E, Piutti S, Verger S, Pagès L, Vercambre G, Poessel J L, Michelot P. Replant diseases: bacterial community structure and diversity in peach rhizosphere as determined by metabolic and genetic fingerprinting. Soil Biology and Biochemistry, 2005, 37(9): 1738- 1746.
[28] Shin H S, Lee M W. Environmental factors and the distribution of soil microorganisms in ginseng field. The Korean Journal of Microbiology, 1986, 24(2): 184- 193.
[29] Lee M W, Shin H S, Choi H J. Spore germination of some fungi under different soil conditions in relation to fungistasis. The Korean Journal of Mycology, 1985, 13(4): 195- 201.
[30] 赵其国. 土壤科学发展的战略思考. 土壤, 2009, 41(5): 681- 688.
[31] 寻路路, 赵宏光, 梁宗锁, 韦美膛, 刘峰华, 韩蕊莲. 三七根腐病病株和健株根域土壤微生态研究. 西北农业学报, 2013, 22(11): 146- 151.
[32] 姜飞, 刘业霞, 艾希珍, 郑楠, 王洪涛. 嫁接辣椒根际土壤微生物及酶活性与根腐病抗性的关系. 中国农业科学, 2010, 43(16): 3367- 3374.
Effectsofnakedbarleyrootrotonrhizospheresoilmicroorganismsandenzymeactivity
LI Xueping1, 2, LI Jianhong1, QI Yonghong1,2, GUO Wei1, LI Xiao1, LI Minquan1, 2,*
1CollegeofPrataculture,GansuAgriculturalUniversity,Lanzhou730070,China2GansuAcademyofAgriculturalSciences,Lanzhou730070,China
国家公益性行业(农业)计划项目(201503112)
2016- 05- 31; < class="emphasis_bold">网络出版日期
日期:2017- 04- 24
10.5846/stxb201605311049
*通讯作者Corresponding author.E-mail: lmq@gsau.edu.cn
李雪萍,李建宏,漆永红,郭炜,李潇,李敏权.青稞根腐病对根际土壤微生物及酶活性的影响.生态学报,2017,37(17):5640- 5649.
Li X P, Li J H, Qi Y H, Guo W, Li X, Li M Q.Effects of naked barley root rot on rhizosphere soil microorganisms and enzyme activity.Acta Ecologica Sinica,2017,37(17):5640- 5649.

