自动化前处理-气相色谱串联质谱法测定淡水鱼体中的有机磷阻燃剂
张荧,魏立菲,刘胜玉,刘威,刘昕宇,李逸
珠江水资源保护科学研究所,珠江流域水环境监测中心,广州 510611
自动化前处理-气相色谱串联质谱法测定淡水鱼体中的有机磷阻燃剂
张荧*,魏立菲,刘胜玉,刘威,刘昕宇,李逸
珠江水资源保护科学研究所,珠江流域水环境监测中心,广州 510611
应用自动化前处理设备和气相色谱串联四级杆质谱仪建立了淡水鱼体中10种有机磷阻燃剂的检测方法。该方法先采用自动索氏提取仪进行样品的提取,再应用凝胶渗透色谱净化仪和florisil柱对提取液进行两级净化,最后用气相色谱串联四级杆质谱法(多反应监测模式)对样品中的有机磷阻燃剂(OPFRs)定性定量。实验表明,凝胶渗透色谱净化系统在以乙酸乙酯∶环己烷(1∶1,V/V)为流动相,流速为5.0 mL·min-1的条件下,收集OPFRs的最佳时间为900~1 680 s;方法的检出限为0.002~0.192 ng·g-1湿重,加标水平为5.000 ng·g-1湿重时,平均加标回收率为48.7%~122%,相对偏差除磷酸三乙酯(TEP)(17.7%)和磷酸三(1,3-二氯异丙基)酯(TDCP)(11.9%)外均小于10%。应用该方法测定采集于东江某污水处理厂入河排污口的鱼类样品时,回收率指示物(d27-TBP)的回收率为82.4%~114%,鱼类样品中∑OPFRs的浓度范围为nd~6.41 ng·g-1湿重。
有机磷阻燃剂;自动化;串联质谱;淡水鱼体
Received14 January 2017accepted20 March 2017
Abstract: An analytical method for the determination of 10 organophosphorus flame retardants (OPFRs) in freshwater fish samples was developed using automated equipment for pretreatment and gas chromatography-tandem mass spectrometry (GC-MS/MS) for quantification. In the present method, the samples were extracted using automatic soxhlet extraction system, and then a two-step clean-up (including automatic gel permeation chromatography (GPC) and florisil) was used to purify the extract. Finally, the GC-MS/MS was used for qualitation and quantitation by multi-reaction monitoring (MRM) mode. Experimental results showed that the best collection time of the automatic GPC system was from 900 to 1 680 seconds using ethyl acetate and hexane mixture (1:1, V/V) as mobile phase at a flow rate of 5.0 mL·min-1. The method detection limits ranged from 0.002 ng·g-1to 0.192 ng·g-1wet weight, and the recoveries were in the range of 48.7%-122%, with relative standard deviations (RSDs) of less than 10% except for triethylphosphate (TEP) (17.7%) and tris(1,3-dichloropropyl) phosphate (TDCP) (11.9%). The developed method was applied to determine the OPFRs in freshwater fish collected from an outlet of a sewage treatment plant in the East River. The recoveries of d27-TBP spiked in the samples ranged from 82.4% to 114%, and the total concentrations of OPFRs in the samples ranged from not detected to 6.41 ng·g-1wet weight.
Keywords: organophosphorus flame retardants; automation; tandem mass spectrometry; freshwater fish
近30年来,阻燃剂在减少火灾引起的生命财产损失方面发挥了重要的作用。然而,部分阻燃剂由于具有持久性、生物富集性和环境毒性等,进入环境后,可能对生物体和人类产生危害。随着各国对溴代阻燃剂(brominated flame retardants, BFRs)环境效应的关注以及BFRs的禁用,有机磷阻燃剂(organophosphorus flame retardants, OPFRs)的产量快速提高,据欧洲阻燃剂协会的统计,2006年西欧OPFRs的产量大约为91 000 t·a-1,比2005年提高了7.1%,比2001年提高了9.6%[1]。另据前瞻产业研究院预计,未来我国磷系替代溴系的步伐会快于全球,到2020年磷系、无机和其他新型阻燃剂将成为重点产品,其比重或可达阻燃剂总量的30%。
有报道指出,多种OPFRs具有神经毒性、生殖毒性、致癌性和基因毒性[2-3]。随着其产量的显著增加,OPFRs的污染已引起了各国政府的高度关注,其污染现状、环境行为和毒理效应等成为环境领域的研究热点[1, 4-14]。对OPFRs的毒性研究离不开对其在生物体内的浓度水平的检测,目前国内外对生物体中OPFRs的检测报道主要采用气相色谱法(GC)、气相色谱-质谱法(GC-MS)和气相色谱-串联质谱法(LC-MS/MS)[15-16]。用气相色谱测定OPFRs,在确证方面存在不足,易产生假阳性;气相色谱-质谱法在定性方面优于气相色谱,但由于基质产生的碎片离子有时会对目标物产生干扰,所以在定性方面尚存在不足;气相色谱-串联质谱法通过离子对方式定性化合物,可以弥补GC和GC-MS法在确证方面的不足,且具有杂质影响小,对净化要求低、灵敏度高、适合多组分同时分析等特点。
此外,在分析过程中,样品前处理过程耗费时间最长,一般占整个分析过程的2/3以上的时间,因此,样品前处理过程对分析结果的影响很大。自动化的前处理设备不仅可以大大缩短前处理时间,还能减少人为操作的误差。本研究建立了用自动索氏提取仪和自动凝胶渗透色谱(GPC)净化仪净化生物样品基质,同时测定生物体中10种OPFRs的气相色谱串联质谱法。
1 实验部分(Experimental section)
1.1 仪器、材料与试剂
Foss2050型Soxtec全自动索氏抽提系统(丹麦,Foss公司);全自动凝胶渗透色谱系统(德国,LC-tech,型号Freestyle GPC EVA)含自动凝胶渗透色谱(凝胶渗透色谱柱25 mm×50 cm,填料为50 g的Biobeads SX-3)和在线浓缩装置;Thermo TSQ Quantum XLS三重四级杆气相色谱质谱联用仪(GC-MS/MS),DB-5 MS色谱柱(325 ℃, 30 m×250 μm×0.25 μm);氮吹仪(北京八方世纪科技有限公司,型号BF-2000);FD-80冷冻干燥机(北京博医康)等实验设备。
Florisil小柱:500 mg,3 mL(CNW Technologies);丙酮、正己烷、环己烷和乙酸乙酯均为色谱纯(美国TEDIA);10种OPFRs(具体名称见表1)均为纯品(纯度大于99%,购于德国Dr.Ehrenstorfer公司),d15-磷酸三苯酯(d15-TPP,100 μg·mL-1于异辛烷,AccuStandard)和d27-磷酸三丁酯(d27-TBP,100 μg·mL-1于异辛烷,AccuStandard)为标准溶液。
标准储备液的制备:准确称取10 mg(精确到0.1 mg)OPFRs各标准品分别于10 mL容量瓶中,用乙酸乙酯溶解,配制成1 000 mg·L-1的单标储备液,于-18 ℃条件下储存。
1.2 样品采集和前处理
1.2.1 样品采集与预处理
2014年于惠州市东江某污水处理厂入河排污口附近采集了3条罗非鱼(Oreochromis mossambicus)、2条鲤鱼(Cyprinus carpio)、4条鲢鱼(Hypophthalmichthys molitrix)、3条鳊鱼(Parabramis pekinensis)和6条餐条(Hemiculter leucisculus)。样品运回实验室后,进行解剖,取背脊肌肉用二氯甲烷和正己烷淋滤过的铝箔纸包裹,置于-20 ℃冰箱保存。
1.2.2 自动索氏抽提
每个样品取约10 g湿重,经冷冻干燥处理后,加入约50 g的无水硫酸钠研磨,添加一定量的回收率指示物(d27-TBP),使用Foss索氏抽提仪进行浸提,抽提液为V(丙酮)∶V(正己烷)=1∶1混合提取液80 mL,浸提温度160 ℃,其中浸提时间60 min,淋洗时间60 min。浸提液转换成V(环己烷)∶V(乙酸乙酯)= 1∶1的混合试剂后,转移至管制玻璃瓶待浓缩净化。
1.2.3 自动凝胶色谱净化
自动GPC净化系统采用三联机模式,即浓缩—净化—浓缩。上述浸提液经浓缩并转换溶剂为V(环己烷)∶V(乙酸乙酯)= 1∶1的混合试剂(与GPC流动相溶剂相同)后,再经GPC净化。GPC流动相的柱流速为5.0 mL·min-1,收集时间为900~1 680 s的洗脱液,洗脱液经浓缩为5 mL后,氮吹并转换溶剂为正己烷,浓缩至1 mL,待进一步净化。
1.2.4 Florisil柱净化
取Florisil小柱,先用8 mL乙酸乙酯,再用6 mL正己烷活化,保持该柱湿润,将1.2.3节中洗脱液移至Florisil小柱上,再用2 mL正己烷分2次洗涤样品瓶,将洗涤液一并加到该柱上,待净化液通过该柱后,用8 mL正己烷洗脱,弃去,再用8 mL乙酸乙酯洗脱,收集,收集的洗脱液用氮吹仪氮吹定容至0.5 mL后,加入100 ng内标物d15-TPhP待上机测试。
1.2.5 定性定量分析
仪器条件:DB-5 MS石英毛细管柱,载气为高纯氦气,柱流量为1.2 mL·min-1,进样口温度250 ℃,无分流进样,进样量1 μL;传输线温度280 ℃;离子源温度230 ℃。采用程序升温,初始温度60 ℃,保持1 min,以20 ℃·min-1升至160 ℃,再以10 ℃·min-1升至290 ℃;采用电子轰击离子源(EI),电子能量70 eV,接口温度280 ℃。扫描方式:多反应离子监测模式(MRM),采用“EZ Method”设定方法,在“Start time”设定为“该目标化合物保留时间RT-0.5 min”,在“End time”设定为“该目标化合物保留时间RT+0.5 min”;各种化合物的母离子、子离子、碰撞能量及保留时间见表1。
2 结果与讨论(Results and discussion)
2.1 GPC净化条件的选择
GPC的流动相为V(环己烷)∶V(乙酸乙酯)= 1∶1的混合试剂;混合标准溶液由10种OPFRs和d27-TBP的标准液用3 mL与流动相相同的混合试剂稀释配制而成,进GPC色谱柱量均为100 ng。运行LC-tech全自动凝胶渗透色谱仪将该混合标准溶液全量输入到色谱柱内进行GPC淋洗净化实验,其初始设置参数为:流速5 mL·min-1(恒流方式);Forerun(杂质丢弃时间)780 s;Mainrun(收集时间) 900 s(连续收集15段淋洗液,每段60 s);Tailing时间300 s。
所收集的上述15段淋洗液氮吹定容到0.5 mL,加入内标物d15-TPP后,用GC-MS/MS进行测定,得到10种OPFRs和d27-TBP的GPC淋洗时间与各组分的累积回收率关系曲线(图1)。从淋洗曲线可知,OPFRs和d27-TBP的淋出区间为900~1 680 s。
然而,在900~1 680 s的淋出区间中,动物脂肪可能同时洗出,为此,以玉米油代表动物脂肪,测定了玉米油在紫外波长λ=254 nm时的淋洗曲线。从淋洗曲线可知,玉米油在900 s、960 s和1 020 s时的回收率分别为55.4%、85.2%和100%(图1)。因此,为尽可能在保证目标物的回收率下去除较多的动物脂肪,选择OPFRs和d27-TBP的收集时间为960~1 680 s。
2.2 质谱条件优化
质谱扫描选择多反应监测模式(MRM)。为获得最佳的色谱条件,保证对目标物定量和定性的准确性,对目标物的母离子、子离子、碰撞能量等一系列质谱参数进行了优化。首先采用全扫描(full scan)方式获取待测物的母离子,之后采用子离子扫描方式(product scan),并通过不断改变碰撞能量获得子离子响应最高时的最优碰撞能量。最后,每个OPFR单体选择最优的2~3对离子对和相应的碰撞能量,对目标物进行定性和定量分析。10种OPFRs、d27-TBP和d15-TPhP的质谱条件详见表1,色谱分离效果可见图2。
2.3 线性关系和方法检出限
用阴性基质溶液与有机磷阻燃剂混合溶液配制成浓度分别为0.010、0.020、0.050、0.100、0.200、0.500、1.00 mg·L-1的OPFRs基质标准溶液,用峰面积对浓度作图,得到线性范围和线性相关系数,以每种OPFR的3倍信噪比时的添加浓度确定为检出限,以10倍信噪比的添加浓度确定了定量限。结果表明(表1),在相应的质量范围内,各OPFRs的响应值与其质量浓度均呈良好的线性关系,相关系数均高于0.99,方法的LOD范围为0.002~0.192 ng·g-1湿重,LOQ的范围为0.005~0.641 ng·g-1湿重。

表1 多反应监测模式下有机磷阻燃剂(OPFRs)的保留时间、监测离子对、碰撞能量、线性相关系数和方法的回收率及相对标准偏差(n=3)Table 1 The retention time, ion pair, collision energy, linear correlation of organophosphorus flame retardants (OPFRs) in the MRM mode, and the recovery and relative standard deviation of the method (n=3)

图1 有机磷阻燃剂各组分和玉米油的自动凝胶渗透色谱(GPC)淋洗曲线Fig. 1 The gel permeation chromatography (GPC) elution curves of organophosphorus flame retardants, including their recoveries

图2 MRM模式的质谱条件下有机磷阻燃剂的色谱图Fig. 2 The chromatogram of organophosphorus flame retardants in the MRM mode of the mass spectrum
2.4 质量控制与质量保证(QA/QC)
所有玻璃器皿使用前均用丙酮、二氯甲烷和正己烷依次洗涤2次。在分析过程中,增加了控制样品分析流程(3个方法空白、3个加标空白、3个阴性样品加标和3个样品平行样)等质量控制与质量保证措施。在样品提取前,向每个分析样品加入d27-TBP回收率指示物,用于监测样品的制备与分析及基质的影响。在阴性基质加标和空白加标中加入100 ng的10种OPFRs混合标准溶液,其中阴性基质取样量为20.0 g,OPFRs的质量浓度为5.00 ng·g-1湿重。基质加标和空白加标实验主要检测目标化合物的回收率。在样品分析时,用已知浓度标样检查仪器的灵敏度和稳定性。结果显示,3个方法空白中均未检出OPFRs,基质加标和空白加标中各OPFRs的加标回收率在48.7%~122%之间,样品平行样中80%的OPFRs的对偏差小于10%。
3 实际样品测定(Determination of the actual samples)
应用建立的方法对采自东江某污水处理厂入河排污口5种鱼类中的10种OPFRs进行检测,检出的OPFR单体和总量(∑OPFRs)的浓度见表2,样品中回收率指示物d27-TBP的回收率范围在82.4%~114%之间。
OPFRs在鱼类样品中的检出率极低,检出的4个单体为TPrP、TBP、TCEP和TCiP,它们在所有鱼肉样品中的检出率分别为5.56%、38.9%、50.0%和33.3%。TPrP仅在1条鳊鱼中检出,含量为0.961 ng·g-1湿重(85.8 ng·g-1脂重);TBP在罗非鱼、鲤鱼和餐条中的含量为nd~2.42 ng·g-1湿重(nd~209 ng·g-1脂重),在鳊鱼和鲢鱼中未检出;TCEP在鲤鱼、鳊鱼和餐条中检出,含量为nd~4.96 ng·g-1湿重(nd~148 ng·g-1脂重);TCiP在鲤鱼和鳊鱼中检出,含量为nd~2.42 ng·g-1湿重(nd~121 ng·g-1脂重)。Ma等[9]报道了珠江三角洲地区渔民采集的胡子鲶和草鱼肌肉中TBP、TCEP和TCiP的含量分别为43.9~2 946 ng·g-1脂重,82.7~4 692 ng·g-1脂重和62.7~883 ng·g-1脂重,其浓度水平高于本研究鱼类一个数量级,可能是由于该研究的采样地点处于电子垃圾污染区。国外报道的鲈鱼、鲤鱼、贻贝等体内均发现了高于本研究一个数量级的OPFRs[2],可能是由于物种的差异。
综上所述,采用自动索式抽提-凝胶渗透色谱和Florisil柱净化-GC-MS/MS测定淡水鱼体中OPFRs,通过实验条件优化,该方法OPFRs的加标回收率在48.7%~122%之间,相对标准偏差除TEP(17.7%)和TDCP(11.9%)外均小于10%,生物样品中回收率指示物d27-TBP的回收率范围在82.4%~114%之间,具有较好的准确度和精密度,该方法自动化程度较高,灵敏度高、操作简单快捷且重现性好,节约了时间和成本,可用于实际生物样品的分析和测定。
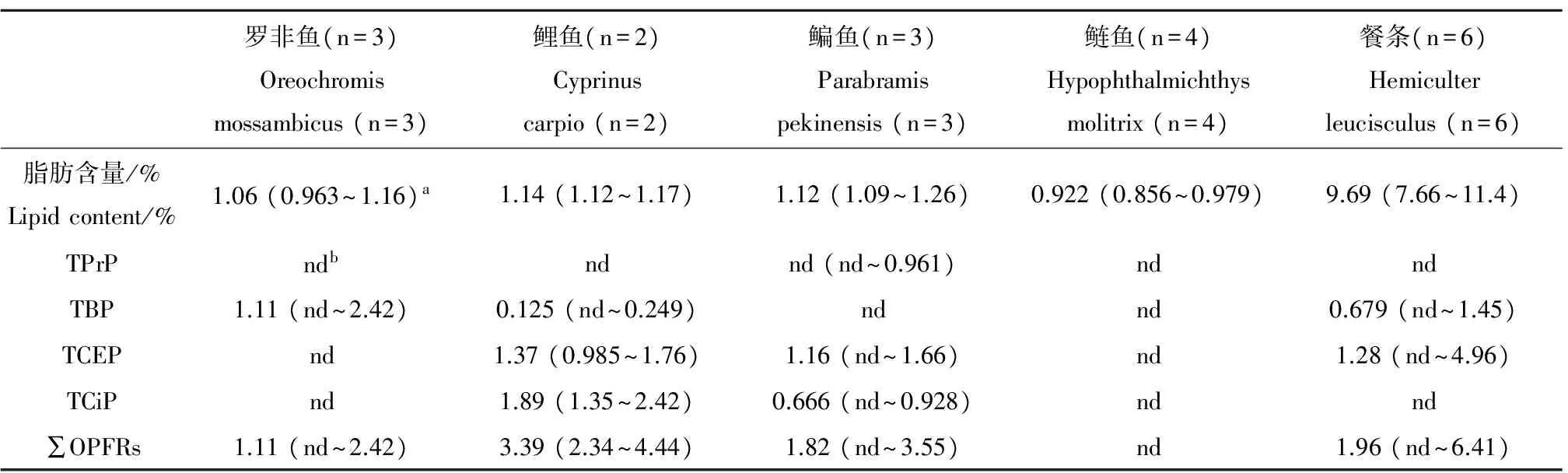
表2 5种鱼类中有机磷阻燃剂的含量(ng·g-1湿重)Table 2 The concentrations of organophosphorus flame retardants in the five kinds of fish (ng·g-1 wt)
注:a中值(范围);b未检出。
Note:amedium value (range);bnot detected.
[1] Chen D, Letcher R J, Chu S. Determination of non-halogenated, chlorinated and brominated organophosphate flame retardants in herring gull eggs based on liquid chromatography-tandem quadrupole mass spectrometry [J]. Journal of Chromatography A, 2012, 1220: 169-174
[2] Wei G L, Li D Q, Zhuo M N, et al. Organophosphorus flame retardants and plasticizers: Sources, occurrence, toxicity and human exposure [J]. Environmental Pollution, 2015, 196: 29-46
[3] Pang L, Liu J, Yin Y, et al. Evaluating the sorption of organophosphate esters to different sourced humic acids and its effects on the toxicity to Daphnia magna [J]. Environmental Toxicology and Chemistry, 2013, 32(12): 2755-2761
[4] Tan X X, Luo X J, Zheng X B, et al. Distribution of organophosphorus flame retardants in sediments from the Pearl River Delta in South China [J]. Science of the Total Environment, 2016, 544: 77-84
[5] He C T, Zheng J, Qiao L, et al. Occurrence of organophosphorus flame retardants in indoor dust in multiple microenvironments of southern China and implications for human exposure [J]. Chemosphere, 2015, 133: 47-52
[6] Brandsma S H, de Boer J, van Velzen M J, et al. Organophosphorus flame retardants (PFRs) and plasticizers in house and car dust and the influence of electronic equipment [J]. Chemosphere, 2014, 116: 3-9
[7] Cristale J, Katsoyiannis A, Sweetman A J, et al. Occurrence and risk assessment of organophosphorus and brominated flame retardants in the River Aire (UK) [J]. Environmental Pollution, 2013, 179: 194-200
[8] Moller A, Xie Z, Caba A, et al. Organophosphorus flame retardants and plasticizers in the atmosphere of the North Sea [J]. Environmental Pollution, 2011, 159(12): 3660-3665
[9] Ma Y, Cui K, Zeng F, et al. Microwave-assisted extraction combined with gel permeation chromatography and silica gel cleanup followed by gas chromatography-mass spectrometry for the determination of organophosphorus flame retardants and plasticizers in biological samples [J]. Analytica Chimica Acta, 2013, 786: 47-53
[10] Kim J W, Isobe T, Chang K H, et al. Levels and distribution of organophosphorus flame retardants and plasticizers in fishes from Manila Bay, the Philippines [J]. Environmental Pollution, 2011, 159(12): 3653-3659
[11] Kim J W, Isobe T, Muto M, et al. Organophosphorus flame retardants (PFRs) in human breast milk from several Asian countries [J]. Chemosphere, 2014, 116: 91-97
[12] Kim J W, Isobe T, Sudaryanto A, et al. Organophosphorus flame retardants in house dust from the Philippines: Occurrence and assessment of human exposure [J]. Environmental Science and Pollution Research, 2013, 20(2): 812-822
[13] Sundkvist A M, Olofsson U, Haglund P. Organophosphorus flame retardants and plasticizers in marine and fresh water biota and in human milk [J]. Journal of Environmental Monitoring, 2010, 12(4): 943-951
[14] Liang K, Liu J. Understanding the distribution, degradation and fate of organophosphate esters in an advanced municipal sewage treatment plant based on mass flow and mass balance analysis [J]. Science of the Total Environment, 2016, 544: 262-270
[15] Quintana J B, Rodil R, Reemtsma T, et al. Organophosphorus flame retardants and plasticizers in water and air II. Analytical methodology [J]. TrAC Trends in Analytical Chemistry, 2008, 27(10): 904-915
[16] Wang X W, Liu J F, Yin Y G. Development of an ultra-high-performance liquid chromatography-tandem mass spectrometry method for high throughput determination of organophosphorus flame retardants in environmental water [J]. Journal of Chromatography A, 2011, 1218(38): 6705-6711
◆
AutomaticPretreatmentandDeterminationofOrganophosphorusFlameRetardantsinFreshwaterFishSamplesbyGasChromatographyTandemMassSpectrometry
Zhang Ying*, Wei Lifei, Liu Shengyu, Liu Wei, Liu Xinyu, Li Yi
Scientific Institute of Pearl River Water Resources Protection, Monitoring Centre of Pearl River Valley Aquatic Environment, Guangzhou 510611, China
10.7524/AJE.1673-5897.20170114009
2017-01-14录用日期2017-03-20
1673-5897(2017)3-604-07
X171.5
A
张荧(1984—),女,环境科学博士,高级工程师,主要研究方向为水环境中有机污染物的迁移和转化,发表学术论文30余篇。
国家自然科学基金项目(41303082);
张荧(1984-),女,工程师,研究方向为水环境有机污染物监测,E-mail: cec_007@126.com;
张荧, 魏立菲, 刘胜玉, 等. 自动化前处理-气相色谱串联质谱法测定淡水鱼体中的有机磷阻燃剂[J]. 生态毒理学报,2017, 12(3): 604-610
Zhang Y, Wei L F, Liu S Y, et al. Automatic pretreatment and determination of organophosphorus flame retardants in freshwater fish samples by gas chromatography tandem mass spectrometry [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 604-610 (in Chinese)

