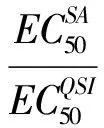基于QSAR模型的磺胺与群体感应抑制剂对枯草芽孢杆菌联合慢性毒性规律初探
张跃恒,王大力,高丹,孙昊宇,印春生, *,林志芬
1. 上海海洋大学海洋科学学院,上海 2013062. 污染控制与资源化研究国家重点实验室,同济大学环境科学与工程学院,上海 200092
基于QSAR模型的磺胺与群体感应抑制剂对枯草芽孢杆菌联合慢性毒性规律初探
张跃恒1,王大力2,高丹2,孙昊宇2,印春生1, *,林志芬2
1. 上海海洋大学海洋科学学院,上海 2013062. 污染控制与资源化研究国家重点实验室,同济大学环境科学与工程学院,上海 200092
群体感应抑制剂是抗生素最有可能的替代品,两者在环境中的共存会对生物造成联合毒性影响。以革兰氏阳性菌枯草芽孢杆菌(Bacillus subtilis,B. subtilis)为模式生物,3种群体感应抑制剂(呋喃酮、吡咯酮和吡咯)和磺胺类药物为研究对象,测定了20 h单一和联合毒性。结果显示,3种群体感应抑制剂和磺胺的联合毒性分别表现为相加和拮抗。同时根据不同的联合毒性效应,以药物和蛋白分子的对接结合能(Ebinding)作为结构参数分别构建了联合毒性的QSAR模型,并分析了不同毒性效应下混合物中各组分的相互作用关系。结果表明,无论是相加还是拮抗,在二元混合体系中磺胺与其靶蛋白DHPS的有效结合浓度总是高于群体感应抑制剂与LuxS的有效结合浓度;但当产生拮抗作用时,磺胺与DHPS的有效结合浓度相对较低,推测可能是群体感应抑制剂的存在使得磺胺由分子态变为离子态,从而使其难以穿过细胞壁与DHPS结合导致的。本研究为建立和分析联合毒性的QSAR模型提供了一定的理论基础。
枯草芽孢杆菌;磺胺;群体感应抑制剂;慢性联合毒性;定量结构-活性相关
Received12 January 2017accepted2 March 2017
Abstract: Quorum sensing inhibitors (QSIs) are a promising alternative to the antibiotics, and the coexistence of antibiotics and QSIs could lead to joint toxic effect on ecosystem. Individual and combined toxicity of sulfonamides and QSIs to Bacillus subtilis (B. subtilis) were determined in this study, which showed that the joint toxic action of sulfonamides and QSIs was addition or antagonism. Based on different joint toxic action, QSAR models were developed using the interaction energies (Ebinding) between drugs and related proteins, and the relationships of components in mixtures were discussed, respectively. It was found that effective binding concentration of sulfonamides with its target protein (DHPS) was higher than that of QSIs with LuxS in spite of different joint toxic actions. However, in the case of synergistic effect, effective binding concentration of sulfonamides with DHPS was relatively lower since sulfonamides changed from molecular state to ionic state with the impact of some QSIs, leading to impossible entering into the cell. This study can provide theoretical basis for the establishment and analysis of QSAR models of joint toxicity.
Keywords: Bacillus subtilis; sulfonamides; QSI; chronic mixture toxicity; QSAR
抗生素广泛应用于医疗及畜牧养殖行业,是世界上用量最大、使用最广泛的药物之一。大部分抗生素不能完全被机体吸收,有80%~90%经由人体和畜禽粪尿排入环境[1-2]。抗生素等药物的过量使用还能导致细菌的耐药性的不断增强[3],因此控制抗生素使用量以及开发新型抗菌药迫在眉睫。群体感应抑制剂(quorum sensing inhibitors,QSIs)是一种作用于细菌群体感应信号通路(quorum-sensing, QS)的药物,它能在不影响细菌生长的情况下,有效隔断细菌毒力因子的形成,同时不对细菌产生选择压力,不会使细菌产生耐药性[4],所以QSIs被认为是抗生素的有效替代品。然而将QSIs直接作用于细菌时,抗菌效果并不理想,因此将QSIs与抗生素联合作用于细菌,可能会提高抗菌效率,同时减少抗生素的使用[5]。另一方面,QSIs进入环境后可能和环境中已存在的抗生素共存[2, 6],对生物产生联合毒性,因此研究抗生素和QSIs的联合毒性具有重要意义。
关于抗生素和QSIs的联合毒性已经开展了部分工作。有研究者发现吡咯类、吡咯酮类QSIs和磺胺对大肠杆菌(Escherichia coli,E.coli)的12 h联合毒性产生了相加或拮抗作用[7];另有人以发光菌(Vibrio fischeri, V. fischeri)为模式生物,用QSIs和磺胺对其进行了15 min联合毒性实验(发光抑制),实验结果显示联合毒性分别显示为协同、相加和拮抗[8]。然而这些研究大都是以革兰氏阴性菌为模式生物进行的。由于针对革兰氏阳性菌的联合毒性鲜有报道,且革兰氏阳性菌和革兰氏阴性菌的拥有不同的群体感应系统[9],联合毒性结果可能存在差异,所以本文对磺胺和群体感应抑制剂对革兰氏阳性菌的联合毒性进行了研究。
目前在混合污染物联合毒性研究中,定量结构-活性相关(QSAR)以其简单方便、经济实用、预测功能强大而成为一种预测混合物联合毒性的有效途径[10]。Zou等[11]在构建混合物对V. fischeri急性和慢性毒性作用的QSAR模型时,将药物分子与蛋白的相互作用能Ebinding值引入方程中,预测方程的决定系数R2分别达到0.999和0.998。Long等[12]和Fang等[13]分别构建了磺胺和其他抗生素对E.coli 12 h、对枯草芽孢杆菌(Bacillus subtilis,B. subtilis)20 h联合毒性作用的QSAR模型,并且指出联合毒性的结果不仅取决于Ebinding值的大小,也可能取决于“有效作用浓度”,为揭示混合物的联合毒性机制提供了一种新思路。
本文以磺胺类抗生素和3类QSIs(呋喃酮、吡咯和吡咯酮)为研究对象,以革兰氏阳性菌B. subtilis为模式生物,研究了抗生素和QSIs的单一及二元联合毒性;此外结合分子对接技术,按联合毒性效果的不同分别构建了抗生素和QSIs二元联合毒性的QSAR模型,并对QSAR模型进行讨论和分析。本文为QSAR模型的建立和分析提供了一定理论基础。
1 材料与方法(Materials and methods)
1.1 实验试剂及受试生物
实验所用抗生素及群体感应抑制剂均购自Sigma-Aldrich有限公司(St. Louis, MO, USA)(纯度>99%),药物信息如表1所示。枯草芽孢杆菌(Bacillus subtilis 168)购自普如汀生物技术有限公司。
1.2 毒性测定及表征方法
1.2.1 培养基及菌液配制
培养基:称取蛋白胨2.50 g,酵母提取物1.25 g,NaCl 1.00 g,加入100 mL蒸馏水溶解,调节pH值为7.0~7.2,高压蒸汽灭菌锅中121 ℃灭菌20 min,制成2.5倍LB培养基。在毒性测试体系中,2.5倍培养基将被稀释成单倍。
菌液配制:将第三代斜面菌种接种至5 mL单倍培养基中,在37 ℃、180 r·min-1条件下振荡培养至对数生长期,用1% NaCl溶液稀释对数生长期的菌液,使菌群密度维持在103cell·mL-1左右,搅拌40 min作为实验菌液备用。
将实验试剂用1% NaCl溶液配制成等对数浓度梯度的系列溶液(助溶剂二甲亚砜<0.5%)。实验时加入系列浓度梯度的化合物80 μL至96孔板中,同时加入2.5倍LB培养基80 μL和40 μL实验菌液。每个梯度设置3个平行,每个板设置18个空白对照,温度设置为37 ℃培养20 h,并用Thermo化学发光读数仪(1510,上海宝赛生物科技有限公司)测定光密度OD620。
1.2.2 单一毒性表征
化合物的单一毒性采用其对受试菌的半数效应浓度EC50来表征。以化合物浓度的负对数为横坐标,抑制率为纵坐标绘制剂量-效应曲线,进行线性回归并得到抑制率-负对数浓度方程,求得50%抑制率对应的化合物浓度即为EC50。抑制率计算公式如式(1):
In%=1-OD/OD0×100%
(1)
式中OD为培养20 h后实验组的测量值,OD0为空白对照组的测量值,In(%)为抑制率。
1.2.3 联合毒性表征
根据单一化合物毒性的EC50值,配制抗生素和QSIs等毒性比的混合溶液。按照单一毒性实验的方法进行实验,测定混合溶液的毒性并得到混合溶液的EC50mix值。联合毒性采用指标TU表征,计算方法如式(2)所示:
TU=CA/EC50A+CB/EC50B
(2)
式中CA和CB分别表示化合物A和化合物B在混合体系中的摩尔浓度(mol·L-1), EC50A和EC50B分别表示化合物A和化合物B的半数效应浓度。
根据Broderiu等[14]的联合毒性判定标准,当TU<0.8时,认为两组分之间存在的是协同效应;0.8>TU>1.2认为两组分之间存在的是加和效应;TU>1.2认为两组分之间存在的是拮抗效应。
1.2.4 分子对接及Ebinding值计算
本文采用Discovery studio 3.1(Accelrys Software Inc.)中的CDOCKER模块进行分子对接,研究了磺胺和QSIs与相关蛋白的相互作用。由于枯草芽孢杆菌中的二氢叶酸合成酶(DHPS)以及信号分子AI-2的合成蛋白LuxS的三级结构都为未见发表,所以需要进行同源建模,具体如下:以Bacillus anthracis中DHPS的三级结构1TWS(PDB:http://www.rcsb.org)为模板,根据草芽孢杆菌的 DHPS氨基酸序列AIU75013.1(NCBI:https://www.ncbi.nlm.nih.gov)进行同源建模,获得枯草芽孢杆菌的DHPS三维结构;以Salmonella typhimurium中的LuxS的三级结构1TJY为模板,根据枯草芽孢杆菌的LuxS氨基酸序列2FQT进行同源建模,获得枯草芽孢杆菌的LuxS三维结构。将磺胺和QSIs分别与其作用靶蛋白对接,以CDOCKER interaction energy (Ebinding,kcal·mol-1)为评价参数,以Ebinding最大负值作为最稳定构象[15]。
1.2.5 QSAR模型建立
QSAR是用来描述分子的物理化学性质与分子生物活性之间关系的模型,本文参照相关研究[11-13]中使用的方法,以分子对接结合能(Ebinding)为结构参数构建了抗生素和QSIs单一和联合毒性的QSAR模型,并利用可决系数(R2)、Fisher值(F)和显著水平(P)来对方程拟合效果进行说明。
2 结果与讨论(Results and discussion)
2.1 抗生素和QSIs的单一毒性
抗生素和QSIs分别单独作用于B. subtilis时,都可以表现出一定程度的抑菌作用。两者单一毒性的-lgEC50(mol·L-1)值如表1所示,其中磺胺类药物的-lgEC50(mol·L-1)为4.33~5.66,毒性从小到大依次为:SPY 图1 磺胺和QSIs对枯草芽孢杆菌20 h的单一毒性效应Fig. 1 Single toxicity of sulfonamides and QSIs to Bacillus subtilis 168 under 20 h exposure 表1 磺胺和群体感应抑制剂(QSIs)的单一毒性及EbindingTable 1 Single toxicity and Ebinding values of sulfonamides and QSIs 有研究显示,磺胺类药物对E. coli的慢性单一毒性-lgEC50(mol·L-1)为5.29~6.35[7,16],整体上大于磺胺对B. subtilis的毒性,推测这可能是革兰氏阳性菌(B. subtilis)的细胞壁比革兰氏阳性菌(E. coli)的细胞壁厚,且肽聚糖含量较高而导致的[13]。 利用分子对接技术,我们分别模拟了磺胺和DHPS、QSIs和LuxS的相互作用,并计算了结合能Ebinding。磺胺类药物是对氨基苯甲酸(pABA)的结构类似物(图2),它能够竞争性地抑制DHPS的活性从而抑制细菌的生长[17-18];而QSIs作为群体感应抑制剂,它的作用途径可能有3种,即作用于信号分子的受体蛋白、信号分子的合成蛋白以及和信号分子本身相互作用[19]。 革兰氏阳性菌中主要存在2种群体感应系统,第1种是种内群体感应系统,第2种是种间群体感应系统。在本文研究中,我们所使用的QSIs的结构和第2种群体感应系统的信号分子呋喃酮酰硼酸二酯(AI-2)类似(如图2)。然而由于在B. subtilis中尚未发现AI-2的受体蛋白[20],因此在本文中我们只考虑QSIs与B. subtilis的信号分子合成蛋白LuxS的结合情况。从分子对接的结果上看(表1),磺胺类药物与其靶蛋白DHPS的Ebinding值在-26.06 kcal·mol-1到-43.09 kcal·mol-1之间,而QSIs和LuxS的Ebinding值介于-11.85 kcal·mol-1和-19.30 kcal·mol-1之间,整体上磺胺与DHPS的Ebinding值大于QSIs和LuxS的Ebinding值。 为验证Ebinding和单一毒性的关系,尝试以Ebinding值为结构参数,结合单一毒性-lgEC50值进行回归,得到回归方程如式(3): -lgEC50=-0.17×Ebinding-0.95 (3) n=19 R2= 0.84 F =94.06 P=0.00 式中,Ebinding为磺胺或QSIs与对应蛋白的结合能。方程决定系数R2达到0.84,这意味着药物的单一毒性的大小与结合能具有很好的相关性。 图2 磺胺和QSIs对枯草芽孢杆菌的毒性机理Fig. 2 Toxic mechanisms of sulfonamides and QSIs in B. subtilis 图3 二元混合物慢性联合毒性Fig. 3 The chronic joint effects of sulfonamides and QSIs 2.2 抗生素和QSIs的联合毒性 2.2.1 联合毒性的作用类型 磺胺类抗生素和QSIs对枯草芽孢杆菌的联合作用绝大部分表现出相加和拮抗(图3)。其中,Fur、2M3o、DL-P和L-Pr同磺胺的联合毒性TU值均大于1.20,呈现出拮抗作用;而2-Py、NV2P、γ-V和磺胺的联合毒性TU值大都位于0.80和1.20之间,表现出相加作用;仅有2-Py 和SPY的TU值为0.59,显示为协同作用。由于协同作用现象只出现了1次,数量过少,不具有代表性,因此在QSAR建模过程中将把该点剔除。 众所周知,磺胺和QSIs对B. subtilis的作用通路是相互独立的(图2),即分别作用于叶酸代谢通路和群体感应信号通路。因此理论上两者的联合毒性应该显示为相加,然而我们的部分实验结果显示出了拮抗,其原因可能是由于部分QSIs的存在可以使磺胺由分子态变为离子态,而离子形态的磺胺药物是难以通过细胞壁进入细菌胞内,从而产生毒性的[21],因此本文实验结果会显示为拮抗。 2.2.2 联合毒性的QSAR预测模型 在上文讨论单一毒性的部分,我们已经将Ebinding值为结构参数进行回归(式(3))并建立方程,获得了单一毒性-lgEC50值和Ebinding值之间较好的相关关系。在这里参照Zou等[11]的方法,继续尝试以Ebinding值为结构参数,建立联合毒性的回归方程。 首先尝试将以上所有实验数据进行回归,回归方程如式(4): (4) n=48 R2=0.46 F =19.70 P=0.00 图4 二元混合物中两组分表观浓度比和有效作用浓度比Fig. 4 Ratios of nominal and actual concentrations of individual chemicals in binary toxicity 式(4)中的R2值仅为0.46,回归结果较差,推测原因可能是磺胺和QSIs的联合毒性属于2种不同的作用类型。 因此,我们尝试根据联合作用(TU)的效果不同,将实验数据分为相加组和拮抗组进行线性回归,回归方程如下: (5) n=21 R2=0.91 F=92.5 P=0.00 (6) n=27 R2=0.78 F = 42.25 P=0.00 式(5)和式(6)分别代表相加组和拮抗组的回归方程,两方程的决定系数R2分别达到0.91和0.78,结果较好。这说明进行分组后,各组内磺胺和QSIs的联合毒性与二者和对应蛋白的结合能有较好的相关关系。 由于混合体系是按等毒性浓度进行配制的,所以表观浓度比即为半数效应浓度之比: (7) 我们用Ri表示磺胺和QSIs的有效结合浓度比。结合式(5)、(6)、(7)可分别得到相加组和拮抗组中的Ri值: (8) 本文的章节2.2.1部分曾推测在联合毒性作用中,磺胺和QSIs的拮抗效应产生的原因可能是部分QSIs能够使磺胺由分子态变为离子态,导致后者难以穿过细胞壁进入细胞、产生毒性。结合上文关于有效结合浓度的讨论,可以较为完整地解释拮抗效应产生的过程。推论过程如下: 当2种药物组分产生拮抗作用,即两者作用过程相互干扰时,Ri值较小(式(9)),即有效结合浓度变小。当2种药物组分产生相加作用,即毒性效果互不影响时,则Ri值较大(式(8)),有效结合浓度较大;这预示着磺胺和QSIs联合作用于枯草芽孢杆菌时,一部分QSIs可以使磺胺由分子态变为离子态,离子态的磺胺难以进入细胞内,则磺胺与DHPS的有效结合浓度就相对降低(Ri较小),最后联合作用表现为拮抗;与之相对的,如果QSIs可以和磺胺分子共存,则磺胺就会较为容易的进入细胞内,与DHPS的有效结合浓度也会较高(Ri较大),最后联合作用表现为相加。 [1] Kümmerer K. Antibiotics in the aquatic environment - A review - Part I [J]. Chemosphere, 2009, 75(4): 417-434 [2] Kümmerer K. Antibiotics in the aquatic environment - A review - Part II [J]. Chemosphere, 2009, 75(4): 435-441 [3] 杨红莲, 袭著革, 闫峻, 等. 新型污染物及其生态和环境健康效应[J]. 生态毒理学报, 2009, 4(1): 28-34 Yang H L, Xi Z G, Yan J, et al. Ecological and environmental health effects of emerging contaminant of concern [J]. Asian Journal of Ecotoxicology, 2009, 4(1): 28-34 (in Chinese) [4] Njoroge J, Sperandio V. Jamming bacterial communication: New approaches for the treatment of infectious diseases [J]. Embo Molecular Medicien, 2009, 1(4): 201-210 [5] 程古月, 郝海红, 戴梦红, 等. 病原菌的群体感应及其抑制剂的研究进展[J]. 科学通报, 2012, 57(21): 1964-1977 Cheng G Y, Hao H H, Dai M H, et al. Quorum sensing of pathogenic bacteria and quorum-sensing inhibitors [J]. Chinese Science Bulletin, 2012, 57(21): 1964-1977 (in Chinese) [6] Kemper N. Veterinary antibiotics in the aquatic and terrestrial environment [J]. Ecological Indicators, 2008, 8(1):1-13 [7] 刘灿, 葛鸿铭, 龙茜, 等. 磺胺与群体感抑制剂对大肠杆菌的联合毒性机制初探[J]. 环境化学, 2015, 34(10): 1854-1859 Liu C, Ge H M, Long X, et al. A preliminary investigation on the mechanism of binary mixture toxicity containing sulfonamides and quorum sensing inhibitors on Escherichia coli [J]. Environmental Chemistry, 2015, 34(10): 1854-1859 (in Chinese) [8] 安情情, 姚志峰, 顾宇菲, 等. 磺胺类抗生素与群体感应抑制剂对发光菌的联合毒性及其机制初探[J]. 环境化学, 2014, 33(12): 2068-2075 An Q Q, Yao Z F, Gu Y F, et al. Joint effects and mechanisms of binary toxicity of sulfa antibiotics and quorum sensing inhibitors to Vibrio fischeri [J]. Environmental Chemistry, 2014, 33(12): 2068-2075 (in Chinese) [9] 孙琦, 梁经纬, 王琳, 等. 细菌群体感应抑制剂的研究进展[J]. 化学与生物工程, 2016, 33(2): 15-21 Sun Q, Liang J W, Wang L, et al. Research progress on bacterial quorum sensing inhibitors [J]. Chemistry & Bioengineering, 2016, 33(2): 15-21 (in Chinese) [10] Xu S, Nirmalakhandan N. Use of QSAR models in predicting joint effects in multi-component mixtures of organic chemicals [J]. Water Research, 1998, 32(8): 2391-2399 [11] Zou X, Zhou X, Lin Z, et al. A docking-based receptor library of antibiotics and its novel application in predicting chronic mixture toxicity for environmental risk assessment [J]. Environmental Monitoring & Assessment, 2013, 185(6): 4513-4527 [12] Long X, Wang D, Lin Z, et al. The mixture toxicity of environmental contaminants containing sulfonamides and other antibiotics in Escherichia coli: Differences in both the special target proteins of individual chemicals and their effective combined concentration [J]. Chemosphere, 2016, 158: 193-203 [13] Fang S, Wang D, Zhang X, et al. Similarities and differences in combined toxicity of sulfonamides and other antibiotics towards bacteria for environmental risk assessment [J]. Environmental Monitoring & Assessment, 2016, 188(7): 429 [14] Broderius S J, Kahl M D, Hoglund M D. Use of joint toxic response to define the primary mode of toxic action for diverse industrial organic chemicals [J]. Environmental Toxicology & Chemistry, 2010, 14(9): 1591-1605 [15] Dai Y, Wang Q, Zhang X, et al. Molecular docking and QSAR study on steroidal compounds as aromatase inhibitors [J]. European Journal of Medicinal Chemistry, 2010, 45(12): 5612-5620 [16] 苏冰梅, 王婷, 方淑霞, 等. 喹诺酮类与磺胺类药物对枯草芽孢杆菌与大肠杆菌的联合毒性及其机制初探[J]. 环境化学, 2015, 34(11): 1975-1980 Su B M, Wang T, Fang S X, et al. The combined toxicity of quinolones and sulfonamides on Bacillus subtilis and Escherichia coli [J]. Environmental Chemistry, 2015,34(11): 1975-1980 (in Chinese) [17] Achari A, Somers D O, Champness J N, et al. Crystal structure of the anti-bacterial sulfonamide drug target dihydropteroate synthase [J]. Nature Structural Biology, 1997, 4(6): 490-497 [18] Sköld O. Sulfonamide resistance: Mechanisms and trends [J]. Drug Resistance Updates Reviews & Commentaries in Antimicrobial & Anticancer Chemotherapy, 2000, 3(3): 155-160 [19] Rasmussen T B, Givskov M. Quorum-sensing inhibitors as anti-pathogenic drugs [J]. International Journal of Medical Microbiology, 2006, 296(2-3): 149-161 [20] Rezzonico F, Duffy B. Lack of genomic evidence of AI-2 receptors suggests a non-quorum sensing role for luxS, in most bacteria [J]. BMC Microbiology, 2008, 8(1): 154 [21] Wang D, Lin Z, Ding X, et al. The comparison of the combined toxicity between Gram-negative and Gram-positive bacteria: A case study of antibiotics and quorum-sensing inhibitors [J]. QSAR & Combinatorial Science, 2016, 35(2): 54-61 [22] Zou X, Lin Z, Deng Z, et al. The joint effects of sulfonamides and their potentiator on Photobacterium phosphoreum: Differences between the acute and chronic mixture toxicity mechanisms [J]. Chemosphere, 2012, 86(1): 30-35 ◆ APreliminaryInvestigationontheChronicSingleandMixtureToxicityofSulfonamidesandQuorumSensingInhibitorstoBacillussubtilisBasedonQSAR Zhang Yueheng1, Wang Dali2, Gao Dan2, Sun Haoyu2, Yin Chunsheng1, *, Lin Zhifen2 1. College of Marine Science, Shanghai Ocean University, Shanghai 201306, China2. State Key Laboratory of Pollution Control and Resource Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China 10.7524/AJE.1673-5897.20170112002 2017-01-12录用日期2017-03-02 1673-5897(2017)3-282-08 X171.5 A 印春生(1963-),男,博士,教授,主要研究方向为海洋化学,发表学术论文100余篇。 同济大学污染控制与资源化研究国家重点实验室自主研究项目(PCRRK16007);国家自然科学基金(21377096,21577105);同济大学英才(攀登)计划(0400219287);中央高校基本科研业务费专项资金( 0400219181) 资助 张跃恒(1992-), 男, 硕士研究生, 研究方向为微生物毒理学,E-mail:M150306594@st.shou.edu.cn *通讯作者(Corresponding author), E-mail: csyin@shou.edu.cn 张跃恒, 王大力, 高丹, 等. 基于QSAR模型的磺胺与群体感应抑制剂对枯草芽孢杆菌联合慢性毒性规律初探[J]. 生态毒理学报,2017, 12(3): 282-289 Zhang Y H, Wang D L, Gao D, et al. A preliminary investigation on the chronic single and mixture toxicity of sulfonamides and quorum sensing inhibitors to Bacillus subtilis based on QSAR [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 282-289 (in Chinese)