同胎龄段早产儿支气管肺发育不良的临床特点和高危因素分析
吴荷芬,蔡登华
(贵州省人民医院:1.新生儿科;2.影像科,贵阳 550000)
同胎龄段早产儿支气管肺发育不良的临床特点和高危因素分析
吴荷芬1,蔡登华2△
(贵州省人民医院:1.新生儿科;2.影像科,贵阳 550000)
目的探讨同胎龄段早产儿支气管肺发育不良(BPD)的高危因素和临床特点,为提高临床诊治水平提供参考依据。方法选取贵州省人民医院2012年1月至2016年12月收治的132例BPD早产儿和同期非BPD早产儿137例作为研究对象,并根据临床分度标准将BPD患儿分为轻度BPD组(n=42)和中重度BPD组(n=90)。比较不同分组患儿的临床特点及BPD的高危因素。结果BPD早产儿的高危因素包括低胎龄、低出生体质量、机械通气及输血。中重度BPD组患儿的CPAP或呼吸机持续时间大于7 d以及输血的百分比显著高于轻度BPD组,输血量、吸氧时间和住院时间显著高于轻度组,差异均具有统计学意义(P<0.05)。BPD患儿胎龄小于32周的占92.4%,出生体质量小于1 500 g的占87.1%,在早期主要表现为Ⅰ级呼吸窘迫综合征,随着治疗时间的延长,在4周前轻度组患儿肺透亮度减低的比例逐渐增加;而中重度患者在早期同样表现为Ⅰ级呼吸窘迫综合征,在2~3周后同轻度组,第4周后该组患儿会发展至BPD Ⅳ期。结论BPD早产儿的高危因素包括低胎龄、低出生体质量、机械通气及输血等。根据患儿的临床特点有助于判断BPD的严重程度,对指导临床制订有效的治疗措施和预防病情加重具有重要意义。
支气管肺发育不良;早产儿;临床特征;高危因素
早产儿支气管肺发育不良(bronchopulmonary dysplasia,BPD)是多种因素导致的一种新生儿慢性肺部疾病,临床上主要表现为肺功能低下、神经系统发育障碍等,通常需要较长时间的辅助呼吸才能维持生命,严重影响患儿的生存质量[1]。随着围生医学和新生儿重症治疗技术的快速发展,低出生体质量儿、极低出生体质量儿及超早产儿的存活率逐渐升高,BPD的发病率也随之升高[2]。但目前临床仍缺乏有效的治疗方法,因此分析患儿的临床特点和高危因素,有助于早期辨识和判断BPD的严重程度,从而及时采取有效措施,提高治疗效果。本研究对132例BPD患儿的临床资料进行了分析,旨在为临床诊治提供参考依据。
1 资料与方法
1.1一般资料 收集贵州省人民医院2012年1月至2016年12月收治的早产儿的病例资料进行回顾性分析。纳入标准:(1)胎龄小于37周且出生后存活大于或等于28 d;(2)已结束治疗;(3)病例资料完整,诊断无争议。按照BPD的患病情况分为BPD组和非BPD组,非BPD组为同期分娩的非BPD早产儿;BPD组患儿按照临床分度标准分为轻度组和中重度组。
1.2诊断、分度标准 早产儿BPD的诊断参照美国国家儿童保健和人类发展研究院(NICHD)颁布的相关标准:(1)早产儿或低体质量儿,出生后28 d(胎龄大于或等于32周者)或校正胎龄36周仍需持续氧疗或机械通气;(2)患儿有慢性或进行性呼吸功能不全,表现为低氧血症或高碳酸血症;(3)胸部X线片及肺部CT表现为双肺不同程度的肺纹理增多、模糊或毛玻璃影、囊泡形成、线状及网格状影;(4)排除先天性心脏病、气胸、胸腔积液、膈疝等疾病[3-4]。根据校正胎龄36周时的吸氧情况进行临床分度,轻度:出生后持续吸氧时间大于或等于28 d,校正胎龄36周时不需吸氧;中度:校正胎龄36周时仍需要吸入浓度小于30%的氧才能维持机体正常的氧分压水平;重度:校正胎龄36周时仍需要吸入浓度大于或等于30%的氧和(或)持续正压通气或机械通气才能维持机体正常的氧分压水平。
1.3方法 采用回顾性研究,收集所有研究对象的基本资料(性别、胎龄、出生体质量、是否是试管婴儿、多胞胎)、分娩时的情况(分娩方式、有无羊水污染、胎膜早破、1 min和5 min Apgar评分)、并发症(有无动脉导管未闭、肺出血、早产儿视网膜病变、贫血、新生儿高胆红素血症、新生儿呼吸窘迫综合征、缺血缺氧性脑病等)及治疗情况(是否输血及输血量、出生后是否使用肺表面活性物质、复苏气囊辅助呼吸次数、用氧时间、住院时间等)、母亲情况(年龄、有无妊娠高血压、孕产史)等因素。比较BPD患儿与非BPD患儿、BPD患儿不同临床分度之间上述指标的差异,分析BPD的相关危险因素。
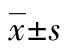
2 结 果
2.1BPD早产儿与非BPD早产儿临床特征比较 BPD早产儿的胎龄更小、出生体质量更低、男性比例更高、1 min和5 min Apgar评分更低;并发动脉导管未闭、早产儿视网膜病变、贫血、呼吸窘迫综合征的概率更高;输血、使用肺表面活性物质、CPAP或呼吸机、呼吸机持续时间大于7 d的比例更高,输血量更多,吸氧时间和住院时间更长。与非BPD早产儿比较,上述指标差异均具有统计学意义(P<0.05),见表1。
2.2早产儿BPD的高危因素分析 将上述有统计学差异的指标作为自变量,对其进行Logistic回归分析,结果显示,BPD早产儿的高危因素包括低胎龄、低出生体质量、机械通气及输血等,见表2。
2.3BPD早产儿胎龄和出生体质量分布情况 胎龄小于32周的患儿占92.4%,出生体质量小于1 500 g的患儿占87.1%,见表3。
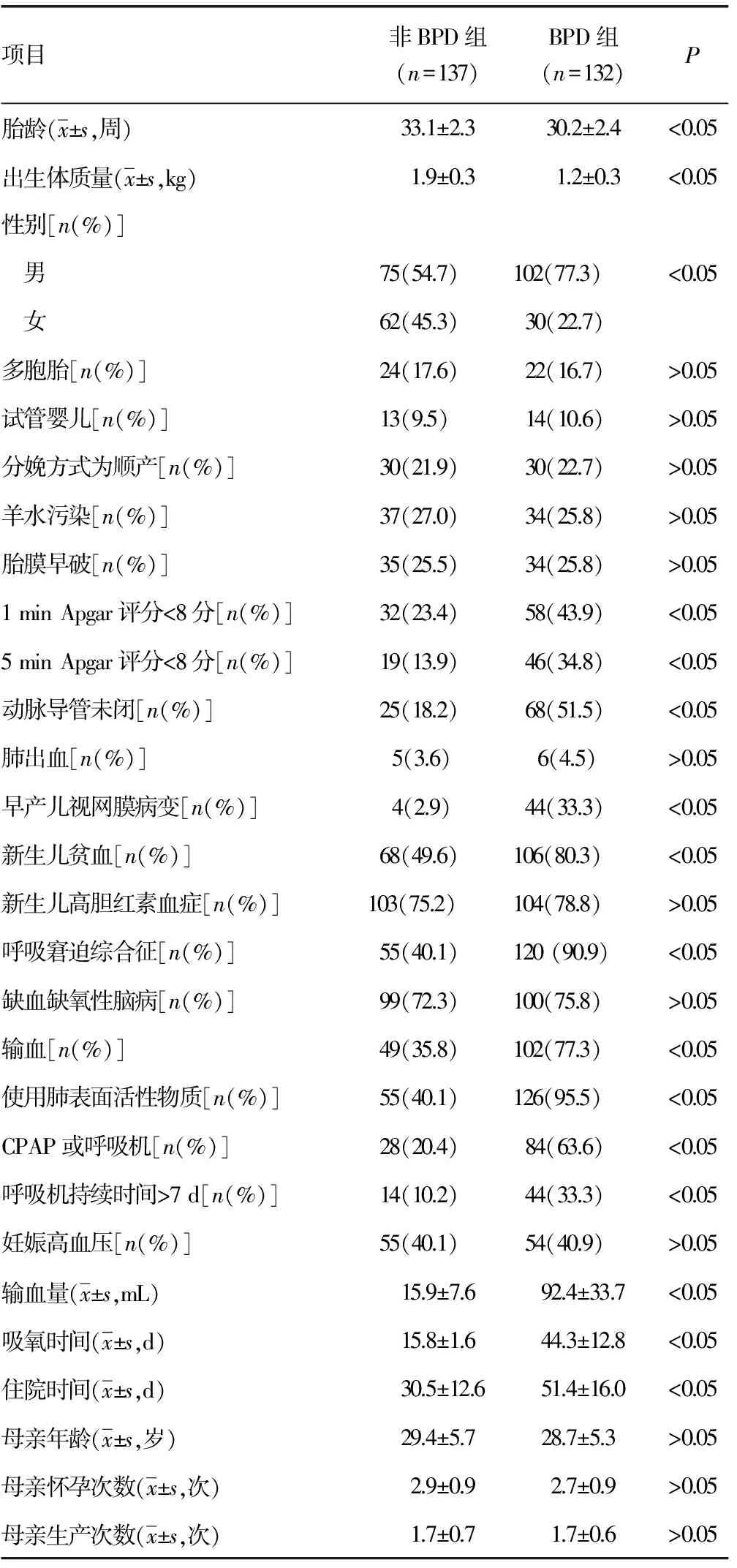
表1 BPD早产儿与非BPD早产儿临床特征比较
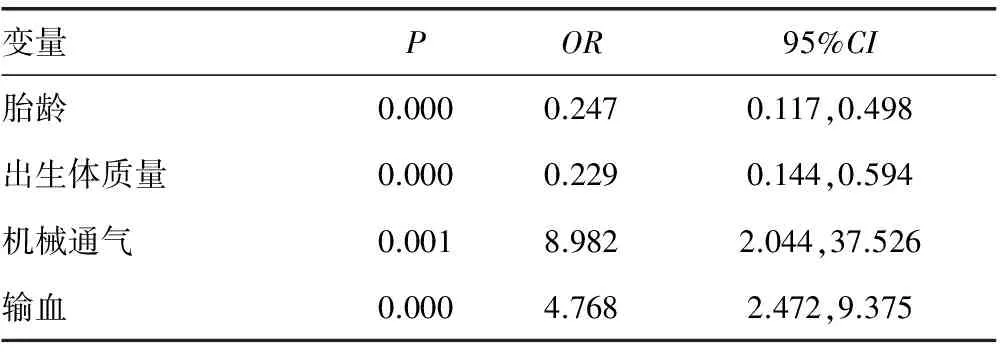
表2 BPD早产儿高危因素Logistic回归性分析
2.4不同临床分度BPD早产儿的临床特点 按照临床分度情况,将132例BPD早产儿分为轻度组42例(31.8%)和中重度组90例(68.2%,中度68例,重度22例),按照表1中所列举的临床特征进行分析比较,结果显示中重度组患儿的CPAP或呼吸机、呼吸机持续时间大于7 d及输血的百分比显著高于轻度组,输血量、吸氧时间和住院时间显著高于轻度组,差异均具有统计学意义(P<0.05)。其他特征比较,两组间差异无统计学意义(P>0.05)。
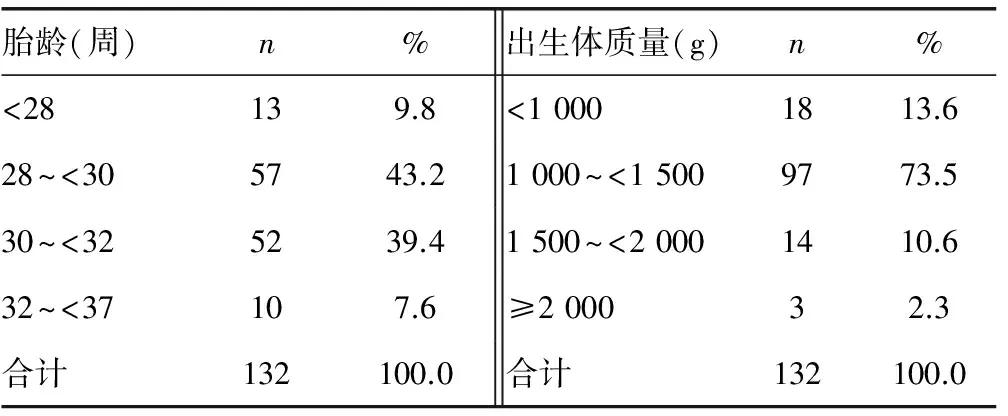
表3 BPD早产儿胎龄和出生体质量分布情况
2.5不同临床分度BPD早产儿病情随时间变化情况 所有患儿均于入院第1天,第1周,第2~3周,第4周行X线片、CT检查,入院第1天两组患者主要表现为Ⅰ级呼吸窘迫综合征;1周后轻度组主要表现为肺透亮度降低,而中重度组主要表现为肺透亮度降低和BPD Ⅲ期改变;第2~3周后轻度组、中重度主要表现为肺透亮度降低、BPD Ⅲ期改变;第4周轻度组主要表现同第2~3周,中重度组则为BPD Ⅳ期改变。
3 讨 论
近年来,诸多学者对BPD的发病机制进行了深入研究,发现BPD的发生与多种因素密切相关,且这些因素或彼此协同或相互独立地诱发早产儿发生BPD[3-5]。有研究显示,长时间的机械通气或可扰乱肺脏的发育进程,实验研究证实机械通气初期可引发早产实验动物出现炎性反应,并进一步造成肺脏损伤[5-6]。另一方面,机械通气过程中可能出现的小气道和肺泡过度通气膨胀也是导致肺脏损伤的重要原因之一[7-9]。在本研究中,BPD组患儿机械通气时间明显长于非BPD组患儿,中重度组患儿的机械通气时间明显长于轻度组患儿,且回归分析显示机械通气是BPD的高危因素,与上述文献报道的结果相符。
在氧气供应时间方面,由于患儿支气管肺发育不良,无法完成正常的呼吸,因此需要长期供应高浓度氧气,以缓解呼吸窘迫等临床症状。而研究已证实高浓度的氧气可阻碍肺组织的正常发育,未成熟的肺组织暴露于高浓度氧气环境中可导致肺泡简单化、炎症及肺血管重塑等损伤,进而使BPD患儿的肺部疾病持续更长时间[10]。另一方面,高氧环境使机体内的氧自由基等代谢产物浓度升高,导致细胞毒性,加重肺损伤[11]。因此,长时间氧气供应也是早产儿BPD的重要高危因素。本组研究结果证实机械通气是早产儿BPD的危险因素,且病情越重,机械通气的应用百分比越高,氧气供应时间越长。
本研究结果显示,除机械通气和高浓度氧气供应外,BPD早产儿的住院时间、呼吸窘迫综合征、新生儿1 min 和5 min Apgar评分小于8分的比例等均显著高于非BPD患儿。究其原因,这些指标提示患儿的病情较为严重,尤其是呼吸窘迫综合征及Apgar评分小于8分反映患儿存在不同程度的窒息,而由于患儿支气管肺发育不良,无法完成正常的呼吸功能,因此需要长期供应高浓度氧气,以缓解呼吸窘迫等临床症状,由于对氧的依赖而间接造成了肺损伤,成为BPD的高危因素[12-13]。住院时间长可增加肺部感染的风险,而院内感染本身就可加重肺损伤[14]。
早产儿BPD由于其特殊的发生机制,病理上主要表现为肺实质炎性病变和纤维化,其病情特点与BPD的严重程度有关[15-17]。本研究结果显示轻度BPD患儿在早期主要表现为Ⅰ级呼吸窘迫综合征,随着治疗时间的延长,在4周前轻度组患儿肺透亮度降低的比例逐渐增加;而中重度患者在早期同样为Ⅰ级呼吸窘迫综合征,在2~3周后同轻度组,第4周后该组患儿会发展至BPD Ⅳ期。CT检查结果显示两组患者的主要临床表现为囊泡形成,依次为条索状影形成、肺透亮度降低,其中肺透亮度降低比例轻度组显著高于中重度组。
综上所述,BPD早产儿的高危因素包括低胎龄、低出生体质量、机械通气及输血等。根据患儿的临床特点有助于判断BPD的严重程度,对指导临床制订有效的治疗措施和预防病情加重具有重要意义。
[1]邵肖梅,叶鸿瑁,丘小汕.实用新生儿学[M].4版.北京:人民卫生出版社,2013:419-420.
[2]岳伟红.早产儿支气管肺发育不良临床高危因素分析[J].儿科药学杂志,2016,22(4):16-18.
[3]曾军安,郭金珍,于萍,等.34例早产儿支气管肺发育不良相关临床高危因素分析[J].中国儿童保健杂志,2015,23(8):847-848.
[4]钟美珍,白海涛,刘登礼,等.早产儿支气管肺发育不良危险因素前瞻性队列研究[J].中国新生儿科杂志,2011,26(6):377-382.
[5]任艳丽,孔祥永,杜志方,等.不同程度支气管肺发育不良早产儿的临床及影像学特点[J].中国当代儿科杂志,2015,17(5):440-444.
[6]张爱民,蒋宗滨,李燕尧,等.外源性瘦素预防糖尿病大鼠呼吸机相关性肺损伤机制探讨[J].山东医药,2016,56(14):25-27.
[7]薛辛东,刘子云.高危早产儿支气管肺发育不良早期监测及其临床意义[J].中国实用儿科杂志,2014,29(1):7-11.
[8]许厚仁,马龙先.机械通气致肺损伤的研究进展[J].南昌大学学报(医学版),2010,50(7):123-125.
[9]张慧,富建华,薛辛冬.机械通气早产儿支气管肺发育不良的高危因素分析[J].中国急救医学,2011,18(6):240-242.
[10]Beeton ML,Maxwell NC,Davies PL,et al.Role of pulmonary infection in the development of chronic lung disease of prematurity[J]. Eur Respir J,2011(37):1424-1430.
[11]李青,徐树红,郑兴惠,等.神经肽P物质对大鼠高氧肺损伤的保护作用[J].第三军医大学学报,2014,36(6):578-582.
[12]王少华,党红星,范倩倩,等.早产新生大鼠高氧肺损伤Shh信号转导途径Smo和Gli1蛋白表达和意义[J].中国新生儿科杂志,2014,29(1):49-53.
[13]早产儿支气管发育不良调查协作组.早产儿支气管肺发育不良发生率及高危因素的多中心回顾调查分析[J].中华儿科杂志,2011,49(9):655-662.
[14]王丽华,宋庆花,刘英慧,等.支气管肺发育不良的X线与多层螺旋CT影像分析[J].中华肺部疾病杂志,2014,7(4):427-429.
[15]Durrmeyer X,Kayem G,Sinico M,et al.Perinatal risk factors for bronchopulmonary dysplasia in extremely low gestational age infants:a pregnancy disorder-based approach[J].J Pediatr,2012(160):578-583.
[16]陈超,袁琳,早产儿支气管肺发育不良的病因及危险因素[J].中国实用儿科杂志,2014,29(1):5-7.
[17]常立文.早产儿支气管肺发育不良的定义演变及其诊断[J].中国实用儿科杂志,2014,29(1):1-4.
10.3969/j.issn.1671-8348.2017.27.034
R722.6
B
1671-8348(2017)27-3850-04
2016-11-12
2017-04-27)

