乙型肝炎病毒抑制肝细胞免疫检查点PD-1配体基因表达的研究*
郭莲娣,王 丹,唐子执,曾 鸣,王小军,刘 聪,李友伟
(1.西南民族大学药学院,成都 610041;2.四川大学华西第二医院,成都 610041;3.四川省德阳市人民医院肝胆外科 618000)
乙型肝炎病毒抑制肝细胞免疫检查点PD-1配体基因表达的研究*
郭莲娣1,王 丹1,唐子执2,曾 鸣2,王小军2,刘 聪2,李友伟3△
(1.西南民族大学药学院,成都 610041;2.四川大学华西第二医院,成都 610041;3.四川省德阳市人民医院肝胆外科 618000)
目的在细胞水平上分析乙型肝炎病毒(HBV)复制及其编码的X基因(HBx)表达对细胞基因表达谱的影响,特别是免疫相关基因表达水平的变化。方法通过慢病毒和pcDNA瞬时转染过表达HBx基因,利用RNA-Seq和RT-qPCR等方法检测免疫相关基因的表达水平,并在HBV复制细胞系中进行验证。结果HBV复制和HBx表达可以剂量依赖性抑制免疫检查点程序性死亡分子1(PD-1)配体基因(PD-L1/CD274)的表达,而HBx基因的H-box突变体的表达失去该抑制效应。结论HBV/HBx具有抑制PD-L1/CD274基因表达的能力,在病毒感染的急性期解除抗原特异性T细胞激活的检查点,活化细胞毒性T细胞,这可能导致T细胞对高度复制的细胞进行攻击和清除,帮助病毒进入较低复制状态,达到病毒-宿主的平衡状态并奠定HBV慢性感染的基础。
肝炎病毒,乙型;HBx;免疫检查点;PD-L1/CD274
目前,免疫治疗通过刺激机体免疫系统提高内源性抗肿瘤免疫效应,已成为治疗肿瘤的新方向。其中免疫检查点程序性死亡分子1(programmed death 1,PD-1)和PD-1配体(PD-1 ligand,PD-L1/CD274)信号通路的激活有助于肿瘤免疫逃逸,对肿瘤的治疗有非常重要的临床意义[1-4]。在乙型肝炎病毒(HBV)感染过程中, PD-L1/CD274的基因表达及其在HBV免疫中的作用机制,HBV是否利用免疫检查点干扰宿主免疫系统,还未被深入研究。HBV的HBx蛋白是具有多种调控功能的病毒蛋白质,广泛参与病毒的复制、蛋白质降解等过程,在HBV感染及原发性肝细胞癌诱发中起关键作用[5-6]。本研究通过探讨HBV HBx的基因表达对免疫检查点信号PD-L1/CD274基因的调节,为进一步探讨免疫检查点PD-L1/CD274在HBV感染与宿主细胞、肝脏微环境和免疫应答网络的相互作用机制打下基础。
1 材料与方法
1.1材料 细胞系293T、L02和T43,大肠杆菌菌种DH5α,载体质粒cDNA及慢病毒包装系统质粒均由华西第二医院基因组稳定性实验室提供; 胎牛血清购自Invitrogen;Infusion克隆试剂盒、T4 DNA连接酶购自Clontech;限制性内切酶、聚偏氟烯(PVDF)膜及转染试剂购自Fugene; ECL发光底物购自Millipore;质粒提取试剂盒、凝胶回收试剂盒和总RNA提取试剂盒购自Qiagen;引物合成及测序由上海生工生物工程有限公司完成;RNA反转录使用Promega-A3500 反转录酶试剂盒;荧光定量聚合酶链反应(PCR)使用Promega Go Taq®qPCR Master Mix试剂盒完成。
1.2方法
1.2.1细胞培养 293T、L02和T43细胞为贴壁生长细胞,将其置于37 ℃、5% CO2培养箱中,用含10%胎牛血清和1%青霉素/链霉素的RPMI-1640培养液培养,定期更换培养液。待细胞贴壁生长至90%汇合度时,弃上清液后加入0.25%胰蛋白酶/乙二胺四乙酸细胞消化液进行细胞传代。
1.2.2分子克隆 通过NCBI查找HBx的DNA序列,基因号为:DQ629997.1,合成其DNA片段并作为模板,设计带有酶切位点的上、下游引物:5′-GTA CGA ATT CAT GGC TGC TCG GAT GTG CTG-3′;5′-GAT CGG ATC CTT ACG CAG AGG TGA AAA AGT TG-3′,PCR扩增出对应的DNA片段后纯化回收,对DNA片段和载体pLVX-IRES-ZsGreen1或pcDNA3.1进行双酶切(EcoRⅠ;BamHⅠ),通过T4 DNA连接酶连接DNA片段和载体,连接产物转化至大肠杆菌DH5α,在含有氨苄青霉素的平板上筛选阳性克隆并鉴定测序,得到重组的pLV-HBx或pcDNA3-HBx载体。
1.2.3慢病毒包装 将对数生长期的293T细胞用胰蛋白酶消化,以2.5×106密度接种于10 cm培养皿,直至细胞汇合度达60%~70%时开始转染。将慢病毒包装系统中的3种质粒DNA溶液(pLV-HBx 10 μg、psPAX2 7.5 μg、pMD2.G 6 μg)用适量无血清培养基Opti-MEM稀释,随后加入60 μL Roche X-treme GENE HP轻柔混匀,室温孵育 20 min以形成转染复合物;然后将上述复合物加到细胞培养皿中,轻轻混匀,培养6~10 h后更换为完全培养基。转染48 h后于倒置荧光显微镜下观察GFP的表达,转染效率应达到90%以上;分别于48 h和72 h收集病毒上清液,再以直径为 0.45 μm的滤器过滤后,分装贮存待用。
1.2.4基因表达谱(RNA-Seq)测定与分析 感染pLV-HBx或pLV-EGFP病毒的L02细胞经总RNA提取、mRNA富集和建立cDNA文库等步骤,进行Illumina-HiSeq测序。获得原始测序序列后,利用HTSeq、DEGSeq和KOBAS等软件进行参考序列比对、基因表达水平、基因差异表达、转录因子和GO/KEGG等生物信息学分析。
1.2.5mRNA提取 将所孵育的3.5 cm2细胞板中加入1 mL Trizol,冰上放置5 min后用枪头吹打,使核酸蛋白复合物完全分离。加入0.2 mL氯仿振荡15 s,静置并离心; 小心吸取离心后上层无色液体(RNA层)移入Qiagen RNA提取试剂盒的吸附柱,经过吸附和洗脱等过程,用50 μL的 DEPC水溶解并离心得到RNA。-70 ℃冰箱保存。 紫外分光光度计测定细胞RNA在260 nm和280 nm处的吸光度值(A),计算RNA的含量和纯度。
1.2.6半定量及荧光定量RT-PCR 2 μg RNA与反转录引物oligdT混匀,70 ℃加热5 min后立即冰浴5~10 min。根据Qiagen试剂盒说明书,在反应体系中加入反转录酶及RNA酶抑制剂各1 μL,dNTP (10 mmol/L)1.5 μL,MgCl21.5 μL,5×缓冲液5 μL,DEPC水补足总体积至25 μL,进行体外反转录反应得到cDNA产物。荧光定量PCR反应体系为cDNA模板1 μL,扩增引物(10 mmol/L)各1 μL,2×缓冲液10 μL,DEPC水补足体积至20 μL。每个样本平行重复3个定量PCR反应。cDNA的半定量检测使用TIANGEN 2×Taq PCR Master Mix试剂盒进行PCR扩增,2%琼脂糖凝胶电泳检测反应产物。所有半定量及定量PCR均选用β-actin基因片段为内参。反应中涉及引物β-actin:正向引物5′-CTC TTC CAG CCT TCC TTC CT-3′,反向引物5′-AGC ACT GTG TTG GCG TAC AG-3′;HBx:正向引物5′-ATG GCT GCT CGG TTG TGC TG-3′,反向引物5′-TTA GGC AGA GGT GAA AAA GT-3′;PD-L1:正向引物5′-CTG TCT TTA TAT TCA TGA C-3′,反向引物5′- AAA GCT TCT CCT CTC TCT TG-3′。
1.2.7蛋白免疫印迹(Western blot) 细胞被PBS清洗2次后,加入RIPA细胞裂解液在冰上裂解30 min后,4 ℃ 14 000 r/min离心15 min,收集上清液并采用BCA法测定蛋白浓度,然后将适量细胞总蛋白经十二烷基硫酸钠-聚丙烯胺凝胶(SDS-PAGE)电泳进行分离,并将蛋白转移至PVDF膜上,电转后的膜在含5% BSA的封闭液中室温封闭1 h。使用PD-L1/CD274一抗4 ℃孵育过夜,PBST清洗3次,然后使用HRP标记的二抗稀释液室温孵育1.5 h,PBST洗3次。最后采用ECL发光试剂盒检测,经凝胶分析系统曝光,分析并存储图片。
2 结 果
2.1HBx基因干扰L02细胞中免疫相关基因的表达 HBx克隆于pLV慢病毒载体,经293T细胞包装的慢病毒感染正常肝细胞系(L02),48 h后收集细胞并提取mRNA,对全基因组表达谱进行定量检测,并与表达EGFP的空病毒感染组进行,分析比对基因表达的变化。HBx表达总共造成L02基因表达谱中779个基因表达的改变,其中包括上调基因431个,下调348个(图1A、1B)。笔者发现有22个免疫相关基因的表达水平受HBx表达的影响而呈现上调或下调(图1C)。
A:RNAseq检测出HBx诱导L02细胞基因表达谱变化的差异基因热图。红色表示高表达基因,蓝色表示低表达基因。B:HBx导致的差异基因火山图。C:HBx导致的22个免疫相关基因表达的改变柱状图,包括PD-L1/CD274、HLA家族和TNF信号通路等
图1 HBx在肝细胞系中表达造成基因表达谱的改变
2.2HBx基因诱导PD-1/CD274的基因表达 由于免疫检查点基因PD-1及其配体在细胞毒免疫中的重要性,本研究选择基因表达受HBx影响的PD-L1/CD274基因进一步研究。HBx基因被克隆到pcDNA3-HA载体上,经转染48 h后在L02细胞中表达(图2A)。提取细胞mRNA后进行RT-qPCR定量检测PD-L1/CD274的基因表达水平,发现PD-L1/CD274基因的表达量相对于pcDNA空载体的细胞显著降低,且差异有统计学意义(P<0.05,图2B);当pcDNA-HBx转染剂量增加,PD-L1/CD274表达则进一步受到抑制,表现出剂量依赖效应(图2C)。Western blot实验也说明HBx基因表达会让PD-L1/CD274基因的表达受到抑制(图2D)。当L02细胞过表达H-box突变的HBx基因(R96E)时,PD-L1/CD274的基因表达则不受HBx的影响,说明HBx对该基因表达的干扰依赖于H-box氨基酸基序的功能(图2E)。
2.3PD-L1/CD274的基因表达在HBV复制细胞中被抑制 由于慢病毒和pcDNA3表达的HBx水平远远高于HBV感染或HBV阳性肝癌的HBx水平,本研究进一步采用整合了HBV基因组,并有HBV病毒活跃复制,同时HBx基因表达量又相对较低的T43细胞为研究体系[7]。T43细胞及其未整合HBV基因组的源细胞系L02的mRNA抽提后进行RT-qPCR定量。笔者发现,T43细胞中的PD-L1/CD274基因表达水平显著低于L02细胞(图3A),说明HBV复制过程中表达的低水平HBx也能够抑制PD-L1/CD274基因的表达,造成免疫耐受环境的抑制。该结果也在HepG2.2.15细胞中得以重复(图3B)。当笔者用3TC降低T43细胞的HBV复制,却不影响HBx表达的情况下,发现PD-L1/CD274基因表达不受影响,说明该基因表达的抑制依赖于HBx的水平,却不依赖HBV的病毒复制水平(图3C)。
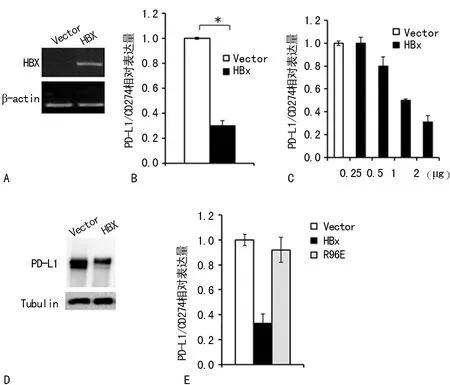
A:RT-PCR检测L02细胞转染pcDNA3-HBx质粒后,HBx的表达情况;以β-actin的PCR产物为PCR反应内参。B:L02细胞中表达pcDNA3-HBx后,荧光定量RT-PCR检测PD-L1/CD274的表达情况;Vector表示空载体。C:L02细胞转染不同剂量的pcDNA3-HBx后检测PD-L1/CD274的表达水平。D:L02细胞表达HBx后用Western blot检测PD-L1/CD274的蛋白水平。E:荧光定量RT-PCR检测野生型和带有R96E突变的HBx对PD-L1/CD274基因表达的影响
图2 HBx抑制PD-L1/C D274的基因表达
3 讨 论
HBV编码的X基因具有表观遗传调控的能力,对病毒复制和基因表达(包括HBx自身的表达)提供正反馈信号,且在病毒感染的转归和肝硬化、肝癌发生的过程中均发挥重要作用[8]。HBx调控病毒/宿主细胞基因表达的能力取决于其羧基端的H-box氨基酸基序,该基序可以通过劫持泛素化酶CRL4,破坏染色质黏连蛋白SMC5/6调控染色质构象和基因表达。在H-box功能丧失的情况下,HBx也会丧失调控病毒基因表达和干扰宿主表观遗传的能力[9-10]。
本研究通过RNA-Seq技术发现HBV感染导致一系列宿主细胞基因表达的改变,其中包括免疫调节基因的增高或降低。其中,本课题组重点研究了在HBx表达和HBV复制的细胞中, PD-L1/CD274基因的抑制机制。这些实验表明,HBx是通过H-box基序和CRL4泛素化酶实现对PD-L1/CD274基因表达的抑制。进一步研究有助于解析HBx-CRL4的表观遗传调控网络如何抑制PD-L1/CD274的基因表达和解除肝细胞的免疫抑制微环境。本研究发现HBx对PD-L1/CD274基因表达的抑制表现出剂量依赖效应,由于HBV高度复制的细胞需要更多的HBx协调,该结果提示有病毒活跃复制的细胞较容易失去PD-L1/CD274的表达,亦容易遭受细胞毒性T细胞的攻击。同时,在HBV编码的DNA多聚酶受到药物抑制,HBx水平不受影响的情况下,HBV对PD-L1/CD274基因表达的抑制则不受影响。
肝脏的对外来抗原具有特殊的耐受机制,可以保护自身免于免疫系统的攻击,同时也不利于肝内病毒的清除,导致病毒长期感染。造成肝脏免疫耐受的机制之一是B7家族的协同刺激分子在肝脏的表达,特别是PD-L1/CD274。不同于B7家族的其他成员,PD-L1/CD274的表达不仅限于抗原递呈和淋巴细胞表面,在包括肝脏在内的多种外周及肿瘤组织中也有表达[11]。此外,肝细胞表面不仅可以组成性地表达PD-L1/CD274蛋白,且受干扰素(INF-γ)的诱导[12];因此,肝脏的免疫耐受微环境有助于保护并容纳HBV的长期慢性感染。本实验结果则证明,病毒感染本身可以依赖HBx基因,对PD-L1/CD274的基因表达进行抑制,减低肝细胞表面呈现的免疫检查点信号,有利于CD8+细胞对病毒的识别,并在早期实现对病毒的清除。
然而, HBV抑制PD-L1/CD274基因表达减低的程度依赖于HBx的剂量,即HBx表达量越高,PD-L1/CD274表达受到抑制的程度越高。由于HBx本身的表达量与病毒复制密切相关,因此,这种剂量依赖效应提示HBV复制过度剧烈的肝细胞将较大程度地出现PD-L1/CD274表达降低,从而首先受到CD8+细胞的攻击;而病毒复制较为温和的细胞则继续依靠免疫耐受机制逃避CD8+细胞的攻击。从HBV急性感染到慢性化的发病过程来看,这种病毒复制/免疫耐受的负反馈机制可以帮助病毒实现与宿主免疫系统的平衡状态,有利于病毒进入慢性感染状态。此外,急性期或爆发性肝炎造成的大面积肝损伤亦可能与大量病毒复制解除免疫抑制/耐受的检查点有关。
总之,本研究发现HBV通过HBx的表观遗传调控功能抑制宿主细胞免疫检查点PD-L1/CD274的基因表达,可以部分和局部解除肝脏的免疫抑制微环境,有助于清除病毒复制过剩的肝细胞,以达到病毒复制和宿主免疫之间的平衡,帮助病毒进入慢性感染阶段。
[1]SwaikaA,HammondWA,JosephRW.
10(6):337-343.
[3]Yoshinari O,Shiojima Y,Igarashi K.Anti-obesity effects of onion extract in Zucker diabetic fatty rats[J].Nutrients,2012,4(10):1518-1526.
[4]Huang KP,Huang J,Xie X,et al.Sirt1 resists advanced glycation end products-induced expressions of fibronectin and TGF-beta 1 by activating the Nrf2/ARE pathway in glomerular mesangial cells[J].Free Radical Biol Med,2013,65(65):528-540.
[5]Emma F,Montini G,Parikh SM,et al.Mitochondrial dysfunction in inherited renal disease and acute kidney injury[J].Nat Rev Nephrol,2016,12(5):267-280.
[6]李栋,林珊.氧化应激与糖尿病肾病[J].中国实用医药,2008,43(6):138-139.
[7]Kao TC,Shyu MH,Yen GC.Glycyrrhizic acid inhibit inflammation via PI3K/Akt/GSK3beta signaling and glucocorticoid receptor activation[J].Food Chem,2010,58(15):8623-8629.
[8]卢梦玲,闫超,赖多,等.CyclinD1与细胞周期调控[J].生物技术通报,2011,43(10):55-59.
[9]毛志敏,黄燕如,万毅刚,等.糖尿病肾病肾组织氧化应激的调控机制及中药的干预作用[J].中国中药杂志,2014,39(19):3707-3712.
[10]剧孟磊,左洋洋,赖宇雄,等.线粒体活性氧——糖尿病肾病进展的中心环节[J].中华肾脏病杂志,2015,31(11):866-869.
[11]Chen J,Zhou Y,Mueller-Steiner S,et al.SIRT1 protects against microglia-dependent amyloid-beta toxicity through inhibiting NF-κB signaling[J].J Biol Chem,2005,280(48):40364-40374.
[12]Kong XX,Wang R,Liu XJ,et al.Function of SIRT1 in physiology[J].Biochemistry (Mosc),2009,74(7):703-708.
HepatitisBvirusinhibitsexpressionoflivercellimmunecheckpointPD-1ligandgene*
GuoLiandi1,WangDan1,TangZizhi2,ZengMing2,WangXiaojun2,LiuCong2,LiYouwei3△
(1.CollegeofPharmacy,SouthwestUniversityforNationalities,Chengdu,Sichuan610041,China;2.WestChinaSecondHospital,SichuanUniversity,Chengdu,Sichuan610041,China;3.DepartmentofHepatobiliarySurgery,DeyangMunicipalPeople′sHospital,Deyang,Sichuan638000,China)
ObjectiveTo analyze the impact of hepatitis B virus (HBV) replication and its coded X gene (HBx) expression on cell gene expression profile,especially the immune related gene expression level changes.MethodsOverexpressed HBx gene was transiently transfected through lenti-virus and pcDNA3,the RNA-Seq and RT-qPCR methods were used to detect the expression levels of immune related genes,which were verified in HBV replication cell line.ResultsThis study found that the HBV replication and HBx expression suppressed the expression of immune checkpoint PD-1 ligand gene (PD-L1/CD274) in a dose-dependent manner,while the expression of H-box mutant in HBx gene lost this inhibition effect.ConclusionHBV/HBx possesses the ability for inhibiting PD-L1/CD274 ligand gene expression,may relieve the checkpoint of antigen-specific T cell activation in viral infection acute stage,activates cytotoxic T cells,which may cause that T cell attack and clear highly replicated cells,helps virus to enter the lower replication status,and reaches the balance status between virus-host and lays a basis of HBV chronic infection.
hepatitis B virus;HBx;immune checkpoint;PD-L1/CD274
10.3969/j.issn.1671-8348.2017.27.003
R512.62
A
1671-8348(2017)27-3752-03
2016-11-21
2017-04-09)
四川省科技厅科技支撑项目(2017FZ0034);四川省卫生和计划生育委员会基金资助项目(16PJ144);国家级大学生创新创业训练计划项目(201610656073)。
郭莲娣(1974-),博士,讲师,主要从事中药抗DNA损伤作用的研究。△
,E-mail:1031572133@qq.com。

