丙泊酚对发育小鼠海马齿状回神经干细胞的影响*
景 胜,彭 静,包晓航,陈 杰,杜智勇,李 洪,黄 河
(第三军医大学新桥医院麻醉科,重庆 400037)
丙泊酚对发育小鼠海马齿状回神经干细胞的影响*
景 胜,彭 静,包晓航,陈 杰,杜智勇,李 洪,黄 河△
(第三军医大学新桥医院麻醉科,重庆 400037)
目的观察丙泊酚对发育小鼠海马齿状回神经干细胞的影响。方法将健康同窝日龄7 d(P7)的C57小鼠分为3组:高剂量丙泊酚组、低剂量丙泊酚组和10%脂肪乳对照组。所有小鼠P7接受药物处理。高剂量丙泊酚组腹腔注射丙泊酚60 mg/kg;低剂量丙泊酚组腹腔注射丙泊酚30 mg/kg;对照组腹腔注射同等体积的10%脂肪乳。部分小鼠注药24 h(P8)后处死,其余小鼠饲养至日龄14 d(P14)处死。采用免疫组织化学法检测海马齿状回中Ki67、巢蛋白(Nestin)、脑脂结合蛋白(BLBP)及神经元核心抗原(NeuN)的形态及表达量。结果高剂量丙泊酚组P8小鼠海马齿状回中Ki67标记的神经干细胞数量较10%脂肪乳对照组明显减少(P<0.01),且Nestin及BLBP标记的干细胞纤维数量、长度均受损(P<0.05)。P14小鼠海马齿状回中NeuN阳性细胞数量低剂量丙泊酚组与10%脂肪乳对照组比较差异无统计学意义(P>0.05),而高剂量丙泊酚组较10%脂肪乳对照组显著减少(P<0.01)。结论高剂量丙泊酚可抑制海马齿状回神经干细胞的增殖,损伤神经干细胞突起数量及突起形态,导致神经元成熟障碍。
二异丙酚;干细胞;海马
丙泊酚因其诱导起效快、苏醒迅速且无蓄积、不良反应小等优点,在临床儿科及产科麻醉中已逐渐推广使用。然而,越来越多的临床观察表明婴幼儿术后认知功能改变与全身麻醉药物接触有密切关系。近期有研究证实全身麻醉药物对发育机体认知功能有潜在的毒性作用,然而其具体作用机制还未明确。文献报道海马齿状回发育与机体认知功能紧密相关,而海马齿状回内干细胞神经发生决定齿状回发育,全身麻醉药物丙泊酚是否通过调控海马齿状回干细胞进而影响机体认知功能尚不清楚。本研究拟采用丙泊酚处理发育小鼠模型,通过免疫组织化学及免疫荧光检测丙泊酚对发育小鼠海马齿状回干细胞的影响,探讨丙泊酚影响发育小鼠术后认知功能的机制。
1 材料与方法
1.1主要试剂 丙泊酚购自Astra Zenenca公司,10%脂肪乳购自Fresenius Kabi公司,兔抗Ki67购自Thermo公司,鼠抗巢蛋白(Nestin)购自BD公司 ,兔抗脑脂结合蛋白(BLBP)及神经元核心抗原(NeuN)均购自Milliproe 公司。生物素化抗鼠、抗兔二抗购自Invitrogen公司,显色试剂盒DAB购自北京中杉公司,荧光二抗cy3抗兔、488抗鼠购自Jackson公司。
1.2实验方法
1.2.1动物与分组 本研究动物实验经第三军医大学动物伦理委员会同意,所有动物实验步骤均遵照美国国家卫生局动物实验准则(2011版)进行,研究所需的健康C57BL/6J临产孕鼠由第三军医大学大坪医院实验动物中心提供,小鼠自由充足摄取食物和水,正常昼夜更替,饲养室温控制在23 ℃左右。小鼠出生当日记为P0,将日龄7 d(P7)同窝小鼠按照随机数字表分为3组:高剂量丙泊酚组、低剂量丙泊酚注射组、10%脂肪乳对照组。
1.2.2药物处理 按照本课题组之前研究[1]制备发育小鼠麻醉暴露模型。腹腔注射不同剂量丙泊酚或10%脂肪乳。高剂量丙泊酚组腹腔注射丙泊酚60 mg/kg,低剂量丙泊酚组腹腔注射丙泊酚30 mg/kg,10%脂肪乳对照组腹腔注射等体积10%脂肪乳。注射药物后将小鼠置于37 ℃恒温充氧保温箱中,待小鼠麻醉苏醒后放回母鼠笼。注药24 h后(P8)处死部分小鼠获取大脑标本,其余小鼠饲养至14 d(P14)处死获取大脑标本。
1.2.3免疫组织化学 P8小鼠通过拖颈处死;P14小鼠以1%戊巴比妥钠(50 mg/kg)腹腔注射麻醉,经左心室灌注0.9%生理盐水约50 mL后,继续灌注预冷的4%多聚甲醛约100 mL,灌注完毕后断头,收集大脑标本用新鲜的4%多聚甲醛固定24 h,随后采用30%蔗糖溶液脱水,待其充分脱水后,OCT包埋后用莱卡冰冻机切片(40 μm),并将其置于冻存液中-20 ℃保存。选取合适的片源用0.01 mol/L PBS漂洗后,3%H2O2室温处理20 min,0.01%PBS漂洗后浸泡于0.3%Triton X-100中,置于37 ℃孵箱孵育30 min,3%BSA封闭反应1 h。分别加入含有一抗工作液兔抗Ki67(1∶500)及BLBP(1∶500)、鼠抗Nestin(1∶200)及NeuN(1∶500),4 ℃孵育过夜。0.01%PBS漂洗后BLBP加入辣根过氧化物酶标记的488驴抗鼠IgG(1∶200);Nestin加入辣根过氧化物酶标记的Cy3驴抗兔IgG(1∶200);Ki67加入生物素化抗兔二抗(1∶500);NeuN加入生物素化抗鼠二抗(1∶500),均在37 ℃孵育2 h。BLBP、Nestin用PBS漂洗后与DAPI室温下反应1 min,漂洗后转移到载玻片上,避光晾干,滴加防淬灭剂后封片。Ki67、NeuN在PBS漂洗后在37 ℃与SABC反应1 h,DAB显示,贴片晾干,中性树脂封片。
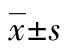
2 结 果
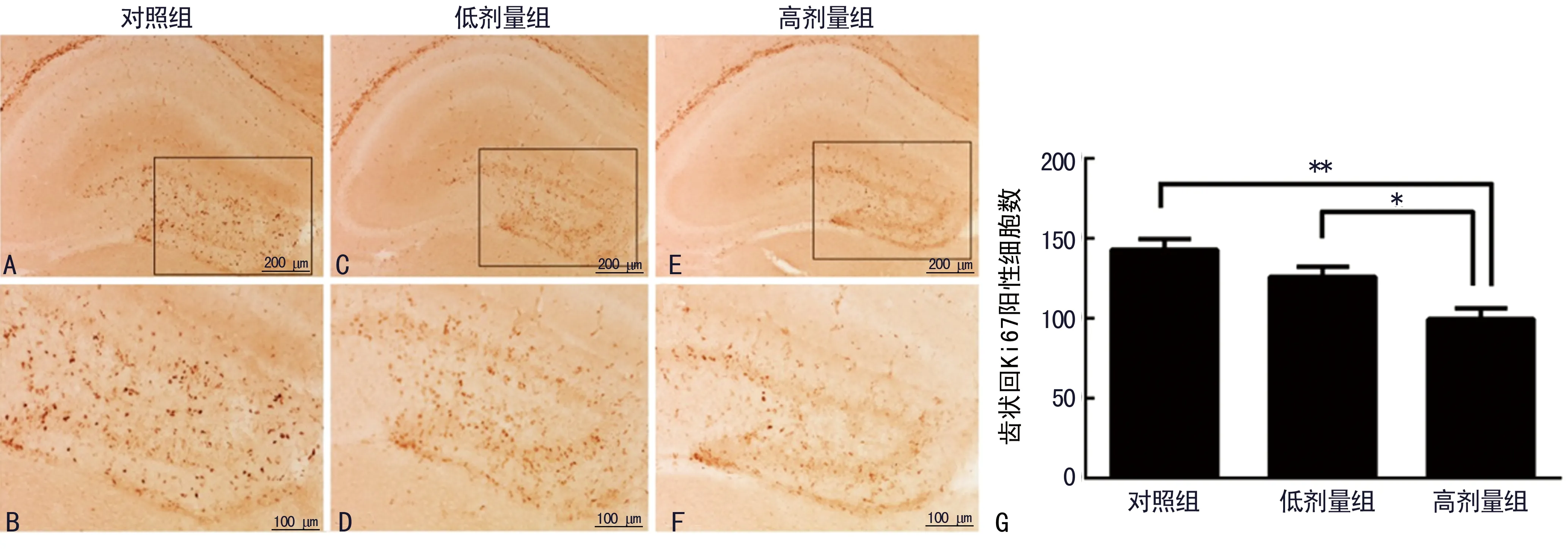
2.1高剂量丙泊酚抑制P8小鼠海马齿状回内神经干细胞的增殖 采用细胞增殖相关的核抗原标记物Ki67检测丙泊酚对P8小鼠海马齿状回中神经干细胞的影响(图1A~F)。免疫组织化学结果显示,Ki67标记的具有增殖功能的神经干细胞主要分布于海马齿状回中的颗粒细胞层。3组Ki67阳性细胞形态上未见明显差异,高剂量丙泊酚组齿状回颗粒细胞层的Ki67阳性细胞数量较低剂量丙泊酚组、10%脂肪乳对照组减少且差异有统计学意义(P<0.05),见图1G。低剂量丙泊酚处理组与10%脂肪乳对照组间Ki67阳性细胞数量未见差异(P>0.05)。
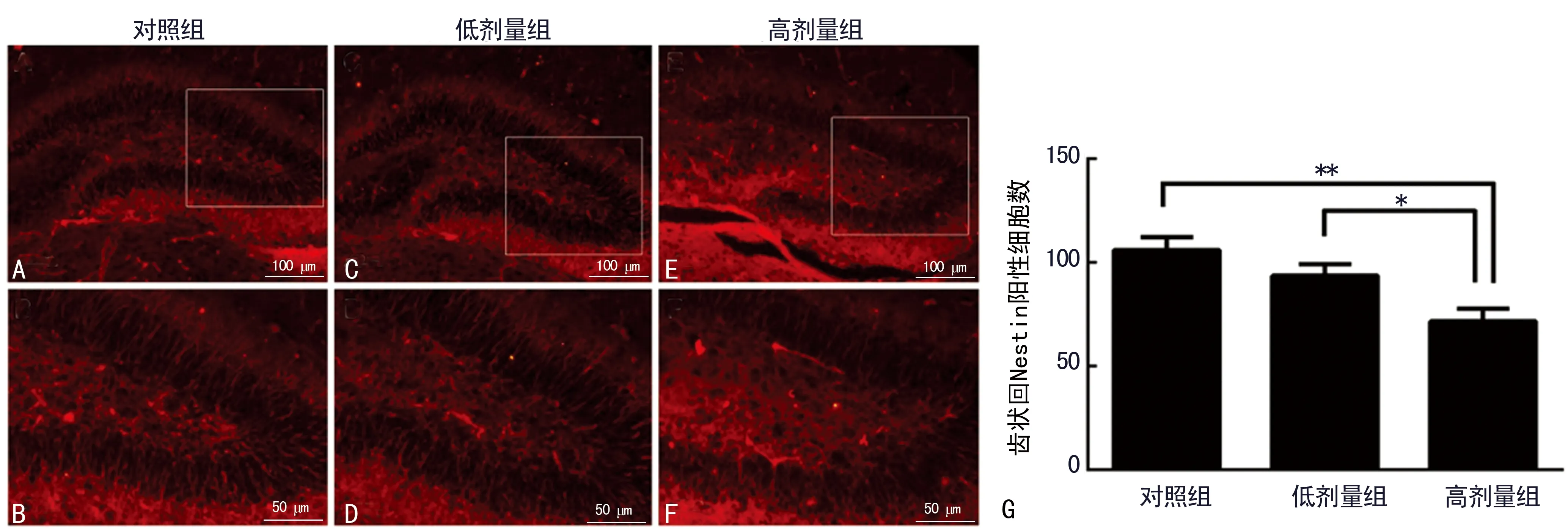
2.2丙泊酚抑制P8小鼠后海马齿状回内神经干细胞的数量且损伤神经干细胞突起 Nestin是一种中间丝类型的蛋白,是神经干细胞的特征性标记物,同时能标记放射状胶质细胞的突起。通过免疫荧光检测Nestin评估丙泊酚对P8小鼠海马齿状回中神经干细胞的影响(图2A~F)。研究结果表明:高剂量丙泊酚组海马齿状回中Nestin阳性细胞数量较10%脂肪乳对照组和低剂量丙泊酚组显著减少(P<0.01),见图2G,同时发现高剂量丙泊酚组Nestin阳性细胞突起出现受损。
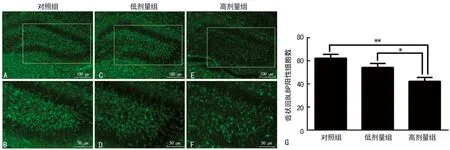
2.3丙泊酚对P8小鼠海马齿状回内放射状胶质细胞的影响 采用放射状胶质细胞突起的特异性标记物BLBP检测丙泊酚对P8小鼠海马齿状回中神经干细胞形态的影响(图3A~F)。免疫荧光结果显示:高剂量丙泊酚组海马齿状回中BLBP阳性细胞数量较10%脂肪乳对照组和低剂量丙泊酚组显著减少(P<0.01),见图3G,且放射状胶质细胞的长突起受损较明显;而与10%脂肪乳对照组相比较,低剂量丙泊酚处理组仅观察到海马齿状回中BLBP阳性细胞放射状胶质细胞的长突起受损。
**:P<0.01,与对照组比较;*:P<0.05,与低剂量组比较

**:P<0.01,与对照组比较;*:P<0.05,与低剂量组比较

**:P<0.01,与对照组比较;*:P<0.05,与低剂量组比较

**:P<0.01,与对照组比较

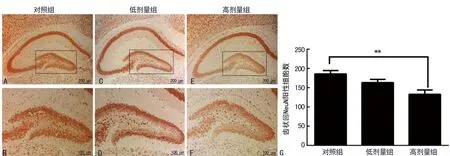
2.4高剂量丙泊酚抑制P14小鼠海马齿状回内成熟神经元的数量 NeuN能够特异性标记成熟神经元。通过评估P14小鼠海马齿状回中NeuN阳性细胞表达量检测丙泊酚对发育小鼠海马齿状回内神经元成熟的影响(图4A~F)。免疫组织化学结果发现高剂量丙泊酚组海马齿状回中NeuN阳性细胞数量较10%脂肪乳对照组显著减少(P<0.01),见图4G,其余未见明显差异。
3 讨 论
越来越多的动物实验表明在脑发育关键时期接触全身麻醉药物会对大脑产生潜在毒性,并可能损伤机体远期的认知功能。最近临床回顾性研究表明小于3岁婴幼儿单次接触全身麻醉药物可能会导致学习、记忆和抽象推理障碍,且小于2岁婴幼儿接触两次或多种麻醉药物在19岁之前诊断注意力缺陷运动障碍风险是健康人的2倍[1-2]。既往研究表明婴幼儿术后学习、记忆、认知能力障碍发生发展与全身麻醉药物暴露有一定关联[3]。
丙泊酚因麻醉诱导起效快、苏醒迅速且无蓄积、不良反应少等优点,已成为临床产科和儿科手术麻醉最常用全身麻醉药物之一。既往研究证实丙泊酚通过GABA受体影响脑内细胞凋亡或脑内神经递质改变[4-7]。同时有研究表明婴幼儿使用全身麻醉药物与认知功能改变之间没有因果关系[8]。而Stargatt等[9]的队列研究指出丙泊酚是引起婴幼儿行为改变的重要危险因素之一;Wilder等[3]研究表明婴幼儿期使用丙泊酚能导致后期学习障碍。况且,众所周知与丙泊酚作用机制相似的乙醇在孕期或婴幼儿期使用会导致婴幼儿行为异常和认知障碍。
全身麻醉药物引起认知功能障碍主要表现为海马主宰的空间定向力受损、学习和记忆力受损,但其发生机制尚未明确。研究表明,决定海马功能的重要因素取决于海马颗粒下区齿状回中神经干细胞产生发育成熟神经元的能力[10-11]。出生后早期海马齿状回神经干细胞为放射状胶质细胞(radial glial cells,RGCs),与大脑皮质内的RGCs类似,海马齿状回内的RGCs为具有极性特征的双极细胞,其放射状长突起起到了类似于“脚手架”的作用,从而引导海马齿状回内神经干细胞的迁移、分化[12]。海马齿状回中RGCs的神经发生是形成新学习记忆的基础。Barry等[13]证实RGCs在神经发生在大脑功能的发育中发挥重要的作用。出生后海马神经发生可以被环境因素和神经递质改变调控[14-15]。因此,丙泊酚是否通过调控海马神经干细胞神经发生从而影响机体后期认知功能值得研究。
Ki67是一种增殖细胞相关的核抗原,其功能与有丝分裂密切相关,是目前用来判断细胞增殖能力的主要指标之一。本研究免疫组织化学结果表明高剂量60 mg/kg丙泊酚组较10%脂肪乳对照组海马齿状回的Ki67阳性细胞明显减少,低剂量30 mg/kg丙泊酚组与10%脂肪乳对照组无明显差异,提示丙泊酚抑制发育小鼠海马齿状回神经干细胞增殖且呈剂量依赖性。新生期海马齿回神经干细胞作为海马神经发生的起始点,其数量减少必将对海马的正常发育过程造成影响,这可能导致更远期的神经功能改变。
Nestin是神经干细胞特征性标记物,同时可以标记RGCs的突起[16]。笔者发现相对于10%脂肪乳对照组,高剂量60 mg/kg丙泊酚不仅减少RGCs的突起数量,还导致长突起的形成障碍。这个结论笔者又通过主要表达于RGCs,功能涉及神经元的发育的BLBP指标进行验证,免疫荧光BLBP研究结论和Nestin荧光研究结果趋势一致。这提示丙泊酚不仅影响发育小鼠齿状回中干细胞增殖能力,还能够抑制RGCS的发生。RGCS在海马的神经发生中发挥关键作用,一方面其能够提供“脚手架”引导海马中神经元的迁移,形成正常海马的分层结构;另一方面,RGCS作为神经祖细胞的一种,可以进一步分化成为神经元及神经胶质细胞,是海马中神经元及胶质细胞的来源。RGCs的发育受阻,对于海马正常结构形成及功能都有一定的影响。
通过检测成熟神经元标记物NeuN观察海马区域成熟神经元数量,发现高剂量60 mg/kg丙泊酚组P14小鼠海马齿状回中NeuN阳性细胞数明显减少且与10%脂肪乳对照组相比差异有统计学意义(P<0.05),而低剂量30 mg/kg丙泊酚组与10%脂肪乳对照组比较NeuN阳性细胞数未见明显差异,提示高剂量丙泊酚抑制小鼠海马齿状回神经干细胞发育成熟,并最终导致神经元数量减少。海马中神经元是海马发挥正常功能的基础,这提示结构的改变及神经元数量的减少是丙泊酚暴露引起的行为改变的关键因素。
综上所述,本研究结果表明丙泊酚抑制发育小鼠海马齿状回中神经干细胞的增殖,同时损伤干细胞突起数量和形态,最后导致成熟神经元的减少。丙泊酚影响发育小鼠海马齿状回干细胞的毒性作用呈现剂量依赖性。笔者合理推测高剂量丙泊酚会影响海马齿状回神经发生,通过此机制也能解释临床观察发现婴幼儿接触全身麻醉药物丙泊酚后出现认知功能改变,但是其如何具体参与到临床行为学的改变,有待后期更深入的研究。
[1]Huang J,Jing S,Chen X,et al.Propofol administration during early postnatal life suppresses hippocampal neurogenesis[J].Mol Neurobiol,2016,53(2):1031-1044.
[2]Olsen EA,Brambrink AM.Anesthesia for the young child undergoing ambulatory procedures:current concerns regarding harm to the developing brain[J].Curr Opin Anaesthesiol,2013,26(6):677-684.
[3]Wilder RT,Flick RP,Sprung J,et al.Early exposure to anesthesia and learning disabilities in a population-based birth cohort[J].Anesthesiology,2009,110(4):796-804.
[4]Yu D,Jiang Y,Gao J,et al.Repeated exposure to propofol potentiates neuroapoptosis and long-term behavioral deficits in neonatal rats[J].Neuroscience Letters,2013,534(1):41-46.
[5]Creeley C,Dikranian K,Dissen G,et al.Propofol-induced apoptosis of neurones and oligodendrocytes in fetal and neonatal rhesus macaque brain[J].Br J Anaesth,2013,110 Suppl 1:29-38.
[6]Luo Y,Coskun V,Liang A,et al.Single-cell transcriptome analyses reveal signals to activate dormant neural stem cells[J].Cell,2015,161(5):1175-1186.
[7]Ponten E,Fredriksson A,Gordh T,et al.Neonatal exposure to propofol affects BDNF but not CaMKⅡ,GAP-43,synaptophysin and tau in the neonatal brain and causes an altered behavioural response to diazepam in the adult mouse brain[J].Behav Brain Res,2011,223(1):75-80.
[8]Geil CR,Hayes DM,McClain JA,et al.Alcohol and adult hippocampal neurogenesis:promiscuous drug,wanton effects[J].Prog Neuropsychopharmacol Biol Psychiatry,2014(54):103-113.
[9]StargattR,DavidsonAJ,HuangGH,etal.AcohortstudyoftheincidenceandriskfactorsfornegativebehaviorchangesinchildrenaftergeneralanesthesiaCurrent state of anti-PD-L1 and anti-PD-1 agents in cancer therapy[J].Mol Immunol,2015,67(2):4-17.
[2]赵飞龙,麦海星,李学超,等.PD-1/PD-L1信号通路在免疫细胞中的作用及其阻断抗体在肿瘤治疗中的应用[J].细胞与分子免疫学杂志,2015(5):701-703.
[3]Gibson A,Ogese M,Sullivan A,et al.Negative regulation by PD-L1 during drug-specific priming of IL-22-secreting T cells and the influence of PD-1 on effector T cell function[J].J Immunol,2014,192(6):2611-2621.
[4]Brahmer JR,Tykodi SS,Chow LQ,et al.Safety and activity of anti-PD-L1 antibody in patients with advanced cancer[J].N Engl J Med,2012,366(26):2455-2465.
[5]Bouchard MJ,Schneider RJ.The enigmatic X gene of hepatitis B virus[J].J Virol,2004,78(23):12725-12734.
[6]Tang H,Oishi N,Kaneko S,et al.Molecular functions and biological roles of hepatitis B virus x protein[J].Cancer Sci,2006,97(10):977-983.
[7]Guo L,Wang X,Ren L,et al.HBx affects CUL4-DDB1 function in both positive and negative manners[J].Biochem Biophys Res Commun ,2014,450(4):1492-1497.
[8]Feitelson MA,Duan LX.Hepatitis B virus X antigen in the pathogenesis of chronic infections and the development of hepatocellular carcinoma[J].Am J Pathol,1997(150):1141-1157.
[9]Li T,Robert EI,van Breugel PC,et al.A promiscuous alpha-helical motif anchors viral hijackers and substrate receptors to the CUL4-DDB1 ubiquitin ligase machinery[J].Nat Struct Mol Biol 2010,17(2):105-111.
[10]Angers S,Li T,Yi X,et al.Molecular architecture and assembly of the DDB1-CUL4A ubiquitin ligase machinery[J].Nature,2006,443(7111):590-593.
[11]Carreno BM,Collins M.The B7 family of ligands and its receptors:new pathways for costimulation and inhibition immune responses[J].Annu Rev Immunol,2002,20(1):29-53.
[12]Belloni L,Allweiss L,Guerrieri F,et al.IFN-alpha inhibits HBV transcription and replication in cell culture and in humanized mice by targeting the epigenetic regulation of the nuclear cccDNA minichromosome[J].J Clin Inves,2012(122):529-537.
Effectsofpropofolonneuralstemcellsinmousedevelopinghippocampaldentategyrus*
JingSheng,PengJing,BaoXiaohang,ChenJie,DuZhiyong,LiHong,HuangHe△
(DepartmentofAnesthesiology,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China)
ObjectiveTo observe the effects of propofol on neural stem cells in mouse developing hippocampal dentate gyrus (DG).MethodsHealthy 7 d old mice from the same litters were randomly allocated into three groups:high dose propofol group,low dose propofol group and 10% fat emulsion control group.All mice were treated with drugs on postnatal 7 d.The mice in high dose propofol group were intraperitoneally injected with 60 mg/kg propofol;the mice in low dose group were intraperitoneally injected 30 mg/kg propofol;while the mice in the control group with equivalent volume of 10% fat emulsion.Some mice were sacrificed at 24 h after medication injection,and the others were sacrificed at postnatal 14 d.The morphology and expression levels of Ki67,Nestin,BLBP and NeuN in hippocampal DG were detected by immunohistochemical method.ResultsHealthy 7 d old mice from the same litters were randomly allocated into three groups:high dose propofol group,low dose propofol group and 10% fat emulsion control group.All mice were treated with drugs on postnatal 7 d.The mice in high dose propofol group were intraperitoneally injected with 60 mg/kg propofol;the mice in low dose group were intraperitoneally injected 30 mg/kg propofol;while the mice in the control group with equivalent volume of 10% fat emulsion.Some mice were sacrificed at 24 h after medication injection,and the others were sacrificed at postnatal 14 d.The morphology and expression levels of Ki67,Nestin,BLBP and NeuN in hippocampal DG were detected by immunohistochemical method.ConclusionHigh dose propofol inhibits the proliferation of neural stem cells in hippocampal DG,and impaired the prominence number of neural stem cells and causes neurons dysmaturity.
propofol;stem cells;hippocampus
10.3969/j.issn.1671-8348.2017.27.005
R994.1
A
1671-8348(2017)27-3759-04
2016-11-28
2017-05-06)
国家自然科学基金资助项目(81370210)。
景胜(1982-),硕士,主治医师,主要从事麻醉药物毒性研究。△
,E-mail:13708385559@163.com。

