GRIM-19在子宫腺肌病中的表达及促进疾病发展的机制研究
蒋 静,陈 燕,吴 宏
(川北医学院附属医院妇产科,四川南充 637000)
GRIM-19在子宫腺肌病中的表达及促进疾病发展的机制研究
蒋 静,陈 燕,吴 宏
(川北医学院附属医院妇产科,四川南充 637000)
目的研究诱导细胞凋亡相关基因-19(GRIM-19)在子宫腺肌病患者子宫内膜组织中的表达水平,并探讨其在疾病发生发展中的分子机制。方法取30例子宫腺肌病患者异位和在位内膜组织,采用免疫组织化学和Western blot检测内膜组织中GRIM-19、磷酸化信号转导及转录激活蛋白3(pSTAT3)和内皮生长因子(VEGF)的表达水平。采用TUNEL检测内膜组织凋亡,CD34抗体直接检测内膜组织新生血管形成。构建GRIM-19 siRNA和重组质粒,转染Ishikawa细胞后检测下游信号分子pSTAT3、信号转导和转录激活因子3(STAT3)和VEGF的变化。结果与对照组相比,子宫腺肌病患者在位内膜和异位内膜组织中GRIM-19表达水平降低。在位内膜和异位内膜组织中细胞凋亡减少,微血管密度、pSTAT3和VEGF表达水平升高。转染Ishikawa细胞,下调GRIM-19表达可显著激活pSTAT3和VEGF。结论GRIM-19通过抑制细胞凋亡和增加新生血管形成,促进子宫腺肌病的发生发展。
凋亡诱导因子;子宫腺肌病;凋亡;血管生成
子宫腺肌病是育龄女性常见的妇科疾病,由子宫内膜腺体和间质侵袭至子宫肌层,并引起肌层显著增厚。目前子宫腺肌病的病因及发病机制尚未完全明确。诱导细胞凋亡相关基因(GRIMs)是一种近年来研究发现的由干扰素/维甲酸合并诱导的细胞凋亡基因编码,通过反义RNA敲除技术筛选出的凋亡蛋白[1]。诱导细胞凋亡相关基因-19(GRIM-19)是GRIMs家族成员之一,在多种正常组织中表达,而在肿瘤如肾透明细胞癌和前列腺癌中GRIM-19表达明显降低[2]。GRIM-19可与信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)结合并抑制其转录活性[3]。持续活化的STAT3可抑制细胞凋亡,并直接上调血管内皮生长因子(vascular endothelial growth factor,VEGF)表达,刺激新生血管形成[4]。研究GRIM-19在子宫腺肌病患者内膜组织中的表达水平,并探索其在疾病发生发展过程中的作用及机制,可能为子宫腺肌病的治疗提高新的靶点。
1 材料与方法
1.1标本收集 子宫内膜标本选取本院2014年1月至2015年12月经腹或腹腔镜子宫切除术患者中经病理证实的30例子宫腺肌病患者(年龄31~41岁,体质量指数17.66~29.4 kg/m2,增殖期子宫内膜17例,分泌期子宫内膜13例),10例非子宫腺肌病患者(年龄33~39岁,体质量指数18.8~26.8 kg/m2,增殖期子宫内膜6例,分泌期子宫内膜4例)。本研究获得本院伦理委员会批准,纳入研究的患者均签署知情同意书。排除标准:近3个月口服避孕药或其他激素药物;子宫内膜癌;盆腔子宫内膜异位症;子宫肌瘤;卵巢囊瘤。收集的子宫内膜标本分别保存于液氮和4%甲醛固定。
1.2TUNEL法检测细胞凋亡 制备内膜组织石蜡包埋切片,利用TUNEL细胞凋亡检测试剂盒(Roche)进行脱蜡、漂洗、蛋白酶K处理、固定和封闭。设置阳性对照和阴性对照,配置Dnasel反应液,孵育并滴加100 μL TdT酶反应液标记,避光孵育60 min后滴加DAB显色液,漂洗后中性树胶封片。在400倍光学显微镜下随机选择5个视野计数TUNEL染色阳性细胞。
1.3免疫组织化学 收集内膜组织甲醛溶液固定,石蜡包埋切片,脱蜡后加入定量pH6.0柠檬酸盐缓冲液和3%H2O2,用血清封闭后滴加一抗,GRIM-19单抗(Abcam,1∶500)、pSTAT3单抗(Abcam,1∶100)、VEGF抗体(Abcam,1∶150)、CD34单抗 (Zhongshan,1∶100),4 ℃孵育过夜。冲洗后滴加二抗,孵育30 min后冲洗显色,复染后封片。采用Image Pro-plus进行免疫组织化学吸光度测量。
1.4蛋白提取及Western blot 使用Tissue Protein Extraction Reagent(Cwbio)提取内膜组织蛋白,BCA法测定蛋白浓度,50 μg/孔上样,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)转膜封闭,孵育抗体并显色。抗体稀释浓度如下:GRIM-19 (Abcam∶mAb,1∶1 000),pSTAT3(Abcam∶mAb,1∶5 000),STAT3(Abcam∶mAb,1∶1 000),VEGF (Abcam∶pAb,1∶1 500),GAPDH(Abcam∶mAb,1∶3 000)。
1.5细胞培养及细胞转染 Ishikawa细胞购自中国科学院上海生物科学院细胞资源中心,采用DMEM培养基和10%FBS培养。pEGFP-N1、GRIM-19重组质粒(pEGFP-N1-GRIM-19)和FAM-siRNA、GRIM-19-siRNA(5′-GGAUUGGAACCCUGAUCUATT-3′)均由上海吉凯基因合成及鉴定。采用Lipofectamine 2000(Invitrogen)转染细胞,转染后6 h更换培养基,荧光显微镜下检测转染效率。转染后48 h提取细胞蛋白进行Western blot检测。
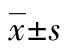
2 结 果
2.1子宫腺肌病患者内膜组织中GRIM-19的表达 采用免疫组织化学方法检测子宫腺肌病患者在位内膜和异位内膜组织以及对照组子宫内膜中GRIM-19表达水平。结果显示GRIM-19染色主要位于子宫内膜腺上皮细胞,子宫腺肌病患者内膜组织中GRIM-19表达明显低于对照组(P<0.05),并且子宫腺肌病患者异位内膜组织中GRIM-19表达低于在位内膜组织,差异具有统计学意义,见图1A。Western blot检测发现:子宫腺肌病患者在位内膜GRIM-19蛋白表达较对照组明显降低(P<0.05),见图1B。
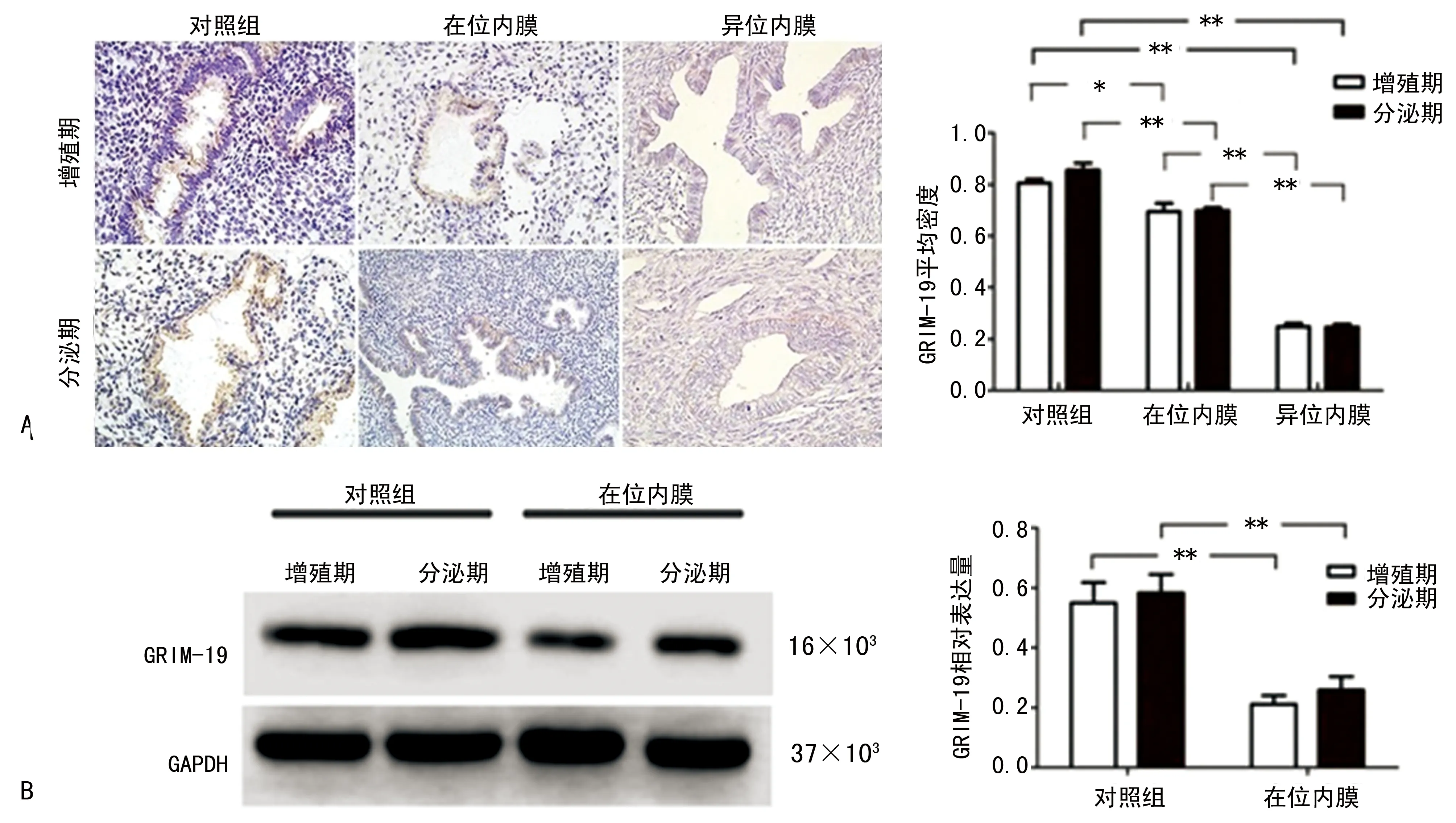
2.2子宫腺肌病患者内膜组织中细胞凋亡情况 采用TUNEL实验检测子宫腺肌病患者内膜组织细胞凋亡情况。与对照组内膜组织相比,子宫腺肌病患者在位和异位内膜组织中凋亡细胞数明显减少(P<0.05),其中异位病灶内膜组织中凋亡细胞数少于在位内膜组织,见图2。不同内膜组织中凋亡细胞数不随月经周期而改变,增殖期和分泌期子宫内膜凋亡细胞数差异无统计学意义(P>0.05)。
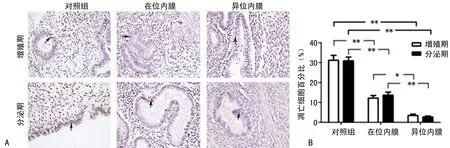
2.3子宫腺肌病内膜组织VEGF表达和新生血管形成 疾病发生发展过程中,VEGF通过刺激血管内皮细胞增生促进血管新生。本实验中采用免疫组织化学法检测内膜组织中VEGF的表达,通过检测新生血管内皮细胞标志物CD34表达来确定内膜组织中微血管密度。结果显示,增殖期和分泌期子宫内膜组织中染色的VEGF主要位于腺上皮细胞内。与对照组内膜组织相比,子宫腺肌病患者在位和异位内膜组织中VEGF表达明显升高(P<0.05),其中异位病灶内膜组织中VEGF表达量最高,见图3A。3组内膜组织中,增殖期与分泌期子宫内膜VEGF表达无明显统计学差异。Western blot检测发现:子宫腺肌病患者在位内膜VEGF蛋白表达较对照组明显升高(P<0.05),见图3B。与对照组内膜相比,子宫腺肌病患者异位内膜组织中微血管密度明显升高,见3C。
2.4GRIM-19通过STAT3调控VEGF表达 采用免疫组织化学法检测内膜组织中pSTAT3表达。结果显示对照组内膜组织中pSTAT3主要位于子宫内膜腺上皮细胞和间质细胞,子宫腺肌病患者在位内膜和异位内膜组织中pSTAT3主要位于腺上皮细胞。在位内膜和异位内膜组织中pSTAT3表达明显高于对照组(P<0.05),见图4A。Western blot检测发现:子宫腺肌病患者在位内膜pSTAT3蛋白表达较对照组明显升高(P<0.05),而两组总STAT3蛋白差异无统计学意义,见图4B。
A:子宫腺肌病患者在位、异位内膜组织和对照组正常内膜组织中GRIM-19免疫组织化学染色×400光镜图及染色阳性细胞平均密度分数;B:子宫腺肌病患者在位内膜组织和对照组正常内膜组织中GRIM-19蛋白表达及蛋白相对表达量柱状图。*:P<0.05,**:P<0.01
图1子宫腺肌病患者内膜组织中GRIM-19的表达情况
A:子宫腺肌病患者内膜组织和对照组内膜组织TUNEL凋亡染色(×400),黑色箭头所示为凋亡细胞TUNEL染色阳性。B:不同组织中TUNEL染色阳性细胞数。*:P<0.05,**:P<0.01
图2子宫腺肌病患者内膜组织细胞凋亡情况
A:子宫腺肌病患者内膜组织和对照组内膜组织VEGF免疫组织化学染色(×400)和染色阳性细胞平均密度分数;B:子宫腺肌病患者在位内膜组织和对照组正常内膜组织中VEGF蛋白表达及蛋白相对表达量柱状图;C:子宫腺肌病患者内膜组织和对照组内膜组织CD34免疫组织化学染色(×200)和微血管密度统计分析柱状图。*:P<0.05,**:P<0.01
图3子宫腺肌病患者内膜组织VEGF表达和微血管密度分析
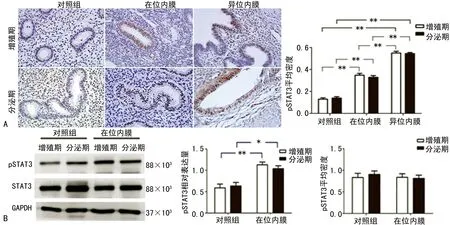
A:子宫腺肌病患者在位、异位内膜组织和对照组正常内膜组织中pSTAT3免疫组织化学染色(×400)及染色阳性细胞平均密度分数;B:子宫腺肌病患者在位内膜组织和对照组正常内膜组织中pSTAT3和总STAT3蛋白表达及蛋白相对表达量柱状图。*:P<0.05,**:P<0.01
图4子宫腺肌病患者内膜组织中pSTAT3的表达情况
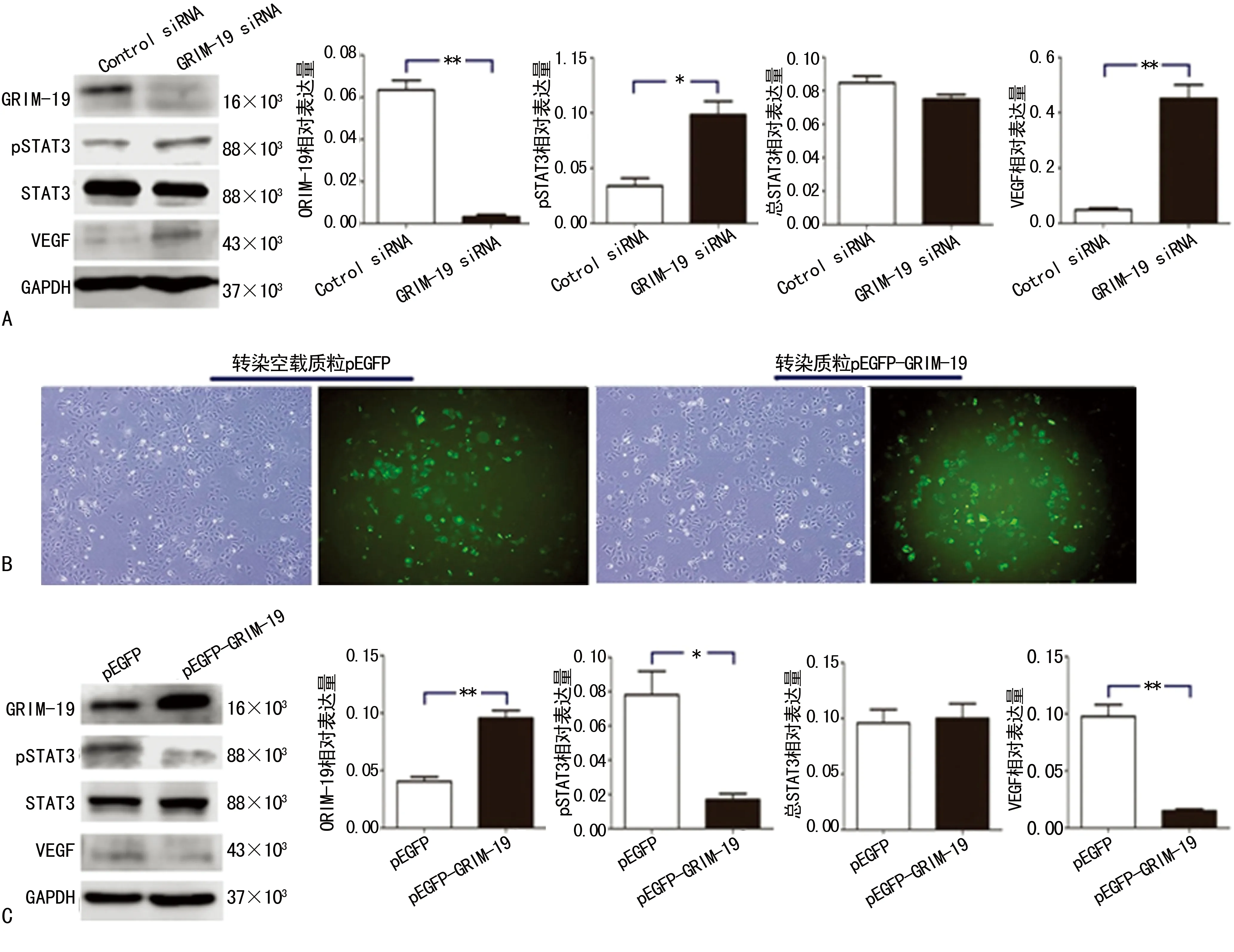
A:Ishikawa细胞转染GRIM-19 siRNA和Control siRNA 48 h后GRIM-19、pSTAT3、STAT3和VEGF蛋白表达及蛋白相对表达量柱状图;B:Ishikawa细胞转染pEGFP-GRIM-19和空载pEGFP后×400荧光和普通镜光镜图;C:Ishikawa细胞转染pEGFP-GRIM-19和空载pEGFP 48 h后GRIM-19、pSTAT3、STAT3和VEGF蛋白表达及蛋白相对表达量柱状图。*:P<0.05,**:P<0.01
图5上调和下调GRIM-19对pSTAT3和VEGF表达的影响
小干扰RNA(GRIM-19 siRNA和Control siRNA)转染Ishikawa细胞。Western blot结果显示相较于空白对照组,转染GRIM19 siRNA后Ishikawa细胞表达GRIM-19明显减少(P<0.05),而pSTAT3及其下游VEGF表达明显增加(P<0.05),见图5A。Ishikawa细胞转染pEGFP-GRIM-19上调GRIM-19表达,荧光显微镜下评估转染效率,见图5B。与空载质粒相比,转染pEGFP-GRIM-19后细胞表达GRIM-19明显增加(P<0.05),pSTAT3和VEGF表达减少(P<0.05);总STAT3表达在两组细胞内差异无统计学意义(P>0.05),见图5C。
3 讨 论
子宫腺肌病的发病机制较为复杂。解剖上子宫内膜基底层缺乏黏膜下层,使得子宫内膜腺体和间质易于侵入子宫肌层,并在肌层内形成异位病灶。然而,触发子宫内膜“侵袭”子宫肌层的具体机制尚未完全明确。Chen等[5]研究发现在异位病灶组织内存在一系列形态功能改变,包括细胞增殖、细胞凋亡和新生血管的形成等。这些功能改变增强了异位病灶内腺上皮细胞和间质细胞的侵袭能力,使得异位的内膜组织更易在子宫肌层内“扩散转移”。研究发现,Ki-67是一种细胞增殖常用标记蛋白,在子宫腺肌病内膜间质细胞内呈高表达[6]。因此,子宫内膜细胞异常的细胞增殖和细胞凋亡可能明显影响子宫腺肌病的发展过程。同时,异位内膜病灶的建立需要新生血管形成并供给血液[7]。在本研究中,笔者检测了子宫腺肌病患者内膜组织中GRIM-19的表达以及细胞凋亡和新生血管形成情况,发现GRIM-19通过调控细胞凋亡和血管形成,在子宫腺肌病的发病机制中起着重要作用。
本研究中,笔者发现子宫腺肌病患者在位内膜和异位内膜组织中细胞凋亡数量显著减少,这与Taguchi等[8]的研究结果一致。这些结果提示抑制细胞凋亡可能是子宫腺肌病发生过程中一个重要的步骤。有研究发现高表达GRIM-19可增强IFN-维甲酸介导的细胞凋亡过程。众多研究提示GRIM-19对细胞凋亡和细胞生长有重要影响。另外,GRIM-19在抑制肿瘤生长的过程中也起着关键作用,GRIM-19等位基因的缺失可增加活体细胞肿瘤易感性[9]。Hao等[10]研究发现低表达GRIM-19可显著增强肝癌细胞黏附和侵袭能力,而Huang等[11]的研究结果提示上调GRIM-19表达可抑制胃癌细胞SGC-7901的黏附、迁移和侵袭过程。本研究中,子宫腺肌病患者在位内膜和异位内膜组织中GRIM-19表达显著减少。这些结果提示,内膜腺上皮细胞低表达GRIM-19可介导细胞凋亡减少,从而诱导腺体和间质侵袭至内膜肌层交界区甚至子宫肌层,导致子宫腺肌病的发生。
为了进一步探讨GRIM-19介导细胞凋亡的分子机制,笔者检测了GRIM-19相关基因STAT3的表达。Bu等[3]发现GRIM-19通过下调细胞增殖和凋亡相关基因表达,抑制STAT3介导的细胞转化和有丝分裂等过程。本实验中,子宫腺肌病患者在位内膜和异位内膜组织中存在STAT3的异常激活,且GRIM-19呈相应的低表达。同本研究结果一致,Yue等[12]发现在宫颈癌细胞中GRIM-19低表达与pSTAT3的过度活化密切相关。pSTAT3在肿瘤生长和转移过程中具有重要作用。STAT3的磷酸化过程主要受上游酪氨酸激酶调控,包括细胞因子、生长因子、非受体酪氨酸激酶等。GRIM-19通过介导v-Src可显著减少pSTAT3及下游相关基因的表达,如c-myc、cyclin B1和cyclin D1等[13]。这些结果提示,GRIM-19可通过抑制pSTAT3活化,从而减少子宫腺肌病内膜细胞凋亡和生长。
VEGF作为新生血管形成过程中重要的因子,也是STAT3下游靶基因蛋白。有研究发现在子宫腺肌病患者在位内膜和异位内膜组织中VEGF水平显著升高[14],同本研究结果一致。组织芯片研究发现,在胃癌细胞中pSTAT3与VEGF的表达存在相关性,高表达的pSTAT3通过介导VEGF启动子活性影响VEGF的表达[15]。本实验中,下调GRIM-19的表达可激活pSTAT3,促进其下游VEGF表达。
综上所述,低表达的GRIM-19可能通过调节GRIM-19-STAT3-VEGF信号通路,抑制细胞凋亡,加快新生血管形成,从而促进子宫腺肌病发生发展。GRIM-19可能成为子宫腺肌病的治疗新靶点。
[1]Hao M,Shu Z,Sun H,et al.GRIM-19 expression is a potent prognostic marker in colorectal cancer[J].Hum Pathol,2015,46(12):1815-1820.
[2]Toshio K,Takuo H,Keiko M,et al.Characterization of pulmonary cysts in Birt-Hogg-Dubé syndrome:histopathological and morphometric analysis of 229 pulmonary cysts from 50 unrelated patients[J].Histopathology, 2014 ,65(1):100-110.
[3]Bu X,Zhao C,Wang W,et al.GRIM-19 inhibits the STAT3 signaling pathway and sensitizes gastric cancer cells to radiation[J].Gene,2013,512(2):198-205.
[4]Ferguson SD,Srinivasan VM,Heimberger AB.The role of STAT3 in tumor-mediated immune suppression[J].J Neurooncol,2015,123(3):385-394.
[5]Chen YZ,Wang JH,Yan J,et al.Increased expression of the adult stem cell marker Musashi-1 in the ectopic endometrium of adenomyosis does not correlate with serum estradiol and progesterone levels[J].Euro J Obstet Gynecol Reprod Biol,2014,173(2):88-93.
[6]Xu H,Yang Y,Zhou C,et al.Increased endometrial expression of CC-chemokine receptor-1 in women with adenomyosis.[J].Histol Histopathol,2014,29(9):1153-1160.
[7]Song WW,Lu H,Hou WJ,et al.Expression of vascular endothelial growth factor C and anti-angiogenesis therapy in endometriosis[J].Int J Clin Exp Pathol,2014,7(11):7752-7759.
[8]Taguchi A,Koga K,Kawana K,et al.Resveratrol enhances apoptosis in endometriotic stromal cells[J].Am J Reprod Immunol,2016,75(4):486-492.
[9]KalakondaS,NallarSC,JaberS,etal.MonoalleliclossoftumorsuppressorGRIM-19promotestumorigenesisinmice[J].ProcNatlAcadSciUSA,2013,110(45):E4213-E4222.
[10]Hao H,Liu J,Liu G,et al.Depletion of GRIM-19 accelerates hepatocellular carcinoma invasion via inducing EMT and loss of contact inhibition[J].J Cell Physiol,2012,227(3):1212-1219.
[11]Huang Y,Yang M,Yang H,et al.Up regulation of the GRIM-19 gene suppresses invasion and metastasis of human gastric cancer SGC-7901 cell line[J].Exp Cell Res,2010,316(13):2061-2070.
[12]Yue X,Zhao P,Wu K,et al.GRIM-19 inhibition induced autophagy through activation of ERK and HIF-1α not STAT3 in Hela cells[J].Tumour Biol,2016,25(1):1-8.
[13]Wang GM,Ren ZX,Wang PS,et al.Plasmid-based Stat3-specific siRNA and GRIM-19 inhibit the growth of thyroid cancer cells in vitro and in vivo[J].Oncol Rep,2014,32(2):573-580.
[14]Huang TS,Chen YJ,Chou TY,et al.Oestrogen-induced angiogenesis promotes adenomyosis by activating the Slug-VEGF axis in endometrial epithelial cells[J].J Cell Mol Med,2014,18(7):1358-1371.
[15]Deng J,Cui J,Jiang N,et al.STAT3 regulation the expression of VEGF-D in HGC-27 gastric cancer cell[J].Am J Transl Res,2014,6(6):756-767.
ExpressionofGRIM-19inadenomyosisanditsmechanismforpromotingdiseaseprogress
JiangJing,ChenYan,WuHong
(DepartmentofObstetricsandGynecology,AffiliatedHospitalofChuanbeiMedicalCollege,Nanchong,Sichuan637000,China)
ObjectiveTo study the expression level of GRIM-19 in endometrial tissue of the patients with adenomyosis and to investigate its molecular mechanism during disease occurrence and progress process.MethodsThe ectopic and eutopic endometrial tissues were obtained from 30 patients with adenomyosis.Immunohistochemistry and Western blot were performed to detect the expression of GRIM-19,pSTAT3 and VEGF.The endometrial tissue apoptosis was assayed by TUNEL.Immunohistochemistry with anti-CD34 antibody was performed to detect angiogenesis in endometrial tissue.GRIM-19 small interfering RNA(siRNA) and recombinant GRIM-19 plasmid were constructed and transfected into Ishikawa cells for detecting the change of downstream signal molecules pSTAT3,STAT3 and VEGF.ResultsThe expression level of GRIM-19 was decreased in the ectopic and eutopic endometrial tissues of patients with adenomyosis compared with control group.Apoptosis in ectopic and eutopic endometrial tissues was reduced;the microvessel density and expression levels of pSTAT3 and VEGF were increased.Transfecting Ishikawa cells and down-regulating GRIM-19 expression could significantly activate pSTAT3 and VEGF.ConclusionGRIM-19 promotes the occurrence and development of adenomyosis by inhibiting apoptosis and angiogenesis.
apoptosis inducing factor;adenomyosis;apoptosis;angiogenesis
10.3969/j.issn.1671-8348.2017.27.021
R711
A
1671-8348(2017)27-3811-05
2016-12-16
2017-05-14)
蒋静(1973-),硕士,副教授,主要从事妇产科疾病的高强度聚集超声治疗。

