甘草酸对高糖诱导的肾小球系膜细胞氧化应激损伤的影响*
侯绍章,张 婷,李 媛,伍智慧
(宁夏医科大学:1.基础医学院病理系;2.护理学院,银川 750004)
甘草酸对高糖诱导的肾小球系膜细胞氧化应激损伤的影响*
侯绍章1,张 婷1,李 媛2,伍智慧1
(宁夏医科大学:1.基础医学院病理系;2.护理学院,银川 750004)
目的探讨甘草酸(GA)对高糖诱导的肾小球系膜细胞氧化应激损伤的影响。方法将HBZY-1细胞分为:正常对照组(NG组)、高糖组(HG组)、高糖+GA组(HG+GA组)。采用四甲基偶氮唑蓝(MTT)法检测细胞增殖活性。用紫外分光光度法检测超氧化物歧化酶(SOD)和丙二醛(MDA)水平,用激光共聚焦检测活性氧(ROS)变化。采用免疫组织化学和Western blot检测锰超氧化物歧化酶(Mn-SOD)蛋白的表达,用Q-PCR检测Mn-SOD mRNA。结果(1)各组HBZY-1细胞形态变化:HBZY-1细胞为菱形,NG组细胞形态正常,结构清晰可辨;HG+GA组细胞数量略增多,个别细胞胞体略肥大;HG组细胞结构不甚清晰,细胞扁平,数量明显增多,胞体略肥大。(2)各组HBZY-1细胞的增殖效应:与NG组相比,HG组OD值明显升高(P<0.05),HG+GA组与HG组相比OD值降低(P<0.05)。(3)RDS含量:HG组RDS相对含量较NG组有所上升,HG+GA组ROS相对含量下降(P<0.05)。(4)各组细胞中Mn-SOD的表达:与NG组相比,HG组Mn-SOD相对表达减少(P<0.05),HG+GA组与HG组相比Mn-SOD表达升高(P<0.05)。结论GA对高糖诱导的HBZY-1细胞异常增殖有一定的抑制作用,GA可通过氧化应激保护高糖诱导肾小球系膜细胞所致的细胞肥大和细胞损伤,GA能调节高糖诱导下Mn-SOD的表达。
甘草酸;肾小球系膜细胞;氧化应激
糖尿病肾病(diabetic nephropathy,DN)是最常见的糖尿病微血管并发症之一,同时是导致终末期肾衰竭和影响糖尿病患者生活质量的重要原因之一[1]。DN的发病机制至今还未完全阐明,有大量研究证实,在DN的发病过程中,血流动力学改变、糖代谢紊乱、脂代谢紊乱、氧化应激、血管活性物质及细胞因子激活等起了重要作用[2-3]。由于糖、脂代谢紊乱,DN会导致线粒体功能紊乱和体内氧化应激水平的升高[4]。研究证实,高糖诱导细胞线粒体呼吸链产生过量活性氧(reactive oxygen species,ROS)是DN并发症发生的启动因素[5],而氧化应激表现为ROS、丙二醛(MDA)增多和抗氧化酶超氧化物歧化酶(SOD)活性下降。另外,过多的 ROS会诱导多种细胞因子表达,使肾小球滤过增加,基底膜增厚,参与DN的发病过程,因此抑制肾脏的氧化应激可有效防治DN[6]。
近年来,从中草药中寻找治疗DN可能的方法和药物成为防治DN的研究热点。甘草的主要成分甘草酸(glycyrrhizic acid,GA)具有明显的抗炎、抗病毒、抗氧化、调节免疫功能等多种药理作用[7]。已有研究表明,GA能明显改善链脲佐菌素(STZ)导致的糖尿病,降低高血糖、高脂血症及相关的氧化应激,有望成为治疗糖尿病的药物。另外GA还能明显缓解糖尿病导致的胰脏和肾脏异常,并且降低氧化应激参数,激活糖异生酶的作用。因此,本实验探讨GA对高糖培养的肾小球系膜细胞氧化应激损伤的影响,为DN的防治提供理论依据。
1 材料与方法
1.1仪器与试剂 CO2培养箱(NUAIR-NU-5510E,美国),超净工作台(BCM-1300A,苏净安泰);GA(日本东京化成工业公司),大鼠肾小球系膜细胞株 HBZY-1(北纳创联生物技术研究院),TTC试剂盒 (南京凯基),细胞培养基DMEM、胎牛血清(FBS)、胰蛋白酶(Hyclone公司)。
1.2方法
1.2.1HBZY-1细胞培养及分组 当HBZY-1细胞生长达到80%融合时,用胰酶消化传代,置于5% CO2培养箱内37 ℃孵育24、48 h。接种于96孔细胞培养板上,继续培养48 h使细胞生长融合。将细胞分为:正常对照组(NG组)、高糖组(HG组)和高糖+GA组(HG+GA组)。
1.2.2采用四甲基偶氮唑蓝(MTT)法进行细胞增殖检测 取对数生长期的HBZY-1细胞,按实验分组分别处理24 h,每孔加入50 μL 1×MTT(5 g/L)孵育4 h,镜下观察,MTT 掺入细胞内,吸出上清液,加入150 μL二甲基亚砜(DMSO)使细胞内甲臜溶解,用平板摇床摇匀振荡10 min,待细胞完全溶解后,放入自动酶标仪490 nm波长读数,并记录光密度(OD)值。
1.2.3HBZY-1细胞中ROS的表达 按照1∶1 000用无血清培养液稀释二氯荧光黄双乙酸盐(DCFH-DA)。按照原位装载探针的方法,取出干预24 h的培养板,去除细胞培养液,加入300 μL稀释好的DCFH-DA,阳性对照孔加入Rosup作为阳性对照。37 ℃细胞培养箱内孵育30 min,利用激光共聚焦显微镜观察(488 nm激发波长,525 nm发射波长)。
1.2.4各组细胞上清液SOD和MDA测定 取对数生长期的HBZY-1细胞,24 h贴壁换液后,按实验分组处理24 h,收集各组上清液,操作按试剂盒说明书进行。
1.2.5免疫荧光检测GA对锰超氧化物歧化酶(Mn-SOD)表达的影响 取对数生长期的HBZY-1细胞,24 h贴壁换液后,按实验分组处理24 h进行免疫荧光检测。(1)多聚甲醛室温固定30 min;(2)0.2% TritonX-100室温处理20 min;(3)3%H2O2孵育30 min;(4)封闭血清37 ℃ 20 min;(5)Mn-SOD一抗孵育(Mn-SOD滴度为1∶300)4 ℃过夜,阴性对照用PBS;(6)荧光二抗工作液37 ℃孵育30 min;(7)DAPI 复染核。
1.2.6Western blot分析 提取蛋白后电泳,转膜,一抗孵育,增强化学发光剂显像,曝光。膜洗脱后再次孵育,β-actin作为内对照。用计算机图像处理系统分析阳性强度。
1.2.7Q-PCR 使用Trizol试剂提取RNA,根据试剂说明书,使用寡聚(dT)18引物(0.5 μg/μL)以总体积为20 μL的RT试剂盒反转录。 使用cDNA和SYBR Green PCR Master Mix在荧光PCR仪(IQ-5)上进行实时PCR。引物为:Mn-SOD正向5′-AAG GAG CAA GGT CGC TTA CAG A-3′;Mn-SOD反向5′-CAA ATG GCT TTC AGA TAG TCA GGT C-3′;mRNA的相对量由2-△△Ct值计算确定。
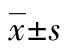
2 结 果
2.1GA对高糖诱导HBZY-1细胞增殖的影响 本研究预实验证实GA 为100 μmol/L 时对正常细胞无明显影响,但对高糖组细胞有抑制作用,作为后续实验的浓度。GA作用于高糖诱导的HBZY-1细胞24、48 h,MTT法检测各组细胞的增殖情况。与NG组相比,HG组细胞增殖明显增加(P<0.05),与HG组相比,HG+GA组细胞增殖受到抑制,差异有统计学意义(P<0.05),见图1。

A:各组细胞HE染色(×400);B:MTT分析图,*:P<0.05,与NG组比较;#:P<0.05,与HG组比较
图1 GA对高糖诱导HBZY-1细胞增殖的影响
2.2GA对高糖诱导HBZY-1细胞ROS的影响 与NG组相比,HG组中高糖诱导的HBZY-1细胞ROS产生增加,处理24 h后达峰值。GA处理后,ROS降低。 这些数据表明,在给予GA后,似乎有ROS产生的损伤或内源性ROS清除/抗氧化能力的增加。GA可抑制HBZY-1在高糖刺激下ROS的产生,见图2。
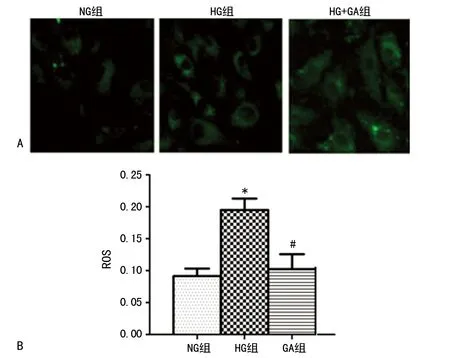
A:处理24 h各组细胞ROS水平(×400);B:激光共聚焦检测各组细胞ROS水平;*:P<0.05,与NG组比较;#:P<0.05,与HG组比较
图2 GA对高糖诱导HBZY-1细胞ROS的影响
2.3GA对高糖诱导HBZY-1细胞MDA水平和SOD活性的影响 HBZY-1细胞在高糖诱导下的MDA水平升高,处理24 h达峰值,而SOD活性下降,见图3。
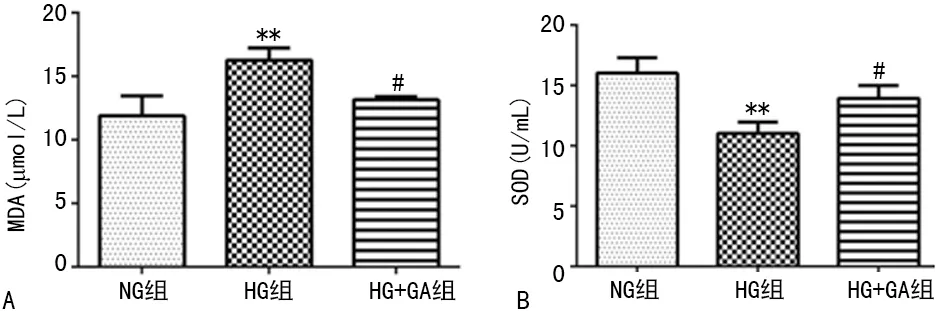
A:MDA水平;B:SOD活性,**:P<0.05,与NG组比较;#:P<0.05与HG组比较
图3 GA对高糖诱导的HBZY-1细胞MDA水平和SOD活性的影响
2.4GA对高糖诱导HBZY-1细胞中Mn-SOD蛋白表达的影响 与NG组相比, HG组Mn-SOD的表达水平降低。相比之下,GA治疗24 h内引起HBZY-1细胞的Mn-SOD蛋白表达增加。在各组中,Mn-SOD mRNA水平上变化与蛋白水平相似,见图4。

A:免疫荧光法检测各组中Mn-SOD蛋白表达(×400);B:免疫组织化学检测Mn-SOD的表达率;*:P<0.05,与NG组比较;#:P<0.05,与HG组比较。C:Western blot检测各组中Mn-SOD蛋白表达;D:Mn-SOD蛋白率。E:Mn-SOD mRNA表达,*:P<0.05,与NG组比较;#:P<0.05,与HG组比较
图4 HBZY-1细胞中Mn-SOD mRNA水平
3 讨 论
DN作为糖尿病最常见的并发症,近年来已成为糖尿病致死、致残的主要原因,因此许多国内外肾脏病学者把关注方向定于DN致病因素及机制研究。DN发病过程包括氧化应激、血管活性物质及细胞因子、糖代谢紊乱及由此导致的非酶糖化、多元醇通路激活、蛋白激酶C信号途径活化、血管活性物质及细胞因子等引起[2]。目前研究表明,氧化应激在DN的发病过程中起重要作用。氧化应激最主要的表现为ROS产生增多,从而引起机体一系列的损伤。糖尿病状态下肾脏氧化应激的发生与3个方面因素有关:机体ROS 大量增加;非酶性抗氧化分子减少;肾组织内的抗氧化酶活性改变。而ROS产生过多,可激活细胞内信号传导系统如p38/MAPK、ERK和JNK/SAPK、活化转录因子、表达转化生化因子-β(TGF-β)等活性产物,使细胞外基质(ECM)蛋白合成增加,降解减少,导致DN的发生和发展[3]。在DN的发病机制中,如何有效降低氧化应激损伤成为关注热点。本实验通过MTT法检测,发现GA能够显著提高高糖诱导产生氧化应激损伤的肾小球系膜细胞活力,提高细胞存活率,降低细胞内由高糖诱导的ROS产生。
DN的发病机制之一就是高血糖所导致的代谢异常,最终导致氧化应激反应,即线粒体电子传递链形成的超氧化物增多。而氧化应激的主要表现为ROS、MDA的增多和抗氧化酶SOD活性的下降。另外,有研究显示,高糖所致的肾皮质损伤也与氧化应激有关。在DN的发病中,氧化应激起到了关键的作用。在糖尿病/高血糖状态下,大多数组织都会产生大量的活性氧。在DN时,肾小球系膜细胞能够产生过量的ROS。同时,肾小球系膜细胞在高糖环境下生长,氧化应激是由自由基在体内产生的一种负面作用。在高糖环境中,氧化应激反应的主要表现为ROS产生增多[8-9]。同时,ROS可以与蛋白质、核酸等发生反应,从而引起炎性反应、细胞凋亡和细胞增殖等。另外,在DN中ROS与细胞增殖和DNA合成有密切的关系。在糖尿病/高血糖中,活性氧ROS主要在线粒体产生,因此ROS也可以破坏线粒体[10]。除了ROS在氧化应激中起到重要作用外,中和降解内源性抗氧化剂在细胞内氧化应激反应中也起到了重要的作用。例如,Mn-SOD也称作SOD2,是一种重要的抗氧化酶,Mn-SOD的主要作用是调节ROS的新陈代谢。所以,当Mn-SOD代谢紊乱时会导致ROS的产生增多,进而引起DN损伤。
另外,有研究表明,白藜芦醇能够改善高脂饮食引起的肥胖症和胰岛素抵抗,其主要作用也是通过调节AMPK/SIRT1通路而增加Mn-SOD的合成[11]。还有研究表明,SIRT1能够改善糖尿病/高血糖导致的内皮细胞损伤,主要是通过上调Mn-SOD的表达而发挥作用[12]。氧化应激反应能够导致MDA的产生过多,并且能够导致8-OHdG相应的增加而诱导DNA氧化损伤。因此,SOD水平和MDA表达量是氧化应激反应的重要标志物,引起氧化应激标志物变化的原因之一就是抗氧化酶的活性降低,从而导致细胞损伤。另外有研究证实,GA能够通过抗氧化作用减缓四氯化碳诱导的小鼠肝损伤。前期实验证实GA对DN具有保护作用,其涉及的可能分子机制与氧化应激有关。本研究利用免疫组织化学及Western blot方法检测Mn-SOD表达变化,结果表明Mn-SOD在正常肾小球系膜细胞中有表达,在高糖组中Mn-SOD蛋白表达减少,而HG+GA组中表达有所增加,说明GA能促进高糖诱导HBZY-1细胞中Mn-SOD蛋白的表达,抑制ROS,对高糖诱导的HBZY-1细胞损伤具有保护作用。
综上所述,GA可以减轻高糖诱导的肾小球系膜细胞的氧化应激损伤,其主要机制与降低胞内 ROS 产生和增加Mn-SOD蛋白的表达有关。本实验中GA减缓氧化应激损伤具体机制并未阐明,还有待进一步的验证。
[1]李栋,林珊.microRNAs在糖尿病肾病发病机制中的作用[J].天津医药,2015,43(6):698-701.
[2]AghadavodE,KhodadadiS,BaradaranA,etal.Roleofoxidativestressandinflammatoryfactorsindiabetickidneydisease[J].IranJKidneyDis,2016,[6]Worley MJ,Liu S,Hua Y,et al.Molecular changes in endometriosis-associated ovarian clear cell carcinoma[J].Eur J Cancer,2015,360(13):1831-1842.
[7]陈安安,汪炬.肿瘤中雌激素信号转导通路的研究进展[J].中国病理生理杂志,2012,28(3):570-576.
[8]Lai CR,Hsu CY,Chen YJ ,et al.Ovarian cancers arising from endometriosis:a microenvironmental biomarker study including ER,HNF-1β,p53,PTEN,BAF250a,and COX-2[J].J Chin Med Assoc,2013,76(11):629-634.
[9]DeLair D,Oliva E,Kobel M,et al.Morphologic spectrum of immunohistochemically characterized clear cell carcinoma of the ovary:a study of 155 cases[J].Am J Surg Pathol,2011,35(1):36-44.
[10]Tsuchiya A,Sakamoto M,Yasuda J,et al.Expression profiling in ovarian clear cell carcinoma:identification of hepatocyte nuclear factor-1 beta as a molecular marker and a possible molecular target for therapy of ovarian clear cell carcinoma[J].Am J Pathol,2003,163(6):2503-2512.
[11]Carli C,Metz CN,Al-Abed Y,et al.Up-regulation of cyclooxygenase-2 expression and prostaglandin E2 production in human endometriotic cells by macrophage migration inhibitory factor:involvement of novel kinase signaling pathways[J].Endocrinology,2009,150(7):3128-3137.
[12]Sivula A,Talvensaari-Mattila A,Lundin J,et al.Association of cyclooxygcnase-2 and matrix metallop roteinase-2 expression in human breast cancer[J].Breast Cancer Res Treat,2005,89(3):21-25.
[13]易金玲,沈艳丽,冯文广,等.子宫内膜异位症患者异位内膜组织中miR-556-3 p、VEGF 表达变化 [J].山东医药,2016,56(7):50-52.
Influenceofglycyrrhizicacidonoxidativestressinjuryofglomerularmesangialcellsinducedbyhighglucose*
HouShaozhang1,ZhangTing1,LiYuan2,WuZhihui1
(1.DepartmentofPathology,BasicMedicalCollege;2.SchoolofNursing,NingxiaMedicalUniversity,Yinchuan,Ningxia750004,China)
ObjectiveTo investigate the influence of glycyrrhizic acid (GA) on oxidative stress injury in glomerular mesangial cells (HBZY-1) induced high glucose.MethodsHBZY-1 was cultured and divided into the normal control group,high glucose group and high glucose + GA group.The cell proliferation activity was measured by MTT assay.UV spectrophotometry was used to detect the SOD and MDA levels.And the ROS changes were detected by laser confocal microscopy.Immunohistochemistry and Western blot were used to detect the expression of Mn-SOD protein in various groups.Mn-SOD mRNA was detected by Q-PCR.Results(1)The morphological changes in each group:HBZY-1 cells were diamond-shaped,cells were normal and the structure was clear in the NG group.In the HG+GA group,the number of cells was increased slightly,individual cell body was slightly hypertrophy.The cell structure in the HG group was not clear,the cells appeared flat,the number was increased significantly,the cell body was slightly hypertrophy.(2)The proliferative effect of HBZY-1 in each group:compared with the NG group,the OD value in the HG group was significantly increased,and the OD value in the HG+GA group was decreased compared with the HG group(P<0.05).(3)The relative content of ROS in the HG group was higher than that in the NG group,and which in the HG+GA group was decreased (P<0.05).(4)The expression of Mn-SOD in each group:the relative expression of Mn-SOD in the HG group was significantly lower than that in the NG group (P<0.05),and the expression of Mn-SOD in the HG+GA group was increased compared with the HG group(P<0.05).ConclusionGlycyrrhizic acid has a certain inhibiting effect on the abnormal proliferation of HBZY-1 induced by high glucose.Glycyrrhizic acid can protect the cell hypertrophy and cell damage caused by glomerular mesangial cells via oxidative stress,and glycyrrhizic acid can regulate the Mn-SOD expression induced by high glucose.
glycyrrhizic acid;mesangial cell;oxidative stress
10.3969/j.issn.1671-8348.2017.27.001
R364
A
1671-8348(2017)27-3745-03
2016-12-08
2017-05-26)
国家自然科学基金资助项目(81160106)。
侯绍章(1975-),博士,副教授,主要从事糖尿病肾病及肿瘤的基础和临床研究。

