铁(Ⅱ)配合物的合成与ct-DNA作用的光谱分析
陶璐(长沙医学院基础医学院,湖南 长沙 421019)
铁(Ⅱ)配合物的合成与ct-DNA作用的光谱分析
陶璐(长沙医学院基础医学院,湖南 长沙 421019)
设计合成一个铁(Ⅱ)配合物[Fe(LA)2Br2](LA=鹅掌楸碱),以ct-DNA为靶点,通过紫外-可见光谱、荧光光谱和DNA粘度实验研究了配合物与ct-DNA的键合方式。研究表明所合成的配合物与DNA之间存在插入作用和静电作用。
配合物;ct-DNA;光谱分析;插入作用
鹅掌楸碱是一种典型的异喹啉类生物碱,具有显著的抗肿瘤、抗病毒、抑菌消炎等活性。铁元素是人生命体内必需的微量元素,尤其是二价铁,每个血红素都是由卟啉衍生物与铁(Ⅱ)形成的络合物。本文以鹅掌楸碱为配体,与铁(Ⅱ)离子配位合成配合物[Fe(LA)2Br2](配合物晶体结构见图1)。以ct-DNA为靶点,通过紫外-可见光谱、荧光光谱和DNA粘度实验研究了该配合物与ct-DNA的键合方式,为研究此类配合物的药理活性提供了科学依据。
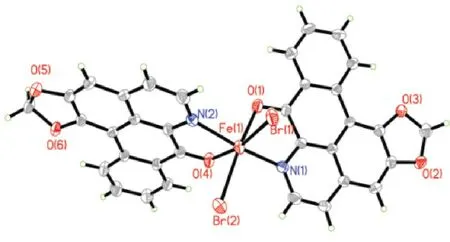
图1 配合物的晶体结构图
1 实验部分
1.1 仪器与试剂
紫外-可见光谱仪;SHIMADZU RF-5301PC荧光光谱仪;Brookfield DV-II pro数字式旋转粘度计;数显多功能测量仪。
鹅掌楸碱;FeBr2;乙醇;十二烷基磺酸钠(SDS)、三羟甲基氨基甲烷(Tris)购于Sigma公司、小牛胸腺DNA(ct-DNA)购于华美生物工程公司; GelRed购于Biotium公司);实验用水均为二次蒸馏水。
Tris-HCl-NaCl缓 冲 液:Tris 0.005 mol/L,NaCl 0.05 mol/L,pH值以盐酸滴定调节至7.35;
BPE 缓 冲 液 :Na2HPO40.006 mol/L,NaH2PO40.002 mol/L,Na2EDTA0.001 mol/L,pH = 6.99 ;DNA 纯 度 :将适量的ct-DNA溶于Tris-HCl-NaCl 缓冲液中,经紫外吸收光谱测定,在260nm和280nm处的吸光度符合:A260nm/A280nm≈1.8~1.9:1,表明DNA中不含蛋白质,因此使用之前不再纯化[1]。DNA储液浓度为2×10-3mol/L;GelRed浓度:将 原 始 的0.018 mol/L的GelRed用Tris-HCl-NaCl缓 冲 液稀释为1.8×10-3mol/L的溶液;SDS:0.02 mol/L。
1.2 实验方法
(1) 配合物的合成实验
称 取LA(0.05 mmol,0.014 g)和FeBr2(0.05 mmol,0.001 g)加入到一端封闭的25cmPyrex厚壁玻璃管中,往管中滴加0.7mL EtOH和0.3mL H2O,用液氮冷冻后,在抽真空的条件下将开口端熔封,混合均匀后置于110℃烘箱中,待其静置反应三天后梯度降温到室温,生成大量黑色的菱形块状晶体(Yield:90%)。挑选合适的单晶进行X-射线衍射分析,确定配合物即[Fe(LA)2Br2]。
(2)配合物的光谱分析实验
用DMSO作为溶剂将配合物配制2×10-3mol/L的储备液。紫外-可见光谱滴定分析:将配合物溶液稀释至2×10-5mol/L。①配合物与ct-DNA的紫外-可见光谱分析,按[ct-DNA]/[配合物]=0、0.1、0.2…1.1的比例依次测定紫外-可见光谱。②配合物与SDS的紫外-可见光谱分析,按[SDS]/[配合物]=0、0.5、1的比例分别测其紫外-可见光谱。DNA粘度的测定:温度恒定在35℃,配合物储备液以微量进样器滴加 至ct-DNA的BPE缓 冲 液(1×10-3mol/L,23mL)中,按 照[配合物]/[DNA]= 0、0.01、0.02…0.10的累加比例逐渐滴加,反应等量时间分别记录η,以配合物的(η/η0)1/3对([配合物]/[DNA])作粘度分析曲线图。荧光光谱滴定分析:a.配合物与ct-DNA的荧光光谱分析,配合物溶液稀释至2×10-5mol/L,按[ct-DNA]/[配合物]=0、1、2…10的比例分别测其荧光光谱。b.GelRed、配合物与ct-DNA竞争性键合荧光光谱分析,将[ct-DNA]/[GelRed]比值固定为10:1,按[配合物]/[GelRed]=0:1、1:1、2:1…的比例趋势依次加入配合物,观察随着配合物浓度的增加荧光曲线的变化,直到荧光曲线饱和。
2 结果与讨论
化合物与DNA作用方式可分为共价结合、非共价结合和剪切作用三种,其中非共价结合主要包括:静电结合、沟槽结合和插入结合三种形式[2]。
2.1 配合物与ct-DNA的紫外-可见光谱分析
图2中虚线表示未加入ct-DNA时配合物的紫外吸收曲线,实线为随着ct-DNA加入配合物的紫外吸收曲线。虚线中247nm和269nm处的特征吸收峰归属于稠环共轭体系的π→π*电子跃迁,416nm处的特征吸收峰归属于杂环N和羰基O的n→π*电子跃迁。随着ct-DNA浓度的逐渐增加,吸收光谱表现出了减色和红移现象。根据公式{ [DNA]/(εa-εf)=[DNA]/(εb-εf)+1/[Kb(εb-εf)]} 计 算 配 合 物 与DNA 作用的结合常数Kb([DNA]代表DNA的浓度;εa为表观摩尔吸光系数;εb为与DNA结合后的摩尔吸光系数;εf为配合物的摩尔吸光系数)。通常对DNA具有较强插入作用的化合物,其和ct-DNA的结合常数Kb>105mol/L。以[ct-DNA]为x轴,[ct-DNA]/( εa-εf)为y轴 作 图,线 性 拟 合 得 到Kb=4.08×104mol/L,接近105mol/L。因此可以推断,配合物与DNA存在插入作用。
2.2 配合物与SDS静电作用分析
图3中虚线表示配合物在二次蒸馏水中的紫外吸收曲线,实线表示随着SDS加入配合物的紫外吸收曲线。随着SDS浓度增大,247nm处的紫外吸收光谱出现了减色现象,吸光度由0.66763Å降到0.60703Å,说明配合物与SDS存在着静电作用,可以推测配合物与同带负电荷的DNA可能存在静电作用。
2.3 DNA粘度实验
当平面小分子插入到DNA双链相邻的碱基对之间时,碱基对的间距会增大。DNA的结构变松弛,相应溶液的粘度会增大。而静电作用、沟槽键合等则不会引起DNA溶液粘度的增加。所以测定溶液粘度是检测配合物与DNA是否以插入方式结合最有效的方法[3]。

图2 配合物与ct-DNA相互作用的紫外光谱
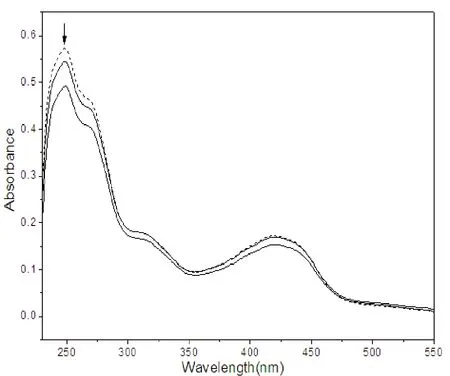
图3 配合物与SDS的静电作用图
图4中实心三角形所连曲线是配体LA与ct-DNA作用后的相对粘度变化曲线,实心正方形所连曲线是配合物与ct-DNA作用后的相对粘度变化曲线。随着配体、配合物的依次加入,ct-DNA溶液的粘度呈现明显增大的趋势。当[配合物]/[ct-DNA]=0.1时,相对粘度比值(η/η0)1/3=1.1811。由此可以推测,配合物是以经典的插入键合方式产生作用。配合物较配体使ct-DNA溶液粘度的增加的强度更高。表明配体LA与金属配位后,提高了配体LA对生物大分子DNA的键合作用。
2.4 荧光光谱分析
图5中虚线表示未加入ct-DNA时配合物的荧光发射曲线,实线表示随着ct-DNA的浓度增大,配合物与ct-DNA作用后的荧光发射曲线。随着ct-DNA浓度不断增大,该发射峰的荧光强度表现明显的减弱。当[ct-DNA]/[配合物]=1时,配合物在505nm处的最大发射峰由I=697.419减弱到I=639.351,减色8.3%;当[ct-DNA]/[配合物]=10时,I=412.481,总共减色40.9%。配合物与ct-DNA发生了插入作用从而荧光强度减弱。
溴化乙锭EB具有共轭芳香平面性结构,其本身几乎没有荧光,但能平行插入双链DNA的碱基之间使本身荧光强度显著增强。如果小分子配合物也能与DNA发生类似的插入作用时,配合物会与EB竞争与DNA的结合位点,会使EB在DNA的结合位点部分游离出来,从而使体系的荧光强度减弱。因此,根据这一体系的荧光强度变化可初步判断配合物与DNA的结合模式[4]。GelRed安全无毒的优势使其越来越广泛地替代可致癌的EB用于生物化学分析[5]。
图6中虚线表示GelRed-ctDNA体系的荧光发射曲线,实线表示随着配合物加入的荧光变化曲线。随着配合物的浓度增大,配合物在504nm附近产生了很强的荧光发射,它的增强强度要明显大于GelRed荧光的减弱程度。[配合物]/[GelRed]=0:1时,GelRed在590nm处的最大荧光强度为I0=437.015,[配合物]/[GelRed]=5:1 时,I=198.966,减色54.5%,此时GelRed荧光减色基本趋于饱和。这表明配合物、GelRed与ct-DNA之间存在着一定程度的竞争性键合作用,从而证明配合物对ct-DNA的插入作用。
3 结语
结果表明,配合物[Fe(LA)2Br2]由于配体鹅掌楸碱具有良好的平面型结构,能够以插入键合的方式作用于DNA双链的碱基对间。配合物与SDS存在着静电作用,可以推测配合物与同带负电荷的DNA可能存在静电作用。
[1]Marmur J.,et al.Aprocedure for the isolation of deoxyribonucleic acid frommicroorganisms[J].J.Mol.Biol.,1961,3∶208-218.
[2]靳兰,杨频,李青山.荧光法研究手性金属配合物与DNA的作用机理[J].高等学校化学学报,1996,17∶1345-1348.
[3]S.Satyanarayana,J.C.Dabrowiak,J.B.Chaires,et al.Neither Δ- nor Λ-tris(phenanthroline)ruthenium(II) binds to DNAby classical intercalation[J].Biochem.,1992,31(39)∶9319-9324.
[4]沈景山,孙丹丹,付连春,等.荧光光谱法研究抗癌药物与DNA的相互作用[J].光谱与光谱分析 ,2005,25(2)∶232-234.
[5]Barton J K,Goldberg J M,Kumar C V,Turro N J.J.Am.Chem.Soc.,1986,108∶2081-2088.
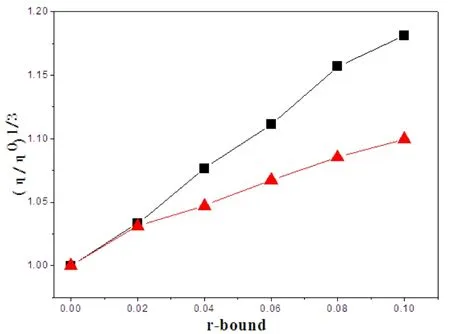
图4 配体和配合物与ct-DNA作用相对粘度变化曲线图
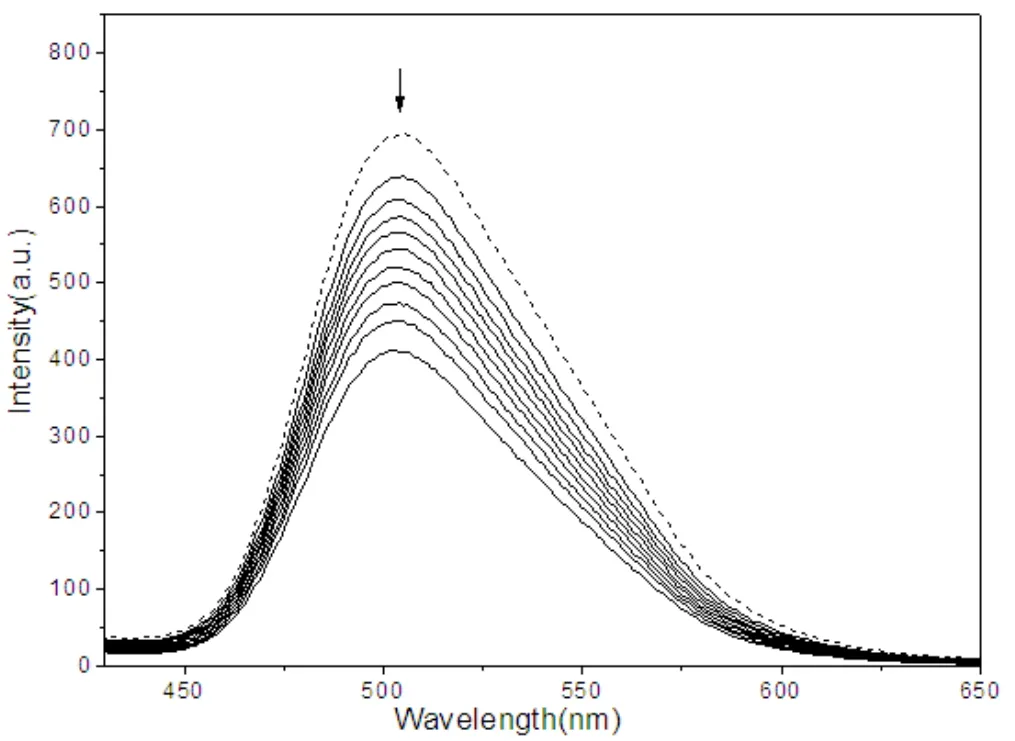
图5 配合物与ct-DNA相互作用的荧光光谱
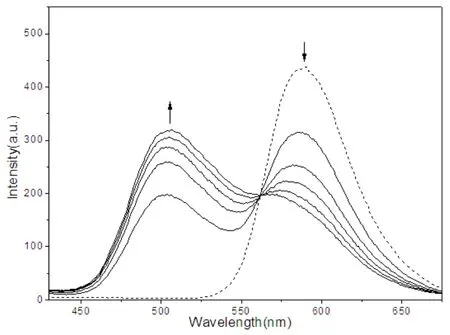
图6 配合物、GelRed与ct-DNA竞争性键合的荧光光谱
陶璐(1986- ),女,湖南醴陵人,讲师,硕士研究生,研究方向:无机药物化学。

