川明参提取物质量标准的构建
徐玉玲, 谢 敏, 张 佳, 贺桢翔, 钟林江, 刘 涛
(成都大学 药学与生物工程学院, 四川 成都 610106)
川明参提取物质量标准的构建
徐玉玲, 谢 敏, 张 佳, 贺桢翔, 钟林江, 刘 涛
(成都大学 药学与生物工程学院, 四川 成都 610106)
为构建川明参提取物的质量标准,按照《中国药典》2015年版及相关文献方法分别建立川明参提取物性状、薄层色谱鉴别、水分、灰分、炽灼残渣、重金属等项目的检查方法并规定限度.以欧前胡素为指标,采用HPLC法测定川明参提取物中欧前胡素的含量.通过测定浸膏的吸湿性、流动性、堆密度等物理特性,从物理、化学角度全面控制川明参提取物的质量.结果显示:供试品与对照品在相同位置处呈现相同颜色的荧光斑点,清晰可见,分离度好.川明参提取物的水分<9.0%,灰分<12.0%,炽灼残渣<13.0%,欧前胡素含量>0.108%.川明参提取物的临界相对湿度为52%,休止角不应超过59.0°,堆密度不应超过0.8 g/cm3.方法准确可靠,重复性好,可控性高,可操作性强,所建标准可用于川明参提取物的质量控制.
川明参提取物;高效液相色谱法;质量标准;物理性质;欧前胡素
0 引 言
川明参,别名明参、土明参等,为伞形科川明参属植物川明参的干燥根[1],具有滋阴、健脾等功效,常用于脾虚食少、肺阴虚证等病症的治疗[2-4],其产区主要分布于四川金堂、苍溪、巴中等地,作为可药食两用的药材,川明参的市场需求量较大[5].川明参仅在2010年版《四川省中药材标准》有简单的外观性状描述,而《中国药典》2015年版中尚未对其收载[6].目前,中药及中药提取物的质量标准多对其中的化学成分进行定性定量控制,但该方法可控性较差.此外,中药提取物大都为药品、保健食品或化妆品的中间体或原料药,其理化性质对于其进一步开发利用有着较大的影响.本课题组前期已完成川明参提取物的制备工艺研究,为进一步控制其质量,本研究拟在相关技术要求和指导原则的基础上,借鉴物理指纹图谱的概念,研究并建立基于物理化学参数及化学成分的质量标准,拟为川明参提取物在生产应用中的质量控制提供依据.
1 仪器及试药
1.1 仪 器
实验所用仪器包括:P230II型高效液相色谱仪(大连依利特分析仪器有限公司),FA-2004型分析电子天平(上海良平仪器仪表有限公司),BS-6KH型电子天平(上海友声衡器有限公司),SX-2.5-10型马弗炉、DZF-6050A型真空恒温干燥箱(北京中兴伟业仪器有限公司),HH-6型数显电子恒温水浴锅(常州国华电器有限公司),DZTW型电子调温电热套(天津市静海县工兴电器厂),酒精计(河北省武强县同辉仪表厂).
1.2 试 药
实验所用试药包括:川明参,共3批,分别采收于四川省苍溪县龙山镇、阆中市老观镇构溪乡和阆中市千佛镇,经成都大学刘涛研究员检验为伞形科植物川明参的干燥根;川明参提取物(批号,20160312、20160318、20160426、20160517、20160518、20160723、20161010、20170104、20170113、20170206),自制;欧前胡素对照品(批号,16070704,HPLC≥98%),四川省维克奇生物科技有限公司;铜(单元素标准溶液GSB 04-1725-2004)、汞(单元素标准溶液GSB 04-1729-2004)、砷(单元素标准溶液GSB 04-1714-2004)、镉(单元素标准溶液GSB 04-1721-2004)、铅(单元素标准溶液GSB 04-1742-2004);甲醇为色谱纯,水为娃哈哈纯净水,其余试剂均为分析纯.
2 方法与结果
2.1 制备方法
称取川明参药材适量,加入6倍量60%乙醇,每次提取0.5 h,共3次,合并提取液,均匀混合后抽滤,取滤液并浓缩至密度约为1.1,制得浸膏,并将浸膏在80 ℃条件下减压干燥.
测量结果表明,10批川明参提取物(批号为,20160312、20160318、20160426、20160517、20160518、20160723、20161010、20170104、20170113、20170206)的出膏率分别为,17.13%、14.32%、6.24%、6.08%、5.75%、15.32%、11.66%、16.32%、14.32%、10.38%.
2.2 性状观察
取川明参提取物样品,进行性状观察,并规定其性状标准为:本品为均匀黄褐色粉末,气芳香,味微苦.
2.3 物理性质
2.3.1 临界相对湿度测定.
选取川明参提取物(批号为,20170104、20170113、20170206),研磨成细粉,待用.分别称取1 g左右的浸膏粉末,平铺于干燥至恒重的蒸发皿中,称重并干燥至恒重,备用.配制4种浓度不同的硫酸溶液,分别置干燥器中,密闭放置12 h,使其内部环境湿度分别为48%、51%、55.4%、61.2%.将已恒重的样品精密称重后置于不同湿度环境的干燥器中,每个干燥器中放3份,放置48 h后,25 ℃恒温吸湿至恒重,精密称重并计算吸湿百分率计算公式见式(1),

(1)
以吸湿百分率为纵坐标,RH%为横坐标作图,结果如图1、表1所示.

图1吸湿百分率与相对湿度关系图
绘制如图1所示吸湿曲线两端的切线,两切线交点对应的横坐标即为临界相对湿度(critical relative humidity,CRH),由此测得此浸膏的CRH为52%.
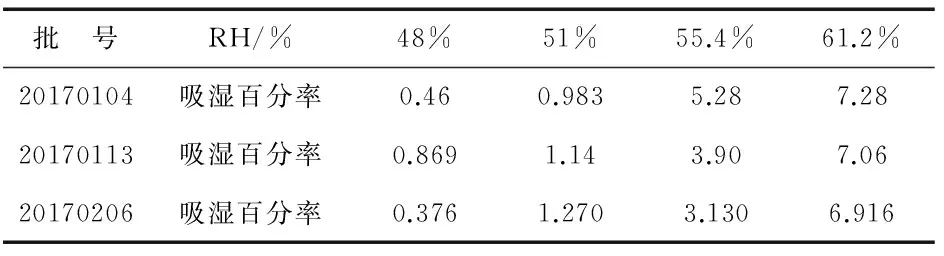
表1 不同相对湿度条件下浸膏吸湿率
2.3.2 流动性(休止角)测定.
将3只漏斗串联后固定于水平放置的坐标纸上的适宜高度处,将浸膏粉末缓缓地倒入最上面的漏斗中,直到最下面的漏斗形成的圆锥体粉末尖端接触到漏斗下口为止,测出圆锥底部的直径(2R)及漏斗下口距坐标纸的距离(H).根据,α=tan-1(H/R),计算休止角α,其结果见表2.

表2 粉末休止角
结果表明,川明参提取物粉末的平均休止角为49.18 °,高于40 °,休止角较大,流动性较差.按照平均值的+20%规定其限度,规定本品休止角不得超过59.0 °.
2.3.3 堆密度测定.
取浸膏粉末适量,小心装入10 cm3的量筒中,每隔2 s用玻璃棒轻轻击打量筒5 cm处,共击4次,直到装满10 cm3的量筒.根据量筒中样品质量(W)除以量筒的容积,计算样品的堆密度ρ.4批浸膏样品的堆密度测定结果见表3.

表3 粉末堆密度
结果表明,川明参提取物粉末的平均堆密度为0.66 g/cm3.按照平均值的+20%规定其限度,规定本品堆密度不得超过0.8 g/cm3.
2.4 薄层色谱定性鉴别研究
2.4.1 对照品溶液制备.
称取欧前胡素适量,加甲醇制成每1 mL含0.24 mg欧前胡素的对照品溶液.
2.4.2 供试品溶液制备.
称取川明参提取物(批号,20160312)约0.5 g,加入乙醚10 mL,超声处理20 min,使之充分溶解,滤过,滤液挥干,加乙酸乙酯2mL溶解残渣,制得供试品溶液.
2.4.3 川明参提取物的薄层色谱鉴别.
分别吸取供试品溶液及对照品溶液各6 μL,点于同一硅胶G薄层板上,以石油醚(60~90 ℃)—乙醚(1∶5)为展开剂,待其展开,取出晾干,置于紫外光灯(365 nm)下检视.结果显示,供试品色谱中与欧前胡素对照品在相同位置处显相同颜色的斑点(见图2).

1、3为对照品溶液,2、4为供试品溶液
图2川明参提取物薄层色谱图
2.5 检 测
2.5.1 水 分.
取10批川明参提取物细粉适量,精密称定,按照《中国药典》2015年版四部的水分测定法进行测定,结果见表4.

表4 水分含量测定结果
根据检测结果,所测样品水分含量最高为7.88%,最低为6.37%,平均为7.69%.按照平均值的+20%规定其限度,规定本品水分不得超过9.0%.
2.5.2 灰 分.
取6批川明参提取物细粉约2 g,精密称定,按照《中国药典》2015版四部的总灰分测定法进行测定,结果见表5.
根据检测结果,所测样品灰分含量最高为11.64%,最低为8.31%,平均为10.02%.按照平均值的+20%规定其限度,规定本品灰分不得超过12.0%.

表5 灰分测定结果
2.5.3 炽灼残渣.
取6批川明参提取物细粉约1.5 g,精密称定,按照《中国药典》2015年版四部的炽灼残渣检查法进行检查,结果见表6.

表6 炽灼残渣检查结果
根据检测结果,所测样品炽灼残渣含量最高为12.47%,最低为8.42%,平均为10.84%.按照平均值的+20%规定其限度,规定本品炽灼残渣不得超过13.0%.
2.5.4 重金属及有害元素.
取5批次川明参提取物细粉约1.5 g,精密称定,按照《中国药典》2015年版四部的铅(Pb)、镉(Cd)、铜(Cu)、砷(As)、汞(Hg)测定法进行含量检查,结果见表7.
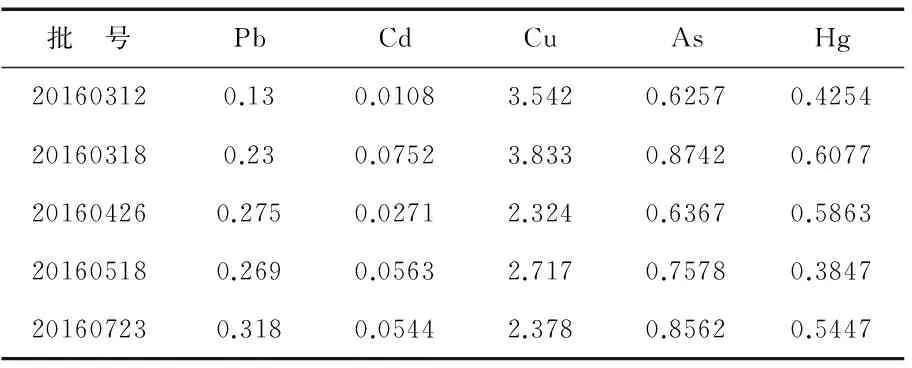
表7 重金属及有害元素检查结果(mg·kg-1)
根据《中国药典》2015年版的相关规定,规定本品铅不超过5 mg/kg、镉不超过0.3 mg/kg、铜不超过20 mg/kg、砷不超过2.0 mg/kg、汞不超过0.2 mg/kg.
2.6 川明参提取物含量测定
2.6.1 色谱条件.
实验色谱条件为:色谱柱为Global Chromatography C18(250 mm×4.6 mm,5 μm);流动相为甲醇—水(62∶38);流速为1 mL·min-1;柱温为20 ℃;进样量为10 μL;检测波长为246 nm.
2.6.2 对照品溶液制备.
称取欧前胡素对照品适量,精密称定,加甲醇25 mL,制成每毫升含0.24 mg欧前胡素的对照品溶液.精密移取0.24 mg/mL欧前胡素对照品溶液5 mL于25 mL容量瓶中,加甲醇溶解并定容至刻度线,摇匀,制得48.00 μg/mL的对照品溶液.
2.6.3 供试品溶液制备.
称取明参提取物粉末(60目)1 g,精密称定,置于具塞锥形瓶中,加甲醇25 mL,称定重量,超声处理30 min,冷却至室温,用甲醇补足损失的质量,摇匀,滤过,取续滤液5 mL于10 mL的容量瓶中,加入甲醇定容至刻度,微孔滤膜滤过,制得供试品溶液.
2.6.4 线性关系考察.
分别精密移取欧前胡素对照品溶液3、4、5、6、7 mL于10 mL容量瓶中并稀释至刻度,摇匀.在“2.6.1”项色谱条件下测定欧前胡素峰面积,并以对照品进样量为横坐标(X),峰面积为纵坐标(Y)绘制标准曲线,得线性回归方程,Y=3 622.8X+5.611(r=0.9997).结果表明,欧前胡素的进样量在0.144~0.336 ug范围内,峰面积与进样量呈良好的线性关系.
2.6.5 精密度实验.
精密吸取“2.6.2”项下对照品溶液,连续进样6次,在“2.6.1”项色谱条件下测定,记录峰面积,计算其RSD.结果显示,RSD值为0.47%,表明仪器精密度良好.
2.6.6 重复性实验.
取同一批次川明参提取物粉末(批号,20161010),平行6份,按“2.6.3”项下方法制备供试品溶液,进行测定,记录峰面积,计算其RSD.结果显示,RSD值为1.99%,表明该方法重现性良好.
2.6.7 稳定性实验.
精密吸取同一供试品溶液,分别于 0、1、2、3、4、5、6、7、8 h后进样.结果显示,RSD值为1.38%,表明样品在8 h内稳定性良好.
2.6.8 加样回收实验.
精密称取含有量已知的川明参提取物粉末(批号,20161010)共6份,每份0.5 g,各加入欧前胡素对照品溶液适量,按“2.6.3”项下方法制备供试品溶液,在“2.6.1”项色谱条件下进行测定,计算加样回收率,结果见表8.结果显示,RSD值为2.07%,表明回收率良好.

表8 欧前胡素加样回收率实验结果
2.6.9 样品含量测定.
取10批川明参提取物,按“2.6.3”项下方法制备供试品溶液,按“2.6.1”项下色谱条件测定欧前胡素的峰面积,采用外标一点法计算出各批次提取物中欧前胡素的含量,结果如表9所示.

表9 各批次提取物含量测定
结果显示,所测样品中欧前胡素含量平均为0.135%.按照平均值的-20%规定其限度,规定川明参中欧前胡素的含量不低于0.108%.
3 结 语
川明参为我国特有的单种属植物,但该药材尚未收载入相关药典标准,缺乏合适的质量控制方法.本课题组在完成川明参提取物制备工艺基础上[8],以川明参提取物为研究对象,初步测定其物理化学性质.研究结果表明,采用物理参数控制提取物的质量,可更直观全面地展现和控制提取物的质量.
中药浸膏的物理性质是影响浸膏质量的重要因素,与固体制剂成型工艺密切相关.中药浸膏的质量控制不应仅局限于指标成分的含量测定、定性鉴别、外观性状及检查,还应加入堆密度、吸湿性、流动性等物理指标.本研究为了建立基于物理化学特性的川明参提取物质量控制标准和体系,对提取物的3个物理参数,即吸湿性、流动性与堆密度进行了测定,从物理化学角度控制川明参提取物的质量.
研究发现,川明参根部主要化学成分为多糖类、香豆素类及黄酮类等[9].本课题组前期研究发现,川明参提取物中7-甲基香豆素含量过低,不能将其作为指标成分,而欧前胡素具有平喘、抗过敏等作用,性质较稳定,具有较大的研究价值,故确定选择以欧前胡素作为评价指标[10-11].
本研究按照确定的制备工艺,由3批不同产地的川明参药材制备出了不同批次的川明参提取物,用于质量标准研究.基于充分的物理性质研究和定性、定量分析,建立了川明参提取物的质量控制方法和标准,涉及性状、物理性质、薄层色谱鉴别以及含量测定.在薄层色谱鉴别方法考察过程中,分别选择了氯仿—甲醇(2∶1)、二氯甲烷—甲醇(1∶1)、石油醚(60~90 ℃)—乙醚(3∶2)、以石油醚(60~90 ℃)∶乙醚(1∶5)等多种溶剂系统比较对欧前胡素的薄层展开效果.结果表明,以石油醚(60~90 ℃)—乙醚(1∶5)为展开剂,展开效果较好,斑点清晰可见、分离度好.采用HPLC法,以欧前胡素作为检测指标,测定其含量并规定川明参提取物中欧前胡素含量不得低于0.108%.本研究所建立的质量标准可控性高,能全面有效地控制川明参提取物的质量,为川明参提取物的质量控制提供了可靠保障.
[1]四川省食品药品监督管理局.四川省中药材标准[R].成都:四川省卫生厅,2010.
[2]张梅,苏筱琳,雨田,等.川明参药理作用初步研究[J].中药药理与临床,2007,23(2):49-50.
[4]赵波,李宏,刘军,等.川明参中香豆素类成分的研究[J].中药与临床,2010,01(02):23-24.
[5]陈丹丹,彭成.川明参的药理作用及开发前景[J].中药与临床,2011,2(2):35-37.
[6]刘静,李宏,郭平,等.川明参质量标准初步研究[J].中成药,2010,32(2):329-331.
[7]张毅,徐冰,孙飞,等.中药提取物粉末物理指纹谱研究及应用[J].中国中药杂志,2016,41(12):2221-2227.
[8]刘涛,唐开城,谢敏,等.川明参产地加工方法初步研究[J].成都大学学报(自然科学版),2016,35(4):331-334.
[9]金滨滨,陈朝霞,陈璐,等.川明参地上部分与根的化学成分比较研究[J].中药与临床,2013,4(6):7-10,17.
[10]贾艳,马改霞,朱慧芳,等.川明参香豆素的提取及抗氧化活性研究[J].食品工业,2016,38(7):185-187.
[11]雷晓莉,张梅.不同加工方法对川明参多糖及欧前胡素含量的影响[J].中药与临床,2012,3(2):34-35.
Abstract:According to the “Chinese Phar-macopoeia” 2015 edition and based on the literature method,the quality standard of Chuanminshen violanceum extract is respectively established for its characters,TLC,physical properties,water content,ash content,residue on ignition,heavy metals,and other items.The corresponding limits are constituted.The imperatorin is used as an index,and the HPLC is applied to determine the contents of imperatorin for Chuanminshen violanceum extract.Through the test of the moisture obsorption performance,mobility and bulk density,etc.,of the extract,the quality of the extract is controlled completely from both physical and chemical perspective.The experimental results show that the sample extract and the contrast extract take on fluorescent spots of the same color and have good resolution which can be clearly seen at the same position.CRH of Chuanminshen violanceum extract is 52%,angle of repose is no more than 59.0°,bulk density is no more than 0.8 g/cm3,water<9.0%,ash<12.0%,residue on ignition <13.0%,imperatorin is <0.108%.It is thus demonstrated that the methods are accurate and reliable,with strong repeatability,controllability,operability,so that it can be used for the study of the quality standard of Chuanminshenviolanceum extract.
Keywords:Chuanminshen violaceum extract;HPLC;quality standard;physical property;imperatorin
ConstructionofQualityStandardofChuanminshenViolanceumExtract
XUYuling,XIEMin,ZHANGJia,HEZhenxiang,ZHONGLinjiang,LIUTao
(School of Pharmacy and Bioengineering, Chengdu University, Chengdu 610106, China)
1004-5422(2017)03-0230-05
2017-06-01.
四川省千人计划(2013332)资助项目.
徐玉玲(1975 — ), 女, 硕士, 高级工程师, 从事中药制剂开发与中成药质量再评价研究.
R284.2
A
文章编号:1004-5422(2017)03-0235-04

