耐碳青霉烯类弗劳地枸橼酸杆菌耐药机制及治疗策略研究*
向 丹,张利军,周先玉,王云英
(重庆医科大学附属第二医院检验科,重庆 400010)
论著·临床研究
耐碳青霉烯类弗劳地枸橼酸杆菌耐药机制及治疗策略研究*
向 丹,张利军,周先玉,王云英△
(重庆医科大学附属第二医院检验科,重庆 400010)
目的探索耐碳青霉烯类弗劳地枸橼酸杆菌耐药机制及治疗对策。方法收集来自该院的17株耐碳青霉烯类弗劳地枸橼酸杆菌临床资料,采用PCR方法扩增碳青霉烯类耐药基因;采用琼脂稀释法和肉汤稀释棋盘法测磷霉素单药及联合用药最低抑菌浓度(MIC)值,计算部分抑菌浓度指数(ΣFICI)。结果8株菌产blaNDM-1,9株菌产blaIMP,blaKPC、blaOXA-48、blaSPM均未检出;磷霉素联合亚胺培南协同作用和相加作用占75.00%,其中协同作用高达56.25%,磷霉素联合头孢哌酮/舒巴坦钠协同作用和相加作用占50.00%。结论磷霉素联合亚胺培南或头孢哌酮/舒巴坦钠体外有较好的抗菌活性,亚胺培南联合磷霉素效果可能更好。
β内酰胺酶类;碳;柠檬酸杆菌,弗氏;碳青霉烯酶;弗劳地枸橼酸杆菌;联合药敏;耐药机制
弗劳地枸橼酸杆菌为条件致病菌,当机体抵抗力下降时,可引起呼吸道、消化道、泌尿系统感染及败血症等[1]。随着临床碳青霉烯类抗菌药物的广泛应用,耐碳青霉烯类菌株的临床检出率逐年增加,多呈广泛耐药(XDR)或全耐药(PDR)的特征[2-4]。临床医生对多重耐药菌感染的治疗常感到棘手,探索针对此类细菌感染的新的治疗策略迫在眉睫[3]。本研究对耐碳青霉烯类弗劳地枸橼酸杆菌耐药情况及耐药机制进行分析,现报道如下。
1 材料与方法
1.1材料 收集本院2013年3月至2016年1月从临床标本中分离的17株亚胺培南耐药的弗劳地枸橼酸杆菌,采用改良Hodge试验和乙二胺四乙酸(EDTA)纸片增效法筛查试验菌株耐药表型。所有菌株均用VITEK 2-Compact全自动微生物分析系统进行细菌鉴定和药敏试验,结果按照2015版美国临床实验室标准化协会(CLSI)规则和标准[5]判定。质控菌株:大肠埃希菌ATCC 25922,铜绿假单胞ATCC 27853,大肠埃希菌ATCC 35218,肺炎克雷伯菌ATCC 700603。
1.2方法
1.2.1仪器与试剂 哥伦比亚血平板、巧克力平板、麦康凯平板、血培养瓶、药敏M-H平板(法国生物梅里埃公司),药敏纸片(英国Oxoid公司),磷霉素(山西仟源医药集团股份有限公司),亚胺培南(美国默沙东公司),头孢哌酮/舒巴坦钠(SCF,美国辉瑞制药有限公司),6-磷酸葡萄糖(德国Sigma公司);血培养仪Bact/Alert 3D、自动化鉴定仪VITEK2-Compact(法国生物梅里埃公司),PCR仪、凝胶成像仪(美国Bio-Rad公司),PCR相关试剂(大连Takara生物有限公司)。
1.2.2碳青霉烯类耐药基因检测 采用PCR检测菌株耐药基因,煮沸法提取细菌DNA,反应体系:总反应体积 25.00 μL,DNA 2.00 μL,引物各0.75 μL,Takara rTaq DNA polymerase 12.50 μL,灭菌纯水 9.00 μL;反应条件:95 ℃ 预变性 5 min,95 ℃ 变性30 s,退火温度55 ℃ 30 s,72 ℃ 1 min,30个循环,72 ℃延伸10 min,引物序列[4]及来源见表1。PCR扩增产物经1.2%琼脂糖(含goodview)电泳分离,凝胶成像系统成像观察结果。PCR扩增产物送由上海生工生物工程股份有限公司合成测序,测序结果在NCBI上使用BLAST程序比对(https://www.ncbi.nlm.nih.gov)。

表1 耐药基因扩增引物序列
F:上游序列;R:下游序列
1.2.3磷霉素单药及联合用药最低抑菌浓度(MIC)值检测
1.2.3.1琼脂稀释法测单药MIC值 磷霉素(在配制磷霉素的M-H琼脂时加入一定量的6-磷酸葡萄糖,使其最终浓度为25 μg/mL)、亚胺培南、SCF单药药敏试验采用琼脂稀释法检测,药物最低浓度无细菌生长者,即为该药物对受试菌的MIC值。
1.2.3.2肉汤稀释棋盘法测磷霉素联合用药MIC值 根据琼脂稀释法测定MIC值确定药物联合测定的稀释度,以MIC值为中间点。使用96孔无菌微孔板,将配置好的每种抗菌药物最高从4倍MIC浓度开始用无菌M-H肉汤倍比稀释,取7个稀释浓度,各取60 μL分别排列在微孔板的行与列上,然后在无菌微孔板上加入120 μL配置好的菌液,使最终接种菌量为5×105CFU/mL,混匀,37 ℃过夜孵育培养,无菌生长的最低浓度为对应的MIC值。通过FIC指数计算公式,判断联合效果部分抑菌指数(∑FICI),计算和判读标准:∑FICI=联合时甲药的MIC/甲药的MIC+联合时乙药的MIC/乙药的MIC。∑FICI≤0.5为协同作用,>0.5~<1.0为相加作用,≥1.0~<2.0为无关作用,≥2.0为拮抗作用[6]。
1.3统计学处理 主要采用统计学描述。
2 结 果
2.1菌株临床资料 17株耐碳青霉烯类弗劳地枸橼酸杆菌菌株临床资料统计见表2。
2.2耐药表型及耐药基因检测结果 改良Hodge试验和EDTA纸片增效法筛查结果:17株菌均显示阳性,检出率为100%(17/17)。采用PCR方法对17株菌耐药基因进行检测,其中8株菌产blaNDM-1,检出率为47.06%(8/17);9株菌产blaIMP,检出率为52.94%(9/17);blaKPC、blaOXA-48、blaSPM均未检出,见图1。
2.3菌株耐药情况分析 药敏结果按照2015版CLSI规则和标准[5]进行判定。其中菌株对哌拉西林/他唑巴坦、氨曲南、阿米卡星体外有较高的敏感度,敏感率分别是58.82%、52.94%、47.06%;对妥布霉素、头孢吡肟体外敏感度较差,敏感率均为23.53%;对头孢他啶、环丙沙星、复方磺胺甲噁唑、头孢噻肟则表现为全部耐药,见表3。
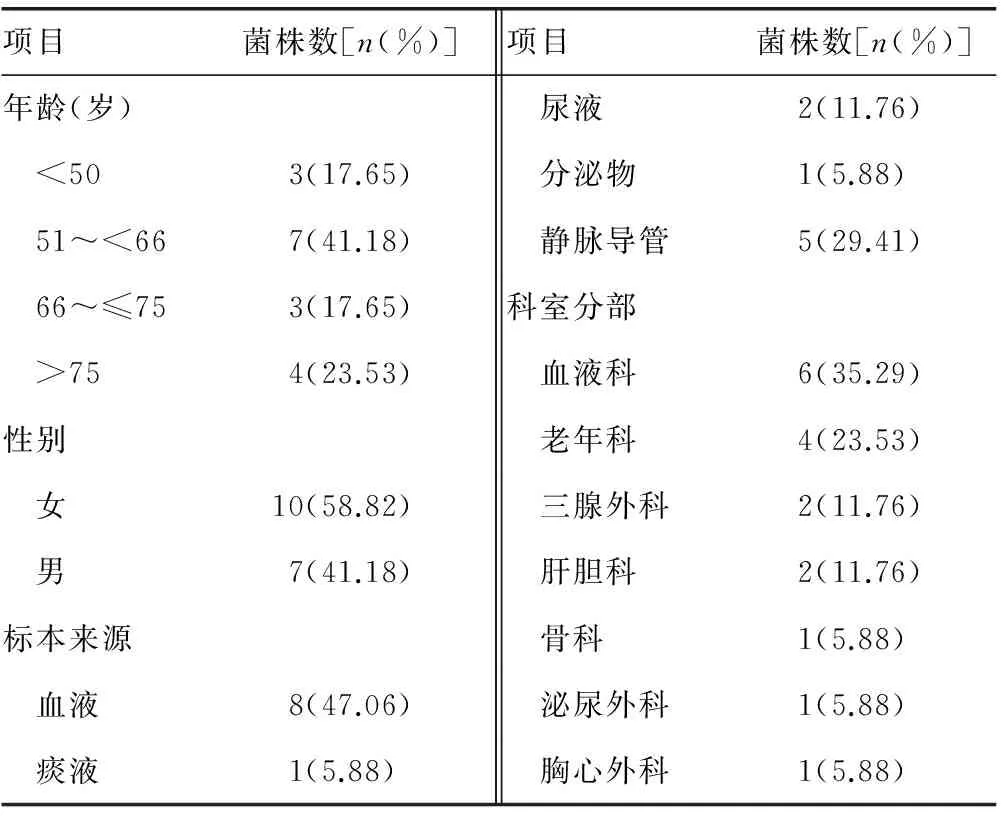
表2 17株菌株临床资料统计
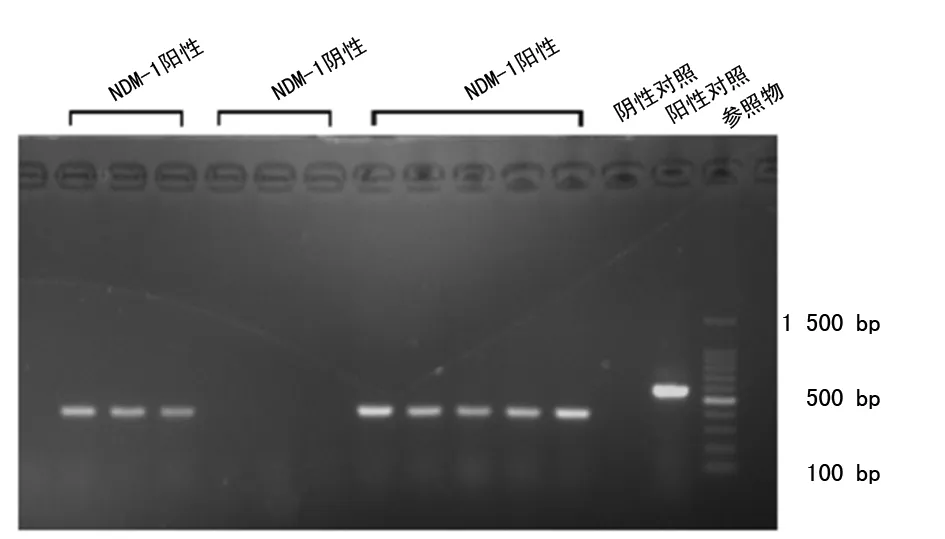
图1 blaNDM-1耐药基因扩增电泳图
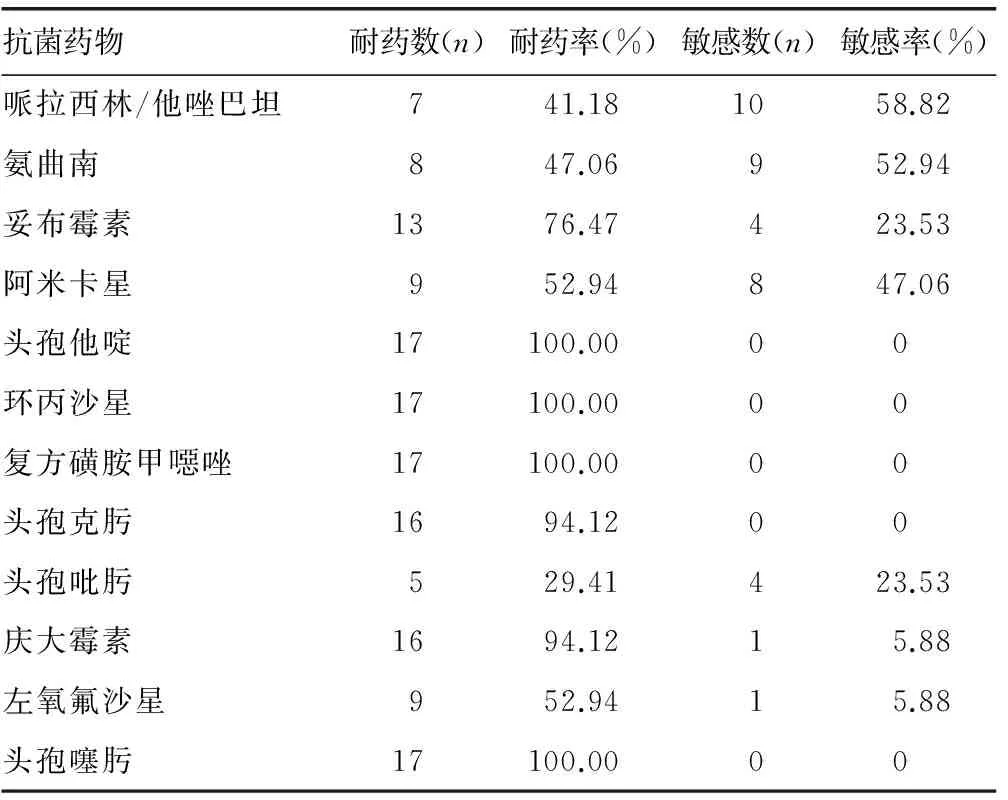
抗菌药物耐药数(n)耐药率(%)敏感数(n)敏感率(%)哌拉西林/他唑巴坦741.181058.82氨曲南847.06952.94妥布霉素1376.47423.53阿米卡星952.94847.06头孢他啶17100.0000环丙沙星17100.0000复方磺胺甲噁唑17100.0000头孢克肟1694.1200头孢吡肟529.41423.53庆大霉素1694.1215.88左氧氟沙星952.9415.88头孢噻肟17100.0000
2.4琼脂稀释法和肉汤稀释棋盘法测磷霉素单药及联合用药的MIC值 磷霉素与亚胺培南、SCF单用及联合用药的MIC结果见表4。磷霉素与亚胺培南联用,ΣFICI≤0.5占56.25%,>0.5~<1.0占18.75%,≥1.0~<2.0占25.00%;磷霉素与SCF联用,ΣFIC≤0.5占12.50%,>0.5~<1.0占37.50%,≥1.0~<2.0占50.00%,见表5。
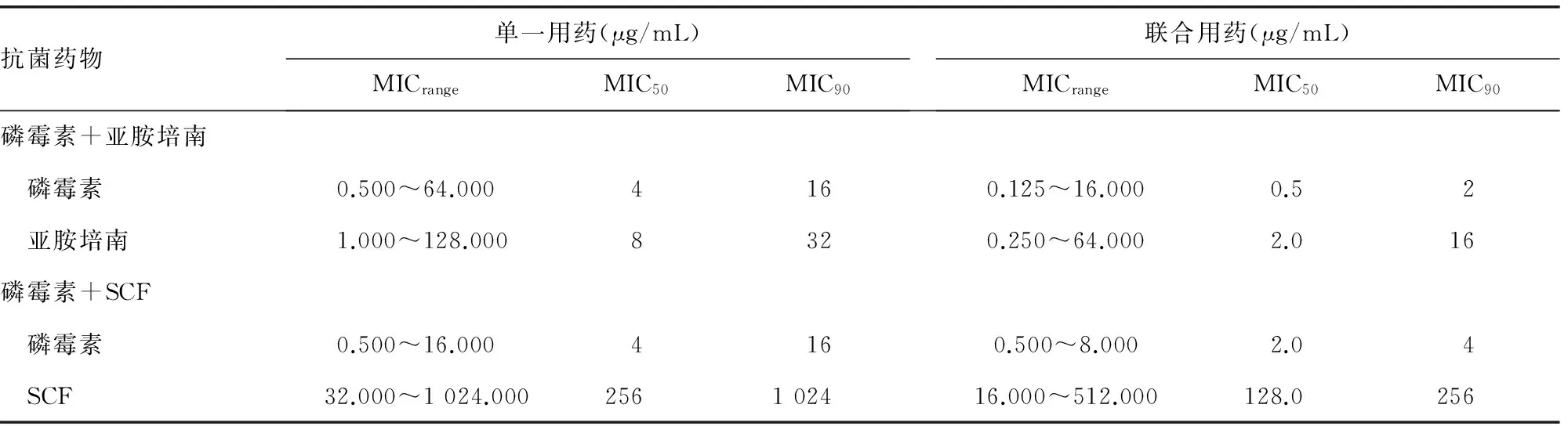
表4 磷霉素与亚胺培南、SCF单药与联用的体外抗菌活性

表5 FICI指数分布百分比(%)
3 讨 论
碳青霉烯类抗菌药物被认为是治疗革兰阴性杆菌感染的最后一道防线,有报道指出肠杆菌科细菌对碳青霉烯类抗菌药物的敏感度逐年下降[1,7],且随着临床多重耐药菌的检出逐年增加[3,8],新的抗菌药物研发过程缓慢,使耐碳青霉烯类细菌感染的治疗变得更加困难。因此,研究这些耐药菌的耐药机制和寻找更有效的治疗方法尤为重要。
本研究中,试验菌株分部在不同的科室,菌株标本主要来自血液和静脉导管,和弗劳地枸橼酸杆菌主要引起呼吸系统、尿道系统感染结论不一致[7],提示耐碳青霉烯类弗劳地枸橼酸杆菌感染的多样性,可引起多部位的感染。同一科室同一时期或不同时期多次检出该菌株,不排除该菌株长期持续存在于环境中或是菌株来自同一菌属的可能,本课题组将进一步对菌株的流行病学进行研究。
在中国有报道指出产blaNDM-1的菌株主要是鲍曼不动杆菌[9],而国外则认为肺炎克雷伯菌是主要产blaNDM-1的菌株[10]。本研究采用PCR方法对菌株耐药基因进行检测,17株菌株均产金属β-内酰胺酶,其中8株产blaNDM-1,9株产blaIMP,不同于其他研究[9-10],同时,本研究中所有菌株均产金属β-内酰胺酶,金属β-内酰胺酶能有效水解除氨曲南以外的几乎所有β-内酰胺类抗菌药物,表3显示氨曲南耐药率为47.06%,提示菌株在产碳青霉烯酶的同时可能合并其他耐药机制。
17株菌对2、3代头孢菌素和磺胺类抗菌药物耐药率达到100.00%,喹诺酮类耐药率高达90.00%以上,治疗时应该首先避免选用此类抗菌药物;氨基糖苷类抗菌药物中阿米卡星敏感率47.06%,较其他氨基糖苷类抗菌药物敏感率高,这和其他研究一致[11],但由于氨基糖苷类抗菌药物毒副作用大,不建议首选治疗。哌拉西林/他唑巴坦、氨曲南敏感率较高,但对XDR肠杆科细菌感染诊疗的专家共识并不建议单独用药。目前,国外有研究指出磷霉素单用或联合使用其他药物,对于治疗耐碳青霉烯类肠杆菌科细菌疗效显著[12-13]。磷霉素属于细菌繁殖期快速杀菌剂,抗菌谱广,对革兰阳性菌及革兰阴性菌均有杀灭作用,通过抑制细菌细胞壁的早期合成,破坏其完整性,有利于其他抗菌药物进入细菌体内,从而杀灭细菌[14]。本研究采用肉汤稀释棋盘法对磷霉素、磷霉素+亚胺培南、磷霉素+SCF体外抗菌活性进行研究,结果显示:联合用药较单一用药时的MIC50、MIC90明显降低,磷霉素联合亚胺培南协同作用和相加作用占75.00%,其中协同作用高达56.25%,明显高于国内其他研究[15],磷霉素联合SCF协同作用和相加作用占50.00%,低于磷霉素联合亚胺培南。故治疗耐碳青霉烯类弗劳地枸橼酸杆菌的感染时,可以考虑使用亚胺培南或SCF+磷霉素治疗,根据体外药敏试验结果亚胺培南+磷霉素可能效果更佳。
综上所述,本研究用磷霉素联合亚胺培南或SCF对耐碳青霉烯类弗劳地枸橼酸杆菌进行了体外药物敏感试验,试验结果显示磷霉素联合亚胺培南或SCF在体外均有较好的抗菌活性,特别是亚胺培南+磷霉素可能效果更好。在新型抗菌药物有限的前提下,磷霉素联合其他抗菌药物治疗耐药菌感染可能是临床抗感染治疗的一个新方向,但需要指出的是,到目前为止临床使用磷霉素联合其他抗菌药物抗感染治疗仍然缺乏临床研究,临床用药需谨慎。
[1]李金,胡志东,汪复,等.2005-2014年CHINET变形杆菌属、沙雷菌属、枸橼酸杆菌属、摩根菌属及普罗威登菌属细菌耐药性监测[J].中国感染与化疗杂志,2016,16(3):284-293.
[2]田磊,陈中举,孙自镛,等.2005-2014年CHINET肠杆菌属细菌耐药性监测[J].中国感染与化疗杂志,2016,16(3):275-283.
[3]Potter RF,D′Souza AW,Dantas G.The rapid spread of carbapenem-resistant Enterobacteriaceae[J].Drug Resist Updat,2016(29):30-46.
[4]Nordmann P,Naas T,Poirel L.Global spread of Carbapenemase-producing Enterobacteriaceae[J].Emerg Infect Dis,2011,17(10):1791-1798.
[5]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing[J].Twenty-fourth Infor Suppl,2015,34(1):24
[6]周庭银. 临床微生物诊断与图解[M].3版. 上海:上海科学技术出版社,2012:44-48.
[7]WangJT,WuUI,LauderdaleTL,etal.Carbapenem-nonsusceptibleEnterobacteriaceaeinTaiwan[J].
PLoS One,2015,10(3):e0121668.
[8]Aschbacher R,Giani T,Corda D,et al.Carbapenemase-producing Enterobacteriaceae during 2011-2012 in the Bolzano area(Northern Italy):increasing diversity in a low-endemicity setting[J].Diagn Microbiol Infect Dis,2013,77(4):354-356.
[9]Chen Y,Zhou Z,Jiang Y,et al.Emergence of NDM-1-producing Acinetobacter baumannii in China[J].J Antimicrob Chemother,2011,66(6):1255-1259.
[10]Baraniak A,Izdebski R,Fiett J,et al.NDM-producing Enterobacteriaceae in Poland,2012-2014:inter-regional outbreak of Klebsiella pneumoniae ST11 and sporadic cases[J].J Antimicrob Chemother,2016,71(1):85-91.
[11]Livermore DM,Mushtaq S,Warner M,et al.Activity of aminoglycosides,including ACHN-490,against carbapenem-resistant Enterobacteriaceae isolates[J].J Antimicrob Chemother,2011,66(1):48-53.
[12]Seija V,Medina Presentado JC,Bado I,et al.Sepsis caused by New Delhi metallo-β-lactamase(blaNDM-1) and qnrD-producing Morganella morganii,treated successfully with fosfomycin and meropenem:case report and literature review[J].Int J Infect Dis,2015(30):20-26.
[13]Du XX,Wang JF,Fu Y,et al.Genetic characteristics of blaNDM-1-positive plasmid in Citrobacter freundii isolate separated from a clinical infectious patient[J].J Med Microbiol,2013,62(Pt9):1332-1337.
[14]Michalopoulos AS,Livaditis IG,Gougoutas V.The revival of fosfomycin[J].Inter J Infect Dis,2011,15(11):e732-739.
[15]钱学深,夏文颖,梅亚宁,等.磷霉素联合亚胺培南对碳青霉烯类耐药肠杆菌细菌的体外抗菌活性研究[J].中国临床药理学杂志,2016,32(2):156-158.
Studyondrugresistancemechanismincarbapenem-resistantCitrobacterfreundiiandtreatmentstrategies*
XiangDan,ZhangLijun,ZhouXianyu,WangYunying△
(DepartmentofClinicalLaboratory,SecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China)
ObjectiveTo explore the drug resistance mechanisms of carbapenem-resistant Citrobacter freundii (C.freundii) and its treatment strategies.MethodsClinical data of 17 strains of carbapenem-resistant C.freundii from this hospital were collected.Carbapenemase resistant genes were amplifies by polymerase chain reaction (PCR).The agar dilution method and the broth dilution method were used to determine the minimal inhibition concentration (MIC) of single antimicrobial drug and drug combination,the partial inhibitory concentration index (∑FICI) was calculated.ResultsEight strains were found to produce blaNDM-1and 9 strains produced blaIMP,blaKPC,blaSPMand blaOXA-48were not detected in the study.Furthermore,the synergistic effect and addictive effect of fosfomycin combined imipenem accounted for 75.00%,in which,the synergistic effect was up to 56.25%.the synergistic effect and addictive effect of fosfomycin and cefoperazone/sulbactam accounted for 50.00%.ConclusionFosfomycin combined with imipenem or cefoperazone/sulbactam has good antibacterial activity in vitro,but imipenem combined with fosfomycin may have better effect.
beta-lactamases;carbon;citrobacter,freundii;carbapenemase;Citerobacter freundii (C.freundii);combined chemosensitivity;resistance mechanisms
R446.5
A
1671-8348(2017)26-3635-03
2017-02-24
2017-06-21)
10.3969/j.issn.1671-8348.2017.26.012
重庆市科委基础科学与前沿技术研究(一般)项目(cstc2017jcyjAX0065)。
向丹(1990-),初级技师,在读硕士,主要从事临床微生物方面研究。△
,E-mail:yuzhihang1118@sina.com。

