纳米钯用于抗肿瘤的研究
姚依兰,冯 阁,黄凤华,舒 畅,张西锋
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
纳米钯用于抗肿瘤的研究
姚依兰,冯 阁,黄凤华,舒 畅,张西锋
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
以本实验室合成的纳米钯(PdNPs)为研究对象,以子宫颈癌细胞Hela细胞为模型,检测纳米钯的抗肿瘤活性。结果表明:HeLa细胞经纳米钯处理后,细胞增殖显著被抑制,细胞内乳酸脱氢酶(LDH)和活化氧(ROS)水平显著上升,PdNPs降低了HeLa细胞组蛋白去乙酰化酶(HDAC)、谷胱甘肽(GSH)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性,促进了细胞的凋亡。此为癌症的治疗提供一个新的治疗方法。
纳米钯;抗肿瘤;活化氧;凋亡
Abstract:The effects of nano-palladium (PdNPs),synthesised by our lab, were studied in this study. Using Hela cells as a model,the anti-tumor activity of PdNPs was checked. The results show that the cell viability was significantly inhibited after PdNPs treated, the levels of Lactate dehydrogenase(LDH) and reactive oxygen species(ROS) in the treated cells were significantly increased,and PdNPs reduced the activity of histone deacetylase (HDAC), glutathione (GSH), superoxide dismutase (SOD) and catalase (CAT) in HeLa cell, eventually leading to cell apoptosis. Which is a new treatment for the treatment of cancer.
Key words:palladium nanoparticle; antitumor; reactive oxygen species(ROS);apoptosis
1 引言
一类新的材料逐渐被人们熟知,那就是纳米材料(nanomaterial)。它是纳米级结构材料的简称,指在三维空间中的材料其至少有一维是纳米级别,尺寸在0.1―100 nm。纳米材料特殊的构成方式,与其他物质相比具有更大的比表面积,这样就赋予了它一些独特的效应,分别是体积效应、表面效应、量子尺寸效应和宏观量子隧道效应。纳米材料的化学性能、催化性能、光学性能、电磁性能、力学性能都有其独特之处,进而使纳米材料的研究与应用得到了迅速的发展[1-2]。医学中,利用纳米材料良好的生物相容性、透过性和吸附性,可以将纳米材料作为载体,负载药物,制成缓释剂和靶向制剂[3]。研究者们发现纳米材料对肿瘤细胞活性有不同程度的抑制作用,这引起了广泛的关注,可为肿瘤治疗提供新的治疗方法。
金属纳米颗粒以其特异的特性,已用于抗肿瘤的治疗与研究[4-5]。PdNPs已被用作抗菌剂,抗真菌剂和抗癌剂,但它们在癌症研究中的作用仍然难以捉摸。本研究以本实验室合成的纳米钯(PdNPs)为研究对象,以子宫颈癌细胞Hela细胞为模型,检测纳米钯的抗肿瘤活性。为PdNPs用于癌症的研究和治疗提供参考。
2 材料与方法
2.1 材料
纳米钯为本实验室合成;细胞培养相关试剂购自Sigma公司,其它所用试剂均为国产分析纯试剂;MTT、LDH、ROS和HDAC检测试剂盒购自Beyotime公司,氧化应激标记物检测试剂盒购自艾美捷科技公司。
2.2 仪器与设备
荧光倒置显微镜及显微图像分析系统 Nikon TE2000U;CO2培养箱 Thermo。
2.3 方法
氧化应激标记物和组蛋白去乙酰化酶的检测方法参考试剂盒的说明书进行。细胞的培养、噻唑蓝(MTT)检测、活化氧(ROS)检测和脱氧核糖核苷酸末端转移酶介导的缺口末端标记(TUNEL)检测等方法[6]。
3 结果与分析
3.1 PdNPs抑制Hela细胞的活性
以宫颈癌Hela细胞来评估PdNPs的抗肿瘤活性。用不同浓度的PdNPs处理细胞24 h,然后用WST-8法来检测细胞活力。如图1所示,PdNPs对Hela细胞生长具有抑制作用,PdNPs对于HeLa细胞的50%抑制浓度为125 nM。

图1 HeLa细胞经过不同浓度PdNPs处理后细胞活性
3.2 PdNPs抑制组蛋白去乙酰化酶(HDAC)的活性
在空白组的基础上,设置50 nM的PdNPs处理组。结果如图2所示,与对照组相比50 nM的PdNPs在一定程度上降低了HDAC的活性。
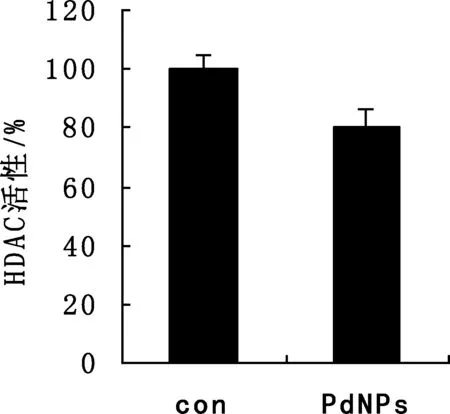
图2 PdNPs对Hela细胞HDAC活性的影响
3.3 PdNPs的细胞毒性
当细胞膜被破坏时,细胞内的乳酸脱氢酶(lactate dehydrogenase, LDH)就会被释放到细胞外,LDH的泄漏量是评估细胞毒性的重要标准,因此我们通过LDH法来评估组合药物的细胞毒性。测量对照组和处理组细胞外的LDH含量。如图3A所示,PdNPs处理组与对照组相比LDH的泄漏量有所提高。
利用荧光探针DCFH-DA来检测细胞中活性氧的水平,DCFH-DA本身没有荧光,当它自由穿过细胞膜,进入活细胞后,被细胞内的酯酶水解生成DCFH。DCFH不能通透细胞膜,从而探针被固定在细胞内,无荧光的DCFH被细胞内的活性氧氧化生成有荧光的DCF,从而检测DCF的荧光就可以知道细胞内活性氧的水平。如图3B所示,PdNPs处理组与对照组相比, DCF的荧光强度增高,ROS有所提高。
3.4 PdNPs对氧化应激标记物的影响
通过保持细胞中ROS的水平来杀死癌细胞,进而达到治疗的目的,确实是一种有效的方法,但是细胞中ROS的水平取决于ROS的产生和消除这两个方面。Oberley 等人认为在恶性细胞和原发性癌组织中ROS清除酶的水平会有显著的改变。因此我们研究PdNPs会不会影响HeLa细胞中相关标记物的水平,比如丙二醛(malondialdehyde, MDA)、谷胱甘肽(glutathione, GSH)、超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)。从实验结果(图4)可知,PdNPs处理组中的MDA含

图3 PdNPs对Hela细胞的细胞毒性
量达到了1.5 nmol/mg蛋白。HeLa细胞处理后GSH、SOD和CAT的水平,它们的含量是细胞中的GSH、SOD和CAT的水平是细胞抗氧化能力一个非常重要的指标[7]。细胞内GSH的水平会影响抗癌药物诱导癌细胞凋亡的效果[8]。与对照组相比,处理组的GSH、SOD和CAT的水平都明显降低,这和前面的实验结果是一致的,PdNPs会升高HeLa细胞中ROS的水平,降低GSH的水平。

图4 PdNPs对Hela细胞氧化应激标记物的影响
3.5 PdNPs促进细胞凋亡
JC-1是一种理想的检测线粒体膜电位(mitochondrial membrane potential, MMP)的荧光探针,它用途广泛,可以检测纯化的线粒体、细胞和组织的膜电位,MMP下降意味着细胞出现凋亡。细胞在MMP较高时,JC-1会形成聚合物(J-aggregates) 发出红色荧光并且聚集在线粒体的基质(matrix)中;在MMP降低后,JC-1为单体(monomer),不能聚集在线粒体的基质中,发出绿色荧光,我们通过荧光颜色的变化来检测MMP的变化,并且红绿荧光的相对比例会显示线粒体去极化的水平。HeLa细胞经过PdNPs处理24 h后,加入JC-1来测定MMP。由图5A可以看到与对照组相比,处理组的红/绿荧光强度比有所下降,说明处理组细胞MMP去极化严重。
Caspase-3的激活会诱导DNA的断裂,这是细胞凋亡的一个生化学特征。我们通过TUNEL试剂盒来检测经过处理后的HeLa细胞的凋亡情况。由图5B可知,凋亡的HeLa细胞被标记在图中显示成亮白点,与对照组相比,PdNPs处理组的细胞凋亡更为显著。

图5 PdNPs对Hela细胞凋亡的影响
4 结论
通过WST-8来研究PdNPs对癌细胞活性的影响,发现PdNPs对细胞的毒性都有浓度依赖性。对于HeLa细胞,PdNPs的50%抑制浓度为125 nM。
纳米钯颗粒(PdNPs)的异质性具有催化性能、高的表面积与体积比和高的表面能[9]。含有砜的聚酰胺的PdNPs配合物有一个独特性质就是高抗菌效力[10]。与单独使用化疗和光热治疗相比,加入PdNPs后,PdNPs会显示出协同作用并提高疗效[11]。有研究表明,PdNPs对五种不同的人癌细胞系都有高细胞毒性[12]。另外,PdNP的细胞毒性和诱导凋亡是有浓度依赖性的,并且和许多细胞因子的表达有关[13]。在诱导人卵巢的凋亡和自噬,PdNPs也是有浓度依赖性的[14]。 大量的研究报告了通过化学方法合成PdNPs,然而,用生物分子介导PdNPs的合成和PdNPs的细胞毒性机制并不是很明确。因此,合成具有生物相容性、无毒、环保的PdNPs是必不可少的,生物相容性的PdNP对于癌症研究和治疗也会有积极意义。化疗在癌症治疗中得到了广泛的应用,但是治疗效果却因为肿瘤异质性和肿瘤耐药性的产生而大打折扣,但如果使用组合疗法,可能同时抑制多个目标或信号通路,这就显得至关重要[15]。例如,血管内皮生长因子(VEGFR)抗体DC101和长春碱组合使用,在异种神经母细胞瘤模型中会出现持续的肿瘤消退[16]。
通过保持ROS在一个高水平,进而可以有效地杀死癌细胞。此不仅关系到ROS的产生,也关系到ROS的消除。由我们的研究结果可以知道,PdNPs可以降低细胞消除ROS的能力,这样从另一方面提升了细胞中ROS的水平。Huang 等人研究了SOD是如何作为被杀死的癌细胞的标记。SOD水平的降低会使细胞中活性氧的水平升高,这样会导致线粒体介导的细胞凋亡[17]。
[1] Zhang H, Zheng D, Ding J, et al. Efficient delivery of ursolic acid by poly (N-vinylpyrrolidone)-block-poly (ε-caprolactone) nanoparticles for inhibiting the growth of hepatocellular carcinoma in vitro and in vivo[J]. Int J Nanomedicine ,2015,10:1909-1920.
[2] Kruefu V, Wisitsoraat A, Tuantranont A, et al.Gas sensing properties of conducting polymer/Au-loaded ZnO nanoparticle composite materials at room temperature[J]. Nanoscale Res Lett, 2014, 9(1):467.
[3] Fang W, Tang S, Liu P, et al. Pd nanosheet-covered hollow mesoporous silica nanoparticles as a platform for the chemo-photothermal treatment of cancer cells[J]. Small, 2012, 8(24):3816.
[4] Perillo E, Hervé-Aubert K, Allard-Vannier E, et al. Synthesis and in vitro evaluation of fluorescent and magnetic nanoparticles functionalized with a cell penetrating peptide for cancer theranosis[J]. Colloid Interface Sci,2017,499(29):209-217.
[5] Labala S, Jose A, Chawla S, et al. Effective melanoma cancer suppression by iontophoretic co-delivery of STAT3 siRNA and imatinib using gold nanoparticles[J].Int Pharm. 2017, S0378-5173(17):30273-30279.
[6] Zhang X F, Choi Y J, Han J W. Differential nanoreprotoxicity of silver nanoparticles in male somatic cells and spermatogonial stem cells[J]. Int Nanomed, 2015,10: 1335-1357.
[7] Dröge W. Free radicals in the physiological control of cell function[J]. Physiological Reviews, 2002, 82(1):47-95.
[8] Fath M A, Ahmad I M, Smith C J, et al. Enhancement of carboplatin-mediated lung cancer cell killing by simultaneous disruption of glutathione and thioredoxin metabolism[J]. Clinical Cancer Research An Official Journal of the American Association for Cancer Research, 2011, 17(19):6206-17.
[9] Narayanan R, Elsayed M A. FTIR study of the mode of binding of the reactants on the Pd nanoparticle surface during the catalysis of the Suzuki reaction[J]. The journal of physical chemistry. 2005, 109(10):4357.
[10] Elhusseiny A F, Hassan H H. Antimicrobial and antitumor activity of platinum and palladium complexes of novel spherical aramides nanoparticles containing flexibilizing linkages: structure-property relationship[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2013, 103(103C):232-245.
[11] Fang W, Tang S, Liu P, et al. Pd nanosheet-covered hollow mesoporous silica nanoparticles as a platform for the chemo-photothermal treatment of cancer cells[J]. Small, 2012, 8(24):3816.
[12] Balbin A, Gaballo F, Ceballostorres J, et al. Dual application of Pd nanoparticles supported on mesoporous silica SBA-15 and MSU-2: supported catalysts for C-C coupling reactions and cytotoxic agents against human cancer cell lines[J]. Rsc Advances, 2014, 4(97):54775-54787.
[13] Boscolo P, Bellante V, Leopold K, et al. Effects of palladium nanoparticles on the cytokine release from peripheral blood mononuclear cells of non-atopic women[J]. Journal of Biological Regulators & Homeostatic Agents, 2010, 24(2):207.
[14] Gurunathan S, Kim E, Han JW, et al. Green Chemistry Approach for Synthesis of Effective Anticancer Palladium Nanoparticles[J]. Molecules, 2015, 20(12):22476.
[15] Li F, Zhao C, Wang L. Molecular-targeted agents combination therapy for cancer: developments and potentials[J].International Journal of Cancer Journal International Du Cancer, 2014, 134(6):1257-69.
[16] Klement G, Baruchel S, Rak J, et al. Continuous low-dose therapy with vinblastine and VEGF receptor-2 antibody induces sustained tumor regression without overt toxicity[J]. Journal of Clinical Investigation, 2000, 105(8):15-24.
[17] Huang P, Feng L, Oldham E A, et al. Superoxide dismutase as a target for the selective killing of cancercells[J]. Nature, 2000, 407(6802):390-395.
Research on Anti-cancer of palladium nanoparticles
YAOYi-lan,FENGGe,HUANGFeng-hua,SHUChang,ZHANGXi-feng
(School of Biology and Pharmaceutical Engineering,Wuhan Polytechnic University, Wuhan 430023, China)
2017-04-17.
姚依兰(1993-),女,硕士研究生,E-mail:1425888756@qq.com.
张西锋(1977-),男,博士,副教授,E-mail:zhangxf9465@163.com.
国家自然科学基金(B020704).
2095-7386(2017)03-0037-05
10.3969/j.issn.2095-7386.2017.03.007
Q 819
A

