α-硫辛酸联合青霉胺对TX乳鼠神经元P38 M APK通路的调控作用研究☆
徐陈陈 董健健 程楠 王训 喻绪恩○☆
α-硫辛酸联合青霉胺对TX乳鼠神经元P38 M APK通路的调控作用研究☆
徐陈陈*董健健*程楠*王训*喻绪恩*○☆
目的研究α-硫辛酸(alpha-lipoic acid,ALA)联合青霉胺(Penicillamine,PCA)对Wilson病(Wilson disease,WD)模型TX乳鼠神经元P38 MAPK通路的调控机制。方法本实验乳鼠神经元通过原代方法分离培养所得,分为正常对照组、模型组、ALA组、PCA组及联合组。采用流式细胞仪检测药物治疗前后活性氧释放量及JC-I荧光强度的变化;Western blot法检测经药物作用后P38丝裂原活化蛋白激酶、细胞色素C、半胱氨酸天冬氨酸蛋白酶-9、半胱氨酸天冬氨酸蛋白酶-3蛋白的表达。结果经流式细胞仪检测结果可知ALA、PCA及联合用药均能减少神经元内ROS释放量且其MFI分别为59.29±1.22、53.19±1.34及52.46±1.23,增进JC-1的荧光强度(P<0.01),且同ALA组和PCA组比,联合组ROS释放量明显降低,JC-1的荧光强度显著增强。 Western blot检测发现与正常组相比,模型组乳鼠神经元内P38MAPK,Cyt C,Caspase 9,Caspase 3蛋白含量显著增加(P<0.01);与模型组相比,LA组、PCA组及联合组乳鼠神经元内P38 MAPK,Cyt C,Caspase 9,Caspase 3蛋白表达水平明显下降;联合组P38 MAPK,Cyt C,Caspase 9,Caspase 3蛋白含量较LA组及PCA组减少。结论ALA联合PCA可促进铜排出,降低高铜诱导的线粒体损伤,降低高铜神经毒性,延缓神经元凋亡,改善WD神经系统损伤症状。
细胞凋亡 Wilson病氧化应激 神经毒性
Wilson病(Wilson disease,WD)是一种表现为铜沉积于肝脑等器官和组织的遗传性疾病。本课题单位2015年在对2695例WD患者统计中发现以神经系统症状首发的占56.33%,且多数患者在病程后期都会出现一定程度的神经损害,给患者生活的各个方面带来了非常不利的影响[1]。本研究通过流式细胞仪及Western blot技术观察线粒体保护剂ALA及驱铜药PCA对 TX乳鼠神经元内(reactive oxy-gen species,ROS)释放量及P38丝裂原活化蛋白激酶 (mitogen-activated protein kinase,P38 MAPK)通路相关蛋白表达的影响,以期揭示ALA联合PCA通过调控P38 MAPK通路改善神经损伤,发挥神经保护作用。
1 实验动物与方法
1.1 细胞7对TX小鼠种鼠及DL小鼠从美国Jackson实验动物中心引进,共同饲养于安徽医科大学SPF级实验动物中心,模型动物在入组前随机选择5只进行铜生化指标 (铜蓝蛋白、铜氧化酶、血清铜等)和基因检测以确定种鼠及其子代的遗传均一性(即均具有WD模型应具有的特性),乳鼠神经元通过原代方法分离培养所得。
1.2 实验方法
1.2.1 细胞培养 原代分离提取DL、TX乳鼠神经元,培养基为含2%B27(Gibco,1542466)的Neurobasal(Gibco,LOT2015-0504)(含10%进口胎牛血清和1%双抗),置于37℃、5%CO2培养箱,24 h后半量换液。
1.2.2 药物浓度与时间筛选 取对数生长期的TX乳鼠神经元,加含不同浓度 (0.75 mM、1.5 mM、3.0 mM、4.5 mM)PCA及不同浓度 (1.25 mM、2.5 mM、5.0 mM、7.5 mM)ALA 分 别 作用 12 h、24 h、36 h、48 h,后于每个时间点分别加DMSO于酶标仪上检测细胞活力,计算药物的处理浓度与时间。
1.2.3 实验分组及药物处理 实验分别设正常对照组、模型组、ALA组、PCA组及联合组。正常对照组和模型组用完全培养基培养,ALA组、PCA组及联合组分别用含ALA培养基、含PCA培养基及含ALA和PCA联合培养基培养。
1.2.5 Western blot法检测细胞中P38通路上相关蛋白表达的变化 取对数生长期的DL及TX乳鼠神经元,按1.2.3实验分组继续培养24 h,消化收集细胞后裂解,提取总蛋白,Bradford法测定蛋白含量。取蛋白20 μg作电泳,将蛋白样本转移至NC 膜上。膜用5%脱脂奶粉封闭4 h,PBST洗3次,每次10 min,分别加入兔抗细胞色素C(CytochromeC,CytC)多克隆抗体(Abcam,GR45115-12),兔抗半胱氨酸天冬氨酸蛋白酶-9(cysteinyl aspartate specific proteinase,Caspase 9)多克隆抗体 (Abcam,GR54565-14),兔抗半胱氨酸天冬氨酸蛋白酶-3(cysteinyl aspartate specific proteinase,Caspase3)多克隆抗体(Abcam,GR46235-14)蛋白的抗体,4℃过夜。分别加入辣根过氧化物酶标记山羊抗兔IgG(Abcam,GR231489-1),脱色摇床摇1.5 h,PBST洗3次,每次10 min。以β-actin作为内参。凝胶成像系统拍照,采用Image J软件对各目的条带与内参条带进行灰度比较,计算各组蛋白的相对表达量。
1.3 统计学方法采用统计软件SPSS 17.0进行统计,各项实验数据用(±s)表示,实验组与对照组之间采用t检验,检验水准α=0.05,Graph Pad Prism5软件作图。
2 实验结果
2.1 药物浓度与时间筛选MTT法检测不同浓度ALA和PCA作用于TX乳鼠神经元 12、24、36、48 h四个时间点对神经元活力的影响(见图1)。结果发现,24 h时1.5 mM PCA及4.5 mM ALA的TX乳鼠神经元活力值最高。因此,选择24 h作为药物作用时间,PCA及ALA分别选取1.5 mM、4.5 mM作为实验药物浓度。
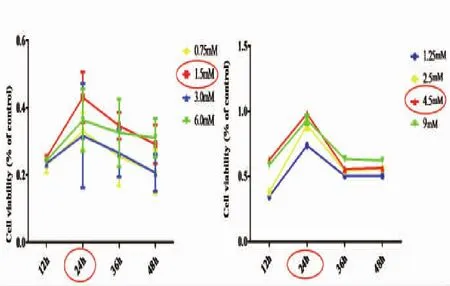
图1 不同浓度和时间PCA和ALA对TX乳鼠神经元活力的影响(图左为PCA,图右为ALA,n=6)
2.2 流式细胞仪检测神经元中ROS释放量及JC-1荧光强度的变化流式细胞仪检测各组细胞活性氧水平,与正常对照组比,模型组ROS荧光强度显著增加 (P<0.01);ALA和PCA处理后细胞内活性氧水平减少,处理组活性氧水平与模型组相比,差异具有统计学意义(P<0.01),ALA、PCA 及联合用药均能使神经元细胞内ROS的量明显降低(P<0.01), 其 MFI分别为 59.29±1.22、53.19±1.34及52.46±1.23,同时与ALA组和PCA组相比,联合组ROS释放量明显降低,表明联合组能明显降低神经元细胞内产生的ROS(见图2)。
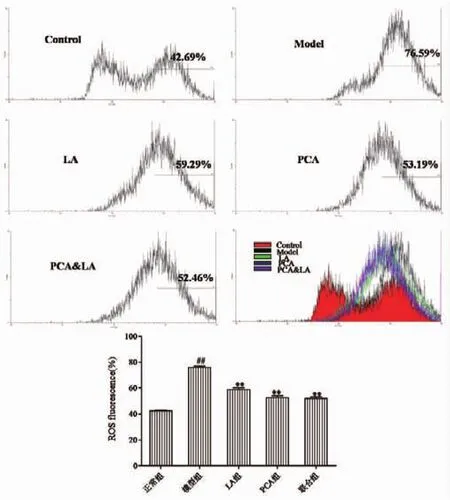
图2 PCA和ALA作用于TX乳鼠神经元24 h后ROS荧光强度变化(n=6)(#P <0.05,##P<0.01,与正常组比;*P<0.05,**P<0.01,与模型组比)
流式细胞仪检测线粒体膜电位,检测结果可知,模型组JC-1主要以单体形式存在,说明神经元线粒体膜电位水平显著下降,较正常对照组相比,差异具有统计学意义(P<0.01)。加入药物ALA和PCA后,JC-1主要呈聚合物状态,细胞线粒体膜电位上升,与模型组相比较,差异具有统计学意义(P<0.01),且联合组JC-1的荧光强度显著高于ALA组和PCA组(见图3)。
2.3 Western blot法检测神经元P38通路上相关蛋白表达的变化实验结果如图4所示:与正常组相比,模型组乳鼠神经元内P38、Cyt C、Caspase 9、Caspase 3蛋白含量显著01)。与模型组相比,LA组乳鼠神经元内 P38、Cyt C、Caspase 9、Caspase 3蛋白表达水平明显下降;PCA组乳鼠神经元内 P38、Cyt C、Caspase 9、Caspase 3 蛋白表达水平显著下调 (P<0.01);联合组 P38、Cyt C、Caspase 9、Caspase 3蛋白含量较模型组减少,且差异均具有显著统计学意义(P<0.01)。与ALA组和 PCA组相比,联合组 P38、Cyt C、Caspase 9、Caspase 3蛋白含量均明显降低。
转子每一转出现的齿槽转矩基波周期数等于定子槽数Z和极数2p的最小公倍数Nc,即一个齿槽转矩基波周期对应的机械角θ1=360°/Nc。因此,如果定子铁芯的斜槽角和它相等,即可消除齿槽转矩的基波:
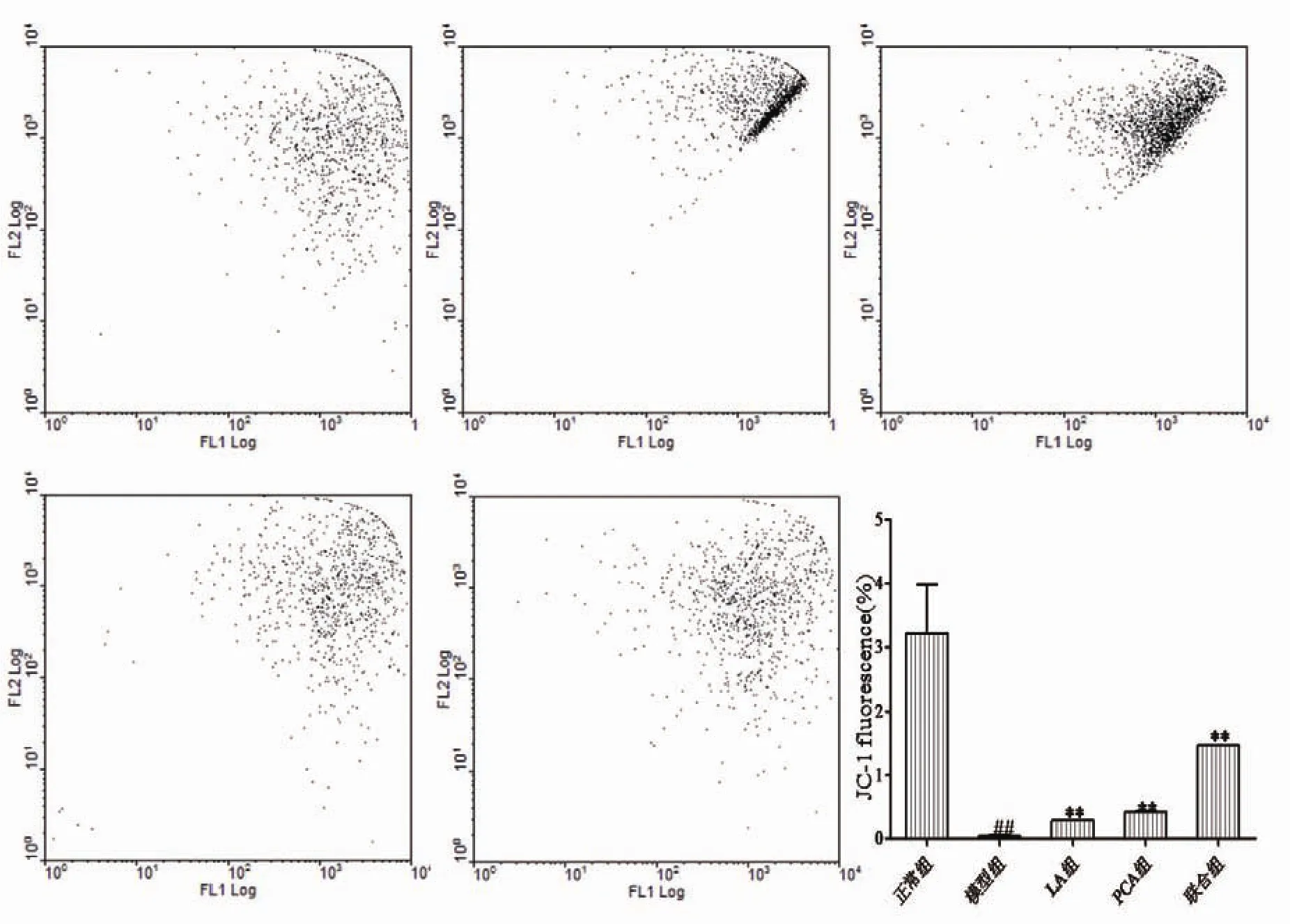
图3 PCA和ALA作用于TX乳鼠神经元24 h后JC-1荧光强度变化(n=6)(#P<0.05,##P<0.01,与正常组比;*P<0.05,**P<0.01,与模型组比)

图4 PCA和ALA对TX乳鼠神经元P38通路相关蛋白表达影响 (n=3)(#P<0.05,##P<0.01,与正常组比;*P<0.05,**P<0.01,与模型组比;aP<0.05,aaP<0.01,与 LA 组比;bP<0.05,bbP<0.01,与 PCA 组比)
3 讨论
铜在细胞呼吸,抗氧化防御及神经传递中有着重要功能,但过量铜会产生神经毒性。WD是一种可治性的遗传性铜代谢障碍变性疾病,过量的铜可渐进性沉积于脑导致铜毒性损伤神经系统[2]。约三分之二的WD患者伴有不同程度的神经/精神症状。根据目前铜损伤神经元机制学说的研究,我们设想其可能机制为铜离子在脑中沉积激活氧化应激,活化P38 MAPK通路,导致神经元变性坏死。PCA是治疗WD的首选药物,可增加机体排铜量,降低体内铜的蓄积以达到机体铜负平衡状态,减轻铜对机体的毒性作用。但单纯排铜已不能满足脑型WD的治疗。近年来于体内外实验发现ALA具有明显的神经保护作用[3-7],但其对WD模型TX乳鼠神经元保护作用机制还不明确,因此本实验研究ALA联合PCA对TX乳鼠神经元P38 MAPK信号通路调控作用机制。
类芬顿反应发现自由基可介导游离铜的毒性作用。当铜产生的自由基超过细胞抗氧化能力,就会产生氧化应激。与其他器官相比,大脑由大量神经元组成,因其高氧代谢、温和的抗氧化系统和低水平自由基清除力等,大脑更易受氧化损伤[8-10]。线粒体是ROS产生主要来源和主要靶点[11]。研究发现铜介导的氧化应激参与神经变性病的发生和发展[12-13]。本实验发现高铜状态下的TX乳鼠神经元ROS释放量显著增加,线粒体膜电位水平下降,线粒体损伤程度增加,表明高铜可激活氧化应激。
作为MAPK家族的一员,P38 MAPK可被环境应力激活参与细胞分化、凋亡和自噬。目前,对于P38 MAPK在神经元凋亡中的作用已引起了极大的关注。体内外实验发现激活P38 MAPK可损伤神经元,抑制可减少脑缺血损伤,起到神经保护作用[14-16]。在高铜诱导小脑颗粒神经元的实验中发现P38 MAPK参与其促凋亡进程,且P38 MAPK可能是ROS下游效应器[17]。本研究结果表明高铜下的TX乳鼠神经元可诱导ROS大量释放,引起线粒体膜电位水平降低并促进Cyt C释放至胞质,正反馈性促进ROS产生,形成恶性循环,同时ROS作为第二信使激活P38 MAPK信号通路,终活化 Caspase,参与促细胞凋亡进程,引起神经元凋亡。本实验通过流式可知与ALA组和PCA组相比,联合组能明显降低神经元胞内ROS含量和JC-1的荧光强度;采用Western blot法结果显示,联合组 P38、Cyt C、Caspase 9、Caspase 3 蛋白含量均较ALA组和PCA组明显降低。综合表明,ALA联合PCA可促进铜排出,减少ROS产生,抑制P38 MAPK通路,阻断凋亡发生,保护神经元。ALA联合PCA可改善高铜损伤神经元状态,延缓细胞凋亡。
[1]杨任民,韩咏竹,胡纪源,等.肝豆状核变性[M].北京:人民卫生出版社,2015,366-373.
[2]杨任民.肝豆状核变性驱铜治疗的再认识 [J].医药专论,2010,31(5):257-259.
[3]赵星丞,赵虹.α-硫辛酸在帕金森病中的神经保护作用研究[J].检验医学与临床,2017,14(3):452-453.
[4]赵冉冉,徐晓臣,徐飞,等.天然抗氧化剂α-硫辛酸对血管性痴呆大鼠线粒体的保护作用 [J].山西医科大学学报,2014,45(12):1136-1139.
[5]李艳花,肖保国,马存根,等.硫辛酸对 LPS诱导的帕金森病小鼠黑质多巴胺能神经元损伤的影响 [J].中国病理生理杂志,2015,31(2):201-205.
[6]GUOFU LI,JIAHONG FU,YANG ZHAO,et al.Alpha-Lipoic Acid Exerts Anti-Inflammatory Effects on Lipopolysaccharide-Stimulated Rat Mesangial Cells via Inhibition of Nuclear Factor Kappa B(NF-κB)Signaling Pathway[J].Inflammation,2015,38(2):510-519.
[7]NAJAFI R,SHARIFI AM,HOSSEINI A.Protective effects of alpha lipoic acid on high glucose-induced neurotoxicity in PC12 cells[J].Metab Brain Dis,2015,30(3):731-738.
[8]JOHNSONWM,WILSON-DELFOSSEAL,MIEYALJJ.Dysregulation of glutathione homeostasis in neurodegenerative diseases[J].Nutrients,2012,4(10):1399-1440.
[9]ROBERTS RA,SMITH RA,SAFE S,et al.Toxicological and pathophysiological roles of reactive oxygen and nitrogen species[J].Toxicology,2010,276(2):85-94.
[10]LAN AP,CHEN J,HU Y,et al.The neurotoxicity of iron,copper and cobalt in Parkinson’s disease through ROS-mediated mechanisms[J].Biometals,2016,29(4):665-678.
[11]VAKIFAHMETOGLU-NORBERG H,OUCHIDA AT,NORBERG E.The role of mitochondria in metabolism and cell death[J].Biochemical and Biophysical Research Communications,2017,482(2017):426-431.
[12]AIPING LAN,XIANJIA XIONG,YI HU,et al.AMPK Inhibition Enhances the Neurotoxicity of Cu(II)in SH-SY5Y Cells[J].Neurotox Res,2016,30(3):499-509.
[13]DUSEK P,ROOS PM,LITWIN T,et al.The neurotoxicity of iron,copper and manganese in Parkinson’s and Wilson’s
[14]diseases[J].J Trace Elem Med Biol,2015,31(2014):193-203.WANG W,TANG L,WANG Y,et al.Biochanin A protects against focal cerebral ischemia/reperfusion in rats via inhibition of p38-mediated inflammatory responses [J].J.Neurol.Sci,2015,348(1-2):121-125.
[15]LIU XW,JI EF,LI XD,et al.Protective effects of the p38MAPK inhibitor SB203580 on NMDA-induced injury in primary cerebral cortical neurons[J].Mol.Med.Rep,2014,10(4):1942-1948.
[14]LI H,ZHOU S,WANG L,et al.The role of p38MAPK signal pathway in the neuroprotective mechanism of limb postconditioning against rat cerebral ischemia/reperfusion injury[J].J Neurol Sci,2015,357(1-2):270-275.
[17]CHEN X,LAN X,PI R,et al.P38 and ERK,but not JNK,are involved in copper-induced apoptosis in cultured cerebellar granule neurons[J].Biochemical and Biophysical Research Communications,2009,379(4):944-948.
(责任编辑:李立)
《中国神经精神疾病杂志》参考文献著录规则
我刊参考文献著录采用GB/T 7714-2015《信息与文献参考文献著录规则》。该标准规定了参考文献的著录项目、著录顺序、著录用符号、著录用文字、各个著录项目的著录方法以及参考文献在正文中的标注法。现将该标准中常用信息摘录于下。
1专著的著录格式
主要责任者.题名:其他题名信息 [文献类型标识/文献载体标识].其他责任者.版本项.出版地:出版者,出版年:引文页码[引用日期].获取和访问路径.数字对象为宜标识符.
示例:
[1]陈登原.国史旧闻:第1卷[M].北京:中华书局,2000:29.
[2]哈里森,沃尔德伦.经济数学与金融数学[M].谢远涛,译.北京人民大学出版社,2012:235-236.
[3]赵学功.当代美国外交[M/OL].北京:社会科学文献出版社,2001[2014-06-11].http://www.cadal.zju.edu.cn/book/trySinglePage/33023884/1.
2连续出版物中析出文献的著录格式
析出文献主要责任者.析出文献题名 [文献类型标识/文献载体标识].连续出版物题名:其他题名信息,年,卷(期):页码[引用日期].获取和访问路径.数字对象唯一标识符.示例:
[1]袁训来,陈哲,肖书海,等.蓝田生物群:一个认识多细胞生物起源和早期演化的新窗口 [J].科学通报,2012,55(24):3219.
[2]李幼平,王丽.循证医学研究方法:附视频 [J/OL].中华移植杂志 (电子版),2010,4(3):225-228[2014-06-09].http://www.cqvip.com/Read/Read.aspx?id=36658332.
[3]KANAMORI H.Shaking without quaking[J].Science,1998,279(5359):2063.
[4]FRESE K S,KATUS H A,MEDER B.Next-generation sequencing:from understanding biology to personalized medicine[J/OL].Biology,2013,2(1):378-398[2013-03-19].http://www.mdpi.com/2079-7737/2/1/378.DOI:10.3390/biology2010378.
3其他应注意的问题
个人著者,其姓全部著录,字母全大写,名可缩写为首字母;如用首字母无法识别该人名时,则用全名。西文期刊刊名的缩写可参照ISO 4的规定。我刊参考文献标注方法采用顺序编码制,即按正文中引用文献出现的先后顺序连续编码,将序号置于方括号中,参考文献表中各篇文献按正文部分标注的序号依次列出。
该标准中其他规则及示例请见原文。
The molecular regulatory mechanism of co-treatment with LA and PCA on P38 MAPK signaling pathway in the neurons of TX suckling mice.
XU Chenchen,DONG Jianjian,CHENG Nan,WANG Xun,YU Xuen.Department of Neurology,Neurological Research Institute Affiliated Hospital,Anhui University of Traditional Chinese Medicine,Hefei 230061,China.Tel:0551-62816159.
ObjectiveTo detect the molecular regulatory mechanism of co-treatment with LA and PCA on P38 MAPK signaling Pathway in the Neurons of Wilson's Disease Model-TX mice.MethodsThe neurons of TX suckling mice were isolated and cultured by primary method,and were divided into control group,model group,ALA group,PCA group and combined group.Flow cytometry was used to analyze the expression of ROS and JC-1.Western blot was used to detect the expression of P38 MAPK,Cyt C,Caspase 9 and Caspase 3.ResultsFlow cytometry results showed that MFI of ROS was 59.29±1.22,53.19±1.34 and 52.46±1.23 in ALA,PCA and co-treatment.ALA,PCA and co-treatment could significantly reduce the release of ROS and enhance the fluorescence intensity of JC-1 (P<0.01).Compared with ALA group and PCA group,combined group could reduce the release of ROS and significantly enhance the fluorescence intensity of JC-1.Western blot indicated that the expression levels of P38 MAPK,Cyt C,Caspase 9,Caspase 3 in the neurons of model group had a remarkable increase compared with control group.Compared with the model group,thethree treatment groups could decrease the expression levels of P38 MAPK,Cyt C,Caspase 9 and Caspase 3 in the neurons of TX suckling mice (P<0.01).Meanwhile,the protein levels of P38 MAPK,Cyt C,Caspase 9 and Caspase 3 had a significant decrease compared with ALA group and PCA group.Conclusionhe present findings suggestthatco-treatmentwith LA and PCA can increase the copperexcretion,reduce copper-induced mitochondria damage and attenuate the neurotoxicity,which in turn decrease neuronal apoptosis and improve neurological impairment of WD.
Apoptosis Wilson's disease Oxidative stress Neurotoxicity
R742.4
A
2017-04-12)
10.3969/j.issn.1002-0152.2017.08.009
☆国家自然科学基金项目(编号:81603596);省自然科学基金项目(编号:1508085MH153)
* 安徽中医药大学神经病学研究所附属医院神经内科(合肥230061)
○☆通信作者(E-mail:neurodoctorqlc@163.com)

