在线固相萃取-液相色谱-串联质谱法快速测定玉米粉和面粉中伏马毒素
马俊美,刘 东,张雷雷,沈 璐,王丽霞*,张 岩*
在线固相萃取-液相色谱-串联质谱法快速测定玉米粉和面粉中伏马毒素
马俊美,刘 东,张雷雷,沈 璐,王丽霞*,张 岩*
(河北省食品检验研究院,河北省食品安全重点实验室,河北 石家庄 050200)
建立在线固相萃取- 液相色谱-串联质谱法检测玉米粉和面粉中3 种伏马毒素的分析方法。样品用乙腈-水(50∶50,V/V)提取,提取液直接上样,经过WA X在线固相萃取柱净化,以0.1%甲酸溶液和乙腈为流动相,经XBridge C18色谱柱分离,采用电喷雾正电离多反应模式监测,内标法定量。结果表明:伏马毒素B1、伏马毒素B2和伏马毒素B3在0.05~50 ng/mL之间线性关系良好,相关系数均大于0.999 0;检出限和定量限分别为0.08 μg/kg和0.2 μg/kg;添加水平为0.2~50.0 μg/kg时,方法回收率范围为93.9%~117.8 %,相对标准偏差范围在1.8%~9.4%。此方法简便快速、灵敏度高,可用于玉米粉和面粉中伏马毒素的准确定量。
在线固相萃取净化;液相色谱-串联质谱;同位素稀释;伏马毒素
伏马毒素是由串珠镰刀菌在一定温湿度条件下产生的一类水溶性次级代谢产物,由Gelderblom等首次从串珠镰刀菌培养液中分离出[1-2]。截至目前,已发现的伏马毒素有28 种[3],其中以B族的伏马毒素B1(fumonisin B1,FB1)、伏马毒素B2(fumonisin B2,FB2)和伏马毒素B3(fumonisin B3,FB3)为主要存在形式[4]。伏马毒素主要对玉米、小麦、大米、大麦、小米等粮谷造成污染,具有很强的细胞毒性及免疫毒性,与人类食道癌、肝癌、胃癌的发生密切相关,对人类和动物健康构成严重威胁[5-9]。许多国家已经颁布或制定了谷物中伏马毒素的限量标准:如瑞士规定玉米中FB1和FB2总量的最高限量为1 000 μg/kg;美国食品与药物管理局规定玉米中FB1、FB2和FB3总量的最高限量为2 mg/kg,欧盟规定伏马菌素最大允许限量为1 mg/kg[10]。我国尚无明确的限量标准。因此,建立可靠、简便、灵敏、高效的FB1、FB2和FB3检测方法,可为我国粮谷类食品安全提供必要的技术支撑。
目前,伏马毒素的检测方法主要有薄层色谱法[11]、酶联免疫法[12-15]、气相色谱法[16]、高效液相色谱法[17-21]、液相色谱-质谱联用法[22-29]等。其中,薄层色谱法和酶联免疫法存在灵敏度低、假阳性率高的问题,气相色谱法检测流程耗时长,高效液相色谱法和液相色谱-质谱联用法是食品安全国家标准规定的伏马毒素的测定方法[30],但高效液相色谱法需先进行柱前或柱后衍生,液相色谱-质谱联用法采用传统的离线净化方法,都不同程度的存在过程繁琐,所需时间长等缺点。在线固相萃取技术是近年来发展起来的全自动样品处理技术,有效简化了前处理过程,同时保证了方法的灵敏度。目前,鲜见在线固相萃取技术应用于粮谷中伏马毒素检测的报道。本研究采用Spark Holland公司的在线固相萃取装置,应用液相色谱-串联质谱法结合同位素内标校正。该方法简便、快速、灵敏度高、稳定性好,可以准确检测玉米粉与面粉中的3 种伏马毒素。
1 材料与方法
1.1 材料与试剂
玉米粉与面粉样品 市售。
FB1、FB2、FB3(50 μg/mL)及同位素内标13C34-FB1(25 μg/mL)、13C34-FB2(10 μg/mL)、13C34-FB3(10 μg/mL) 美国S igma-Aldrich公司;甲醇、乙腈(色谱纯) 德国Meker公司;超纯水(电阻率为18.2 MΩ·cm,25 ℃) 美国Millipore公司。
1.2 仪器与设备
WAX弱阴离子在线净化小柱(10 mm×1 mm)、HLB在线固相萃取小柱(10 mm×1 mm)、MAX强阴离子在线净化小柱(10 mm×1 mm) 美国Waters公司;Triple Quad 6500液相色谱-质谱联用仪(配有电喷雾离子源及MultiQuant 3.0.1数据处理系统) 美国AB公司;Symbiosis(Pico)在线固相萃取系统 荷兰Spark Holland公司;3K13离心机 德国Sigma公司;VORTEX GENIUS 3涡旋仪 德国IKA公司;超声波清洗器德国Elma公司。
1.3 方法
1.3.1 样品前处理
准确称取5.0 g样品于50 mL聚丙烯离心管中,加入100 ng的同位素内标混合溶液,再加入20 mL乙腈-水(50∶50,V/V)提取溶剂,涡旋混匀1 min,超声提取10 min,4 500 r/min离心10 min;取上清液过0.22 μm有机系滤膜,供液相色谱-串联质谱分析测定。
1.3.2 色谱条件
在线净化固相萃取柱为WAX(10 mm×1 mm),分析色谱柱使用XBridge C18色谱柱(4.6 mm×150 mm,5 μm);流动相A为0.1%甲酸溶液,流动相B为乙腈。柱温35 ℃,进样量20 μL,当液相色谱进行梯度洗脱时,在线净化系统进行下一个样品净化。色谱分离程序见表1,在线净化程序见表2。在线净化的流路装配简图见图1。
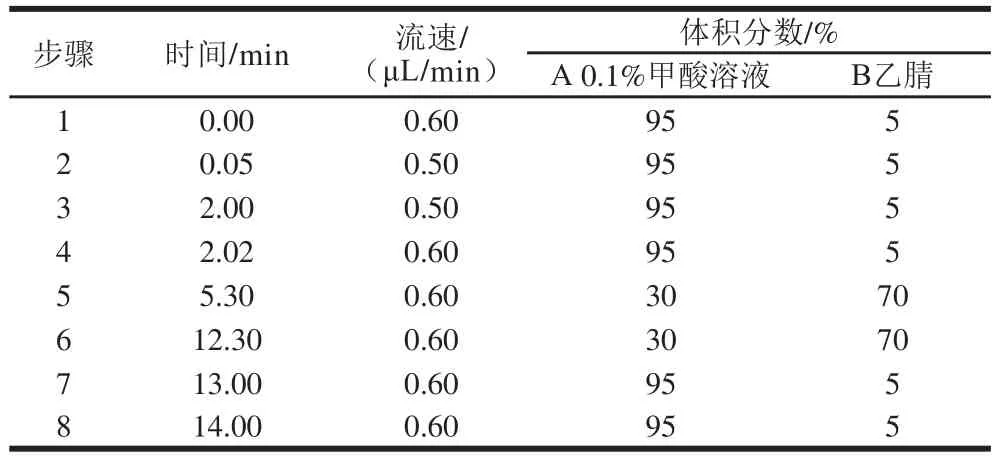
表1 色谱分离洗脱程序Table 1 Procedures of chromatographic separation
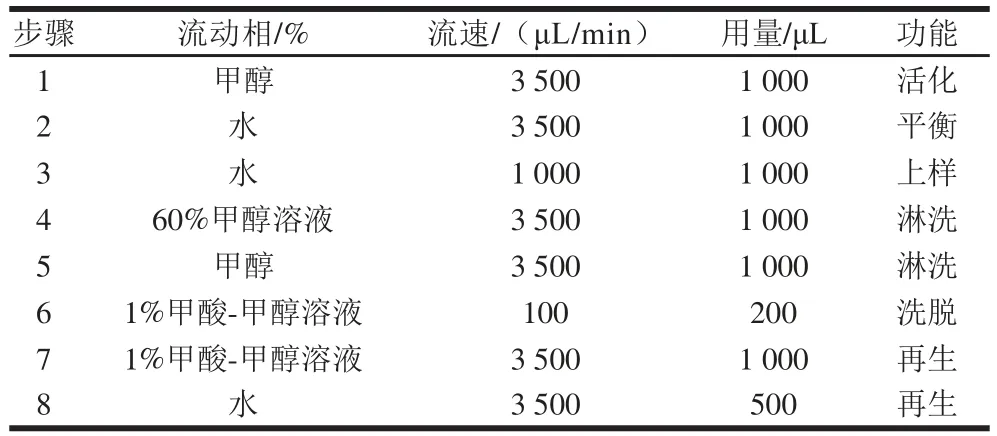
表2 在线净化程序Table 2 Procedures of on-line SPE

图1 在线净化流路装配简图Fig. 1 Schematic representation of on-line SPE p urifi cation
1.3.3 质谱条件
电喷雾离子源,正离子模式;扫描方式:多反应监测;离子化电压5 500 V;雾化器压力50 psi;辅助气压力55 psi;气帘气30 psi;离子源温度500 ℃。监测离子及质谱参数见表3。

表3 分析物的质谱参数Table 3 Mass spectrometric parameters for the analysis of analytes
2 结果与分析
2.1 质谱条件优化
通过蠕动泵,让6 种化合物标准品(质量浓度为100 ng/mL)以5 μL/min的速率直接注入质谱仪中,以全扫描模式确定目标化合物的母离子质量数。伏马毒素为两性化合物,因此本实验分别在正负离子2 种模式下对化合物进行质谱条件优化,实验中发现,2 种模式下化合物均有响应,但正离子模式下的灵敏度远高于负离子模式。最终确定目标化合物以[M+H]+作为母离子,对母离子进行二级扫描,分别确定其定性和定量离子。对子离子的去簇电压,碰撞能量等参数进行优化。目标化合物的定性和定量离子对的质谱检测参数见表3,色谱图见图2。
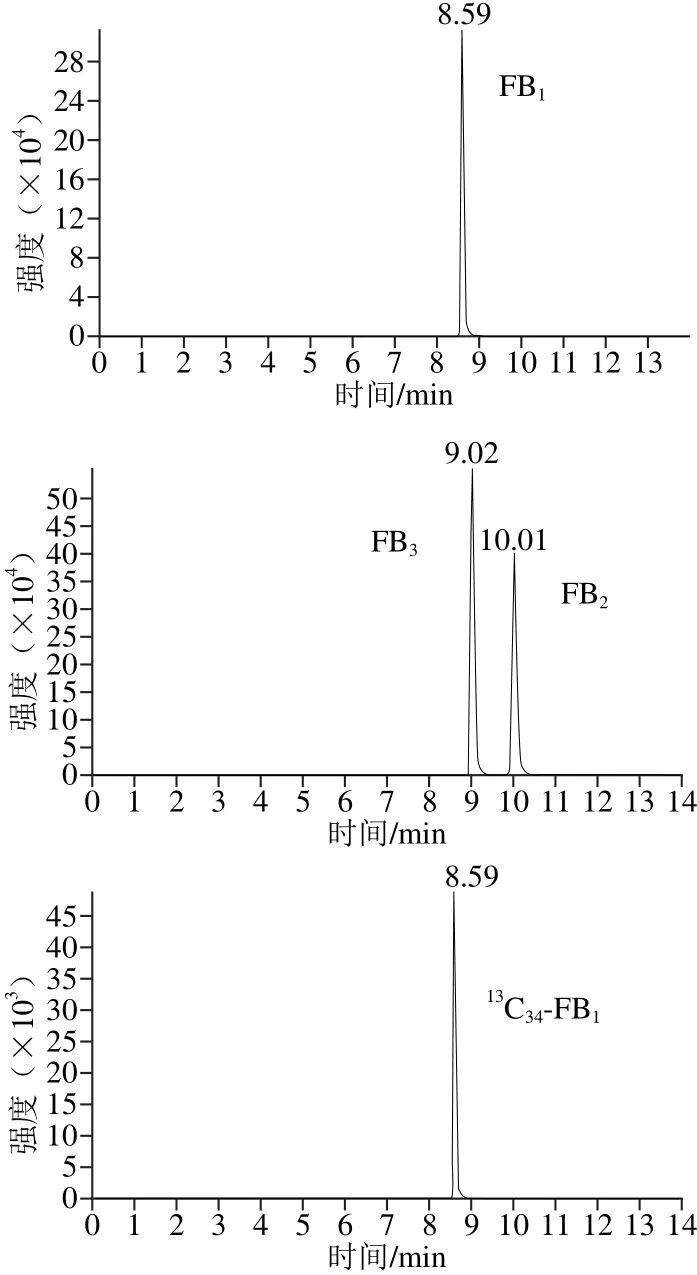
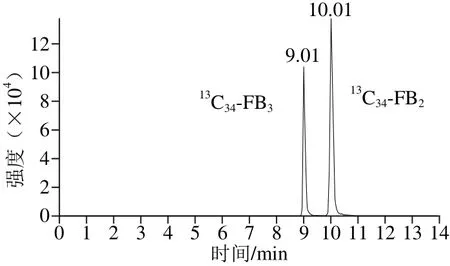
图2 伏马毒素的液相色谱-质谱图(20 ng/mL)Fig. 2 HPLC-MS patterns of fumonisins (20 ng/mL)
2.2 色谱条件优化
比较了甲醇-水、乙腈-水、乙腈-0.1%甲酸溶液3 种流动相体系在相同的液相分离程序条件下目标物的出峰情况。通过对比,使用乙腈-0.1%甲酸溶液(V/V)流动相体系产生的峰形要优于使用甲醇-水、乙腈-水流动相体系的峰形。伏马毒素在电喷雾离子源正离子模式下产生的是[M+H]+离子,酸性溶液有助于离子化,在水和乙腈体系中添加容易挥发的甲酸可提高伏马毒素的离子化效率,改善目标物的峰形,故选择乙腈-0.1%甲酸溶液作为流动相。
在线净化过程中洗脱液采用聚焦模式直接注入色谱柱入口处,洗脱溶剂为高浓度有机相,为使洗脱液在色谱柱入口处产生聚集效应,流动相要保持高浓度水相,实验比较了水相比例为90%、95%和98%时,目标物在色谱柱上的保留情况,结果表明:水相比例为90%时,目标物在色谱柱上有扩散,水相比例增加到95%时,无扩散现象,继续增加无明显变化,故选取水相比例为95%;此外,由于洗脱速度较大,需要改变流动相的速度,使洗脱速度和流动相速度之和保持一定,避免由于瞬间洗脱速度较大、总体速度变化快而导致压力波动较大,造成出峰异常。
2.3 在线固相萃取条件的优化
2.3.1 固相萃取柱的选择
实验选取目前常用于伏马毒素检测的净化小柱:MAX强阴离子交换柱(10 mm×1 mm)、WAX弱阴离子交换柱(10 mm×1 mm)、HLB(10 mm×1 mm)3 种在线固相萃取小柱,以3 种目标化合物的标准品(质量浓度为20 ng/mL)的峰面积为研究对象。在1.3.2节固相萃取条件下,通过比较每种净化小柱对伏马毒素的净化效果,来选择合适的固相萃取小柱。实验表明,伏马毒素在HLB净化柱上保留能力较弱,当用甲醇淋洗时,伏马毒素和杂质被同时洗脱下来,造成最终不出峰,MAX柱和WAX柱对伏马毒素的净化效果较好,但伏马毒素经过WAX柱净化后的峰面积高于MAX柱。故选择WAX柱作为在线固相萃取小柱。
2.3.2 洗脱溶剂的优化
比较了0.5%甲酸-甲醇溶液、1%甲酸-甲醇溶液、2%甲酸-甲醇溶液对伏马毒素在WAX柱上的洗脱效果,实验发现,不同体积分数的甲酸-甲醇溶液均可以将伏马毒素从固相萃取小柱上洗脱下来,用0.5%甲酸-甲醇溶液洗脱比1%甲酸-甲醇溶液和2%甲酸-甲醇溶液洗脱回收率稍低,1%甲酸-甲醇溶液和2%甲酸-甲醇溶液洗脱效果相当,故选用的洗脱溶剂为1%甲酸-甲醇溶液。
2.3.3 洗脱液体积的优化
在线净化过程中洗脱液体积是非常重要的参数,直接影响着回收率的高低和色谱峰形。在上样量一定(20 μL),洗脱速率一定(100 μL/min)的条件下,选取洗脱液为100、150、200、250、300 μL进行实验,以化合物标准品(质量浓度为20 ng/mL)的峰面积考察洗脱效果。目标化合物峰面积变化情况如图3所示,随着洗脱液用量的逐渐增大,目标化合物出峰面积逐渐增加,当洗脱液达到200 μL后,峰面积变化趋于稳定,故选择洗脱液体积为200 μL。
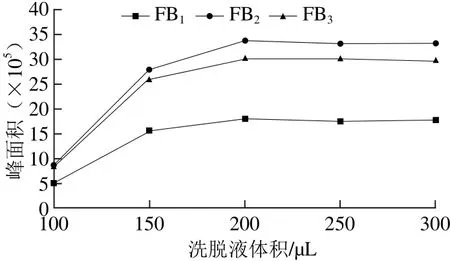
图3 在线固相萃取洗脱体积的优化Fig. 3 Optimization of solvent volume for online SPE
2.4 方法的线性方程、检出限和定量限结果
采用玉米粉和面粉空白基质配制0.05~50 ng/mL系列标准工作液,其中内标质量浓度为5 ng/mL,以目标物的色谱峰面积为纵坐标(y),以各组分的质量浓度(ng/mL)为横坐标(x)作线性回归方程,检出限和定量限分别以信噪比的3 倍和10 倍计算,见表4。
2.5 方法的回收率与精密度结果
在确定的实验条件下,向玉米粉和面粉基质中添加0.2、1、10、50 μg/kg 4 个水平的混合标准溶液,每个添加质量浓度水平重复6 次,进行加标回收率和精密度测定,结果见表5,3 种伏马毒素在玉米粉基质中4 个加标水平的回收率范围为93.9%~117.8%,相对标准偏差(relative standard deviation,RSD)范围在1.8%~9.4%;在面粉基质中4 个加标水平的回收率范围为94.3%~108.2%,RSD范围在2.9%~8.3%,说明方法准确可靠,重复性好。
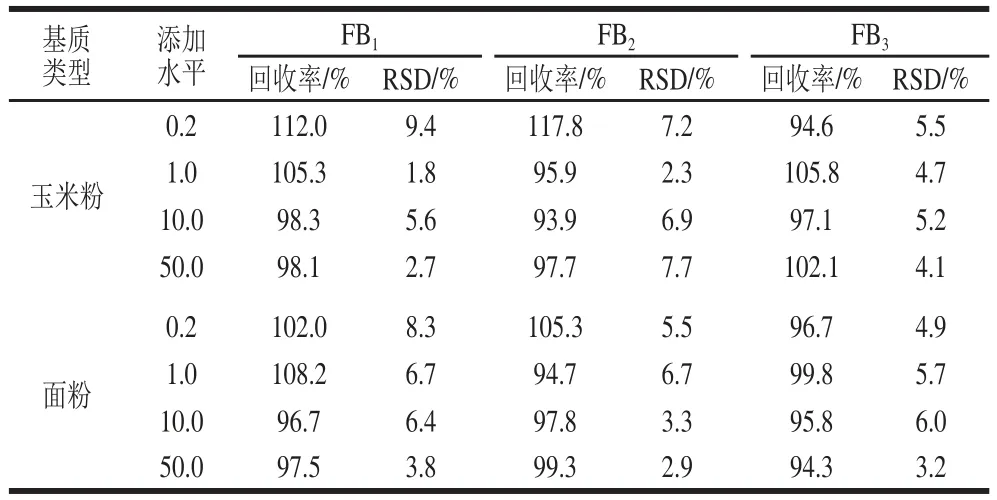
表5 方法的回收率和精密度(n=6)Table 5 Recoveries and precision of the method (n=6)
2.6 本方法与标准方法对比
取玉米粉和面粉空白样品,配成20 μg/kg的伏马毒素加标样品,分别按照本方法和GB 5009.240—2016《食品中伏马毒素的测定》中的液相色谱-串联质谱法进行测定,每种方法平行测定6 次,显著水平α为0.05,对2 种方法样品检测结果进行t检测检验,结果见表6。本方法与国标方法在检测玉米粉与面粉中的3 种伏马毒素时,检测结果无显著性差异,证明本方法准确可靠,实际可行。
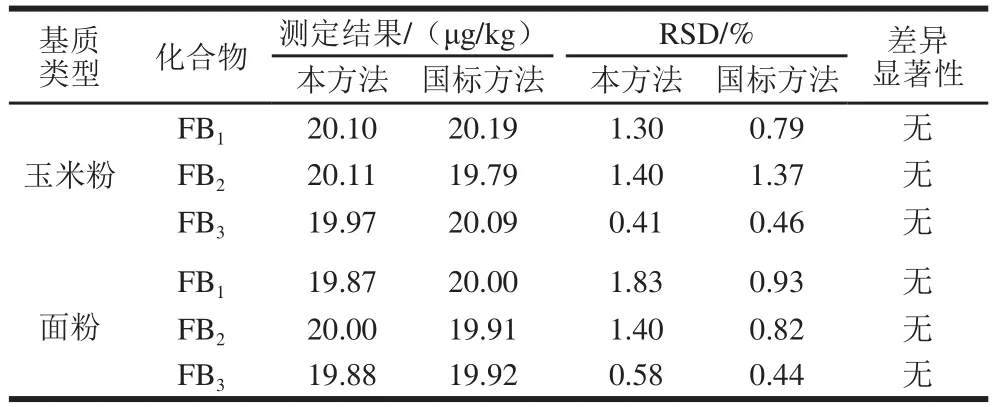
表6 与国标对比实验结果Table 6 Comparison of HPLC-MS-MS and the national standard meetthhoodd
2.7 实际样品的测定结果

表7 实际样品检测结果Table 7 Analysis of real samples
利用本实验建立的方法,对当地市场购买的10 个玉米粉、10 个面粉样品中FB1、FB2和FB3进行了检测,结果见表7。玉米粉样品受伏马毒素的污染较为严重,全部检出FB1,污染水平范围5.0~498.9 μg/kg,低于欧盟规定的直接供人类消费的玉米及其制品的限量标准1 000 μg/kg。
3 结 论
本实验建立了在线固相萃取净化-液相色谱-串联质谱测定玉米粉和面粉中3 种伏马毒素的检测方法。样品经乙腈提取,WAX在线固相萃取柱净化,用液相色谱-串联质谱法结合同位素内标校正。与已报道的方法相比,操作简便快速,灵敏度高,实现了样品萃取富集的自动化,适用于玉米粉和面粉中3 种伏马毒素含量的测定,可为其他基质中伏马毒素含量的测定提供参考,也可为农产品中伏马毒素的风险评估提供技术支撑。
[1] HUI G H, JIN J J, DENG S G, et al. Winter jujube (Zizyphus jujuba Mill.) quality forecasting method based on electronic nose[J]. Food Chemistry, 2015, 170∶ 484-491. DOI∶10.1016/j.foodchem.2014.08.009.
[2] 王军淋, 胡玲玲, 蔡增轩, 等. 超高压液相色谱法同时检测玉米中的伏马毒素B1、B2、B3[J]. 食品安全质量检测学报, 2013, 4(1)∶216-223.
[3] 刘中勇, 刘津, 张喆, 等. 粮谷类食品中伏马毒素限量标准和检测方法进展[J]. 粮食与饲料工业, 2009(7)∶ 45-47. DOI∶10.3969/j.issn.1003-6202.2009.07.017.
[4] 周贻兵, 吴坤, 李磊, 等. 超高效液相色谱串联质谱法测定啤酒中伏马毒素的含量[J]. 中国酿造, 2016, 35(1)∶ 152-155. DOI∶10.11882/j.issn.0254-5071.2016.01.034.
[5] 杨俊花, 刘峰良, 杨海峰, 等. 伏马毒素毒性作用的研究进展[J]. 上海农业学报, 2015, 31(1)∶ 142-146. DOI∶10.15955/j.issn1000-3924.2015.02.31.
[6] 林维宣, 裴轶君, 董伟峰. 固相萃取-高效液相色谱法测定玉米中伏马毒素B1[J]. 大连轻工业学院学报, 2004, 23(1)∶ 15-17.DOI∶10.3969/j.issn.1674-1404.2004.01.005.
[7] XING F Q, LI Z, SUN A Z, et al. Reactive oxygen species promote chloroplast dysfunction and salicylic acid accumulation in fumonisin B1-induced cell death[J]. FEBS Letters, 2013, 587(14)∶ 2164-2172.DOI∶10.1016/j.febslet.2013.05.034.
[8] LI R J, TAO B, PANG M H, et al. Natural occurrence of fumonisins B1and B2in maize from three main-producing provinces in China[J]. Food Control, 2015, 50∶ 838-842. DOI∶10.1016/j.foodcont.2014.09.034.
[9] 马皎洁, 胡骁, 邵兵, 等. 超高效液相色谱-串联质谱法测定面粉、玉米及其制品中的伏马菌素研究[J]. 山东大学学报(医学版), 2012,50(4)∶ 115-120. DOI∶10.6040/j.issn.1671-7554.2012.04.026.
[10] 刘印平, 路杨, 王丽英, 等. 液相色谱串联质谱-同位素内标法快速测定玉米面中的伏马菌毒素[J]. 食品安全质量检测学报, 2015, 6(10)∶3817-3821.
[11] 曹娅, 孙利, 王明林, 等. 粮谷中8 种痕量真菌毒素的定量分析方法[J]. 分析测试学报, 2013, 32(3)∶ 150-155. DOI∶10.3969/j.issn.1004-4957.2013.02.002.
[12] 何庆华, 许杨, 刘师文. 直接竞争化学发光酶免疫法检测谷物中的伏马菌素B1[J]. 食品科学, 2012, 33(22)∶ 173-176.
[13] 管迪, 潘灿平, 王文, 等. 磁微粒酶联免疫吸附法测定玉米中的伏马毒素B1[J]. 食品科学, 2014, 35(8)∶ 208-211. DOI∶10.7506/spkx1002-6630-201408041.
[14] HENG Y J, JIANG W X, SAEGER S D, et al. Development of a sensitive enzyme-linked immunosorbent assay for the detection of fumonisin B1in maize[J]. Toxicon, 2012, 60(7)∶ 1245-1250.DOI∶10.1016/j.toxicon.2012.08.011.
[15] LING S L, PANG J, YU J J, et al. Preparation and identification of monoclonal antibody against fumonisin B1and development of detection by Ic-ELISA[J]. Toxicon, 2014, 80∶ 64-72. DOI∶10.1016/j.toxicon.2013.12.008.
[16] 张浩, 侯红漫, 刘阳, 等. 伏马菌素检测方法的研究进展[J]. 中国粮油学报, 2007, 22(4)∶ 137-142. DOI∶10.3321/j.issn∶1003-0174.2007.04.032.
[17] 张晓旭, 肖志勇, 张红艳, 等. 柱后衍生-高效液相色谱法测定玉米中伏马菌素B1和B2[J]. 色谱, 2012, 30(8)∶ 792-797. DOI∶10.3724/SP.J.1123.2012.03048.
[18] 孙利, 霍江莲, 崔维刚, 等. 粮食产品中真菌毒素的色谱及质谱检测技术研究进展[J]. 食品科学, 2013, 34(19)∶ 367-375. DOI∶10.7506/spkx1002-6630-201319075.
[19] DILKIN P, MALLMANN C A, ALMEIDA C A, et al. Robotic automated clean-up for detection of fumonisins B1and B2in corn and corn-based feed by high-performance liquid chromatography[J].Journal of Chromatography A, 2001, 925(1/2)∶ 138-145. DOI∶10.1016/S0021-9673(01)01037-8.
[20] SMITH L L, FRANCIS K A, JOHNSON J T, et al. Quantitation of fumonisin B1and B2in feed using FMOC pre-column derivatization with HPLC and fl uorescence detection[J]. Food Chemistry, 2017, 234∶174-179. DOI∶10.1016/j.foodchem.2017.04.142.
[21] 郑铁松, 钟文辉. 高效液相色谱法测定食品中的伏马毒素[J]. 食品科学,2004, 25(3)∶ 135-136. DOI∶10.3321/j.issn∶1002-6630-2004.03.029.
[22] REN Y P, ZHANG Y, HAN S Y, et al. Simultaneous determination of fumonisins B1, B2and B3contaminants in maize by ultra highperformance liquid chromatography tandem mass spectrometry[J].Analytica Chimica Acta, 2011, 692(1/2)∶ 138-145. DOI∶10.1016/j.aca.2011.03.005.
[23] 李永刚, 张瑞, 聂晓明. 高效液相色谱-串联质谱法测定玉米油中的伏马毒素[J]. 中国卫生检验杂志, 2017, 27(3)∶ 336-343.
[24] 廉慧锋, 赵笑天, 王蓉珍, 等. 超高效液相色谱-串联质谱法同时测定玉米、花生、麦仁中的9 种真菌毒素[J]. 食品科学, 2010, 31(20)∶360-366.
[25] 图雅, 马俊华, 李慧娟, 等. 同位素稀释-超高效液相色谱-串联质谱法测定婴幼儿谷物米粉中伏马菌素B1、B2及B3[J]. 中国卫生检验杂志, 2016, 26(19)∶ 2779-2781.
[26] 骆春迎, 余辉菊. 稳定同位素稀释-液相色谱-串联质谱法测定啤酒中的3 种伏马毒素[J]. 中国卫生检验杂志, 2016, 26(19)∶ 2776-2778; 2781.
[27] 陈丽慧, 蔡伟鹏, 白艳艳, 等. 高效液相色谱-三重四极杆质谱法同时测定大米中的伏马毒素B1、B2、B3[J]. 实用预防医学, 2017, 24(3)∶375-377.
[28] 郭文博, 杨俊花, 韩铮, 等. 高效液相色谱-串联质谱法测定不同畜禽配合饲料中伏马毒素的含量[J]. 分析化学, 2015, 43(3)∶ 414- 418.
[29] 李正翔, 陈小龙, 曹赵云, 等. 液相色谱-串联质谱法测定粮谷中的伏马毒素[J]. 分析测试学报, 2014, 33(2)∶ 167-172. DOI∶10.3969/j.issn∶1004-4957.2014.02.009.
[30] 国家卫生和计划生育委员会. 食品中伏马毒素的测定∶ GB 5009.240—2016[S]. 北京∶ 中国标准出版社, 2016∶ 2-13.
On-Line Solid Phase Extraction Combined with Liquid Chromatography-Tandem Mass Spectrometry for Determi nation of Fumonisins in Corn and Wheat Flour Samples
MA Junmei, LIU Dong, ZHANG Leilei, SHEN Lu, WANG Lixia*, ZHANG Yan*
(Hebei Food Safety Key Laboratory, Hebei Food Inspection and Research Institute, Shijiazhuang 050200, China)
An analytical method was developed to determine three fumonisins in corn and wheat fl our samples using online solid phase extraction combined with high performance liquid chromatography-tandem mass spectrometry (HPLCMS-MS). Samples were extracted with an acetonitrile-water mixture (50∶50, V/V) and purifi ed with an on-line solid phase extraction column (WAX column). The fumonisins were separated on an XBridge C18colum by using 0.1% formic acid solution mixed with acetonitrile as the mobile phase. Multiple reaction monitoring was used to acquire mass spectrometric data under positive elect rospray ionization mode. The internal standard method was adopted for quantifi cation. The results showed that good linearity was obtained in the range of 0.05–50 ng/mL for fumonisin B1, fumonisin B2and fumonisin B3,and the correlation coeffi cients were all greater than 0.999 0. The limits of detection (LOD) and quantitation (LOQ) for these analytes were 0.08 and 0.2 μg/kg, respectively. Recoveries of the method were in the range of 93.9%–117.8% at spiked levels between 0.2 and 50 μg/kg, and precision (expressed as relative standard deviation) ranged from 1.8% to 9.4%. The developed method could be used for the accurate quantitative measurement of fumonisins in corn and wheat fl our samples.
on-line solid phase extraction; liquid chromatography-tandem mass spectrometry; isotope dilution; fumonisin
O657.63
A
1002-6630(2017)20-0300-06
马俊美, 刘东, 张雷雷, 等. 在线固相萃取-液相色谱-串联质谱法快速测定玉米粉和面粉中伏马毒素[J]. 食品科学, 2017,
10.7506/spkx1002-6630-201720044. http://www.spkx.net.cn
MA Junmei, LIU Dong, ZHANG Leilei, et al. On-line solid phase extraction combined with liquid chromatographytandem mass spectrometry for determination of fumonisins in corn and wheat fl our samples[J]. Food Science, 2017, 38(20)∶300-305. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201720044. http∶//www.spkx.net.cn
2017-03-27
河北省食品药品监督管理局食品安全科技计划项目(PT2014028;PT2014033);
“十二五”国家科技支撑计划项目(2015BAK36B03);国家重大科学仪器设备开发专项(2012YQ03011110)
马俊美(1990—),女,助理工程师,硕士,研究方向为食品安全。E-mail:jmma1221@163.com
*通信作者:王丽霞(1963—),女,正高级工程师,硕士,研究方向为食品安全检测与风险评估技术。
E-mail:lisawang9078@vip.sina.com
张岩(1979—),男,正高级工程师,博士,研究方向为食品安全。E-mail:snowwinglv@126.com
DOI∶10.7506/spkx1002-6630-201720044

