血清血管内皮生长因子对慢性阻塞性肺疾病急性加重期合并呼吸衰竭患者预后的判断价值
赵秀清,陈 伟,吴多省,刘晓燕
(1.海南省东方市东方医院 呼吸科,海南 东方,572600;2.海南医学院第一附属医院 呼吸科,海南 海口,570102;3.陕西省安康市石泉县中医医院 检验科,陕西 石泉,725200)
血清血管内皮生长因子对慢性阻塞性肺疾病急性加重期合并呼吸衰竭患者预后的判断价值
赵秀清1,陈 伟2,吴多省1,刘晓燕3
(1.海南省东方市东方医院 呼吸科,海南 东方,572600;2.海南医学院第一附属医院 呼吸科,海南 海口,570102;3.陕西省安康市石泉县中医医院 检验科,陕西 石泉,725200)
血清血管内皮生长因子;慢性阻塞性肺疾病急性加重期;呼吸衰竭;超敏C反应蛋白
慢性阻塞性肺疾病(COPD)是一种呼吸科常见的不可逆性气道疾病,该病发病率高,病死率也高[1]。COPD患者在感染等诱因下出现急性发作,即慢性阻塞性肺疾病急性加重期(AECOPD),其咳嗽、咳痰甚至呼吸困难等症状会进一步加重,引起心肺功能失调,机体代谢障碍,最终发展为呼吸衰竭[2]。有研究[3]发现血管内皮生长因子(VEGF)具有调节血管渗透性的作用,能调节肺泡上皮细胞以及血管内皮细胞的凋亡。VEGF是一种促血管生成因子,主要参与慢性炎症反应过程,在COPD患者的气道慢性炎症中起主要的气道重塑作用[4]。本研究探讨血清VEGF与AECOPD合并呼吸衰竭患者预后因素的相关性,现报告如下。
1 资料与方法
1.1 一般资料
选取本院呼吸科和ICU病房2015年1月—2016年5月的70例AECOPD合并呼吸衰竭患者。纳入标准:既往确诊为COPD患者;入院时符合AECOPD诊断标准;动脉气血分析符合Ⅰ和Ⅱ型呼吸衰竭标准。在静息状态下,动脉血氧分压[p(O2)]低于8 kPa (60 mmHg),伴有或不伴二氧化碳分压[p(CO2)]高于6.65 kPa (50 mmHg);吸烟史大于5年。排除标准:单纯严重心脏系统疾病(如左心衰竭)引起的低氧血症;无其他严重性系统疾病。
1.2 方法
采用前瞻性研究方法,从AECOPD患者合并呼吸衰竭入院日起,截至AECOPD患者合并呼吸衰竭好转出院或死亡。收集AECOPD患者的年龄、身高、体质量、COPD病程、吸烟指数、既往病史。所有AECOPD患者均采用经验性抗感染、祛痰、支气管抗张、氧疗等治疗,若患者病情严重者进行有创机械通气,入住ICU病房观察治疗。入院后,首先抽取AECOPD患者动脉血2 mL,采用电极法测定其动脉血气。入院24 h内抽取AECOPD患者清晨静脉血,采用酶联免疫吸附法(ELISA)测定其血清VEGF。采用乳胶免疫比浊法测定血清超敏C反应蛋白(hs-CRP)。采用凝固法来测定血浆纤维蛋白原(FIB)。由本院检验科来检测其外周血中性粒细胞分数(N)。计算体质量指数(BMI)。
1.3 评价指标
比较2组患者的年龄、COPD病程、吸烟指数、血清VEGF含量、hs-CRP含量、外周血中性粒细胞数、BMI、动脉血气分析、动脉血pH以及氧合指数。分析血清VEGF含量与BMI、动脉血pH、COPD病程、p(CO2)的相关性。分析血清VEGF对AECOPD合并呼吸衰竭的预后价值。
1.4 统计学处理
采用SPSS 9.0统计学软件进行数据处理。采用独立t检验比较2组各指标关系。计数资料采用卡方检验,采用均数±标准差来表示计量资料。采用非条件多因素Logistic回归分析AECOPD合并呼吸衰竭患者的预后因素。P<0.05为差异有统计学意义。
2 结 果
2.1 2组AECOPD合并呼吸衰竭患者入院时基本资料比较
在70例AECOPD患者中,死亡16例,存活54例,存活率为77.15%。2组的性别差异无统计学意义(P<0.05)。在2组患者的预后因素比较中,存活组的年龄、COPD病程、吸烟指数显著低于死亡组(P<0.05)。死亡组的BMI显著低于存活组(P<0.05)。见表1。
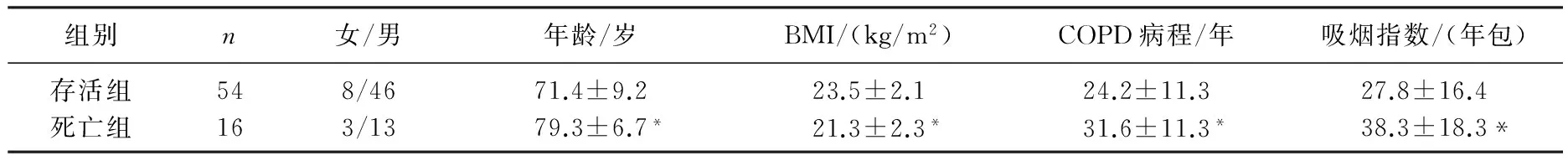
表1 2组AECOPD合并呼吸衰竭患者入院时基本资料比较
与存活组比较,*P<0.05。
2.2 2组AECOPD患者检测指标比较
死亡组的hs-CRP含量、外周血中性粒细胞数(N)以及p(CO2)显著高于存活组(P<0.05)。死亡组的血清VEGF含量、pH值以及氧合指数显著低于存活组(P<0.05)。2组的FIB比较,差异无统计学意义(P>0.05)。见表2。

表2 2组AECOPD患者检测指标比较
与存活组比较,*P<0.05。
2.3 AECOPD并发呼吸衰竭患者预后的多因素回归分析
因变量为AECOPD的预后,自变量为性别(1表示男性,0表示女性)、年龄、BMI、COPD 病 程、吸 烟 指 数 及 血 清 VEGF、hs-CRP、外周中性粒细胞、p(CO2)、氧合指数,采用Logistic回归分析得出,血清 VEGF、hs-CRP值、p(CO2)进入回归方程。见表3。血清VEGF含量与BMI、动脉血pH呈正相关性(r=0.349、0.314;P=0.02、0.012)。血清VEGF含量与COPD病程、p(CO2)、hs-CRP呈负相关性(r=-0.249、-0.568、-0.612;P=0.354、0.001、0.001)。
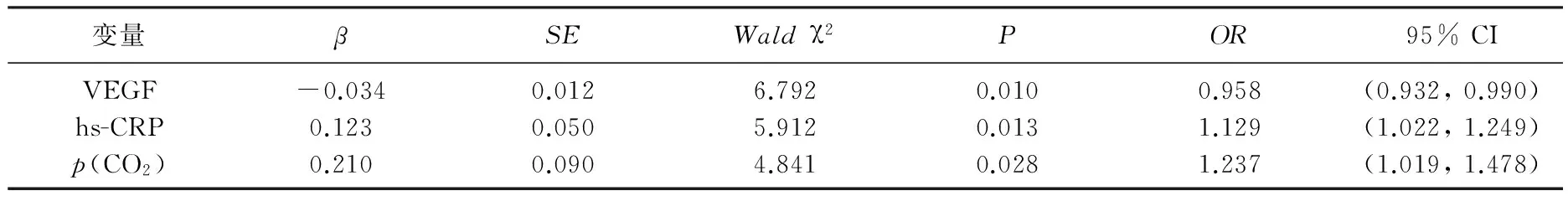
表3 AECOPD并发呼吸衰竭患者预后的多因素回归分析
3 结 论
COPD多发生于中老年人群,近年来该病发病率、致死率不断升高[5]。COPD患者受到感染等诱因而发生咳嗽、咳痰、呼吸困难等症状加重,病情进展而进一步发展为AECOPD,往往须入院治疗,严重者需要做气管切开通气等开创性治疗手段,但病死率仍然很高[6]。本研究单因素分析显示,死亡组的年龄、COPD病程、吸烟指数显著高于存活组。死亡组的BMI值显著低于存活组。死亡组的hs-CRP含量、外周血中性粒细胞数(N)以及p(CO2)显著高于存活组。死亡组的血清VEGF含量、pH值以及氧合指数显著低于存活组。通过多因素分析,在排除AECOPD合并呼吸衰竭患者的一般情况后,发现血清 VEGF、hs-CRP值、p(CO2)进入回归方程,即成为AECOPD合并呼吸衰竭患者预后的独立危险因素。其中,血清VEGF含量与BMI、动脉血pH呈正相关性。血清VEGF含量与COPD病程、p(CO2)呈负相关性。2组的FIB比较,差异无统计学意义。
有研究[7]发现,hs-CRP在COPD患者系统性炎症发应中升高,hs-CRP水平的高低影响到COPD患者的生活质量、运动能力、疾病的预后。刘红菊等[8]发现hs-CRP升高提示COPD病情加重。王璨丽等[9]发现AECOPD合并呼吸衰竭患者hs-CRP显著高于健康人。黄燕华等[10]发现hs-CRP作为COPD患者病情加重的预测因素之一,hs-CRP显著增高提示AECOPD合并呼吸衰竭的风险大,与本研究中hs-CRP为AECOPD合并呼吸衰竭患者预后的独立危险因素相一致。
有研究[11]发现,VEGF在吸烟COPD患者中表达水平比不吸烟COPD患者高,VEGF与吸烟指数呈相关性。有研究[12]观察到香烟的烟雾会降低VEGF的表达,是因为其会干扰VEGF介导的存活信号传导,从而对内皮细胞和血管起保护作用,减少其损伤。有研究[13]发现,临床上病情严重的AECOPD患者的痰VEGF表达水平逐渐减少时,第1秒用力呼气容积也会逐渐下降,二者呈显著相关性,提示VEGF表达水平降低会破坏肺泡壁。因此,一些学者认为在COPD患者的早期代偿阶段,一定表达水平的血清VEGF会减少炎症对肺泡的损害。随着COPD患者病情的进展,发展为AECOPD合并呼吸衰竭时,VEGF表达水平下降,导致肺泡壁和微血管受损[14],与本研究结果发现血清VEGF表达水平的下降成为AECOPD合并呼吸衰竭患者预后的独立危险因素相一致。有研究[15]发现FIB的升高提示COPD患者病情的加重,但本研究结果发现在死亡组患者与存活组患者的比较中,FIB与AECOPD合并呼吸衰竭无相关性,可能原因是此次研究的样本量少,尚不足以发现FIB与AECOPD合并呼吸衰竭的关系。
[1] 童卫泉,杨宏宽,夏婷婷,等.雷帕霉素对慢性阻塞性肺疾病大鼠气道重塑中血管内皮生长因子表达作用的研究[J].中国全科医学,2016(36):4484-4488,4494.
[2] 柳馨,王建清.血管内皮生长因子与慢性阻塞性肺疾病关系的研究进展[J].临床医药实践,2016(03):202-204.
[3] Marcos P J,Sanjuán P,Huerta A,et al.Relationship Between Severity Classification of Acute Exacerbation of Chronic Obstructive Pulmonary Disease and Clinical Outcomes in Hospitalized Patients[J].Cureus,2017,9(1):e988-993.
[4] Sriram K B,Singh M.Lung ultrasound B-lines in exacerbations of chronic obstructive pulmonary disease[J].Intern Med J,2017,47(3):324-327.
[5] 张杰,张颖,余其贵,等.老年慢性阻塞性肺疾病急性发作患者血清中血管内皮因子变化及其意义[J].安徽医药,2014(01):109-112.
[6] Bathoorn E,Groenhof F,Hendrix R,et al.Real-life data on antibiotic prescription and sputum culture diagnostics in acute exacerbations of COPD in primary care[J].Int J Chron Obstruct Pulmon Dis,2017,12:285-290.
[7] Flattet Y,Garin N,Serratrice J,et al.Determining prognosis in acute exacerbation of COPD[J].Int J Chron Obstruct Pulmon Dis,2017,12:467-475.
[8] 刘红菊,吴小侠.无创呼吸机治疗慢性阻塞性肺疾病合并Ⅱ型呼吸衰竭的护理观察[J].实用临床医药杂志,2012,16(16):41-42.
[9] 王璨丽,胡静,秦磊.血管内皮生长因子在慢性阻塞性肺疾病急性加重期诊断中的应用及预后评估价值[J].中国实验诊断学,2014(09):1440-1443.
[10] 黄燕华,孙赟,殷小伟,等.血清降钙素原在慢性阻塞性肺疾病急性发作期的临床应用价值[J].实用临床医药杂志,2014,18(1):109-110,112.
[11] Kovalenko S,Dorofieiev A.The content of mucin MUC-2,-3 and -4 antigens in the bronchial mucosa membrane of chronic obstructive pulmonary disease patients during acute exacerbation - initial report[J].Adv Respir Med,2017,85(1):3-7.
[12] Toft-Petersen A P,Torp-Pedersen C,Weinreich U M,et al.Trends in assisted ventilation and outcome for obstructive pulmonary disease exacerbations.A nationwide study[J].PLoS One,2017,12(2):e0171713-9.
[13] Koul P A,Mir H,Akram S,et al.Respiratory viruses in acute exacerbations of chronic obstructive pulmonary disease[J].Lung India,2017,34(1):29-33.
[14] 张伟,谷明明,孙璐璐,等.血管内皮生长因子mRNA在慢性阻塞性肺疾病大鼠肺组织中表达水平的动态变化[J].新乡医学院学报,2013(01):9-12.
[15] Mohan A,Arora S,Uniyal A,et al.Evaluation of plasma leptin,tumor necrosis factor-α,and prealbumin as prognostic biomarkers during clinical recovery from acute exacerbations of chronic obstructive pulmonary disease[J].Lung India,2017,34(1):3-8.
R 441.8
A
1672-2353(2017)17-218-03
10.7619/jcmp.201717082
2017-04-17
海南省自然科学基金项目(2015CFB185)
刘晓燕

