Ⅱ、Ⅲ期直肠癌术后三维适形放疗联合化疗与术后单纯辅助化疗的疗效比较
杨俊昌,颜廷华,吴堂兵,俞进友,赵明宏,夏春军
(南通大学附属建湖医院 肿瘤科,江苏 盐城,224001)
Ⅱ、Ⅲ期直肠癌术后三维适形放疗联合化疗与术后单纯辅助化疗的疗效比较
杨俊昌,颜廷华,吴堂兵,俞进友,赵明宏,夏春军
(南通大学附属建湖医院 肿瘤科,江苏 盐城,224001)
直肠癌;三维适形放疗;同期化疗;卡培他滨;辅助化疗
直肠癌是较为常见的恶性肿瘤,手术是直肠癌主要治疗手段,但5年生存率仅为50%,主要原因是局部复发和远处转移,直肠癌术后辅助治疗成为临床上关注的重点。本研究回顾性分析66例Ⅱ、Ⅲ期直肠癌术后三维适形放疗联合化疗与单纯化疗对总生存率(OS)、无局部复发生存率(RDFS)和无远处转移生存率(DDFS)的影响,现报告如下。
1 资料与方法
1.1 临床资料
收集2011年1月—2016年6月在本院治疗的Ⅱ、Ⅲ期直肠癌患者66例,病理为腺癌,化疗前完成胸部、腹部检查排除复发转移,治疗前卡氏评分标准(KPS)评分≥70分。无其他恶性肿瘤病史,未接受过放疗和化疗。术后放化疗组(A组)36例,年龄41~74岁,中位年龄58岁;术后化疗组(B组)30例,年龄37~72岁,中位年龄57岁。见表1。
1.2 治疗方法
1.2.1 放射治疗:选择6MV-X线直线加速器照射方法,采用三维适形放疗(3D-CRT),靶区勾画参照ICRU62号文件规定:临床靶体积(CTV)包括原发肿瘤高危复发区域:直肠癌术后瘤床、直肠周围系膜、骶前、坐骨直肠窝;区域淋巴引流区:髂总血管淋巴引流区、直肠系膜区、髂内血管淋巴引流区、闭孔淋巴引流区。剂量49.4 Gy/26f,或50 Gy/25f。1.2.2 化疗方案:所有患者术后都接受以氟尿嘧啶为基础的同期化疗或辅助化疗。① 放疗同期化疗:卡培他滨1 000 mg/m2,2次/d,第1~14天,3周使用1次。② 辅助化疗:全组患者化疗周期数为2~6周期,中位4周期。A组:CapeOX方案14例,FOLFOX方案18例,FLO方案4例。B组:CapeOX方案6例,FOLFOX方案9例,FLO方案15例;具体方案:CapeOX方案:奥沙利铂125 mg/m2静脉滴注第1天,卡培他滨1 000 mg/m2,2次/d,第1~14天,3周使用1次;FOLFOX方案:奥沙利铂85 mg/m2第1天,亚叶酸钙200 mg/(m2·d),第1~2天,氟尿嘧啶400 mg/( m2·d)静脉滴注以及600 mg/(m2·d) CIV 22 h,第1~2天,2周使用1次;OLF方案:草酸铂125 mg/m2静脉滴注第1天,亚叶酸钙300 mg/m2静脉滴注第1~5天,氟尿嘧啶700 mg/m2静脉滴注第1天,3周使用1次。
1.3 随访与观察方法
所有患者通过门诊或住院复诊及电话随访,以手术当日为随访起始时间。总生存时间(OS):为患者手术当日至死亡或末次随访的时间;无局部复发时间(RDFS):为患者手术当日至肿瘤在盆腔内复发或盆腔淋巴结转移的时间;无远处转移时间(DDFS):为患者手术当日至盆腔以外的脏器或淋巴结出现新病灶的时间。
1.4 统计学处理
组间资料比较采用χ2检验,采用SPSS 17.0统计软件包的 Kaplan-Meier 计算5年OS、RDFS和DDFS,并进行单因素分析预后影响因素。P<0.05为差异有统计学意义。
2 结 果
36例患者完成术后放化疗,其中29例在3年内完成;而30例患者完成术后单纯化疗,其中12例在3年内完成;3年前接受放化疗患者占28%,而3年内接受放化疗患者占70%,术后放化疗患者明显增多,治疗模式发生变化。仅有1例患者放疗至39.9 Gy/21f,因出现4级放射性肠炎中断放疗,其他35例患者均按计划完成放疗。随访截至2016年10月5日。A组1、3、5年RDFS分别为97.1%、81.7%、81.7%,B组分别为96.7%、70.9%、56.7%;A组1、3、5年DDFS分别为97.2%、83.1%、83.1%,B组分别为93.2%、71.9%、53.1%;A组1、3、5年OS分别为100%、84%、84%,B组分别为96.7%、79.5%、51.7%;2组5年RDFS、DDFS、OS比较,差异有统计学意义(P<0.05)。单因素分析结果显示,Dixon术式患者5年RDFS显著高于Miles,术后放疗显著提高5年OS、RDFS、DDFS,见表2。
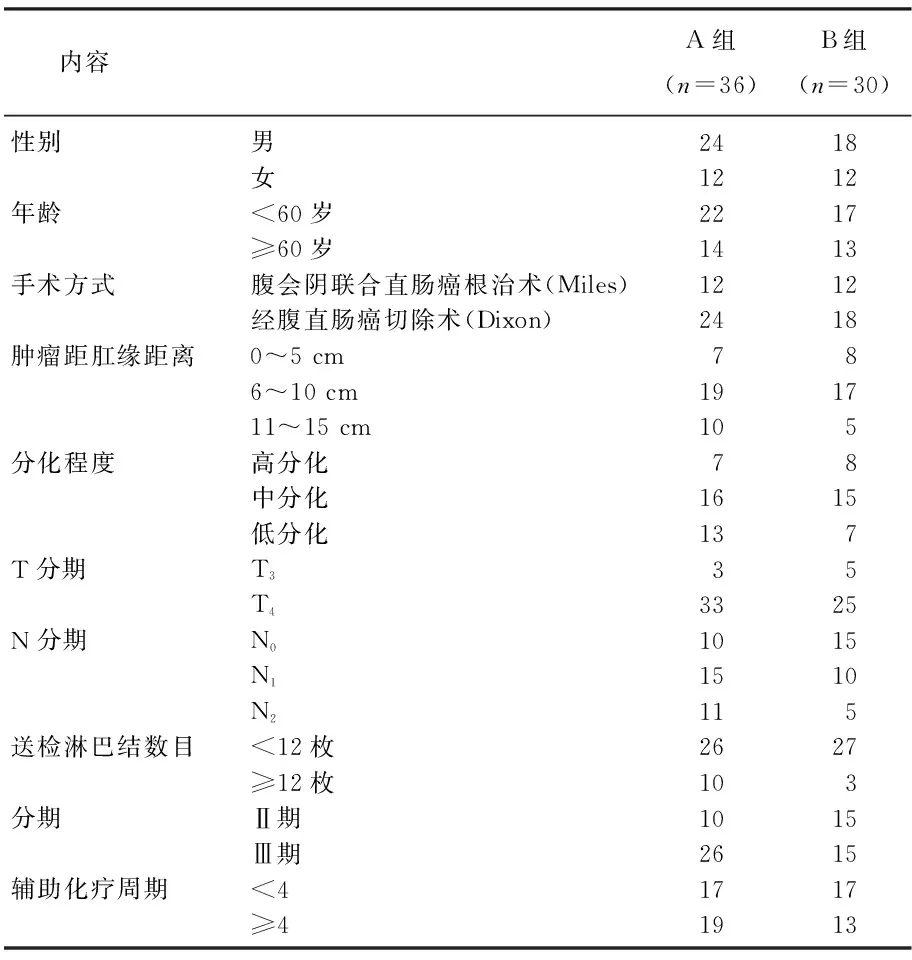
表1 2组直肠癌患者临床资料比较
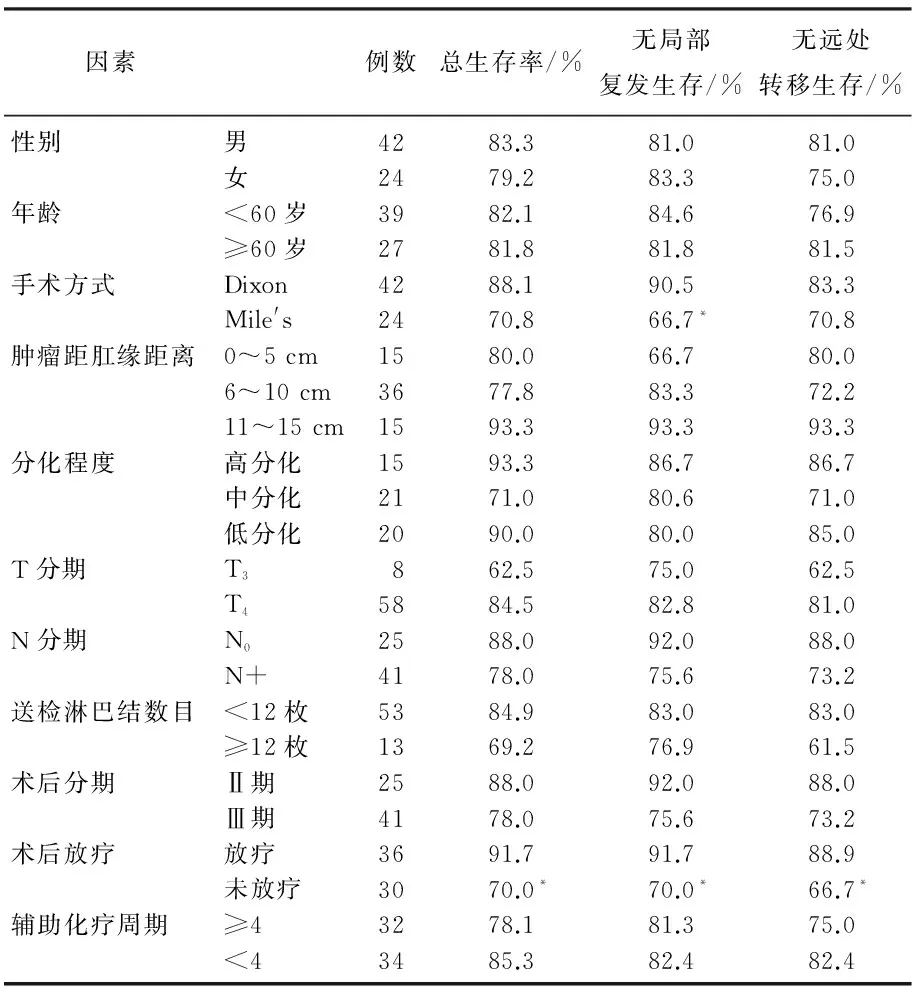
表2 66例Ⅱ、Ⅲ期直肠癌患者5年预后的单因素分析结果
与同一因素另一亚项比较,*P<0.05。
3 讨 论
手术是直肠癌的主要治疗手段,尽管外科手术水平不断进步,但5年生存率仍在50%左右。目前局部晚期直肠癌新辅助放化疗和术后辅助放化疗均是直肠癌综合治疗标准手段[1]。Meta分析[2]表明术前放化疗与术后放化疗比较,局部控制高、毒性低,但国内仍以术后辅助放化疗为主流方式。
NSABP R-01[3]研究报道,与单纯手术相比,术后放疗将局部复发从25%降低至16%,但OS相似。NSABP R-02[4]研究报道直肠癌术后放化疗组5年局部复发率为8%,明显低于术后化疗组的13%,但2组5年DFS和OS无显著差异。而研究[5]比较了术后放疗与术后放化疗的差异,显示了放化疗组在降低局部复发和OS的提高的优势。多项研究显示术后辅助放化疗能够使局部复发率明显降低,但是否能提高生存率观点不同,分析主要原因是前期研究多采用普通外照射联合化疗的不良反应大,文献报道3级以上不良反应发生率高达10%~54%,考虑与普通放疗靶区范围大,周围正常组织保护差,不良反应发生率较高[6-7]。随着肿瘤放射治疗技术及设备的不断发展,三维适形放疗已广泛应用于肿瘤治疗中。三维适形放疗采用共面或非共面的入射方向,可以使高剂量区分布和肿瘤靶区的形状大体相似,不仅照射范围精确、靶区剂量分布较常规放疗更加合理,并更好地保护周围正常组织器官。王培培等[8]报道,直肠癌术后采用三维适形调强放疗治疗,20.9%患者出现1、2级放射性肠炎,无1例患者发生3级。本研究单因素结果显示,术后放疗与5年无局部复发转移及生存相关,采用三维适形放疗,仅1例患者出现4级放射性肠炎,未按计划完成放疗,说明三维适形放疗能够更好地保护小肠组织。
卢宁宁等[9]报道,Ⅱ、Ⅲ期直肠癌术后卡培他滨同步放化疗局部区域控制好,远处转移是失败主要原因,单因素和多因素分析同期放化疗后接受辅助化疗是影响总生存和无远处转移生存的因素。陆忠华等[10]报道Ⅱ、Ⅲ期直肠癌根治术后希罗达同步放化疗,同步放化疗组5年局部复发率为6.25%,明显低于序贯放化组的31.25%,但2组患者长期生存率无显著差异。Lee等[11-12]报道,术后早放疗组局部复发率14.8%,明显低于晚放疗组24.8%,但OS无影响,且该研究10年随访2组在OS、DFS及局部复发率差异均无显著差异。2015版中国结直肠癌诊治规范:Ⅱ、Ⅲ期直肠癌术后推荐先行同步放化疗再行辅助化疗,或先行1~2周期辅助化疗、同步放化疗再辅助化疗的夹心治疗模式,本组患者术后放化疗采用了上述二种治疗方案,术后放化疗组5年RDFS、DDFS、OS分别为81.7%、83.1%、84.0%,明显高于术后单纯化疗组。
单因素分析结果分析,Dixon术式患者5年RDFS、DDFS、OS高于Miles术式患者,考虑前者包含15例上段患者,但仅5年RDFS差异有统计学意义,而5年DDFS、OS无显著差异,考虑总病例数偏少有关。淋巴结转移患者5年RDFS、DDFS、OS高于淋巴结阴性患者,但无显著差异,考虑总病例数偏少有关。AJCC标准[13]推荐淋巴结最少检出数目12枚,邱成志等[14]研究发现≥12枚组5年生存率明显高于<12枚组,送检淋巴结数目是Ⅱ、Ⅲ期结直肠癌独立预后因素,而本组送检淋巴结数目≥12枚组患者生存反而低于<12枚组患者,考虑本组≥12枚组患者明显偏少,仅占20%,发生个案差异较大。
综上所述,本研究显示Ⅱ、Ⅲ期直肠癌根治术后,采用三维适形放疗同期卡培他滨放化疗联合全身化疗,能够降低局部复发及远处转移,可提高生存率。
[1] Sauer R,Becker H,Hohenberger W,et al.Preoperative versus postoperative chemoradiotherapy for rectal cancer[J].N Engl J Med,2014,351:1731-40.
[2] 蔡成,王建平,戴志慧,等.Ⅱ、Ⅲ期直肠癌术前与术后放化疗疗效比较的Meta分析[J].浙江医学,2016,38(1):44-48.
[3] Fisher B,Wolmark N,Rockette H,et al.Postoperative adjuvant chemotherapy with or radiation therapy for rectal cancer:Results from NSABP R-01[J].J Natl Cancer Inst,1998,80(2):21-29.
[4] Wolmark N,Wieand H S,Hyams D M,et al.Randomized trial of postoperative adjuvant chemotherapy with or without radiotherapy for carcinoma of the rectum:national surgical adjuvant breast and bowel project protocol R-02[J].J Natl Cancer Inst,2000,92(5):388-96.
[5] Krook J,Moerter C,Gunderson L L,et al.Effective surgical adjuvant therapy for high-risk rectal carcinoma[J].N Engl J Med,1991,324(11):709-715.
[6] Bagatzounis A,Willner J,Oppitz U,et al.The postoperative adjuvant radiation therapy and radiochemotherapy for UICC stage ⅡandⅢ rectal cancer,a retrospective analysis[J].Strahlenther Onkol,2000,176(3):112-7.
[7] Baglan K L,Frazier R C,Yan D,et al.The dose-volume relationship of acute small bowel toxicity from concurrent 5-Fu based chemotherapy and radiation therapy for rectal cancer[J].Int J Radiat Oncol Biol Phys,2002,52(1):176-83.
[8] 王培培,王军,齐曼,等.直肠癌术后三维适形/调强放疗联合化疗与单纯辅助化疗的疗效比较[J].肿瘤防治研究,2014,41(5):468-473.
[9] 卢宁宁,金晶,李晔雄,等.Ⅱ期和Ⅲ期直肠癌根治术后卡培他滨同期放化疗疗效及失败原因分析[J].中华放射肿瘤学杂志,2011,20(6):497-501.
[10] 陆忠华,王建华,许锡元,等.Ⅱ、Ⅲ期直肠癌根治术后放疗同步希罗达化疗的疗效[J].世界华人消化杂志,2009,17(32):3351-3354.
[11] Lee J H,Ahn J H,Bahng H,et al.Randomized trial of postoperative adjuvant therapy in stage ⅡandⅢ rectal cancer to define the optimal sequence of chemotherapy and radiotherapy:a preliminary report[J].J Clin Oncol,2002,20 (7):1751-8.
[12] Kim T W,Lee J H,Ahn J H,et al.Randomized trial of postoperative adjuvant therapy in stage ⅡandⅢ rectal cancer to define the optimal sequence of chemotherapy and radiotherapy:10-year follow-up[J].Int J Radiat Oncol Biol Phys,2011,81(4):1025-31.
[13] Edler D,Ohrling K,Hallstrom,et al.The number of analyzed lymph nodes-a prognostic factor in colorectal cancer[J].Acta Oncol,2007,46(7):975-981.
[14] 邱成志,吴友谊,王春晓.结直肠癌病检淋巴结数目与TNM分期及预后的关系[J].中华普通外科杂志,2011,26(6):493-495.
R 735.3
A
1672-2353(2017)17-135-03
10.7619/jcmp.201717044
2017-03-09

