MiR-194对恶性黑色素瘤细胞增殖和凋亡的影响及机制
李灵毅,骆曼
(1.华中科技大学同济医学院附属武汉中心医院 皮肤科,湖北 武汉 430030;2.湖北省武汉市第一医院 肿瘤科,湖北 武汉 430022)
MiR-194对恶性黑色素瘤细胞增殖和凋亡的影响及机制
李灵毅1,骆曼2
(1.华中科技大学同济医学院附属武汉中心医院 皮肤科,湖北 武汉 430030;2.湖北省武汉市第一医院 肿瘤科,湖北 武汉 430022)
目的研究miR-194对人恶性黑色素瘤细胞的增殖和凋亡的影响及机制。方法 应用实时荧光定量聚合酶链反应(qRT-PCR)分别检测miR-194在原代正常人皮肤黑色素细胞系PIG1和5种恶性黑色素瘤细胞系(A375、SK-MEL-1、SK-MEL-2、SK-MEL-5及SK-MEL-28)中的相对表达量。利用LipofectamineTM2000分别将A375细胞系转染miR-194 mimics和阴性对照质粒,从而将A375细胞系分为miR-194模拟物组和阴性对照组;应用MTT法和流式细胞术分别测定miR-194模拟物组和阴性对照组细胞的增殖能力及凋亡率,蛋白印迹(Western blot)分别检测miR-194模拟物组和阴性对照组的细胞周期蛋白D1(Cyclin D1)、裂解型半胱氨酸天冬氨酸蛋白酶3(Cleaved Caspase-3)蛋白表达情况。结果miR-194在5种黑色素瘤细胞系A375、SKMEL-1、SK-MEL-2、SK-MEL-5及SK-MEL-28中的表达水平低于正常人皮肤黑色素细胞系PIG1,依次分别是正常细胞系的(0.18±0.03)、(0.25±0.05)、(0.37±0.03)、(0.39±0.04)及(0.45±0.03)倍(均P<0.05)。转染后第0、1、2、3、4及5天,miR-194模拟物组vs阴性对照组的OD值分别为:(0.18±0.02)vs(0.19±0.03)(P>0.05)、(0.29±0.02) vs(0.27±0.03)(P>0.05)、(0.42±0.08) vs(0.45±0.07)(P>0.05)、(0.63±0.09)vs(1.17±0.12)(P<0.05)、(1.05±0.15)vs(2.15±0.21)(P<0.05)及(1.87±0.23)vs(3.18±0.27)(P<0.05)。miR-194 模拟物组和阴性对照组的细胞凋亡率分别为24.2%和9.3%(P<0.05)。Cyclin D1和Cleaved Caspase-3蛋白在miR-194模拟物组中的表达量分别是阴性对照组的(0.36±0.04)和(3.2±0.28)倍(均P<0.05)。结论miR-194在黑色素瘤细胞中低表达,miR-194表达上调可促进黑色素瘤细胞凋亡并抑制黑色素瘤细胞的增殖,其机制可能为下调Cyclin D1蛋白及上调Cleaved Caspase-3蛋白表达。
micR-194;黑色素瘤;增殖;凋亡
Abstract:ObjectiveTo investigate the effect of microRNA-194 (miR-194)on cell proliferation and apoptosis in melanoma cells and potential underlying mechanism.Methods Real-time fluorescence quantitative PCR(qRT-PCR)was utilized to measure miR-194 in normal primary human skin melanocytes(PIG1)and five kinds of malignant melanoma cells (A375,SK-MEL-1,SK-MEL-2,SK-MEL-5 and SK-MEL-28).A375 melanoma cells were transfected with miR-194 mimics or negative control plasmid via lipofectamine 2000 system.The proliferation capability was measured by MTT assay,and apoptosis rate was determined by flowcytometry.Expressions of Cyclin D1 and cleaved Caspase-3 were detected by Western blot.Results The miR-194 level among A375,SK-MEL-1,SK-MEL-2,SK-MEL-5 and SK-MEL-28 was significantly lower than that in PIG1,and fold of PIG1 was(0.18±0.03),(0.25±0.05),(0.37±0.03),(0.39±0.04),and(0.45±0.03) (P<0.05),respectively.OD values at 490 nm on day 0,1,2,3,4,and 5 post transfection in the miR-194 mimics group vs the negative control group were(0.18±0.02)vs(0.19±0.03)(P>0.05),(0.27±0.02)vs(0.29±0.03)(P>0.05),(0.42±0.08)vs(0.45±0.07)(P>0.05),(0.63±0.09)vs(1.17±0.12)(P<0.05),(1.05±0.15)vs(2.15±0.21)(P<0.05)and(1.87±0.23)vs(3.18±0.27)(P<0.05),respectively.The apoptosis rate in the miR-194 mimics group vs the negative control group was 24.2%vs 9.3% (P<0.05).Compared with the negative control group,the miR-194 mimics group had(0.36±0.04)-fold change and(3.2±0.28)-fold change in Cyclin D1 and cleaved Caspase-3,respectively (P<0.05).ConclusionsThere is low expression of miR-194 in melanoma cells.Up-regulation of miR-194 can promote apoptosis rate and inhibit proliferation of melanoma cells by down-regulation of Cyclin D1 protein and up-regulation of cleaved Caspase-3 protein.
Keywords: miR-194;melanoma;proliferation;apoptosis
恶性黑色素瘤是一类恶性程度较高的皮肤肿瘤[1-2],常见于皮肤,约占皮肤肿瘤的10%,死亡率可接近80%[3-4],其发病率在全球呈不断上升趋势[3-4],有家族聚集倾向[3-4]。本病早期症状不典型,我国每年新发病例持续增长约2万例[2],本病易于早期转移,预后多较差,5年生存率仅约15%[2]。本病死亡率极高,尤其是转移性黑色素瘤,患者中位生存期仅约6月,5年生存率<5%[5]。本病目前尚无理想的根治手段,因此深入研究恶性黑色素瘤的发病机制为提高恶性黑色素瘤的疗效具有重要意义。miRNA是一类约由18~25nt组成的小分子非编码RNA,在增殖、分化、代谢、凋亡及发育过程中发挥重要作用[6-7]。多种恶性肿瘤的发生过程与miRNA表达谱的改变密切相关,miRNA的异常表达是参与肿瘤细胞增殖生长重要分子机制之一[8-10],因此,miRNA可能成为肿瘤治疗的新靶点。miR-194已被证实在其他肿瘤的发生、发展中都起到关键的调控作用,并存在异常表达[11-15],但目前尚未发现有关miR-194与恶性黑色素瘤的文献报道。本研究miR-194对恶性黑色素瘤细胞增殖、凋亡、迁移及侵袭的影响,为探求新的有效的治疗方法提供理论基础。
1 材料与方法
1.1 材料
原代正常人皮肤黑色素细胞系PIG1和恶性黑色 素 瘤 细 胞 系 A375、SK-MEL-1、SK-MEL-2、SK-MEL-5及SK-MEL-28(购自中国医学科学院),胎牛血清及RPMI 1640培养基(购自美国Roswell公司),实验所需的Cyclin D1、Caspase-3及GAPDH一抗(购自美国BD公司),二抗(购自湖北省武汉博士德生物科技有限公司),miR-194 mimics及Scramble(由广州锐博生物科技有限公司合成)。
1.2 细胞培养、转染及分组
原代正常人皮肤黑色素细胞系PIG1和恶性黑色素瘤细胞系 A375、SK-MEL-1、SK-MEL-2、SKMEL-5及SK-MEL-28均种植于RPMI 1640培养基并培养于37℃、5%二氧化碳CO2培养箱中,于48 h后消化传代,利用LipofectamineTM2000分别将A375细胞系转染miR-194 mimics和阴性对照质粒,并将A375细胞系分为miR-194模拟物组和阴性对照组,miR-194转染序列:miR-194 mimics-sense正向引物,5'-UGUAACAGCAACUCCAUGUGGA-3';miR-194 mimics-antisense反向引物,5'-UCCACAU GGAGUUGCUGUUACAUU-3'。阴性对照组转染序列:miR-194 NC-sence正向引物,5'-UUCUCCGAA CGUGUCACGUTT-3';NC-anti-sence 反向引物,5'-A CGUGACACGUUCGGAGAATT-3'。
1.3 RNA提取及实时荧光定量聚合酶链反应
用All-in-One miRNA-194抽提试剂盒和Allin-One miRNA实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测试剂盒提取和分离miRNAs,ABI Prism 7700 system的SYBR Green Reagents(日本TaKaRa株式会社),qRT-PCR在 ABI 7500 qRT-PCR仪中,以U6小核RNA作为内参,使用2-ΔΔCt方法定量,量化miR-194相对表达水平。
1.4 细胞增殖实验
采用MTT法,将miR-194模拟物组和阴性对照组两组细胞消化成单细胞悬液后,按每孔2×103个细胞接种于96孔板上,培养基体积为200 μl。培养24 h后加入5 mg/ml MTT溶液40 μl,孵育4 h后每孔加入200μl DMSO,摇床上充分震荡。在转染1、2、3、4及5 d后于490 nm波长测定OD值。重复3次,取平均值。
1.5 细胞凋亡测定
采用流式细胞术,用Annexin V/PI染色检测,将两组细胞消化成单细胞悬液后,PBS清洗2次,并使用Binding Buffer重悬,加入相应比例的Annexin V抗体,避光染色10 min后加入适量PBS溶液以及PI染料,流式细胞仪检测Annexin V阳性细胞比例来确定细胞凋亡的变化。
1.6 Western blot法
将miR-194模拟物组和阴性对照组两组细胞裂解、变性后,以每孔30μg总蛋白上样,浓缩胶80 V电泳50 min,分离胶100 V电泳100 min。湿法转膜,加入GAPDH、Cyclin D1及Caspase-3一抗,抗体浓度为1∶300,于4℃孵育过夜,PBST漂洗3遍,二抗(1∶500)37℃孵育 4 h,PBST 漂洗后,ECL 液显影,用Quantity One 1-D分析灰度值,目的蛋白相对表达量=目的蛋白测定值/GAPDH,实验重复3次,取平均值。
1.7 统计学方法
数据分析采用SPSS 17.0统计软件和Graph软件,计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR-194在黑色素瘤细胞系中的表达
qRT-PCR检测miR-194在原代正常人皮肤黑色素细胞PIG1和恶性黑色素瘤细胞系的相对表达量,在PIG1细胞系中miR-194相对表达量为1,A375、SK-MEL-1、SK-MEL-2、SK-MEL-5、及 SKMEL-28细胞系miR-194相对表达量依次为(0.18±0.03)、(0.25±0.05)、(0.37±0.03)、(0.39±0.04)及(0.45±0.03),经方差分析,差异有统计学意义(F=121.13,P=0.000);经 LSD-t检验,A375、SKMEL-1、SK-MEL-2、SK-MEL-5 及 SK-MEL-28 细胞系miR-194相对表达量均低于PIG1(P<0.05)。见图1。
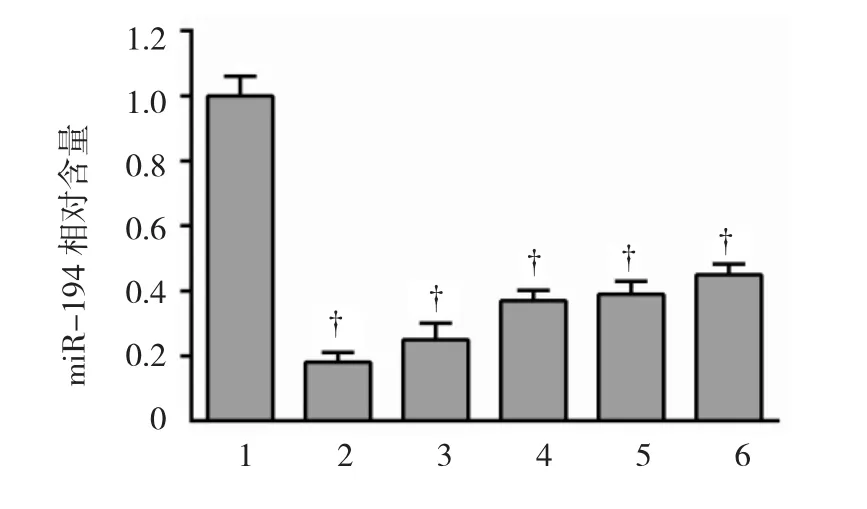
图1 miR-194在正常黑色素细胞系及恶性黑色素瘤细胞系中的表达

图2 阴性对照组和miR-194模拟物组细胞增殖曲线
2.2 过表达miR-194对A375细胞增殖和凋亡的影响
转染24h后,miR-194模拟物组与阴性对照组miR-194相对表达量分别为(10.3±0.51)vs(1.00±0.00),P<0.001(见图 2A);MTT 实验显示,在转染后0、1、2、3、4 及 5 d,miR-194 模拟物组与阴性对照组OD值分别为[(0.18±0.02)vs(0.19±0.03),t=-0.547,P=0.306]、[(0.27±0.02)vs(0.29±0.03),t=-0.960,P=0.195]、[(0.42±0.08)vs(0.45±0.07),t=-0.488,P=0.325]、[(0.63±0.09)vs(1.17±0.12),t=-6.235,P=0.001]、[(1.05±0.15)vs(2.15±0.21),t=-7.382,P=0.000]及[(1.87±0.23)vs(3.18±0.27),t=-6.397,P=0.001](见图2B);流式细胞术测定两组凋亡率,结果显示,miR-194模拟物组vs阴性对照组凋亡率为[(24.6±2.5)%vs(9.4±1.1)%,t=9.639,P=0.000]。见图3。
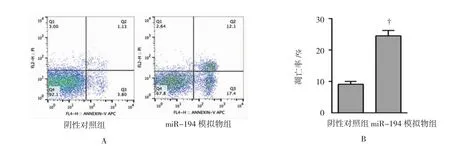
图3 阴性对照组及miR-194模拟物组凋亡率比较
2.3 miR-194对 Cyclin D1、Caspase-3蛋白表达的影响
Western blot检测增殖、凋亡相关的蛋白质,发现miR-194模拟物组中Cyclin D1下调,而凋亡发生标志物Cleaved Caspase-3上调表达,miR-194模拟物组vs阴性对照组Cyclin D1蛋白相对表达量为[(0.36±0.04)vs(1.00±0.00),t=-27.712,P=0.000];miR-194模拟物组vs阴性对照组Cleaved Caspase-3蛋白相对表达量为[(3.20±0.28)vs(1.00±0.00),t=13.608,P=0.000]。见图4。

图4 miR-194对Cyclin D1、Caspase-3蛋白表达的影响
3 讨论
恶性黑色素瘤常发病于皮肤,有极高的死亡率[4]。恶性黑色素瘤就诊时往往就已经进入晚期[16]。尽管与西方发达国家相比,恶性黑色素瘤在我国的发病率较低,但是本病发生率在我国依然呈上升趋势,保守估计每年大约有2万例新发患者[2]。本病预后较差,5年生存率不足20%[2],若是转移性黑色素瘤,患者的中位生存期约为半年左右,5年生存率不足5%[5]。
目前,研究miR-194与恶性黑色素瘤关系的文献报道较少,但是个别文献已经证实microRNA在恶性黑色素瘤发生、发展中所起的作用[17-18],miR-194-33a过表达可抑制人皮肤恶性黑色素瘤细胞系A375的增殖、黏附、迁移及侵袭[17],孙慧娟[18]等学者亦证实上调miR-205的表达后,人皮肤恶性黑色素瘤细胞系A375的增殖、黏附以及迁移均有不同程度的减低。然而目前关于miR-194的研究主要集中消化道肿瘤方面,且miR-194对肿瘤的调控作用与其和p53基因密不可分[19]。miR-194在结肠癌、食管癌及胰腺癌细胞中存在异常表达,并其与p53基因的关系可能是miR-194作为MDM2(双微体2癌基因)/p53调节回路的重要分子,能反馈性地对MDM2/p53蛋白的表达起到关键的调控作用,从而影响肿瘤的发生、发展过程[12,19-20]。miR-194在肝细胞癌中高表达,可抑制肝星状细胞的过度激活,从而抑制肝纤维化进展及肝癌细胞的发生和转移[14,21]。miR-194表达异常能够调控肠上皮细胞发生变异,并对肠道肿瘤的转移起到正向调控作用[22]。此外,尚有研究表明,miR-194也与昼夜生理节律有着密切的关系[23]。本研究证明miR-194在肿瘤发生及发展过程中起到的关键作用。
本研究miR-194对黑色素瘤细胞增殖、凋亡的影响及机制。首先,笔者利用qRT-PCR法证明miR-194在5种人恶性黑色素瘤细胞系中较正常人皮肤黑色素细胞系低表达,提示其可能起“抑癌基因”的作用;其次,对恶性黑色素瘤细胞系转染miR-194后,笔者发现miR-194过表达可促进人恶性黑色素瘤细胞系A375的凋亡同时抑制A375细胞增殖。
作为细胞周期G1/S期检查点,Cyclin D1在细胞增殖调控过程中起着重要的作用,若其持续激活,将导致G1期缩短,细胞提前进入到S期,进而导致增殖失调,而引起肿瘤发生[24],其在非小细胞肺癌及乳腺癌等肿瘤中都存在高表达[25-26],本研究中,进一步探讨miR-194对细胞增殖的影响发现,miR-194下调Cyclin D1的表达,其机制可能为miR-194下调Cyclin D1的表达,并进而抑制细胞周期提前进入到S期,进而抑制细胞增殖过程。与增殖相反的过程是凋亡,细胞凋亡途径主要包括两条,内源性途径和外源性途径[27],内源性途径主要由线粒体介导,在多种凋亡刺激信号的刺激下,线粒体外膜通透性发生改变,并进一步激活Caspase-3、8及9,并将DNA裂解为180~200 bp大小的片段,进而引起凋亡小体;而外源性途径,由死亡受体所介导,并进一步激活Caspase-3、8而诱导凋亡,Caspase-3是内源性和外源性途径的最终作用分子[28]。本研究中检测miR-194模拟物组发现Caspase-3蛋白表达量高于阴性对照组,表明其诱导凋亡的机制可能为通过上调Caspase-3而起作用。
综上所述,本研究发现miR-194在黑色素瘤细胞中呈低表达,miR-194表达上调可促进黑色素瘤细胞凋亡并抑制黑色素瘤细胞的增殖,其机制可能是通过下调Cyclin D1蛋白及上调Cleaved Caspase-3蛋白水平而实现的,这为深入了解黑色素瘤的发病机制提供新的视野,可能作为新的治疗靶点。
[1]POUST J.Targeting metastatic melanoma[J].American Journal of Health-System Pharmacy,2008,65(9):9-15.
[2]CSCO黑色素瘤专家委员会.中国黑色素瘤诊治指南(2011版)[J].临床肿瘤学杂志,2012,17(2):159-171.
[3]GARBE C,EIGENTLER T K,KEILHOLZ U,et al.Systematic review of medical treatment in melanoma:current status and future prospects[J].Oncologist,2011,16(1):5-24.
[4]徐毅,周建大,罗成群,等.中国汉族黑色素瘤家系临床特点分析[J].激光生物学报,2007,16(6):792-794.
[5]GRAY-SCHOPFER V,WELLBROCK C,MARAIS R.Melanoma biology and new targeted therapy[J].Nature,2007,445(7130):851-857.
[6]MOLN?R A,SCHWACH F,STUDHOLME D J,et al.miRNAs control gene expression in the single-cell alga Chlamydomonas reinhardtii[J].Nature,2007,447(7148):1126-1129.
[7]XIAO C,RAJEWSKY K.MicroRNA control in the immune system:basic principles[J].Cell,2009,136(1):26-36.
[8]GARZON R,CALIN G A,CROCE C M.MicroRNAs in cancer[J].Annual Review of Medicine,2009,60(1):167-179.
[9]WANG Y,RUSSELL I,CHEN C.MicroRNA and stem cell regulation[J].Curr Opin Mol Ther,2009,11(3):292-298.
[10]NEGRINI M,NICOLOSO M S,CALIN G A.MicroRNAs and cancer-new paradigms in molecular oncology[J].Curr Opin Cell Biol,2009,21(3):470-479.
[11]BRAUN C J,ZHANG X,SAVELYEVA I,et al.p53-Responsive microRNAs 192 and 215 are capable of inducing cell cycle arrest[J].Cancer Res,2008,68(24):10094-10104.
[12]GEORGES S A,BIERY M C,KIM S Y,et al.Coordinated regulation of cell cycle transcripts by p53-Inducible microRNAs,miR-192 and miR-215[J].CancerResearch,2008,68(24):10105-10112.
[13]KRÜTZFELDT J,RÖSCH N,HAUSSER J,et al.MicroRNA-194 is a target of transcription factor 1(Tcf1,HNF1α)in adult liver and controls expression of frizzled-6[J].Hepatology,2012,55(1):98-107.
[14]VENUGOPAL S K,JIANG J,KIM T H,et al.Liver fibrosis causes downregulation of miRNA-150 and miRNA-194 in hepatic stellate cells,and their overexpression causes decreased stellate cell activation[J].Am J Physiol Gastrointest Liver Physiol,2010,298(1):G101-106.
[15]MENG Z,FU X,CHEN X,et al.miR-194 is a marker of hepatic epithelial cells and suppresses metastasis of liver cancer cells in mice[J].Hepatology,2010,52(6):2148-2157.
[16]RIGEL D S,RUSSAK J,FRIEDMAN R.The evolution of melanoma diagnosis:25 years beyond the ABCDs[J].CA Cancer J Clin,2010,60(5):301-316.
[17]陈瑶,周建大.探讨miR-33a对人皮肤恶性黑色素瘤细胞系A375增殖、黏附和迁移的影响及其可能机制[J].临床医学,2016,36(4):23-24.
[18]孙慧娟,胡纯婷,吴共发.miR-205对黑色素瘤A375细胞增殖、黏附和迁移的影响及机制探讨[J].山东医药,2012,52(44):23-25.
[19]BRAUN C J,ZHANG X,SAVELYEVA I,et al.p53-Responsive microRNAs 192 and 215 are capable of inducing cell cycle arrest[J].Cancer Res,2008,68(24):10094-10104.
[20]SONG B,WANG Y,KUDO K,et al.miR-192 Regulates dihydrofolate reductase and cellular proliferation through the p53-microRNA circuit[J].Clin Cancer Res,2008,14(24):8080-8086.
[21]MENG Z,FU X,CHEN X,et al.miR-194 is a marker ofhepatic epithelial cells and suppresses metastasis of liver cancer cells in mice[J].Hepatology,2010,52(6):2148-2157.
[22]SMITH C M,WATSON D I,MICHAEL M Z,et al.MicroRNAs,development of Barrett's esophagus, and progression to esophageal adenocarcinoma[J].World J Gastroenterol,2010,16(5):531-537.
[23]NAGEL R,CLIJSTERS L,AGAMI R.The miRNA-192/194 cluster regulates the Period gene family and the circadian clock[J].FEBS J,2009,276(19):5447-5455.
[24]张宏艳,刘端祺,范萍,等.乳腺癌普查初步报道及资料分析[J].解放军医学杂志,2007,32(6):654.
[25]KOSACKA M,PIESIAK P,KOWAL A,et al.Galectin-3andcyclin D1 expressioninnon-small cell lungcancer[J].Journal of Experimental&Clinical Cancer Research,2011,30(1):101.
[26]R?GELSPERGER O,WLCEK K,EKMEKCIOGLU C,et al.Melatonin receptors,melatonin metabolizing enzymes and cyclin D1 in human breast cancer[J].Journal of Receptors and Signal Transduction,2011,31(2):180-187.
[27]WANG L,YANG J K,KABALEESWARAN V,et al.The Fas-FADD death domain complex structure reveals the basis of DISC assembly and disease mutations[J].Nat Struct Mol Biol,2010,17(11):1324-1329.
[28]TAIT S W G,GREEN D R.Mitochondrial regulation of cell death[J].Cold Spring Harbor Perspectives in Biology,2013,5(9):64-74.
Effect of miR-194 on cell proliferation and apoptosis in melanoma cells and potential mechanism
Ling-yi Li1,Man Luo2
(1.Department of Dermatology,Tongji Medical College,Huazhong University of Science and Technology,Wuhan,Hubei 430030,China;2.Department of Oncology,the First Hospital of Wuhan,Wuhan,Hubei 430022,China)
R730.261
A
10.3969/j.issn.1005-8982.2017.21.006
1005-8982(2017)21-0031-06
2017-02-14
骆曼,E-mail:luomansunshine@163.com

