癫痫发作患者近期IL-1β、TNF-α水平与脑电图异常的关系
傅勇,李希芝,郭玉洁,郑静,王洪财
(滨州医学院附属医院,山东滨州256603)
癫痫发作患者近期IL-1β、TNF-α水平与脑电图异常的关系
傅勇,李希芝,郭玉洁,郑静,王洪财
(滨州医学院附属医院,山东滨州256603)
目的探讨癫痫发作患者近期白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)水平变化与脑电图改变程度的相关性。方法选取59例癫痫病患者(癫痫组)和30例健康患者(对照组),癫痫组在癫痫发作1周内、对照组于查体时检测血清IL-1β及TNF-α水平。癫痫组患者行脑电图检查观察脑电图异常程度,比较脑电图不同异常程度患者血清IL-1β、TNF-α水平的差异,并采用Kendall分析癫痫患者脑电图异常程度与血清IL-1β、TNF-α水平的相关性。结果与对照组比较,癫痫病近期发作患者IL-1β及TNF-α水平明显增高 (P均﹤0.05)。癫痫病患者59例中,脑电图正常12例、轻度异常17例、中度异常19例、重度异常11例。中、重度异常组血清IL-1β、TNF-α水平均高于正常组及轻度异常组,重度异常组血清IL-1β、TNF-α水平高于中度异常组(P均<0.05);IL-1β及TNF-α水平与脑电图异常程度呈正相关(tau_b分别为 0.634、0.663,P均<0.05)。结论癫痫病发作患者近期IL-1β及TNF-α水平与脑电图异常程度有关,可作为判断癫痫患者脑功能损伤程度的辅助手段之一。
癫痫;白细胞介素-1;肿瘤坏死因子-α;脑电图
癫痫是多种原因导致的脑部神经元高度同步化异常放电的临床综合征,具有发作性、短暂性、重复性和刻板性的特点。其发病机制复杂,且至今未完全阐明,神经免疫调节网络失衡可能是其发生发展因素之一[1,2]。癫痫可引起机体全身急性炎症反应,激活的巨噬细胞和NK细胞促炎性细胞因子大量释放,包括白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)等多种细胞因子参与了癫痫发病的病理生理过程[3,4]。本研究旨在通过测定癫痫近期发作患者血清IL-1β及TNF-α浓度及脑电图变化,探讨癫痫发作患者近期细胞因子水平与中枢神经功能损害的关系。
1 资料与方法
1.1 临床资料 选取2014年3月~2017年3月本院收治癫痫患者59例(癫痫组),男37例、女22例,年龄(46.56±9.04)岁。患者均符合国际抗癫痫联盟关于癫痫发作分类,并经临床及脑电图确诊。入院前1周内均有癫痫发作,其中单纯部分发作28例,复杂部分性发作11例,部分继发全面性发作20例。患者半年内未服用影响免疫功能的药物,治疗依从性好;同时排除1周内有感染、发热及严重心、肺、肾、肝功能损害等合并症患者。另选择同期体检健康对照组30例,男20例、女10例,年龄(45.32±7.68)岁,其性别构成、年龄、体质量指数与癫痫组比较无统计学差异(P>0.05)。
1.2 血清IL-1β、TNF-α检测 收集癫痫组患者癫痫发作1周内外周静脉血3~5 mL,离心后留取血清,-70 ℃保存,采用ELISA法测定血清IL-1β、TNF-α水平。试剂盒购自上海宝曼生物科技有限公司,由专业人员严格按试剂说明书操作。对照组于查体时采外周静脉血3~5 mL与癫痫组同法测定血清IL-1β、TNF-α水平。
1.3 脑电图检查 癫痫组患者采用16导康泰CMS4000动态脑电图仪进行动态脑电图检查。按国际10~20系统放置电极,严格按照动态脑电图操作流程,描记包含至少1个觉醒-睡眠周期。参考黄远桂《临床脑电图学》成人诊断标准将患者分为正常(枕区α或β节律为主,左右对称)、轻度异常(节律不规则或慢波增多)、中度异常(为节律减慢、左右不对称,或出现局灶性δ波等)、重度异常(广泛弥漫性慢波或周期样放电)4组。

2 结果
2.1 两组血清IL-1β、TNF-α水平比较 癫痫发作后患者近期血清IL-1β、TNF-α水平均高于对照组(P均<0.05)。见表1。
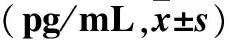
表1 两组血清IL-1β、TNF-α水平比较
注:与对照组比较,△P<0.05。
2.2 癫痫发作后患者近期脑电图表现 脑电图正常12例、轻度异常17例、中度异常19例、重度异常11例。表现为痫样放电(棘波、尖波、棘慢、多棘慢、尖慢或慢波等)、节律、波幅、频率及波形的改变、背景活动异常或无特异性变化。
2.3 脑电图不同异常程度癫痫患者血清IL-1β、TNF-α水平比较 脑电图轻度异常组血清IL-1β、TNF-α水平与正常组比较差异无统计学意义(P>0.05);中、重度脑电图异常组血清IL-1β、TNF-α水平均明显高于脑电图正常组及轻度异常组,重度异常组血清IL-1β、TNF-α水平高于中度异常组(P均<0.05),见表2。
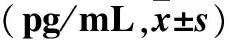
表2 脑电图不同异常程度癫痫患者血清IL-1β、TNF-α水平比较
2.4 脑电图异常程度与血清 IL-1β、TNF-α水平的关系 经Kendall相关分析,脑电图异常程度与血清 IL-1β、TNF-α浓度呈正相关(tau-b分别为0.634、0.663,P均<0.05)。
3 讨论
细胞因子是一类由免疫活性细胞产生的小分子多肽或糖蛋白,具有广泛生物学活性。动物实验与临床研究均表明:免疫紊乱或异常在癫痫的发病过程中有着重要的意义,细胞因子与中枢神经系统细胞因子受体结合后,通过改变电压门控或受体偶联离子通道活性,影响神经细胞间信号传递过程,增强或减弱突触后电位活动,使得中枢神经系统兴奋性发生改变等机制,参与癫痫的发病过程[5]。IL-1家族包括IL-1α、IL-1β、IL-1Ra等配体,通常体内浓度极低,在某种病理状态下,如脑缺血、脑损伤、惊厥等应激刺激时,IL-1水平明显提高。在中枢神经系统中主要以IL-1β为主,由胶质细胞及神经元分泌。Omran等[6]通过对未成年大鼠及儿童中央颞区癫痫模型动态观察发现,观察组海马区IL-1β的表达明显上调。Choi等[7]研究发现热惊厥患儿高迁移率族蛋白1及IL-1β等促炎因子水平较仅有发热的对照组明显升高。对West综合征患者的研究表明,脑脊液IL-1受体拮抗剂水平显著降低[8]。Uludag等[9]对22例内侧颞叶及17例外侧颞叶癫痫的研究表明,观察组IL-1β、IL-1Ra的水平显著上升。TNF-α是一种非特异性促炎因子,由活化的单核或巨噬细胞产生,具有外周和中枢神经系统双重来源,是中枢神经组织参与免疫应答和炎症级联反应的重要介质,脑外伤后TNF-α由星形细胞、小胶质细胞及血管内皮细胞等释放,在多条炎症信号通路中处于关键地位,在脑损伤初期可诱发炎症级联反应[10]。神经系统中的TNF-α主要由胶质细胞产生,通常中枢神经系统内含量很低,只有在癫痫发作时,血脑屏障遭到破坏,TNF通过进入脑内,同时异常放电的神经元及其周围神经胶质细胞也增加TNF的合成和分泌。Kim等[11]通过对动物模型研究发现,大鼠发生癫痫持续状态(SE)后,神经胶质细胞经TNF-α活性明显增强,推测由TNF-α介导的 p65-Thr 485 NF-κB 磷酸化与SE引起的血管性水肿有关。对慢性癫痫患者的研究也表明,脑内的神经胶质细胞可出现反复增生和激活,提示其可能是内源性致痫物[12]。
炎症反应可能与疾病的严重程度有关[13]。赵卫海等[14]通过对53例急性颅脑损伤患者的研究发现,急性颅脑损伤患者血清TNF-α、IL-1等早期即有升高,伤后第3天达到高峰,第7天开始下降。血清TNF-α、IL-1等含量在各个时间点重度组高于中度组,中度组高于轻度组及对照组。且重型颅脑损伤组在病程第1、3、7天血清TNF-α、IL-1等水平较轻、中型组显著升高,证实血清TNF-α、IL-1等水平与急性颅脑损伤的严重程度呈正相关。刘国军等[15]对40例脑外伤性癫痫患者外周血中TNF-α、IL-1β等水平进行检测后发现,观察组在第0.5~11天各时间点TNF-α、IL-1β等水平均高于对照组,于第3~5天达最高峰,第14天基本恢复到正常,在第3天时,观察组重型脑外伤患者的TNF-α、IL-1β水平高于中型患者,且早期癫痫发作率高于中型者。国外相关研究也表明:脑外伤致脑功能受损患者IL-1β、TNF-α等炎性细胞因子水平升高程度与其预后有关[16]。以上表明:外周细胞因子的水平与脑损害程度有密切关系。
脑电图是将脑部神经元的自发性生物电活动借助电子技术加以放大百万倍并记录于屏幕或图纸上,是目前监测脑功能较为敏感的指标,可以对癫痫或脑内重大病变提供极有价值的信息。脑电图表现异常程度反映了癫痫患者发作后中枢神经系统功能损害程度。李欣等[17]研究发现,老年癫痫患者发作后1、24 h的脑电图及血清TNF-α等细胞因子及脑电图异常率均明显增高;脑电图异常癫痫患者血清TNF-α等因子表达水平均明显高于脑电图正常癫痫患者,且随着脑电图检测结果加重,血清TNF-α表达水平呈明显加重趋势,两者呈正相关性关系。郑艳等[18]通过对61例50岁以上中老年癫痫患者的研究发现,发作后脑电图检查异常癫痫患者的血清IL-1β及TNF-α在癫痫患者体内呈高表达,并且与脑电图检查结果异常呈正相关,IL-1β及 TNF-α可作为脑电图检查的辅助诊断指标。
本研究显示,癫痫组发作近期血清IL-1β、TNF-α水平均明显高于对照组,癫痫近期发作脑电图中、重度患者外周血中TNF-α、IL-1β测定浓度明显增高,且增高水平与脑电图异常呈正相关,表明IL-1β、TNF-α在癫痫发生机制中有着重要的作用。
[1] Dubey D, Farzal Z, Hays R, et al. Evaluation of positive and negative predictors of seizure outcomes among patients with immune-mediated epilepsy: a meta-analysis[J]. Ther Adv Neurol Disord, 2016,9(5):369-77.
[2] Idro R, Opar B, Wamala J, et al. Is nodding syndrome an Onchocerca volvulus -induced neuroinflammatory disorder? Uganda's story of research in understanding the disease[J]. Int J Infect Dis, 2016,45:112-117
[3] Devinsky O, Schein A, Najjar S. Epilepsy associated with systemic autoimmune disorders[J]. Epilepsy Curr, 2013,13(2):62-68.
[4] Webster KM, Sun M, Crack P, et al. Inflammation in epileptogenesis after traumatic brain injury[J]. J Neuroinflammation, 2017,14(1): 10.
[5] Gorter JA, van Vliet EA, Aronica E. Status epilepticus, blood-brain barrier disruption, inflammation, and epileptogenesis[J]. Epilepsy Behav, 2015,49:13-16.
[6] Omran A, Peng J, Zhang C, et al. Interleukin-1β and microRNA-146a in an immature rat model and children with mesial temporal lobe epilepsy[J].Epilepsia, 2012,53(7):1215-1224.
[7] Choi J, Min HJ, Shin JS. Increased levels of HMGB1 and pro-inflammatory cytokines in children with febrile seizures[J]. J Neuroinflammation, 2011,8(1):135.
[8] Haginoya K, Noguchi R, Zhao Y, et al. Reduced levels of interleukin-1 receptor antagonist in the cerebrospinal fluid in patients with West syndrome[J]. Epilepsy Res, 2009,85(2-3):314-317.
[9] Uludag IF, Duksal T, Tiftikcioglu BI, et al. IL-1β, IL-6 and IL1Ra levels in temporal lobe epilepsy[J]. Seizure, 2015, 26: 22-25.
[10] Ziebell JM, Morganti-Kossmann MC. Involvement of pro-and anti-inflammatory cytokines and chemokines in the pathophysiology of traumatic brain injury[J]. Neurotherapeutics, 2010,7(1): 22-30.
[11] Kim JE, Ryu HJ, Choi SY, et al. Tumor necrosisfactor-α-mediated threonine 435 phosphorylation of p65 nuclear factor-κB subunit in endothelial cells induces vasogenic edema and neutrophil infiltration in the rat piriform cortex following status epilepticus[J]. J Neuroinflammation, 2012,12(9):6.
[12] Prasad R, Srivastava R, Mishra OP, et al. Cerebrospinal Fluid TNF-α, IL-6, and IL-8 in Children With Bacterial Meningitis[J]. Pediatr Neurol, 2014,50(1):60-65.
[13] Ashhab MU, Omran A, Kong H, et al. Expressions of Tumor Necrosis Factor Alpha and MicroRNA-155 in Immature Rat Model of Status Epilepticus and Children with Mesial Temporal Lobe Epilepsy[J]. J Mol Neurosci, 2013,51(3):950-958.
[14] 赵卫海, 海陈炼, 余国栋. 血清TNF-αIL-1 IL-6 IL-8在急性颅脑损伤后含量变化及意义[J].中国实用神经疾病杂志,2013,16(16):22-23.
[15] 刘国军,黄建敏,李雪斌,等.炎性细胞因子、C反应蛋白在脑外伤性癫痫中的变化及意义[J].山东医药, 2012, 52(9):39-40.
[16] Abdul-Muneer PM, Chandra N, Haorah J. Interactions of oxidative stress and neurovascular inflammation in the pathogenesis of traumatic brain injury[J]. Mol Neurobiol, 2015,51(3):966-979.
[17] 李欣,曹祥,汪麟,等.老年癫痫患者脑电图检查与血清细胞因子水平的相关性[J].中国老年学杂志, 2015,35(11):3055-3056.
[18] 郑艳, 陈岚, 余倩. 癫痫患者血清白细胞介素-1β 及肿瘤坏死因子-α表达及其与脑电图的关系[J]. 中国老年学杂志,2017,37(5):1217-1219.
10.3969/j.issn.1002-266X.2017.33.031
R741.044
B
1002-266X(2017)33-0090-03
2017-05-29)

