机器人辅助前列腺癌根治术治疗复杂前列腺癌的难点及技巧分析
武鹏 秦卫军 张龙龙 孟平 王延柱 杨晓剑 袁建林
1第四军医大学西京医院泌尿外科 710032 西安
机器人辅助前列腺癌根治术治疗复杂前列腺癌的难点及技巧分析
武鹏1秦卫军1张龙龙1孟平1王延柱1杨晓剑1袁建林1
1第四军医大学西京医院泌尿外科 710032 西安
目的探讨机器人辅助前列腺癌根治术(RALP)治疗复杂前列腺癌的难点及手术技巧,提高复杂前列腺癌的手术疗效及安全性。方法回顾性分析2013年1月~2017年2月应用机器人行根治性前列腺切除术治疗复杂情况前列腺癌126例患者临床资料,其中新辅助内分泌治疗48例(38.1%),TURP或开放前列腺术后33例(26.2%),大体积前列腺癌29例(前列腺癌体积≥100 ml)(23.0%),中叶明显突向膀胱16例(12.7%)。手术方式均采用经腹膜内入路机器人辅助前列腺癌根治术,高危患者同时行盆腔淋巴结清扫。结果126例患者均顺利完成手术,无中转开放、直肠损伤及输血病例。平均手术时间为136 min(86~191 min),术中平均出血量95 ml(45~330 ml),术后平均住院时间7.8 d(5~12 d)。术后病理切缘阳性15例(11.9%);淋巴结阳性7例(5.6%)。术后漏尿3例;淋巴瘘5例,术后1~3周停止。1例吻合口狭窄,经尿道扩张后排尿通畅。平均随访26个月(3~46个月),1年内控尿满意109例(86.5%)。术后生化复发9例(7.1%)。结论机器人辅助根治性前列腺切除术可治疗复杂前列腺癌,但难度相对较大,通过合理的技术优化,可以明显降低手术难度。
前列腺癌;复杂情况前列腺癌;机器人辅助前列腺切除术
随着我国社会老龄化及前列腺癌筛查的开展,前列腺癌的发病率呈逐年上升趋势。2017年中国肿瘤登记年报数据显示[1],前列腺癌是我国男性癌症发病率第6位的恶性肿瘤。从小城市到大城市,发病增加趋势明显,大城市的发病率达到20/10万左右。根据中国前列腺癌联盟(CPCC)的统计,我国前列腺癌患者具有确诊时年龄大、PSA水平高、晚期患者比例高的特点[2]。由于我国不同地域社会经济及医疗条件发展不均衡,尤其在西部及偏远地区,这种情况更加普遍。因此中国泌尿外科医生面对更多的复杂前列腺癌患者,包括新辅助内分泌治疗后、经尿道前列腺电切术(transurethral electroresection of prostate, TURP)或开放前列腺术后、大体积前列腺癌、前列腺中叶突出的患者,临床上对这些患者的治疗是一个巨大的挑战。我院自2013年引入达芬奇机器人手术系统,对复杂前列腺癌患者进行机器人辅助前列腺癌根治术(robot-assisted laparoscopic radical prostatectomy, RALP)126例,效果满意,现报告如下,以总结复杂前列腺癌的手术技巧及经验。
1 资料与方法
1.1临床资料
本组患者126例,平均年龄(68.5±10.2)岁。术前均经直肠前列腺系统穿刺活检或前列腺切除标本病理诊断为前列腺腺癌。所有患者术前行前列腺特异性抗原(prostate specific antigen, PSA)测定,直肠指诊、前列腺B超、MRI或CT、骨扫描等检查。其中术前进行新辅助内分泌治疗48例(38.1%),TURP或开放前列腺术后33例(26.2%),大体积前列腺癌29例(前列腺癌体积≥100 ml)(23.0%),中叶明显突向膀胱16例(12.7%)。大体积前列腺癌是指经过影像学手段测定前列腺的体型较大,目前尚无统一标准。前列腺体积增大会明显提高手术难度,根据本中心的手术经验,筛选体积大于100 ml作为大体积前列腺癌的判断标准。Chia等[3]将膀胱内前列腺突入程度分为三级:Ⅰ级突入膀胱<5 mm,Ⅱ级突入5~10 mm,Ⅲ级突入>10 mm。研究将Ⅲ级突入程度定义为前列腺中叶明显突向膀胱的纳入标准。术前行膀胱镜检查,观察测量中叶突入膀胱腺体的顶端至膀胱基底部前列腺的垂直距离。穿刺Gleason评分≤6分35例(27.8%),3+4分29例(23.1%),4+3分24例(19.0%),≥8分38例(30.1%)。总前列腺特异性抗原(total prostate specific antigen, tPSA)<4 μg/L者9例(7.1%),4~<10 μg/L者27例(21.4%),10~<20 μg/L者43例(34.2%),≥20 μg/L者47例(37.3%)。TURP或开放前列腺术后均超过3个月。所有患者术前尿控功能良好。
1.2手术方法
气管插管全身麻醉,头低脚高仰卧位(倾斜角度约30°),膝关节稍屈曲,髋关节外展。建立通道及连接机械臂:于脐上1 cm纵行切开1.5 cm皮肤,建立气腹,置入12 mm Trocar,作为镜头孔。直视下于脐平面距镜头孔右侧、左侧各8 cm作切口1 cm,分别置入8 mm Trocar,作为1和2臂通道,于1臂右下方8 cm置入Trocar作为3臂通道,分别连接机械臂及镜头。取2臂外下方8 cm处置入12 mm Trocar作为辅助孔。
手术过程如下,①盆腹膜切开:于盆腔顶部倒U形切开盆腹膜,进入Retzius间隙;②清理腹膜外脂肪:将前列腺表面的脂肪组织清理干净,显露盆内筋膜;③盆内筋膜切开:反向牵拉前列腺,使盆内筋膜具有一定张力,由前列腺两侧向耻骨前列腺韧带切开,部分切断耻骨前列腺韧带,暴露背血管复合体(dorsal vessel complex, DVC);④缝扎DVC:2-0可吸收线缝扎DVC后,将缝线悬吊于耻骨联合处。⑤膀胱颈口切开:牵拉尿管,准确寻找前列腺与膀胱颈交界处,切开膀胱颈前壁,后退导尿管,辨认双侧输尿管口。对于中叶明显突向膀胱者,紧贴前列腺中叶分离膀胱颈后唇。输尿管口离膀胱颈口较近,行输尿管插管置入进行标记,离断膀胱颈后壁;⑥前列腺后方精囊及输精管分离:大体积前列腺不易抬起,可采用两侧向中间靠拢方法,由易于游离的侧方逐渐向中央游离,依次切断双侧输精管;⑦狄氏筋膜的分离:充分应用3臂提起精囊腺,两侧交替逐步向前列腺后方钝性分离,直至前列腺尖部。前列腺侧蒂先上Hem-o-lok依次加闭,再剪刀切断,注意保护神经血管束(neurovascular bundle, NVB);⑧前列腺尖部分离:切断DVC,翻转前列腺显露尿道及侧方,充分游离,与前列腺后方分离平面汇合;⑨膀胱颈口尿道重建:吻合前将膀胱后壁狄氏筋膜扇形缝合重建,降低吻合张力。若膀胱颈口过大,2-0可吸收线于后壁或侧壁连续缝合缩窄颈口。膀胱尿道缝合采用单针或双针倒刺线连续缝合,缝合完毕后进行膀胱前壁悬吊,将膀胱前壁组织与耻骨前列腺韧带固定加强。术前评估高危患者行扩大盆腔淋巴结清扫。
1.3随访
术后半年每月复查1次PSA,每2~3个月随访1次,2年后每3个月进行一次PSA和直肠指诊检查,必要时复查骨扫描及盆腔MRI。尿控标准:站立或行走无遗尿,每天使用尿垫少于1块。将PSA水平连续2次≥0.2 μg/L定义为生化复发。随访内容包括PSA及患者尿控情况。高危前列腺癌患者常规行12~18个月辅助雄激素剥夺治疗(androgen deprivation therapy, ADT)。
2 结果
126例患者均顺利完成手术,无中转开放、直肠损伤及输血病例。平均手术时间为136 min(86~191 min),术中平均出血量为95 ml(45~330 ml)(表1)。术后平均住院时间为7.8 d(5~12 d),患者于术后2~3周拔出尿管。术后病理切缘阳性15例(11.9%),淋巴结阳性7例(5.6%)。病理分期T2a期21例(16.7%),T2b期31例(24.6%),T2c期36例(28.6%),T3a期14例(11.1%),T3b期19例(15.1%),T4期5例(3.9%),其中76例(60.3%)术后采取放疗或内分泌辅助治疗。术后发生短期漏尿3例(开放前列腺术后、大体积前列腺癌和中叶明显突向膀胱组各1例),延长尿管留置时间,尿漏恢复。淋巴瘘5例(新辅助内分泌治疗组3例,TURP术后组和大体积前列腺癌组各1例),保证充分引流,术后1~3周停止。1例吻合口狭窄(TURP术后组),经尿道扩张后排尿通畅。平均随访26个月(3~46个月),1年内控尿满意109例(86.5%)。术后生化复发9例(7.1%),平均复发时间28个月(16~41个月),采用放疗结合内分泌治疗1~3个疗程。
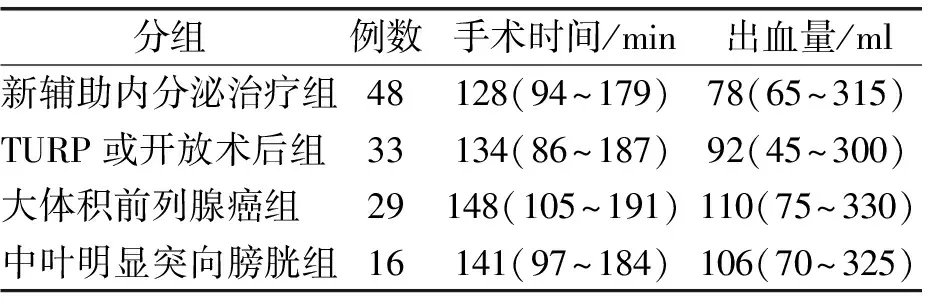
表1 126例患者手术时间及出血量比较
3 讨论
随着机器人技术的发展,前列腺癌根治性手术取得了巨大的进步,手术适应证也在不断拓展[4]。但是对于一些复杂前列腺癌,由于其不同的解剖特点或干预方式,根治性前列腺切除术仍然有很大的技术难度。对这类患者需要优化手术技巧,达到彻底切除肿瘤、保证切缘阴性,同时进行功能重建,恢复尿控及良好保留性功能的目的。
对于这些复杂前列腺癌,主要难点体现在:①空间狭窄。Retzius间隙狭小,耻骨前列腺韧带相对较宽,一次缝扎DVC困难。处理前列腺尖部时,前列腺难以旋转,影响保留功能尿道长度。②容易损伤输尿管口及直肠。输尿管口位置靠近膀胱颈口,切开膀胱颈后唇时易损伤输尿管口。牵拉前列腺活动度小,游离前列腺直肠间隙时损伤直肠。③吻合困难。膀胱尿道管腔直径差距大,无法直接吻合,需行膀胱颈口重建;切除前列腺时膀胱颈部缺损过大,吻合张力大,解剖对位困难[5~7]。根据上述特点,需进行充分术前评估:①术前行直肠指诊、前列腺超声及盆腔MRI平扫+弥散,测定前列腺体积,评估骨盆与前列腺比例,判断手术难易程度;②行膀胱镜检查,观察前列腺中叶是否突出,输尿管口距离;③大体积前列腺癌必要时先行新辅助内分泌治疗,缩小前列腺体积。DVC的处理技巧:①充分应用3臂辅助,将前列腺推向对侧,利于显露;②缝扎时使用0号针,弧度尽量平直。大体积前列腺癌,膀胱颈口留取往往较大,切开时应注意:①寻找前列腺-膀胱正常间隙,保证切缘阴性;②中叶突向膀胱者紧贴前列腺中叶的下缘离断膀胱后唇,便于寻找精囊腺;③辨别输尿管口位置,避免损伤输尿管口,术中可行输尿管插管置入进行标记。由于耻骨后空间狭小,从正中直接抬起前列腺困难,前列腺后壁的处理可以采取侧方入路:优先处理显露相对容易的侧方,离断膀胱和前列腺交界处,逐渐向正中游离,再处理对侧,最后在正中汇合。此类患者吻合前均需要进行膀胱颈口重建,平均手术时间为136 min,较常规RALP手术时间稍延长。
TURP或开放前列腺摘除术后造成前列腺周围炎症反应和纤维化粘连、膀胱颈与前列腺分界不清、膀胱颈部黏膜僵硬及瘢痕化[8, 9]。本组患者均在3个月后再行RALP,减少前列腺周围炎症反应对手术的影响。目前开展的RALP大多数以前入路顺行切除方式为主[10],2010年Galfano等[11]首先报道了主要针对局限性前列腺癌的完全后入路技术,优势在于尿控及性神经的保护。针对此类患者的手术难点,我们设计采取后入路联合前入路技术(Monstouris技术),首先进入前列腺后方打开壁层腹膜,迅速寻找并处理输精管、精囊,分离狄氏筋膜至前列腺尖部,再转回前入路行前列腺顺行切除[12]。此种方法的优点是在TURP术后周围粘连的情况下,准确快速的寻找精囊及输精管,不易损伤直肠,并能缩短手术时间。根据患者体型的差异,术中选择不同方式寻找及分离精囊输精管。体型较瘦患者,在膀胱直肠之间的最下方腹膜反折处寻找两个弓状线,上方的弓状线是两条输尿管壁间段形成的隆起,术中注意防止损伤。下方的弓状线是输精管隆起形成,精囊分别在左右输精管的外下侧。体型肥胖患者,选择在内环口下方先找到输精管,游离切断后,可牵拉输精管远端暴露精囊。新的解剖研究显示狄氏筋膜与前列腺基底水平融合,需要锐性分离[13]。紧靠输精管壶腹部和精囊横向切开狄氏筋膜,可见到直肠前脂肪。在这个脂肪层钝性分离,使前列腺背侧与直肠间安全分离。熟练的吻合技术是保证术后尿控及防止尿漏的关键因素,本组患者采用单针或双针2-0线连续缝合,后壁处作加强处理,膀胱置入F20三腔尿管,缝合完毕后注水100 ml观察吻合口有无漏尿。国外文献报道,RALP术后尿漏平均发生率为1.8%[14]。本组3例(2.4%)患者出现尿漏,与文献报道类似。漏尿患者通过延长导尿管留置时间及加强引流、控制感染,均取得满意效果。
长时间的内分泌治疗使前列腺过度萎缩,体积明显缩小;周围边界模糊失去正常的解剖层次,粘连加重,并且增加了保留NVB的难度。分离NVB时尽量采取钝性分离结合剪刀切开前列腺侧蒂,使用Hem-o-lok夹闭止血的方法,避免使用超声刀或双极电凝造成过多热损伤。如NVB剥离出血较多,使用0号可吸收线缝合止血。针对术前MRI提示NVB受肿瘤侵犯或高龄无性功能要求的患者,我们在分离神经血管束时多采用“经筋膜”或“筋膜外”技术整块切除,避免切缘阳性,保证肿瘤组织的彻底切除。对于高危患者,同时进行扩大盆腔淋巴结清扫。本组7例(5.6%)淋巴结阳性的患者术后行即刻内分泌治疗,合并淋巴瘘者,待淋巴瘘停止后再开始内分泌治疗。
文献报道,病理分期和肿瘤体积占前列腺体积的百分比是手术切缘阳性的独立预测因子,而与选用的手术方式无明显相关性[15]。多项研究显示开放、腹腔镜及机器人方式治疗高危前列腺癌患者的切缘阳性率差异无统计学意义[16~18]。由于达芬奇机器人手术系统自身的优势及手术经验的积累,本组无一例输血病例,切缘阳性及直肠损伤等并发症发生率无明显增加。高危前列腺癌患者术后常规行持续ADT治疗12~18个月。
复杂前列腺癌根治术后尿失禁的原因较多,如尿道括约肌损伤、膀胱颈挛缩、支配尿道括约肌神经损伤、低顺应性膀胱等。如何最大限度减少术后尿失禁的发生一直是前列腺癌根治术的难点[19]。Costello教授在2017 AUA年会上回顾了影响前列腺癌根治手术尿控的因素:患者年龄、是否术前接受过放疗(放疗后的挽救性手术)、盆底功能锻炼、手术经验以及前列腺尖部的处理。张旭教授总结了完整保留盆底结构、膀胱颈及前列腺尖部的保留改善术后尿控的关键技巧[20]。传统观点认为膜部尿道保留长度为0.5~1.0 cm,根据肿瘤的部位、患者的尿道条件及尖部粘连的程度来决定保留尿道的长度。本组患者常规在膀胱尿道吻合前行狄氏筋膜重建,不仅使膀胱颈口与尿道之间张力减低,也使得吻合更为容易。对患者早期尿控的恢复起到了重要作用,避免了严重尿失禁的发生。尤其在大体积前列腺癌患者中,恢复了尿道床后正中嵴“双吊带”作用,促进尿道闭合,有助于RALP术后早期控尿恢复。最新的前列腺解剖研究显示尿道括约肌受前列腺尖部形状的影响[13]。一些患者的阴部神经可能距离前列腺尖部仅3~5 mm,损伤神经可能会影响患者的尿控。大多数观点认为保留神经血管束可以改善患者的尿控,可能是由于保留神经血管束使得前列腺尖部的周围组织保留更好,同时减少了尿控支配神经(阴部神经)损伤的概率[21]。我们在手术细节上注意在分离尖部时保留横纹肌;膀胱尿道吻合口必须无张力并且柔软,重建膀胱颈使颈口大小适当,黏膜对合精确、解剖复位;膀胱前壁悬吊以及术后拔除尿管后鼓励患者进行盆底肌肉锻炼。
综上所述,复杂前列腺癌患者接受RALP技术上可行,通过一系列技术优化,在肿瘤控制及尿控方面效果满意,围手术期并发症无显著增加,但远期效果尚需进一步观察。随着手术不断精准化和前列腺癌全程治疗理念的推广,复杂前列腺癌临床治疗效果会进一步提高。
[1] Chen W, Zheng R, Zhang S, et al. Cancer incidence and mortality in China, 2013. Cancer Lett, 2017,401(10):63-71.
[2] Chen R, Sjoberg DD, Huang Y, et al. Prostate specific antigen and prostate cancer in Chinese men undergoing initial prostate biopsies compared with western cohorts. J Urol, 2017,197(1):90-96.
[3] Chia SJ, Heng CT, Chan SP, et al. Correlation of intravesical prostatic protrusion with bladder outlet obstruction. BJU Int, 2003,91(4):371-374.
[4] Heidenreich A, Pfister D, Porres D. Cytoreductive radical prostatectomy in patients with prostate cancer and low volume skeletal metastases: results of a feasibility and case-control study. J Urol, 2015,193(3):832-838.
[5] 王海峰,杨波,高旭,等.机器人前列腺癌根治术治疗大体积前列腺癌的难点与技巧分析.临床泌尿外科杂志,2014,29(4):281-286.
[6] El-Hakim A, Leung RA, Richstone L, et al. Athermal robotic technique of prostatectomy in patients with large prostate glands (>75 g): technique and initial results. BJU Int, 2006,98(1):47-49.
[7] Singh A, Fagin R, Shah G, et al. Impact of prostate size and body mass index on perioperative morbidity after laparoscopic radical prostatectomy. J Urol, 2005,173(2):552-554.
[8] 刘茁,孟一森,张骞,等.经尿道前列腺电切术后的三孔法腹腔镜下根治性前列腺切除术临床分析.中华泌尿外科杂志,2016,37(8):628-629.
[9] Menard J, De La Taille A, Hoznek A, et al. Laparoscopic radical prostatectomy after transurethral resection of the prostate: surgical and functional outcomes. Urology, 2008,72(3):593-597.
[10] Porpiglia F, Bertolo R, Manfredi M, et al. Total anatomical Reconstruction during robot-assisted radical prostatectomy: implications on early recovery of urinary continence. Eur Urol, 2016,69(3):485-495.
[11] Galfano A, Ascione A, Grimaldi S, et al. A new anatomic approach for robot-assisted laparoscopic prostatectomy: a feasibility study for completely intrafascial surgery. Eur Urol, 2010,58(3):457-461.
[12] Guillonneau B, Vallancien G. Laparoscopic radical prostatectomy: the Montsouris technique. J Urol, 2000,163(6):1643-1649.
[13] Walz J, Epstein JI, Ganzer R, et al. A critical analysis of the current knowledge of surgical anatomy of the prostate related to optimisation of cancer control and preservation of continence and erection in candidates for radical prostatectomy: an update. Eur Urol, 2016,70(2):301-311.
[14] Novara G, Ficarra V, Rosen RC, et al. Systematic review and meta-analysis of perioperative outcomes and complications after robot-assisted radical prostatectomy. Eur Urol, 2012,62(3):431-452.
[15] Kang SG, Schatloff O, Haidar AM, et al. Overall rate, location, and predictive factors for positive surgical margins after robot-assisted laparoscopic radical prostatectomy for high-risk prostate cancer. Asian J Androl, 2015,18(1):123-128.
[16] Lee D, Choi SK, Park J, et al. Comparative analysis of oncologic outcomes for open vs. robot-assisted radical prostatectomy in high-risk prostate cancer. Korean J Urol, 2015,56(8):572-579.
[17] Punnen S, Meng MV, Cooperberg MR, et al. How does robot-assisted radical prostatectomy (RARP) compare with open surgery in men with high-risk prostate cancer? BJU Int, 2013,112(4):E314-E320.
[18] Harty NJ, Kozinn SI, Canes D, et al. Comparison of positive surgical margin rates in high risk prostate cancer: open versus minimally invasive radical prostatectomy. Int Braz J Urol, 2013,39(5):639-646; discussion 647-648.
[19] Ficarra V, Cavalleri S, Novara G, et al. Evidence from robot-assisted laparoscopic radical prostatectomy: a systematic review. Eur Urol, 2007,51(1):45-55; discussion 56.
[20] 艾青,李宏召,马鑫,等.机器人辅助腹腔镜前列腺根治性切除术中尿控和性功能保留的关键手术技巧.微创泌尿外科杂志,2017,6(1):59-61.
[21] Patel VR, Palmer KJ, Coughlin G, et al. Robot-assisted laparoscopic radical prostatectomy: perioperative outcomes of 1500 cases. J Endourol, 2008,22(10):2299-2305.
Difficultiesandoperativeskillsinrobot-assistedlaparoscopicradicalprostatectomyforcomplicatedprostatecancer
WuPeng1QinWeijun1ZhangLonglong1MengPing1WangYanzhu1YangXiaojian1YuanJianlin1
(1Department of Urology, Xijing Hospital, Fourth Military Medical University, Xi'an 710032, China)
Yuan Jianlin, jianliny@fmmu.edu.cn
Objective: To discuss the operative difficulties and skills in robot-assisted laparoscopic radical prostatectomy (RALP) in the management of complicated prostate cancer so as to improve the operation technique.MethodsThe clinical data of 126 cases of complicated prostate cancer receiving RALP from January 2013 to February 2017 in our department were collected and retrospectively analyzed, in which 48 cases received endocrine therapy (38.1%), there were 33 cases after TURP or open prostatectomy (26.2%), 29 cases of large volume prostate cancer (the volume of prostate ≥100 mL) (23.0%), 16 cases (12.7%) of middle lobe of prostate protruding into bladder. Pelvic lymphadenectomy was performed at the same time for high-risk prostate cancer.ResultsAll the 126 cases were operated successfully and there was no open conversion, no rectal injury and no blood transfusion. The average blood loss was 95 mL (range, 45-330 mL). Average operative time was 136 min (86-191 min), and the average postoperative hospital stay was 7.8 d (5-12 d). The pathological margin was positive in 15 cases (11.9%), and lymph nodes were positive in 7 cases (5.6%). The urine leak occurred in 3 cases, and lymphatic leak in 5 cases, which were cured 1-3 weeks after operation. Anastomotic stricture occurred in one case. After urethral dilatation, the urine was unobstructed. The patients were followed up for 26 (3-46) months after RALP. The continence rate was 86.5% within 1 year. Biochemical recurrence rate was 7.1%.ConclusionsRALP is a safe and efficacious surgical modality in the management of complicated prostate cancer. Through reasonable technical optimization, the operation difficulty can be obviously reduced.
prostate cancer; complicated prostate cancer; robot-assisted laparoscopic radical prostatectomy
R737.25
A
袁建林,jianliny@fmmu.edu.cn
2017-06-19
10.19558/j.cnki.10-1020/r.2017.05.003

