迷走神经电刺激对脑外伤昏迷大鼠意识及前额叶皮质γ-氨基丁酸b1受体表达的影响①
廖诚诚,冯珍,黄菲菲,陈琴
迷走神经电刺激对脑外伤昏迷大鼠意识及前额叶皮质γ-氨基丁酸b1受体表达的影响①
廖诚诚,冯珍,黄菲菲,陈琴
目的 研究迷走神经电刺激(VNS)对脑外伤(TBI)昏迷大鼠的促醒效果及其机制。方法 168只健康Sprague-Dawley大鼠随机分为空白组、TBI组、拮抗剂组和VNS组,每组42只。空白组不做任何处理,TBI组、VNS组、拮抗剂组撞击法复制脑外伤模型,造模后昏迷至少30 min的大鼠入选。VNS组予VNS,拮抗剂组侧脑室注射Orexin A受体1拮抗剂SB334867后加VNS,TBI组予假VNS。分别于干预后6 h、12 h、24 h观察大鼠意识水平,应用免疫组化、Western blotting检测前额叶皮质γ-氨基丁酸b1受体(GABAb1R)表达水平。结果 最终空白组42只、TBI组11只、拮抗剂组13只、VNS组28只大鼠觉醒。Western blotting显示,干预后12 h、24 h,GABAb1R蛋白表达TBI组>拮抗剂组>空白组>VNS组(F>60.412,P<0.001)。免疫组化显示,GABAb1R蛋白表达TBI组>拮抗剂组>VNS组>空白组(H=15.121,P=0.002),但不同时间点无显著性差异(H=3.028,P=0.220)。结论 VNS可促TBI昏迷大鼠觉醒,其促醒机制可能与OrexinA介导大鼠前额叶皮质GABAb1R表达水平下调有关。
脑外伤;昏迷;迷走神经电刺激;促醒;γ-氨基丁酸b1受体;大鼠
脑外伤(traumatic brain injury,TBI)昏迷是世界范围内的重大健康与社会问题,更对患者本人及家庭造成巨大的经济负担[1]。TBI住院患者中,约15%出院时仍处昏迷状态[2]。
目前,临床上用于TBI昏迷促醒的神经刺激方法包括经颅直流电刺激、经颅磁刺激、颈部脊髓硬膜外刺激、正中神经电刺激和深部脑刺激等[3-4],但效果不明显或副作用大。近年来,迷走神经电刺激(vagus nerve stimulation,VNS)被认为具备促醒潜能[5-6]。
VNS是将电极缠绕在左侧颈部迷走神经上,通过脉冲发生器产生电流,刺激迷走神经,直接调节皮层重要区域的功能。VNS被应用于许多神经精神疾病,特别是癫痫;VNS还可用于改善心功能、认知功能,调节情绪等[7]。
γ-氨基丁酸 b1 受体(γ-aminobutyric acid b1 receptor,GABAb1R)与意识抑制状态密切相关[8-9],Orexin A则在睡眠-觉醒状态转变中发挥关键作用[10]。
本研究观察VNS对TBI昏迷的促醒作用,同时探究前额叶皮质GABAb1R及Orexin A是否参与VNS促醒机制。
1 材料和方法
1.1 实验动物及分组
无特定病源体健康Sprague-Dawley大鼠168只,雌雄不限,体质量250~300 g,由南昌大学动物科学部提供。室温控制在23℃,自然光照,常规饲养,大鼠自由进食饮水。
大鼠编号001~168,利用随机数字表分为4组,每组42只。空白组不做任何处理,TBI组造模后予假VNS处理,VNS组造模后予VNS,拮抗剂组造模后侧脑室注射Orexin A受体1(Orexin A receptor 1,OXR1)拮抗剂SB334867并予VNS。若实验过程中大鼠死亡,则选择新大鼠补充后继续实验。
大鼠饲养及实验遵守本地实验动物管理委员会相关规定。
1.2 主要仪器及试剂
ZS-BS脑立体定位仪:北京众实迪创科技发展有限公司。ES-420电刺激仪:日本伊藤超短波株式会社。RM2015切片机:LEICA公司。5804-R低温高速离心机:EPPENDOF公司。ChemiDocTMMP Bio-Rad凝胶成像系统:北京博雅创新科技发展有限公司。CWB10组织蛋白抽提试剂盒:北京康为世纪生物科技有限公司。抗GABAb1R抗体(ab131417)、免疫组化用兔抗GABAb1R抗体(ab75239):ABCAM有限公司。抗β-actin单克隆抗体(TA-09)、山羊抗大鼠IgG(ZB-2305)、山羊抗兔IgG(ZB-2301)及相关二抗:北京中杉金桥生物技术有限公司。SB334867:北京华夏远洋科技有限公司。Pro-light HRP化学发光检测试剂、化学发光底物:天根生化科技有限公司。
1.3 造模
采用自由落体撞击法构建TBI动物模型[11]。大鼠置玻璃标本缸内,注入乙醚1~2 ml,1~1.5 min后,大鼠出现软瘫,晃动标本缸大鼠无反应但有呼吸时,立即取出,麻醉成功。头顶部备皮消毒,切开并分离头顶部皮肤、骨膜,暴露顶骨;以颅顶冠状缝与人字缝交点为中点,固定一铁制圆板。待Sprague-Dawley大鼠恢复后爪疼痛刺激反射时,将直径10 mm、质量400 g圆柱形金属撞击锤从40~44 cm高度沿垂直金属杆自由下落,撞击铁质圆盘上。下落高度依据大鼠体质量整,金属杆每隔1 cm开口,以减少下落时管内空气阻力。30 min后根据大鼠的感觉、运动情况[12],将大鼠意识状态分6级:Ⅰ级,笼内正常活动;Ⅱ级,笼内活动减少;Ⅲ级,笼内活动减少,能站立但运动失调;Ⅳ级,翻正反射存在但不能站立;Ⅴ级,翻正反射消失,后爪疼痛反射存在;Ⅵ级,疼痛反射消失。大鼠Ⅴ级、Ⅵ级持续至少30 min被认为是昏迷状态。
1.4 侧脑室注射SB334867
拮抗剂组昏迷时间达30 min,即造模成功后,立即侧脑室注射。大鼠10%水合氯醛3 ml/kg腹腔注射麻醉,俯卧位,头部固定于脑立体定位仪上,头顶皮肤剃毛消毒。正中切口,长约1 cm。剥离颅骨上附属组织,清除颅骨表面血迹,暴露前囟,在前囟后1.0 mm、中线旁开1.5 mm,用牙科钻钻孔至硬脑膜,消毒针尖刺破硬脑膜,垂直插入约4.5 mm,微量注射器以2.5 μl/min速度注入 SB334867 溶液5 μl(SB334867粉末10 mg/kg溶于60∶40 DMSO中);留针2 min后拔针。缝合头皮,消毒后返笼。
1.5 VNS
拮抗剂组侧脑室注射完毕,VNS组与拮抗剂组大鼠同时开始VNS。大鼠仰卧位固定,清除颈毛。沿正中线在大鼠喉和胸骨之间开一个长2.5~4 cm切口,将胸骨舌骨肌与胸骨甲状肌用止血钳分离并固定;定位颈动脉鞘,固定颈部皮肤和肌肉,止血钳钝性分离左侧迷走神经3~4 cm。打开电刺激仪,将电极连接到左迷走神经。刺激参数:频率20 Hz,脉宽0.5 ms,电流1.0 mA,开30 s、关5 min,循环10次,刺激总时间5 min[13]。移除电极,消毒伤口,缝合,放回笼内。
TBI组行相同手术,但无电流输出。
1.6 观察指标
VNS结束后6 h、12 h、24 h再次评定大鼠意识状态,大鼠出现翻正反射定义为觉醒。评定意识状态后大鼠立即10%水合氯醛过量灌注处死。取前额叶皮质,每组选8只用于Western blotting检测,6只用于免疫组化检测。
1.6.1 Western blotting
冰面上分离前额叶皮质组织,蛋白抽屉试剂盒提取蛋白,分装于小管后置于液氮罐内备用。每个样本取等量蛋白加入装载有4×蛋白上样缓冲液的小管,蛋白质与缓冲液3∶1混合,沸水煮5 min;10%SDS凝胶分离蛋白质,转移到聚乙二烯二氟化物(PVDF)膜上;室温下用含5%牛奶的TBST溶液(150 mmol/L氯化钠150 ml、三羟甲基氨基甲烷盐酸20 ml、0.1%Tween 20 ml,pH=7.4)封闭4 h。加兔抗GABA bR1多克隆抗体(1∶500)、鼠抗ß-actin单克隆抗体4℃过夜。TBST洗膜3次,每次10 min。加相应二抗,室温1 h。TBST洗膜3次,每次10 min。加化学发光底物浸泡,使用分子成像仪量化条带蛋白。目的蛋白的灰度与ß-actin灰度的比值作为GABAbR1的表达量。
1.6.2 免疫组化
生理盐水100 ml灌注,4%多聚甲醛300~500 ml灌注至组织变硬。取出大脑,切成1.0×1.0×1.0 cm小块,4%多聚甲醛固定8 h,石蜡包埋,滑动切片机切成厚40µm薄片。脱蜡,3%H2O2室温浸泡抗原修复,山羊血清封闭,室温20 min。滴加兔抗GABAb1R抗体(1∶200),4℃孵育过夜;PBS漂洗,滴加生物素标记山羊抗兔IgG,室温孵育2 h,加辣根酶标记链霉卵白素30 min。加显色剂,苏木精复染1 min;清水冲洗,中性树胶封片,通风柜中晾干。400倍显微镜下拍照,计算免疫组化(IHC)评分。
评分标准:A代表阳性细胞数分级,0~1%=0、1% ~10%=1、 10% ~50%=2、 50% ~80%=3、 80% ~100%=4;B代表阳性细胞染色强度分级,0=阴性、1=弱阳性、2=阳性、3=强阳性;IHC=A×B[14]。阳性染色表现为棕色或棕褐色的着色膜。
1.7 统计学分析
采用SPSS 17.0统计软件进行数据处理。GABAb1R表达Western blotting结果满足方差齐性,数据以(xˉ±s)表示,行单因素方差分析;IHC评分以秩值表示,采用Kruskal-Wallis H秩和检验。显著性水平α=0.05。
2 结果
2.1 意识状态
空白组42只觉醒,TBI组大鼠11只觉醒,拮抗剂组13只觉醒,VNS组28只觉醒。
2.2 Western blotting
VNS后6 h,前额叶皮质GABAb1R表达水平拮抗剂组>TBI组>VNS组>空白组,各TBI组与空白组相比有显著性差异(P<0.05);VNS后12 h和24 h,TBI组>拮抗剂组>空白组>VNS组,各组与TBI组相比有显著性差异(P<0.05),拮抗剂组与VNS组相比有显著性差异(P<0.05)。见表1。
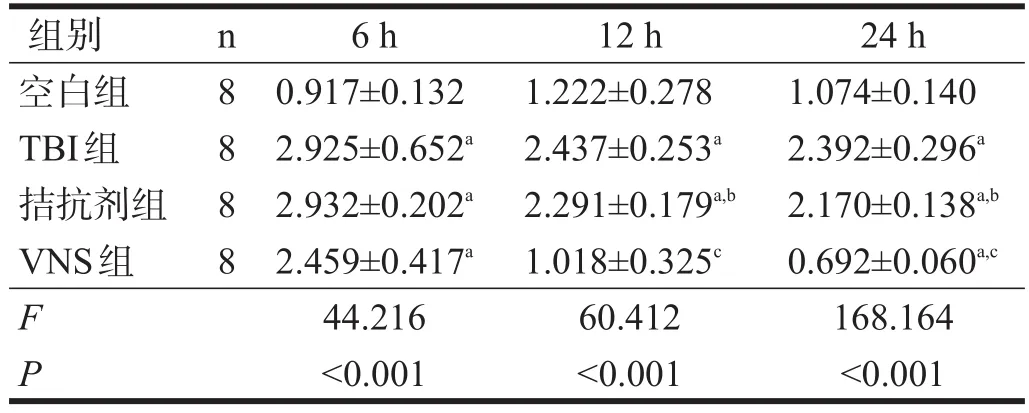
表1 Western blotting各组不同时间点GABAb1R的表达(相对表达量)
2.3 免疫组化
前额叶皮质GABAb1R分布于细胞膜和细胞间隙(图1),各组间GABAb1R表达比较有非常显著性差异(P<0.01)。见表2。但不同时间点间无显著性差异(P>0.05)。见表3。

表2 各组前额叶皮质GABAb1R表达
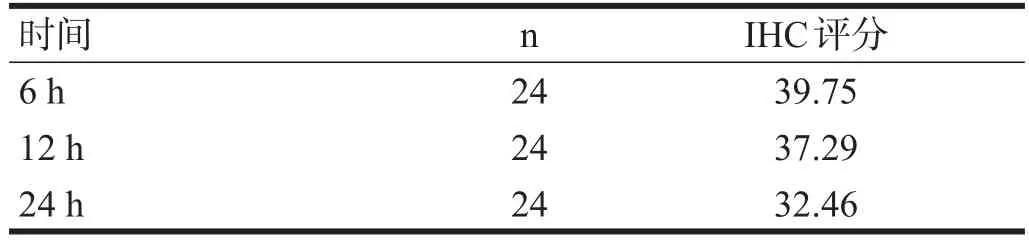
表3 不同时间点前额叶皮质GABAb1R表达

图1 前额叶皮质GABAb1R在不同组别和时间点的表达(免疫组化染色,400×)
3 讨论
迷走神经是混合型神经纤维,在中枢广泛投射,其传入纤维通过孤束核及其上行网状结构系统,到达下丘脑、杏仁核、海马,并弥散性投射至大脑皮质。该解剖特点可能是其治疗各类神经系统疾病的结构基础。
1997年,美国食品药品监督管理局批准VNS应用于治疗癫痫,2005年批准用于治疗抑郁。目前VNS也应用于治疗其他神经系统疾病,如焦虑、偏头痛、帕金森病和阿尔茨海默病[15-17]。Kumaria等[5]提出,VNS也可用于治疗TBI;动物实验证实VNS可改善TBI预后,增加大鼠认知及运动功能[18-20]。VNS对TBI动物可表现出抗水肿[21]、保护神经元、减少血脑屏障破坏[22]的效应,还可降低炎症坏死因子及增加脑血流[6,23]。在VNS在改善TBI后意识水平方面,仅有个别报道[6]。
本研究用动物实验探讨VNS对TBI昏迷的促醒作用及相关机制。电刺激参数参考Shi等[6]的参数;Smith等也用相同的VNS参数治疗TBI[24]。
研究发现,VNS有促醒效果,与董晓阳等[25]实验结果一致。VNS的促醒机理可能在于迷走神经在中枢神经系统投射广泛,包括控制觉醒的重要区域,如小脑、中缝背核、臂旁核、下丘脑、网状系统等[26-27],VNS通过激活这些区域促进昏迷大鼠觉醒;同时,VNS具有抗炎抗水肿作用[5],有利于大脑结构功能恢复,促进觉醒。
本研究发现,TBI后大鼠前额叶皮质GABAb1R表达上调,VNS干预后该GABAb1R下调,VNS的促醒作用可能与下调前额叶皮质GABAb1R表达有关。GABAbR广泛分布于哺乳动物中枢经系统[28],参与癫痫、焦虑、抑郁、伤害感、成瘾及睡眠等病理或生理过程[29-30];GABAbR还参与维持睡眠状态[8-9]。VNS下调这一抑制性递质受体,使中枢趋于活跃,有利于消除TBI后皮层抑制,促进觉醒。
我们前期研究发现,VNS的促醒与上调大鼠前额叶Orexin A有关。本研究显示,当大鼠Orexin A被阻断后,VNS下调GABAb1R作用减弱。Orexin A是下丘脑外侧区生成的小分子神经肽,属兴奋性递质,它对其他兴奋性神经元,如单胺能及胆碱能神经元存在投射,可调节其他神经递质分泌。Orexin A在TBI昏迷促醒中可能起“开关”作用,介导VNS下调GABAb1R,从而促醒。
VNS前需在颈部分离出迷走神经,此过程引起大鼠呼吸道分泌物增多、呼吸不畅甚至窒息。后期将探索无创VNS的可能。本研究仅探讨了VNS对TBI昏迷大鼠前额叶皮质GABAb1R表达的影响,尚未涉及其他兴奋性递质表达。后期将进一步探索VNS促醒机制。
综上所述,VNS可促TBI后昏迷的觉醒,其机制可能与Orexin A介导下调大鼠前额叶皮质GABAb1R表达有关。其具体的作用机制尚有待于进一步研究。
[1]Maas AI,Stocchetti N,Bullock R.Moderate and severe traumatic brain injury in adults[J].Lancet Neurol,2008,7(8):728-741.
[2]Andriessen TM,Horn J,Franschman G,et al.Epidemiology,severity classification,and outcome of moderate and severe traumatic brain injury:a prospective multicenter study[J].J Neurotrauma,2011,28(10):2019-2031.
[3]Georgio Poulos M,Katsakiori P,Kefalopoulou Z,et al.Vegetative state and minimally conscious state:a review of the therapeutic interventions[J].Stereotact Funct Neurosurg,2010,88(4):199-207.
[4]Neren D,Johnson MD,Legon W,et al.Vagus nerve stimulation and other neuromodulation methods for treatment of traumatic brain injury[J].Neurocrit Care,2016,24(2):308-319.
[5]Kumaria A,Tolias CM.Is there a role for vagus nerve stimulation therapy as a treatment of traumatic brain injury?[J].Br J Neurosurg,2012,26(3):316-320.
[6]Shi C,Flanagan SR,Samadani U.Vagus nerve stimulation to augment recovery from severe traumatic brain injury impeding consciousness:a prospective pilot clinical trial[J].Neurol Res,2013,35(3):263-276.
[7]宋璐,刘爱华.迷走神经刺激术在非癫痫领域的应用进展[J].中华临床医师杂志(电子版),2012,6(17):5191-5194.
[8]Gmeiner F,Kołodziejczyk A,Yoshii T,et al.GABA(B)receptors play an essential role in maintaining sleep during the second half of the night in Drosophila melanogaster[J].J Exp Biol,2013,216(Pt 20):3837-3843.
[9]Vienne J,Bettler B,Franken P,et al.Differential effects of GABAB receptor subtypes,{gamma}-hydroxybutyric acid,and Baclofen on EEG activity and sleep regulation[J].J Neurosci,2010,30(42):14194-14204.
[10]de Lecea L,Huerta R.Hypocretin(orexin)regulation of sleep-to-wake transitions[J].Front Pharmacol,2014,5:16.
[11]Feng Z,Zhong YJ,Wang L,et al.Resuscitation therapy for traumatic brain injury-induced coma in rats:mechanisms of median nerve electrical stimulation[J].Neural Regen Res,2015,10(4):594-598.
[12]Feng Z,Du Q.Mechanisms responsible for the effect of median nerve electrical stimulation on traumatic brain injury induced coma:orexin-A-mediated N-methyl-Daspartate receptor subunit NR1 upregulation[J].Neural Regen Res,2016,11(6):951-956.
[13]Jiang Y,Li L,Liu B,et al.PPARγ upregulation induced by vagus nerve stimulation exerts anti-inflammatory effect in cerebral ischemia/reperfusion rats[J].Med Sci Monit,2015,21:268-275.
[14]陶玉,尹海兵,陈旭东,等.UBE2C基因在食管鳞癌中的表达及其临床意义[J].江苏医药,2016,42(16):1816-1818.
[15]Zhou L,Lin J,Kui G,et al.Neuroprotective effects of vagus nerve stimulation on traumatic brain injury[J].Neural Regen Res,2014,9(17):1585-1591.
[16]Groves DA,Brown VJ.Vagal nerve stimulation:a review of its applications and potential mechanisms that mediate its clinical effects[J].Neurosci Biobehav Rev,2005,29(3):493-500.
[17]Vonck K,Raedt R,Naulaerts J,et al.Vagus nerve stimulation…25 years later!What do we know about the effects on cognition?[J].Neurosci Biobehav Rev,2014,45:63-71.
[18]Hays SA.Enhancing rehabilitative therapies with vagus nerve stimulation[J].Neurotherapeutics,2016,13(2):382-394.
[19]Smith DC,Tan AA,Duke A,et al.Recovery of function after vagus nerve stimulation initiated 24 hours after fluid percussion brain injury[J].J Neurotrauma,2006,23(10):1549-1560.
[20]Pruitt DT,Schmid AN,Kim LJ,et al.Vagus nerve stimulation delivered with motor training enhances recovery of function after traumatic brain injury[J].J Neurotrauma,2016,33(9):871-879.
[21]Clough RW,Neese SL,Sherill LK,et al.Cortical edema in moderate fluid percussion brain injury is attenuated by vagus nerve stimulation[J].Neuroscience,2007,147(2):286-293.
[22]Lopez NE,Krzyzaniak MJ,Costantini TW,et al.Vagal nerve stimulation decreases blood-brain barrier disruption after traumatic brain injury[J].J Trauma Acute Care Surg,2012,72(6):1562-1566.
[23]Bansal V,Ryu SY,Lopez N.Vagal stimulation modulates inflammation through a ghrelin mediated mechanism in traumatic brain injury[J].Inflammation,2012,35(1):214-220.
[24]Labiner DM,Ahern GL.Vagus nerve stimulation therapy in depression and epilepsy:therapeutic parameter settings[J].Acta Neurol Scand,2007,115(1):23-33.
[25]董晓阳,冯珍.迷走神经电刺激对脑外伤昏迷大鼠前额叶皮质5-羟色胺2A受体表达的影响[J].中国康复理论与实践,2016,22(4):404-408.
[26]Ansari S,Chaudhri K,AlMoutaery KA.Vagus nerve stimulation:indications and limitations[J].Acta Neurochir Suppl,2007,97(2):281-286.
[27]Ruffoli R,Giorgi FS,Pizzanelli C,et al.The chemical neuroanatomy of vagus nerve stimulation[J].J Chem Neuroanat,2011,42(4):288-296.
[28]Benke D,Zemoura K,Maier PJ.Modulation of cell surface GABAB receptors by desensitization,trafficking and regulated degradation[J].World J Biol Chem,2012,3(4):61-72.
[29]袁莲芳,陈果,侯丽,等.γ-氨基丁酸B受体与应激性防御反应研究现状[J].中华实用诊断与治疗杂志,2015,29(6):521-523.
[30]Black SW,Morairty SR,Chen TM,et al.GABAB agonism promotes sleep and reduces cataplexy in murine narcolepsy[J].J Neurosci,2014,34(19):6485-6494.
Effect of Vagus Nerve Stimulation on Wake-promoting and Expression of γ-aminobutyric Acid b1 Receptor in Prefrontal Cortex of Coma Rats post Traumatic Brain Injury
LIAO Cheng-cheng,FENG Zhen,HUANG Fei-fei,CHEN Qin
Department of Rehabilitation Medicine,the First Affiliated Hospital of Nanchang University,Nanchang,Jiangxi 330006,China
FENG Zhen.E-mail:fengzhenly@sina.com
Objective To investigate the wake-promoting effect of vagus nerve stimulation(VNS)on coma rats after traumatic brain injury(TBI),and the related mechanism.Methods A total of 168 healthy Sprague-Dawley rats were randomly divided into blank group,TBI group,antagonist group and VNS group,42 rats in each group.The latter three groups were established TBI model with impact,and the rats in coma at least 30 minutes were included.VNS group accepted VNS,the antagonist group were injected intralateroventricularly Orexin A receptor 1(OXR1)antagonist SB334867,and TBI group accepted sham VNS.Their behaviors were observed to determine the level of consciousness six,twelve and 24 hours after intervention,while the expression of γ-aminobutyric acid b1 receptor(GABAb1R)in prefrontal cortex was detected with immunohistochemistry and Western blotting.Results There were 42 rats in the blank group,11 rats in TBI group,13 rats in the antagonist group,and 28 rats in VNS group awakened finally.The expression of GABAb1R in prefrontal cortex ranged as TBI group,antagonist group,blank group and VNS group from more to less twelve and 24 hours after intervention under Western blotting(F>60.412,P<0.001),and it ranged as TBI group,antagonist group,VNS group and blank group under immunohistochemistry(H=15.121,P=0.002),with no significant difference among time points(H=3.028,P=0.220).Conclusion VNS can promote waking from coma in rats after TBI,which may relate with the decrease of GABAb1R in prefrontal cortex that induced by OrexinA.
traumatic brain injury;coma;vagus nerve stimulation;wake-promoting;γ-aminobutyric acid b1 receptor;rats
R651.1
A
1006-9771(2017)09-1037-06
2016-11-05
2017-05-11)
10.3969/j.issn.1006-9771.2017.09.010
[本文著录格式] 廖诚诚,冯珍,黄菲菲,等.迷走神经电刺激对脑外伤昏迷大鼠意识及前额叶皮质γ-氨基丁酸b1受体表达的影响[J].中国康复理论与实践,2017,23(9):1037-1042.
CITED AS:Liao CC,Feng Z,Huang FF,et al.Effect of vagus nerve stimulation on wake-promoting and expression of γ-aminobutyric acid b1 receptor in prefrontal cortex of coma rats post traumatic brain injury[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(9):1037-1042.
国家自然科学基金项目(No.81260295)。
南昌大学第一附属医院康复医学科,江西南昌市330006。作者简介:廖诚诚(1988-),女,汉族,江西赣州市人,硕士研究生,主要研究方向:神经康复。通讯作者:冯珍,女,江西南昌市人,教授,主任医师,主要研究方向:神经康复。E-mail:fengzhenly@sina.com。

