改良型激素性股骨头坏死小鼠模型的建立与评价*
王继涛 阮红峰 付方达 吴承亮 △
(1.浙江中医药大学第一临床医学院,浙江 杭州 310053;2.浙江中医药大学骨伤研究所,浙江 杭州 310053;3.浙江省中医院,浙江 杭州 310006)
改良型激素性股骨头坏死小鼠模型的建立与评价*
王继涛1,3阮红峰1,2付方达1,3吴承亮1,2△
(1.浙江中医药大学第一临床医学院,浙江 杭州 310053;2.浙江中医药大学骨伤研究所,浙江 杭州 310053;3.浙江省中医院,浙江 杭州 310006)
目的 为建立有效的动物模型,更好研究激素性股骨头坏死的发病机制,科学阐明中药方剂治疗该疾病的分子作用机制。方法 取45只2月龄雄性C57BL/6小鼠随机平均分为对照组、传统组、改良组。传统组给予脂多糖联合甲强龙激素造模,改良组小鼠则在传统组基础上调整饲料槽的高度,迫使小鼠主动站立取食,并予跑步机上跑步2 h/d;对照组给予等量的生理盐水。定时观察小鼠一般状况,分别于造模前、造模后第4周、第8周抽血检测血液中三酰甘油的含量,并于造模后8周测量小鼠股骨头骨密度,次日处死取双侧股骨头,体视显微镜下观察股骨头外观及色泽。采用苏木精-伊红染色法(HE)及阿尔新蓝染色(ABH)等技术观察小鼠股骨头病理变化。结果 传统组和改良组小鼠精神状态明显差于对照组,且改良组差于传统组 (P<0.05);传统组和改良组血液中三酰甘油的含量高于对照组,改良组高于传统组;骨密度检测显示,传统组和改良组骨密度低于对照组,且改良组低于传统组(P<0.05);股骨头形态学观察发现改良组股骨头软骨下出血坏死的面积较传统组严重,HE、ABH结果显示,传统组有9只出现(空骨陷窝数量增多,骨小梁变细甚至断裂)等骨坏死表现,造模成功率达60%,改良组有11只出现(空骨陷窝数量增多,骨小梁变细甚至断裂)股骨头坏死的表现,造模成功率高达73.3%(P<0.05)。结论 传统造模方法和改良造模方法皆可造模成功,但改良造模方法具有更高成模率。
激素性股骨头坏死 动物模型 甲强龙 脂多糖 跑步机
股骨头坏死(ONFH)是骨科临床难题之一。据流行病学报道,在中国每年新增50~75000例股骨头坏死患者[1]。其中激素性股骨头坏死(SONFH)发病率占非创伤性股骨头坏死的一半以上[2]。SONFH发病好发于青壮年,具有双侧高发病率的特点,且发病率逐年上升[3-4];若不能进行及时有效地治疗,70%的患者最终将发生股骨头塌陷,给个人和社会带来沉重的心理和经济负担[5]。当前SONFH确切的发病机制和始动因素仍不明确,因此建立一个全过程高度模拟人类早期SONFH的动物模型显得尤为迫切和重要。本研究参照RyooS等[6]的方法并加以改进,小剂量脂多糖联合大剂量甲强龙诱导C57BL/6小鼠早期股骨头缺血性坏死,为研究早期SONFH的治疗和预防研究提供动物模型。现报告如下。
1 材料与方法
1.1 实验动物 2月龄SPF级雄性C57小鼠45只,由浙江中医药大学实验动物中心提供,动物许可证号:ACXK(沪)2015-0016。实验动物随机平均分为3组:传统组(激素加内毒素组)、改良组(在传统组的基础上进行站立取食联合运动)以及对照组(仅予等量生理盐水)。
1.2 试剂与仪器 大肠杆菌内毒素 (Sigma公司,美国批号L2880,规格 10 mg);甲泼尼龙琥珀酸钠(甲强龙)(Pfizer Manufacturing Belgium NV公司,批号:A07056);光学显微镜(Olympus公司,日本),Milli-QS超纯水器(美国Millipore公司),青霉素钠(华北制药股份有限公司,批号:F3117217);Sartorius BS110S万分之一电子天平(德国塞多利斯公司);INSTRON万能材料试验机(美国英斯特朗公司),小鼠跑步机(北京智鼠多宝公司),RM2235石蜡切片机、LEICADM500三目生物显微镜及图像信号采集与分析系统(德国Leica公司)。
1.3 模型制备 传统组小鼠腹腔注射脂多糖20 μg/kg,每日1次,连续注射2 d;第3天开始臀肌注射100 mg/kg的甲强龙,连续注射2周;第3周开始隔天注射激素1次直至取材。改良组在传统组基础上调整饲料高度迫使小鼠站立取食增加运动,并予跑步机跑步2 h/d。对照组不做任何处理,并腹腔注射等量的生理盐水。所有动物每周臀部注射3万U青霉素预防感染。造模8周后取材(双侧股骨头)。
1.4 检测指标
1.4.1 动物一般体征 注射药物后连续8周,每日观察各组动物注射后饮食、排便次数、皮毛光泽、体质量、精神状态等情况。
1.4.2 小鼠血液学检查 分别于造模前、造模后第4周、第8周检测血液中三酰甘油(TG)的含量。取血方法:戳刺小鼠眼睑,放血1滴,吸取血滴,置于500 μL的EP管中。
1.4.3 Micro-CT检测及骨密度分析 造模后8周,各组小鼠分批麻醉放在Micro-CT上扫描,对小鼠双侧股骨进行扫描。通过相应分析软件,测得小鼠各组股骨头骨密度。
1.4.4 形态学观察 在无菌条件下,用0.02%的戊巴比妥钠对小鼠(0.2 mL/10 g)进行腹腔注射,麻醉后将小鼠仰卧位固定于手术台上,逐层分离直至暴露髋关节,取出股骨头。用1×PBS清洗股骨头,予体视显微镜下观察双侧股骨头外观及色泽。
1.4.5 组织病理检查 组织置于4%多聚甲醛固定3 d,流水冲洗过夜,脱钙10 d后,以针头无阻力刺透为度。随后进行脱水、透明、浸蜡、包埋、切片、进行HE、ABH染色,光镜下观察股骨头外形、软骨、骨小梁、软骨细胞的变化。
1.5 统计学处理 应用SPSS12.0统计软件。计量资料以)表示,采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 动物一般体征观察 造模后,定时观察和比较3组小鼠的行为学差异,包括饮食、排便次数、皮毛光泽、体质量、精神状态等。脂多糖腹腔注射后,传统组和改良组均出现不同程度的精神萎靡。注射激素第3天后,除对照组外,传统组和改良组均出现大便稀溏,饮食和活动均减少的表现。第10天后开始上述症状开始减轻,造模期间均未出现溃疡,脱毛现象,改良组小鼠精神状态较传统组差。对照组与传统组和改良组比较,对照组小鼠精神状态正常,活动自如,饮食正常,皮毛光泽。各组小鼠体质量变化见表1。由表可知,激素具有能够减轻小鼠体质量的作用,造模后4、8周,传统组和改良组小鼠体质量较对照组明显减轻(P<0.05),改良组与传统组体质量差异无统计学意义(P>0.05)。
表1 各组C57小鼠各时间点体质量比较(g
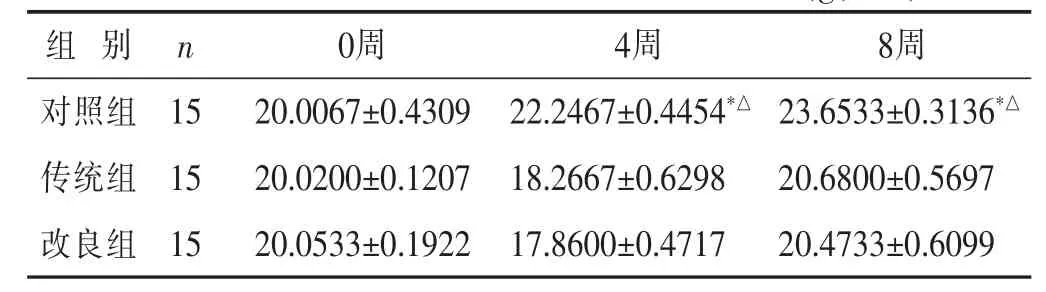
表1 各组C57小鼠各时间点体质量比较(g
与传统组比较,*P<0.05;与改良组比较,△P<0.05。下同。
组 别 n 0周 4周 8周对照组 15传统组 15 20.0067±0.4309 22.2467±0.4454*△ 23.6533±0.3136*△20.0200±0.1207 18.2667±0.6298 20.6800±0.5697改良组 1520.0533±0.1922 17.8600±0.4717 20.4733±0.6099
2.2 各组小鼠各时间点TG比较 见表2。TG水平在造模前、造模后第4周、8周呈渐增趋势,第4周传统组和改良组与对照组相比差异均有统计学意义(P<0.05),传统组和改良组差异无统计学意义(P>0.05);第8周时,传统组和改良组差异具有统计学意义(P<0.05)。
表2 各组C57小鼠各时间点TG水平比较(mg/dL
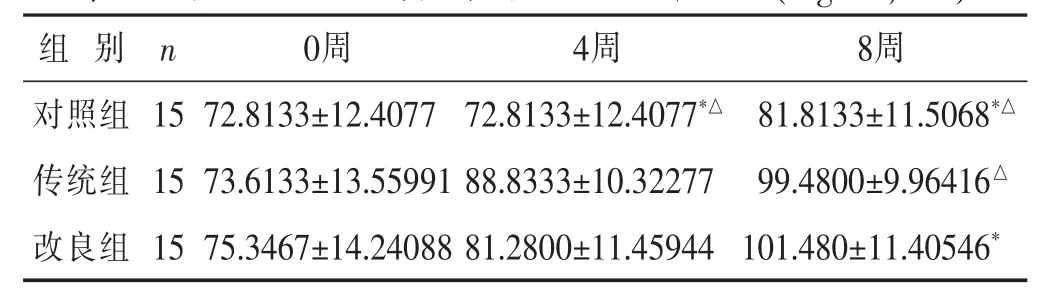
表2 各组C57小鼠各时间点TG水平比较(mg/dL
组 别n 0周 4周 8周对照组 15传统组 15 72.8133±12.4077 72.8133±12.4077*△ 81.8133±11.5068*△73.6133±13.55991 88.8333±10.32277 99.4800±9.96416△改良组 1575.3467±14.24088 81.2800±11.45944 101.480±11.40546*
2.3 各组小鼠各时间点股骨头骨密度比较 见表3。Micro-CT显示,激素注射后股骨头密度逐渐减少。取材时发现改良组较传统组、对照组两组更容易发生骨折,传统组和改良组差异具有统计学意义(P<0.05)。
表3 各组C57小鼠各时间点股骨头密度(BMD)比较(g/cm2s)
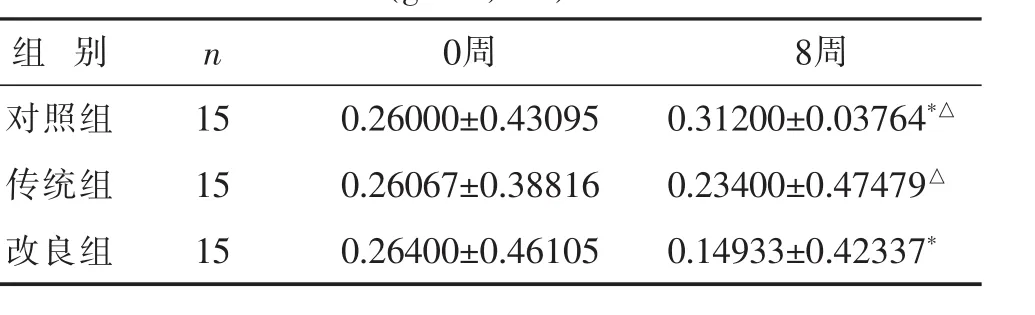
表3 各组C57小鼠各时间点股骨头密度(BMD)比较(g/cm2s)
组 别 n 0周 8周对照组 15传统组 15 0.26000±0.43095 0.31200±0.03764*△0.26067±0.38816 0.23400±0.47479△改良组 150.26400±0.46105 0.14933±0.42337*
2.4 各组小鼠股骨头形态学观察 见图1。造模8周后,对照组股骨头外观明亮洁白,关节表面光滑;传统组大部分小鼠股骨头表面有小面积软骨下出血坏死;改良组大部分小鼠股骨头软骨下坏死的程度和范围严重,软骨关节表面粗糙,出现囊性样改变。
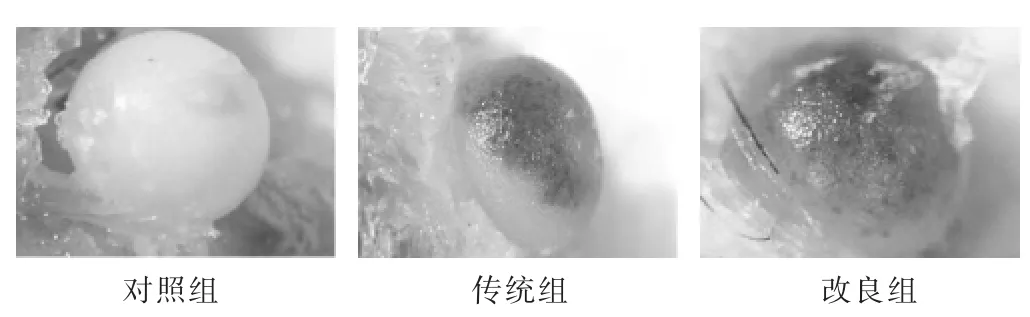
图1 各组小鼠8周时显微镜下股骨头外观(10倍)
2.5 各组小鼠股骨头组织病理学检察 图2为HE染色,背景为粉红色,细胞核为蓝紫色。对照组小鼠股骨头形态正常,骨小梁排列紧密,排列整齐。传统组8周模型小鼠股骨头外形圆滑,骨小梁排列紊乱,改良组8周模型小鼠股骨头,骨小梁排列不规则,骨髓腔细胞死亡、脱落。图3为ABH染色,背景为红色,软骨为蓝色。对照组小鼠股骨头形态正常,软骨表面光滑,软骨基质含量较多,染色较深。传统组小鼠股骨头骺软骨区厚度变薄,软骨成分含量减少,染色变浅,骨小梁变细,部分出现断裂。改良组小鼠股骨骺软骨区厚度显著变薄,骨小梁变细,部分断裂甚至坏死,先前完整的骨骺线开始变得模糊,伴有纤维结构增生,甚至有骨桥形成。
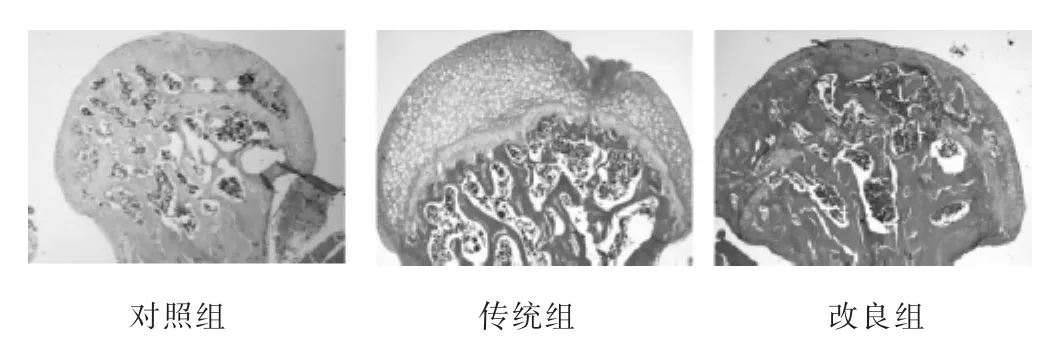
图2 各组小鼠股骨头组织病理学检查(HE染色,50倍)
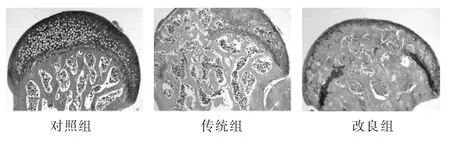
图3 各组小鼠股骨头组织病理学检查(ABH染色,50倍)
3 讨 论
临床上,许多疾病的治疗都需要长期服用大剂量激素类药物,例如肾病综合征,支气管哮喘,SARS等,其带来的并发症股骨头坏死也是很常见的。SONFH的患病人数也越来越多,但其发病机制尚不清楚,且缺乏切实有效的早期诊断和预防方法。因此建立与人类SONFH临床病理特征相似的动物模型并探索其发病机制,寻求有效的治疗和预防方法就显得尤为重要[7]。SONFH患者存在共同的病理特征,即在应用激素前就已经有过敏性血管炎[8]。内毒素使血管内皮发生损伤,造成血液的流速减慢,血管内易凝血的状态,在此基础上大剂量应用激素更符合临床发病特征,且有更好的成模率[9-10]。因此,模型建立选择激素联合内毒素。
理想的SONFH的动物模型应具有和人类高度相似的生理、病理、解剖特点,能够有效地模拟SONFH发展过程。当前主要用兔和鼠用于SONFH造模。选用小鼠作为实验动物。小鼠是四肢动物,具有体质量轻的特点,虽然难以造成股骨头塌陷的模型,但是小鼠作为实验动物有着自身独特的优势。首先,小鼠的造模时间比较短,其次小鼠的活动空间大便于饲养,调整饲料槽的位置,使小鼠主动站立取食,模拟人股骨头的受力状态,有利于观察疾病的发展过程。更重要的是,小鼠与人体的基因具有高度的同源性,这种基因的同源性,使得小鼠生理生化与发育过程的指标与人体大致相似[11],从而对环境及药物的反应也基本相同。为此,选用小鼠作为实验动物。常用的造模方法有:单纯激素、脂多糖联合激素、异体血清联合激素等方法[12-14]。本课题组经过前期的预实验,发现激素用量在20~100 mg/kg的范围内都属于安全用量,相关研究证实在安全范围内,激素用量越大骨坏死发生率越高。故采用的是脂多糖(20 mg/kg)联合大剂量的激素(100 mg/kg)同时配合站立取食联合运动方法。本模型具有两方面优势,一方面迫使小鼠站立取食,能够模拟人股骨头受力[15]。另一方面,运动可以模拟人SONFH早期的日常生活状态。造模8周,B组15只小鼠中出现9只股骨头坏死的表现,成模率达60%;而C组15只小鼠出现10只股骨头坏死的表现;成模率高达73.3%,由此可见改良方法优于传统造模方法。造模过程中未出现小鼠死亡,这可能与无菌的操作习惯和良好的饲养环境有关。
本模型模拟SONFH的早期病变,具有以下优点:1)模型诱导时间比较短,SONFH效果明确;2)实验动物存活率高,具有较好的成模率;3)与临床上激素性股骨头坏死的发病十分相似;4)激素联合运动方法,能较好地模拟人发病早期的日常生活状态。该模型建立,为早期激素性股骨头缺血性坏死研究提供了可靠的实验模型。
综上所述,脂多糖联合甲强龙加站立喂食联合运动方法能够诱导小鼠早期激素性股骨头缺血性坏死的发生,同时具有方法简单、操作方便,成本低廉,成功率高的特点,有效地模拟SONFH早期的发病过程,所以该方法值得在股骨头坏死的动物实验中推广应用。
[1]Fan SH,Wang YY,Lu J,et al.CERS2 suppresses tumor cell invasion and is associated with decreased V-ATPase and MMP-2/MMP-9 activities in breast cancer[J].J Cell Biochem,2015,116(4):502-513.
[2]Xie M,Hu A,Luo Y,et al.Interleukin-4 and melatonin ameliorate high glucose and interleukin-1β stimulated inflammatory reaction in human retinal endothelial cells and retinal pigment epithelial cells[J].Mol Vis,2014(20):921-928.
[3]Lieberman JR,Engstrom SM,Meneghini RM,et al.Which factors influence preservation of the osteonecrotic femoral head[J].Clin Orthop Relat Res,2012,470(2):525-534.
[4]李子荣.股骨头坏死:早期诊断与个体化治疗[J].中国矫形外科杂志,2013,21(19):1909-1911.
[5]Tang C,Chen L,Gu W,et al.Cyclosporin A enhances the ability of trophoblasts to displace the activated human umbilical vein endothelial cell monolayers[J].Int J Clin Exp Pathol,2013,6(11):2441-2450.
[6]Ryoo S,Lee S,Jo S,et al.Effect of lipopolysaccharide (LPS)on mouse model of steroid-induced avascular necrosis in the femoral head (ANFH)[J].J Microbiol Biotechnol,2014,24(3):394-400.
[7]王坤正,王春生,武永刚,等.激素性骨坏死血管变化的实验研究[J].中华医学杂志,2006,92(29):2024-2027.
[8]Saito S,Ohzono K,Ono K.Early arteriopathy and postulated pathogenesis of osteonecrosis of the femoral head.The intracapital arterioles[J].Clin Orthop Relat Res,1992(277):98-110.
[9]边焱焱.大剂量糖皮质激素对骨髓间充质干细胞成骨分化的MiroRNA调节的实验研究[D].北京:清华大学医学部,2012.
[10]张国桥,易诚青,滕松松,等.早期激素性股骨头坏死模型的建立[J].现代生物医学进展,2012,12(7):1223-1224,1235.
[11]Bejar J,Peled E,Boss JH.Vasculature deprivation-induced osteonecrosis of the rat femoral head as a model for therapeutic trials[J].Theor Biol Med Model,2005(2):24.
[12]Bekler H,Uygur AM,Gke A,et al.The effect of steroid use on the pathogenesis of avascular necrosis of the femoral head:an animal model[J].Acta Orthop Traumatol Turc,2007,41(1):58-63.
[13]Okazaki S,Nishitani Y,Nagoya S,et al.Femoral head osteonecrosis can be caused by disruption of the systemic immune response via the toll-like receptor 4 signalling pathway[J].Rheumatology(Oxford),2009,48(3):227-232.
[14]黄思俊,白志强,张弛,等.采用激素联合内毒素建立兔中期股骨头坏死模型[J].中华关节外科杂志:电子版,2016,10(3):331-336.
[15]朱嘉,方以群,金晶,等.激素性股骨头坏死动物模型建立方法初探[J].海军医学杂志,2009,30(2):97-101.
Establishment and Evaluation of a Modified Mouse Model of Steroid Induced Osteonecrosis of the Femoral Head
WANG Jitao,RUAN Hongfeng,FU Fangda,et al. First Clinical Medical School of Zhejiang
Chinese Medicine University,Zhejiang,Hangzhou 310053,China.
Objective: To establish an effective animal model to study the pathogenesis of steroid induced osteonecrosis of the femoral head,and to elucidate the molecular mechanism of the treatment of the disease.Methods: 45 male C57BL/6 mice of two months′old were randomly divided into three groups: the control group(A group) and the traditional group (B group) and the modified group (C group).The traditional group was treated with lipopolysaccharide combined with methylprednisolone.In the modified group,the height of the feed tank was adjusted on the basis of the traditional group,forcing the mice to stand actively for feeding,and running on the treadmill,2 h/d.A group was given the same dose of saline,regularly observing the general condition of mice.Respectively before and four and eight weeks after modeling,three glycerol content in the blood was detected.The femoral head density was measured 8 weeks after modeling,and the mice was sacrificed and the bilateral femoral head was taken the next day.The appearance and color of the femoral head were observed under a stereo microscope.Hematoxylin and eosin(HE) staining and Alcian blue staining(ABH) were used to evaluate the pathological changes of mouse femoral head.Results: Mental state of B and C groups was worse than that of A group,and C group was worse than B group (P<0.05).In the traditional group and the modified group,the content of three glycerol in the blood was higher than that in the control group,and the modified group was higher than the traditional group.Bone mineral density test showed that bone density in the traditional group and the modified groupwas lower than that in the control group,and the modified group was lower than that of the traditional group (P<0.05).The morphological observation of femoral head showed that the area of subchondral hemorrhage and necrosis in the femoral head of the modified group was more serious than that in the traditional group.Hematoxylineosin(HE) staining and Alcian blue staining(ABH) showed that in the traditional group,there were 9 with empty lacunae increasing and trabecular bone thinning and rupturing of bone necrosis;the success rate of the model reached 60%,whilein the modified group,there were 11 with empty lacunae increasing and trabecular bone thinning and rupturing of bone necrosis;the success rate of the model reached 73.3%(P<0.05).Conclusion: The traditional modeling method and improved modeling method can be successfully modeled,but the improved model has higher rate into a mold.
Steroid induced osteonecrosis ofthe femoralhead;Animalmodel;Methylprednisolone;Lipopolysaccharide;Treadmill
R285.5
A
1004-745X(2017)09-1525-04
10.3969/j.issn.1004-745X.2017.09.007
2017-05-19)
国家自然科学基金项目(81273770,8157150451);浙江省自然科学基金项目(LY15H270012,Q17H270023);浙江省中医药科技计划项目(2017ZB026)
△通信作者(电子邮箱:wu.cl@126.com)

