基于野外大田试验的接菌紫穗槐生态修复效应研究
岳 辉, 毕银丽
〔1.中国矿业大学(北京) 煤炭资源与安全开采国家重点实验室, 北京100083;2.西安科技大学 测绘科学与技术学院, 陕西 西安710054〕
试验研究
基于野外大田试验的接菌紫穗槐生态修复效应研究
岳 辉1,2, 毕银丽1
〔1.中国矿业大学(北京)煤炭资源与安全开采国家重点实验室,北京100083;2.西安科技大学测绘科学与技术学院,陕西西安710054〕
[目的] 研究接菌紫穗槐对矿区退化植被的恢复生态效应,以期为丛枝菌根真菌应用于西部干旱半干旱煤矿区生态重建提供理论基础和野外试验基础数据。 [方法] 以紫穗槐为宿主植物,在野外大田条件下研究接种丛枝菌根真菌和紫穗槐的共生状况,以及对煤矿开采沉陷区植物根际土壤的改良作用。 [结果] 4 a的连续监测结果表明,接菌促进了紫穗槐的生长,接菌紫穗槐成活率比对照高30%以上;接菌紫穗槐菌根侵染率和菌丝密度显著高于对照;接种菌根提高了紫穗槐根际土壤有效磷含量且降低了pH值,取得较好的生态修复效应。 [结论] 在野外大田条件下,接种菌根真菌能够促进植物—菌根共生关系的形成,改善植物—菌根共生体的营养环境。
丛枝菌根真菌; 紫穗槐; 野外大田试验; 生态效应; 煤矿区
文献参数: 岳辉, 毕银丽.基于野外大田试验的接菌紫穗槐生态修复效应研究[J].水土保持通报,2017,37(4):1-5.DOI:10.13961/j.cnki.stbctb.2017.04.001; Yue Hui, Bi Yinli. Field experiment of ecological restoration application of arbuscular mycorrhizal fungi inoculation onAmorphafruticosa[J]. Bulletin of Soil and Water Conservation, 2017,37(4):1-5.DOI:10.13961/j.cnki.stbctb.2017.04.001
中国煤炭资源探明资源量为1.145×1011t,煤炭在一次性能源消费中占70%,预计到2050年煤炭仍占中国能源比重的50%[1]。在煤炭大规模的地下开采的同时造成了诸多环境问题,例如土地损毁,固体废弃物如煤矸石和粉煤灰对水体、大气和土壤的污染,植被受损难以恢复,矿区生态坏境恶化以及地质灾害频发等一系列问题[2]。因此矿区生态重建对实现煤炭资源的绿色开采和矿区可持续发展具有重要的现实和战略意义。
丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)是地球土壤中普遍存在的一种共生真菌,能够与80%以上的陆生植物形成共生体,彼此共享营养物质和水分[3]。丛枝菌根真菌并不是宿主专一型的真菌,野外生境下一种菌根真菌可以同时侵染大量的同一类型的植物,也可以同时侵染大量不同类型植物。同时,菌根菌丝形成的庞大地下真菌网络表明菌根真菌在同类型或者不同类型植物之间进行营养物质和水分的分配与植物的植株个体大小以及植株在植物群落中相对的优势地位无关。因此,丛枝菌根真菌在植物群落结构、演替和维持生态系统稳定性方面具有重要的意义[4]。随着对丛枝菌根真菌研究的不断深入,其对提高宿主植物的营养水平[5]、增强植物对恶劣环境的耐受性[6]、改善土壤微环境[7]等方面均有所报道。但是对于丛枝菌根真菌的研究多集中在室内盆栽试验,而野外大田条件下的试验研究报道较少,本文利用神东微生物复垦试验田种植紫穗槐,分析在野外大田条件下接菌和不接菌植物的生长差异,以及接菌对根际微环境的调节作用,研究接菌紫穗槐对矿区退化植被的恢复生态效应,以期为丛枝菌根真菌应用于西部干旱半干旱煤矿区生态重建提供一定的理论基础和野外试验基础数据。
1 材料和方法
1.1 试验材料
宿主植物选择复垦先锋植物紫穗槐(Amorphafruticosa),菌根真菌由中国矿业大学(北京)微生物复垦实验室培养的内生菌根真菌菌种摩西球囊霉菌〔Glomusmosseae(G.m)〕和白色球囊霉菌〔Glomusalbidus(G.a)〕。试验区土壤最大饱和持水量为16.7%,pH值为8.6,有效磷含量为3.4 mg/kg。
1.2 试验方法
试验在陕西省神东大柳塔煤矿活鸡兔矿井采煤沉陷试验基地进行,试验基地气候干旱少雨,年均降雨量在362 mm,年蒸发量是年降雨量的6~7倍。设计CK,G.m和G.a这3个独立的小区,G.m和G.a分别接种摩西球囊霉菌和白色球囊霉菌,CK为对照区不施菌剂。2008年开始栽植紫穗槐,株高20 cm,株间距×行间距1 m×2 m,菌剂每株20 g施于根部;浇水达土壤最大持水量,以后每周浇水1次,1个月后停止浇水自然生长。试验从2008年起至2012年止,4 a间一共进行了7次采样,采样时间分别为2009年9月16日,2010年6月10日,2010年9月13日,2011年6月15日,2011年9月25日,2012年6月16日和2012年9月20日。每次在G.m,G.a和CK区采用S型法随机选定10个样点,采集新鲜根际土壤样本并编号,将土样装入自封袋带回实验室,根际土风干后剔除杂物过2 mm筛备用。
1.3 测试指标与方法
用游标卡尺测量植株地径,用钢尺测量冠幅和株高,成活率(%)=(成活株数/栽种株数)×100%。菌根侵染率参考Haymen的方法[8],菌根侵染率=菌根段数/被检根段数×100%;菌丝密度参考Jakobsen等采用的真空泵微孔滤膜抽滤法[9]。土壤有效磷含量采用0.5 mol/L NaHCO3钼锑抗比色法;速效钾含量采用1.0 mol/L NH4OAC浸提法;pH和EC测定采用去离子水浸泡法[10],水土比为5∶1。
2 结果与分析
2.1 接菌对紫穗槐成活率的影响
植株成活率反映了植物适应野外环境的能力。接菌和不接菌处理对紫穗槐成活率的影响(图1)。由图1可知,在4 a的连续观测中,接菌紫穗槐成活率明显高于不接菌,平均高出30%左右。接菌G.m紫穗槐成活率除个别年份外,均比接菌G.a高出2%~6%。从成活率月份变化趋势来看,接菌紫穗槐在每年6月成活率较9月低1%~6%,不接菌比接菌植株下降更为明显。由于试验区采用自然管理方式,成活率总体呈轻微波动变化趋势,这与试验区每年6—9月为雨季有关。总体上,接种菌根增加了植株适应野外环境的能力使得接菌区紫穗槐成活率明 显高于对照区。

图1 不同接菌处理对紫穗槐成活率的影响
2.2 接菌对紫穗槐生长的影响
紫穗槐4 a中8次对株高、地径和冠幅的监测结果详见表1—4。从不同年份上看,接菌G.m和G.a植株的株高、地径和冠幅要高于不接菌CK,不同年份之间对比差异明显。在相同年分内,由于试验基地地处西北内陆,植物生长发育的主要影响因子为降雨量,雨季从每年的6月开始,这时植株刚开始发育,9月达到最盛,年内植株的株高、地径和冠幅为6月小于9月,这与气候因子有较强的关系,但是不同处理之间存在差异,与不同年份之间的规律一致,即接菌G.m和G.a植株的株高、地径和冠幅要高于不接菌CK。
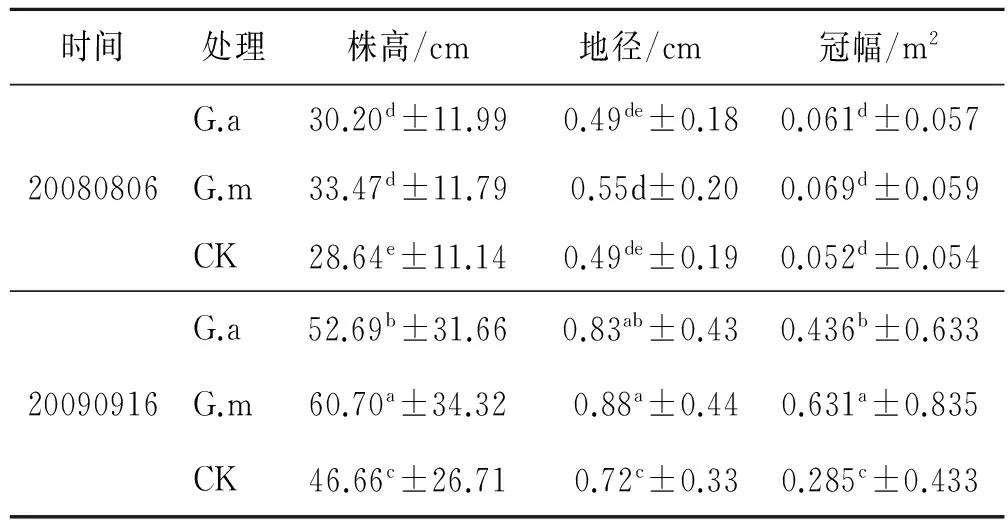
表1 不同处理对紫穗槐的生长影响(第1 a)
注:同一列数据后不同字母表示差异达到显著水平(p<0.05),数值为平均值±标准误差。下同。
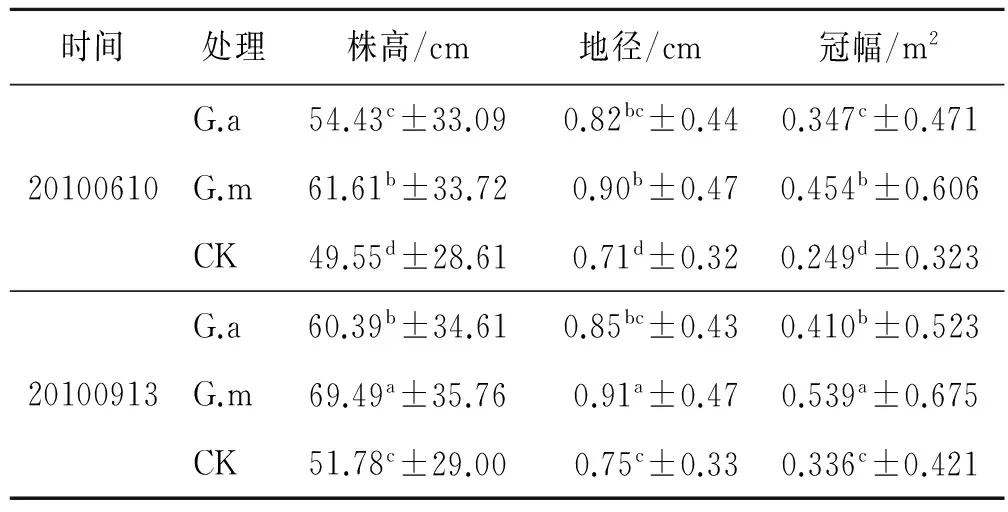
表2 不同处理对紫穗槐的生长影响(第2 a)
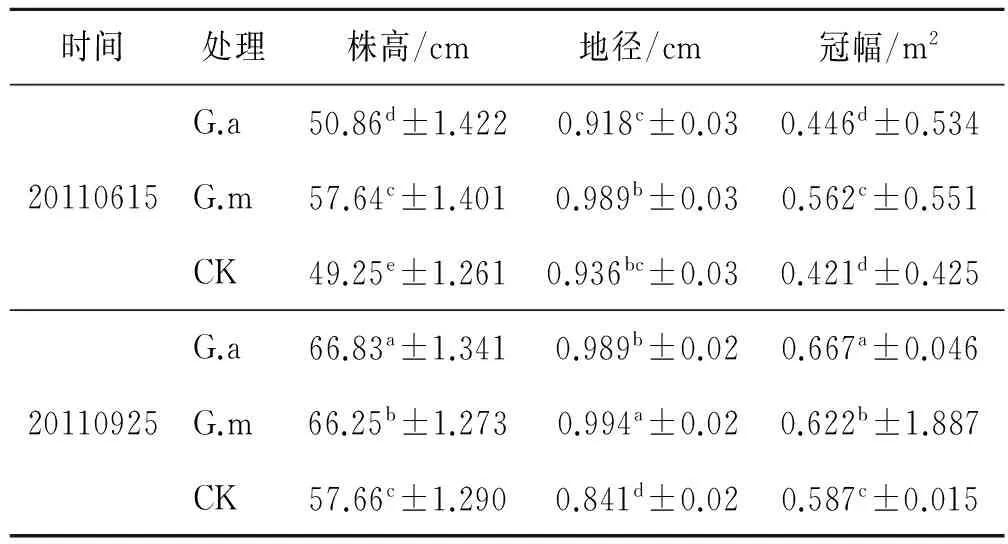
表3 不同处理对紫穗槐的生长影响(第3 a)

表4 不同处理对紫穗槐的生长影响(第4 a)
2.3 接菌对菌根侵染率的影响
菌根侵染率反映了植物根系与菌根真菌共生程度的指标,在野外大田条件下也可以作为菌根—植物共生体适应野外环境的能力的参考,这主要因为菌根真菌容易侵染植物的新生根系,植物生长发育迅速,新生根系大量产生,菌根侵染率会保持在相当高的水平,如果植物生长发育缓慢,新生根系产生较少,则菌根侵染率变低。从7次监测结果看(图2),接菌G.m和G.a植株菌根侵染率会保持在50%~70%的水平上,且6—9月的监测会呈波动变化趋势。这与植株生长发育变化规律一致,植物发育旺盛的9月往往侵染率较高,植物发育开始的6月侵染率往往较低。不接菌CK植株也有较高的菌根侵染率,保持在30%~40%之间,这与本地土壤有含有土著菌根有关,但是整体上,接菌G.m和G.a显著高于不接菌CK。

图2 不同处理对紫穗槐侵染率的影响
2.4 接菌对菌丝密度的影响
菌丝密度反映了植物根际土壤中菌丝网络的发达程度,7次监测结果如图3所示。随着时间的推移,接菌和不接菌植株菌丝密度均呈上升趋势,说明植株与菌丝结合程度在上升,地下菌丝网络趋于稳定。接菌G.m和G.a均显著高于不接菌CK,且单位土壤面积中菌丝密度高出不接菌CK的40%以上,这表明人工接菌能显著提高根际土壤中的菌丝密度,从而扩大植株吸收矿质元素和水分的范围和能力,进而提高植株在贫瘠土壤中的生存能力。
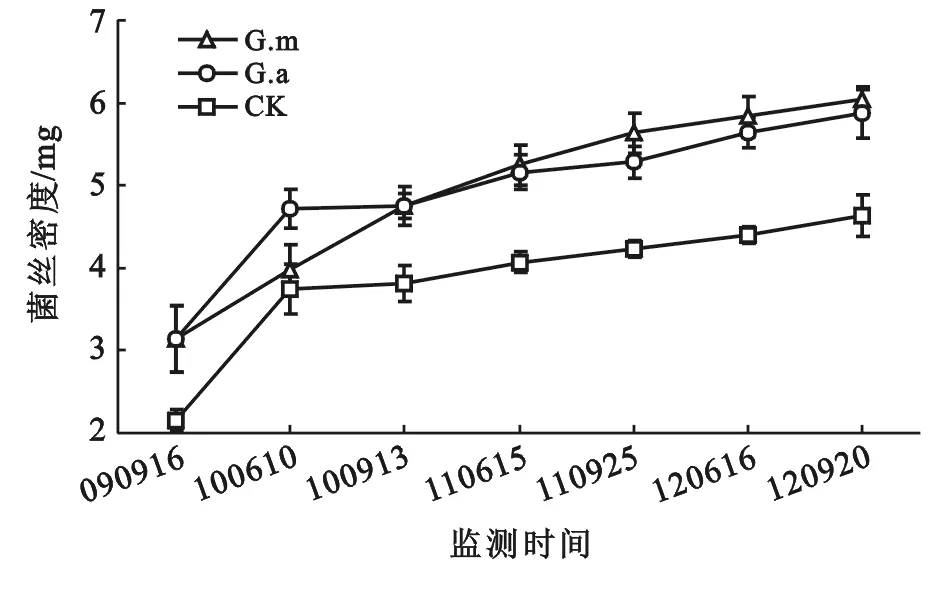
图3 不同处理对紫穗槐菌丝密度的影响
2.5 接菌对紫穗槐根际土壤理化性状的影响
不同处理对紫穗槐根际土壤理化性状的监测结果详见表5—8。接菌1 a后,接菌G.m和G.a有效磷、EC和pH均与对照CK达到显著差异。同比观测后续监测结果,其中pH值接菌比对照低0.26~0.4个单位;EC对照高于接菌植株;有效磷和速效钾含量G.m和G.a显著高于对照CK;随着时间的推移,对照植株根际土壤有效磷含量慢慢降低(第4 a,2.40~2.47 mg/kg),而接菌植株根际土壤有效磷含量维持在稳定的水平(第4 a,3.09~3.84 mg/kg),说明接菌使植物对根际土壤解磷效率提高从而释放更多的有效磷,在满足植株生长发育的需求的同时,保持了土壤中有效磷含量的稳定。

表5 不同处理对紫穗槐根际土壤理化性状的影响(第1 a)
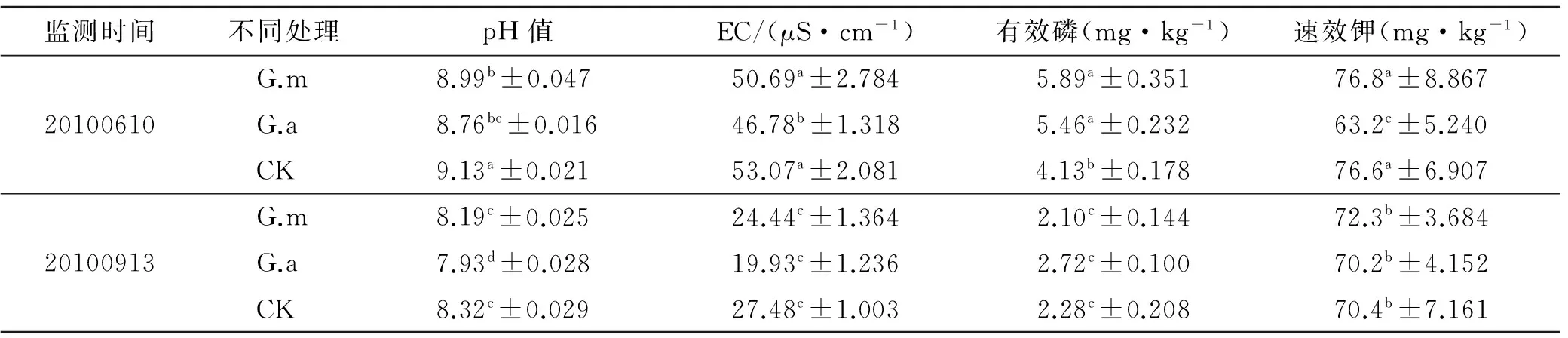
表6 不同处理对紫穗槐根际土壤理化性状的影响(第2 a)
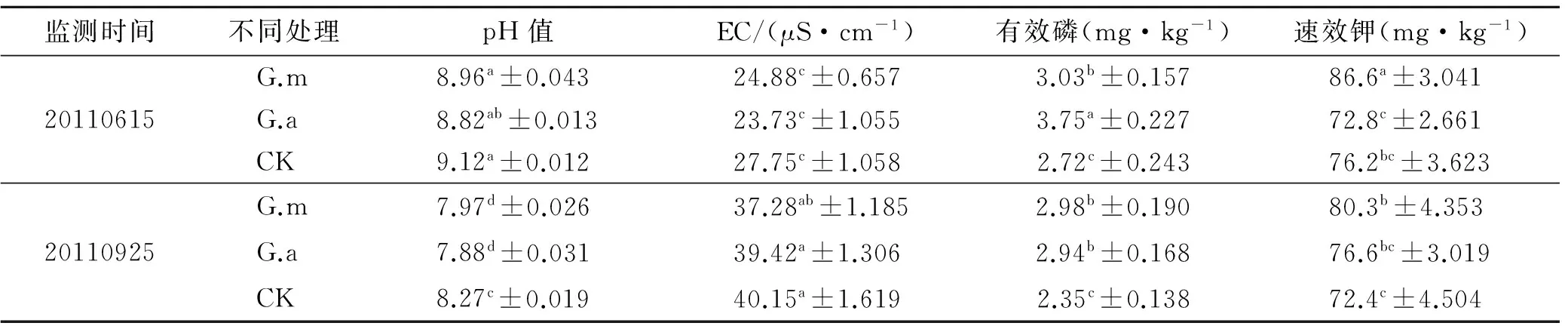
表7 不同处理对紫穗槐根际土壤理化性状的影响(第3 a)

表8 不同处理对紫穗槐根际土壤理化性状的影响(第4 a)
3 讨 论
本研究在野外大田条件下选择紫穗槐为宿主植物,并设计接菌和对照试验,初步分析了菌根真菌在野外条件下与宿主植物的结合程度和对环境的适应能力。菌根侵染率和菌丝密度的试验结果表明,菌根真菌能够侵染紫穗槐根系并具有较高的结合程度,接菌对紫穗槐的生态效应本文主要从植株的成活率、株高、地径和冠幅,以及根际土壤的理化性状来反映,结果表明接菌植株成活率要高出对照30%,而且接菌植物的株高、地径和冠幅也高于对照,接菌植物根际的有效磷保持在相对稳定的水平(第4 a,3.09~3.84 mg/kg)。紫穗槐作为一种耐旱耐寒耐盐碱性的豆科植物,本身根系较发达且有大量根瘤菌附着在植物根系,与菌根真菌结合后形成紫穗槐—菌根真菌共生体,增强了植株耐受极端环境的能力。已有多个报道[11-12]指出,紫穗槐在盆栽试验下,能够提高宿主植物对极端环境的耐受性,提高株高,根系活力,地上和地下干质量,增加脯氨酸,可溶性糖和可溶性蛋白含量。紫穗槐在野外试验中时间是关键因素,王瑾[13]、岳辉[14]和李少朋[15]等均报道过在野外大田条件下对紫穗槐根部接菌,并研究菌根技术对矿区土壤环境的改良作用,结果表明接菌能够促进紫穗槐地上部分和根系生长,接菌紫穗槐根际土壤中球囊霉素、易提取球囊霉素含量显著增加,但是野外大田试验时间较短,分别在5~28个月之间,且较长时间的连续监测报道未见报道,因此本文能够提供长时间(4 a,48个月)的生态效应的动态监测数据,为在野外条件下菌根技术的大规模推广应用提供参考。
盆栽试验和野外大田试验有显著的区别,盆栽试验能够很好地控制植物生长所需的水分、肥料和光照条件,可以进行单因素或者几个可控因素的研究,是进行野外大田推广的必需步骤,而野外大田试验更接近农田复杂环境,是菌根技术走出实验室进行推广应用的必然阶段。目前,对于菌根真菌的研究逐渐由实验室转移到野外大田较为成功的是菌根菌剂生产,Douds[16]在野外露天条件下制备为农业生产所使用的菌剂,但是菌根菌剂的生产也存在质量控制等问题难以大范围推广。尽管野外大田试验存在一定的不可控因素,但是本文设计3种不同的处理,其中两种为接菌处理,一种为不接菌对照处理,并且3种处理的试验区面积相同,面临的野外环境也一致,在4 a间进行了7次监测,取得连续的监测数据,因此能够在一定程度上反映野外大田条件下对紫穗槐接菌所产生的生态效应。
4 结 论
(1) 野外大田条件下对紫穗槐接菌提高成活率达30%以上,提高了接菌蜘蛛的株高、地径和冠幅;成活率总体呈轻微波动变化趋势,这与试验区每年6—9月为雨季有关,也可能是植株在越冬时适应性不同所致。
(2) 接菌紫穗槐菌根侵染率为50%~70%,且6—9月的监测会呈波动变化趋势,对照由于土著菌根真菌的存在,侵染率为30%~40%;接菌G.m和G.a菌丝密度均高于不接菌CK的40%以上。
(3) 接菌紫穗槐根际土壤有效磷含量维持在稳定的水平,高出对照0.4~1.4 mg/kg;pH值接菌比对照降低了0.26~0.4个单位。
[1] 张金锁,姚书志,齐琪,等.我国煤炭资源安全绿色高效开发研究综述[J].资源与产业,2013,15(2):73-78.
[2] 雷少刚,卞正富.西部干旱区煤炭开采环境影响研究[J].生态学报,2014,34(11):2837-2843.
[3] Varga S, Finozzi C, Vestberg M, et al. Arctic arbuscular mycorrhizal spore community and viability after storage in coldconditions[J]. Mycorrhiza, 2015,25(5):335-343.
[4] Alguacil M M, Torrecillas E, Lozano Z, et al. Arbuscular mycorrhizal fungi communities in a coral cay system(Morrocoy, Venezuela) and their relationships with environmental variables.[J]. Science of the Total Environment, 2015, 505:805.
[5] 于淼,毕银丽,张翠青.菌根与根瘤菌联合应用对复垦矿区根际土壤环境的改良后效[J].农业工程学报,2013,29(8):242-248.
[6] 李芳,高萍,段廷玉.AM菌根真菌对非生物逆境的响应及其机制[J].草地学报,2016,24(3):491-500.
[7] 宋福强,杨国亭,孟繁荣,等.丛枝菌根化大青杨苗木根际微域环境的研究[J].生态环境,2004,13(2):211-216.
[8] Phillips J M, Haymen D S. Improved procedures for clearing and staining parasitic and vesicular arbuscular mycorrhizal fungi for rapid assessment of infection [J]. Trans. British Mycol. Society, 1970,55(1):158-161.
[9] Johansen A, Jakobsen I, Jensen E S. External hyphae of vesicular-arbuscular mycorrhizal fungi associated withTrifoliumsubterraneumL.[J]. New Phytologist, 1992, 124(1):371-379.
[10] 鲍士旦.土壤农化分析[M].北京:农业出版社,2000.
[11] 陈婕,谢靖,唐明.水分胁迫下丛枝菌根真菌对紫穗槐生长和抗旱性的影响[J].北京林业大学学报,2014,36(6):142-148.
[12] 崔大练,马玉心,石戈,等.紫穗槐幼苗叶片对不同干旱梯度胁迫的生理生态响应[J].水土保持研究,2010,17(2):178-185.
[13] 王瑾,毕银丽,邓穆彪,等.丛枝菌根对采煤沉陷区紫穗槐生长及土壤改良的影响[J].科技导报,2014,32(11):26-32.
[14] 岳辉,毕银丽,ZhakypbekY,等.接种菌根对神东矿区采煤沉陷地的生态修复效应[J].科技导报,2012,30(36):56-60.
[15] 李少朋,毕银丽,孔维平,等.丛枝菌根真菌在矿区生态环境修复中应用及其作用效果[J].环境科学,2013,34(11):455-4459.
[16]JrDD,NagahashiG,PfefferPE,etal.On-farmproductionofAMfungusinoculuminmixturesofcompostandvermiculite[J].BioresourceTechnology, 2006, 97(6):809-818.
Field Experiment of Ecological Restoration Application of Arbuscular Mycorrhizal Fungi Inoculation onAmorphaFruticosa
YUE Hui1,2, BI Yinli1
〔1.State Key Laboratory of Coal Resources and Safe Mining, China University of Mining and Technology(Bejing), Beijing 100083, China; 2.College of Geomatics, Xi’an University of Science and Technology, Xi’an, Shaanxi 710054, China〕
[Objective] The ecological restoration effect of inoculation ofAmorphafruticosain mining area of degraded vegetation was studied, to provide theoretical basis and field experimental data for the application of arbuscular mycorrhizal fungi in the ecological reconstruction of arid and semi-arid coal mines in Western China. [Methods] TakeAmorphafruticosaas the host plant, the symbiotic status of arbuscular mycorrhizal fungi andAmorphafruticosawas observed in field conditions and the improvement of plant rhizosphere soil in coal mining subsidence area was studied. [Results] Through 4 years continual monitoring, the results showed that the inoculation promoted the growth ofAmorphafruticosa, inoculation survival rate was higher than 30%; the mycorrhizal infection rate and hyphal density of inoculatedAmorphafruticosawere significantly higher than those of the control; the rhizosphere soil available phosphorus of the inoculatedAmorphafruticosaincreased and the pH value decreased. According to these, the ecological restoration effect was achieved. [Conclusion] Under field conditions, mycorrhizal fungi can promote the formation of plant-mycorrhizal symbiosis and improve the nutrient environment of plant-mycorrhizal symbiosis.
arbuscularmycorrhiza;Amorphafruticosa;fieldexperiment;ecologicaleffect;coalminingarea
A
: 1000-288X(2017)04-0001-05
: X171.4
2016-11-26
:2017-01-03
国家自然科学基金项目“西部干旱半干旱煤矿区微生物联合修复机理及其生态响应”(51574253)
岳辉(1983—),男(汉族),山东省淄博市人,博士,讲师,主要从事生态恢复与环境遥感研究。E-mail:13720559861@163.com。
毕银丽(1971—),女(汉族),陕西省米脂县人,教授,博士生导师,主要从事微生物复垦方面的研究。E-mail:ylbi88@126.com。

