羟基哌啶酮抗肿瘤药物的结构及抗肿瘤活性研究
王青龙,王素文,侯桂革,王春华,孙居锋
(滨州医学院, 山东 烟台 264003)
科研与开发
羟基哌啶酮抗肿瘤药物的结构及抗肿瘤活性研究
王青龙,王素文,侯桂革,王春华,孙居锋
(滨州医学院,山东烟台264003)
通过X-ray单晶衍射表征药物(3E,5E)-N-苄基-3,5-二(4-羟基苯亚甲基)-4-哌啶酮盐酸盐(A)的结构。A (C26H24ClNO3, Mr=433.91)结晶在triclinic晶系,P-1空间群,a = 9.8813(4), b = 11.1292(4), c = 12.9552(5) Å, α = 98.058(3)°, β = 108.134(4)°, γ = 107.353(3)°,U=1248.93(8)Å3, Z = 2。CCK-8法评价其对A549、SGC-7901、HePG2、Hela、K562等肿瘤细胞系的抗肿瘤活性及对正常细胞HUVEC的细胞毒性。结果显示,A对SGC7901、K562和Hela的活性较好,其中对K562的抑制活性最好,IC50= 7.86μM。并且对正常细胞HUVEC的细胞毒性较小。
α,β-不饱和酮;抗肿瘤;单晶结构
α,β-不饱和酮结构单元是姜黄素及其衍生物的有效药效团,能够与巯基发生有效的烷基化反应[1-4],表现出较强的抗肿瘤活性。而具有双α,β-不饱和酮药效团的衍生物则能够与巯基发生两次连续的烷基化反应,受到科学家们的广泛关注,认为α,β-不饱和酮药物将是最有潜在应用价值的抗肿瘤药物之一[5-8]。但是大部分的α,β-不饱和酮药物的抗肿瘤活性和生物利用率比较低,导致其临床应用受到限制。尽管如此,孙居锋研究组[8-11]对该类化合物进行了有效的结构改造,利用环己酮或哌啶酮与芳醛发生Claisen-Schmidt缩合将两个α,β-不饱和酮药效团桥连起来,得到一系列具有良好抗肿瘤活性的3,5-二芳亚甲基-4-哌啶酮衍生物。其中候选药物(3E,5E)-N-苄基-3,5-二(4-羟基苯亚甲基)-4-哌啶酮(B)[9]对HL60表现出一定的抑制活性。为深入研究该候选药物的抗肿瘤活性,本研究通过X-Ray单晶衍射表征化合物B的盐酸盐(A)的结构,并利用CCK-8法评价A对A549、SGC-7901、HePG2、Hela、K562等肿瘤细胞系的抗肿瘤活性及对正常细胞HUVEC的细胞毒性。此外,通过共聚焦显微成像技术,实时检测K562细胞对药物A的体外的摄取情况,初步探究细胞对药物的摄取量与时间和浓度的关系。
图1 A的分子结构
1 实验部分
1.1 试剂
化合物A根据文献方法制得[9],二甲基亚砜(分析纯,国药集团化学试剂有限公司)、顺铂(DDP,注射用顺铂,齐鲁制药)。
1.2 单晶测试
取化合物A的0.30×0.28×0.26 mm的单晶,粘在洗玻璃丝上,298(2) K条件下在Bruker SMART APEX CCD型单晶衍射仪上测得。CCDC:1051620,C26H24ClNO3,Mr=433.91,triclinic晶系,P-1空间群,a = 9.8813(4),b=11.1292(4), c=12.9552(5)Å,α = 98.058(3)°, β = 108.134(4)°, γ = 107.353(3)°,U = 1248.93(8)Å3, Z = 2.Dc = 1.154 g·cm-3,μ(Mo-Kα) = 0.178 mm-1,T=298(2) K. 4392 unique reflections [Rint=0.0000]. Final R1[with I > 2σ (I)]=0.0479, wR2(all data) = 0.1447。
1.3 抗肿瘤活性测试
选用肿瘤细胞系5种:人胃癌细胞系SGC7901、人肺癌细胞株A549、人肝癌细胞株HePG2、人慢性髓原白血病细胞K562和人宫颈癌细胞HeLa。选用正常细胞株1种:人脐静脉内皮细胞HUVEC。CCK-8法[8]实验:取细胞1×104/100μL,接种于96孔培养板内,37℃条件培养24h, 20 L不同浓度的A加入,继续培养48h,然后每孔加入10 μL的CCK-8溶液,37 ℃孵育4h,酶标仪检测450 nm处的吸光度,计算IC50值。A的浓度分别是200、100、10、1、0.1、0.01 μg/mL。阳性对照药DDP,浓度分别是200,20,2.0,0.20,0.020 μg/mL。
2 结果与讨论
2.1 结构分析
本研究中,A溶于甲醇溶液后置于室温下结晶得到块状晶体,A结晶在triclinic晶系,P-1空间群。扭转角θC4-C6-C7-C8 = -21.7(4)° 和θC11-C13-C14-C16 = 15.4(4)°,因此化合物表现为E, E构型。据文献报道,该类化合物均以E, E构型为最稳定的构型[8,12]。从而导致哌啶酮两侧的两个芳基苯环基本共面,它们之间的二面角只有5.74(5)°。哌啶酮N上的苄基取代基为A的辅助药效团,它与哌啶酮环的二面角较大,为51.207(67)°,而与分子两侧的芳环间的二面角却只有36.789(80)°和34.887(71)°。有趣的是,A分子中氮原子上形成了盐酸盐,从而导致该分子在水中有一定的溶解度,而在非极性溶剂如丙酮、乙醚中溶解度较差。如图1所示,游离的氯离子通过氢键作用将A链接起来,形成沿晶体学b轴的一维链状结构。具体地,氯原子分别与O-H和N-H形成N1-H1···Cl1 和O2-H2···Cl1氢键,与C9-H9和C20-H20形成两组非经典氢键C9-H9B···Cl1和C20-H20B···Cl1,另外,一维链状结构中,还有一组分子间氢键,C20-H20A···O2。具体的氢键键长和键角列于表1中。
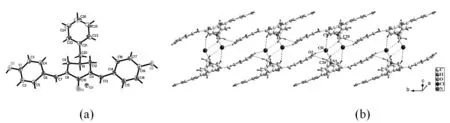

图2 (a) A的分子结构; (b)通过分子间氢键连接成的一维链状结构
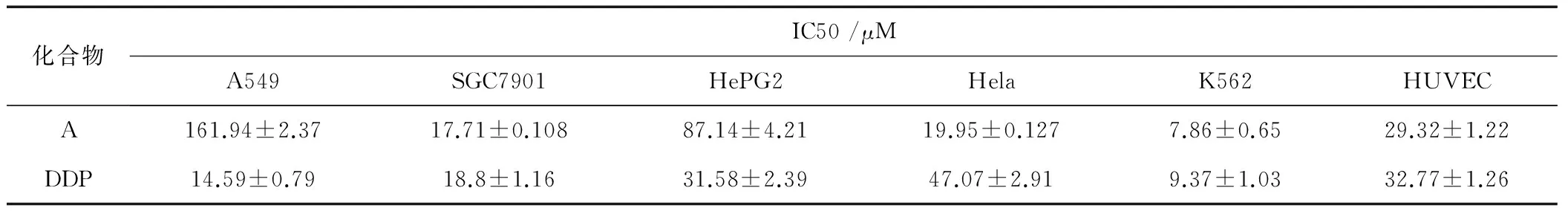
表2 A的抗肿瘤活性和细胞毒性
2.2 抗肿瘤活性及细胞毒性分析
如表2得知,A对A549、SGC7901、K562、Hela、HePG2等肿瘤细胞均具有显著的抑制活性。以DDP作为对照,药物对不同的肿瘤细胞系呈现出不同的抑制活性,药物A对SGC7901、K562和Hela的抑制活性较好, IC50值小于20 μM,均优于DDP。其中对人慢性髓原白血病细胞K562的抑制活性最好, IC50=7.86 μM。而对A549和HePG2表现出较弱的抑制活性。为验证A对正常细胞的细胞毒性,我们选择人脐静脉内皮细胞HUVEC细胞来进一步测试。如表2所示,对HUVEC的毒性IC50值为29.32 μM,大于对照组DDP的细胞毒性(32.77 μM),说明A对HUVEC有一定的毒性。但远小于对肿瘤细胞系的毒性作用。结果显示,A对部分肿瘤细胞系有较好的抗肿瘤活性,特别是K562,但对正常细胞的毒性较小,说明A作为抗肿瘤药物的候选药物,具有潜在的应用价值。
3 结论
本文报道了 (3E,5E)-N-苄基-3,5-二(4-羟基苯亚甲基)-4-哌啶酮盐酸盐(A)的单晶结构。CCK-8法评价药物对SGC7901、K562和Hela的抑制活性较好,并且对HUVEC的毒性较小。该研究为开发自主知识产权的新型抗肿瘤候选药物提供了有利素材。
[1] Zhang X F, Sun W, Pei W. Research progress on the chemistry of α,β-unsaturated ketones[J]. Zhejiang Chemical Industry, 2008, 39(3):15-20.
[2] Yu M R, Jiang F C, Ding Z S. Advances in studies on curcumin[J].Chin Herbal Drugs, 2009, 40(5): 828-831.
[3] Yin D F. α,β-不饱和酮与不饱和羧酸类香料的合成及其在卷烟中的应用[D]. 长沙:湖南师范大学, 2010.
[4] El-Subbagh H I, Abu-Zaid S M, Mahran M A, et al. Synthesis and biological evaluation of certain α,β-unsaturated ketones and their corresponding fused pyridines as antiviral and cytotoxic agents[J]. J Med Chem, 2000, 43: 2915-2921.
[5] Das U, Sakagami H, Chu Q, et al. 3,5-Bis(benzylidene)-1-[4-2- (morpholin-4-yl)ethoxyphenylcarbonyl]-4 -piperidone hydrochloride: a lead tumor-specific cytotoxin which induces apoptosis and autophagy[J]. Bioorg Med Chem Lett, 2010, 20(3): 912-917.
[6] Li H C, Yang X M, Wang P, et al. Synthesis of α,β-unsaturated ketone derivates[J]. Chemical Reagents, 2009, 31(11):933-935.
[7] Wang M, Ruan Y X, Peng Y, et al. Study of cell toxicity of dauricine on daudi cells based on atomic force microscope[J]. J Instrum Anal,2011,30(2):121-127.
[8] Sun J F, Zhang S P, Yu C, et al. Design, synthesis and bioevaluation of novel N-substituted-3, 5-bis(arylidene)-4-piperidone derivatives as cytotoxic and antitumor agents with fluorescent properties[J]. Chem Biol Drug Des, 2014, 83: 392-400.
[9] Sun J F, Li K K, Zhang S P. Synthesis and cytotoxicity study of N-benzyl-3,5-bis(Arylmethylene) -4-piperidones [J]. Chin Pharm J,2012,47(19):1588-1591.
[10] Gu S X, Yao K L, Gu Y H. Study on the synthesis and antibacterial aactivity of MANNICH mannich bases containing α,β-unsaturated ketone[J]. Acta Pharmaceutica Sinica, 1997 , 32 (1): 38-42.
[11] Sun J F, Li K K, Yu C, et al. Synthesis and characterization study of N-substitution-3,5-bis(arylmethylene)-4-piperidones[J]. Chemical Reagents, 2011, 07:613-616.
(本文文献格式:王青龙,王素文,侯桂革,等.羟基哌啶酮抗肿瘤药物的结构及抗肿瘤活性研究[J].山东化工,2017,46(16):1-2,4.)
Structure and Antitumor Activities of Hydroxy-Substituted Piperidone Antitumor Drugs
Wang Qinglong,Wang Suwen,Hou Guige,Wang Chunhua,Sun Jufeng*
(School of Pharmacy,Binzhou Medical University,Yantai 264003,China)
(3E,5E)-N-benzyl-3,5-bis(4-hydroxybenzylidene)-4-Piperidone (A) was characterized by X-ray diffractometer. A (C26H24ClNO3,Mr=433.91) belongs to the triclinic system, space group P-1 with a = 9.8813(4), b = 11.1292(4), c = 12.9552(5) Å, α = 98.058(3)°, β = 108.134(4)°,γ=107.353(3)°,U=1248.93(8) Å3, Z=2. The antitumor activities against human neoplastic cell lines A549, HePG2, MCF-7, SGC-7901, OVCA-433 and the cytotoxicity for HUVEC cell lines by CCK-8 method were subsequently evaluated. The antitumor activities against SGC7901, K562 and Hela were better with the lower cytotoxicity against HUVEC cell, while the best one was K562 cells, which IC50=7.86 μM.
α,β-unsaturated ketone; antitumor; single-crystal structure
TQ463;R914
:A
:1008-021X(2017)16-0001-02
2017-06-11
山东省自然科学基金(No. ZR2014BL008),烟台市科技计划(2015WS010)
王青龙,硕士研究生,研究方向:药物合成与活性评价;通信作者:孙居锋,女,硕士,副教授,研究方向:药物合成与活性评价。

