低温锻炼期光周期对笃斯越橘脂肪酸和碳水化合物含量的影响
乌凤章
低温锻炼期光周期对笃斯越橘脂肪酸和碳水化合物含量的影响
乌凤章
(大连大学现代农业研究院,辽宁大连116622)
利用气质联用法和高效液相色谱法研究低温锻炼期不同光周期处理对笃斯越橘(Vaccinium uligiuosum L.)枝条脂肪酸和碳水化合物含量影响,探究抗冻性与脂肪酸和碳水化合物含量关系,阐明抗冻性形成生理生态机制。文章以3年生笃斯越橘苗为材料,将苗木分别置于4℃低温下短日照(10 h)和长日照(14 h)人工环境,处理21 d后测定枝条相对电导率、脂肪酸、可溶性糖及淀粉含量。结果表明,低温和短日照共同作用显著降低饱和脂肪酸含量,提高总不饱和脂肪酸比例和脂肪酸不饱和度。硬脂酸含量和脂肪酸不饱和度与抗冻性有关。低温锻炼期蔗糖、葡萄糖、果糖和总可溶性糖含量显著提高,主要与低温诱导作用有关,受光周期影响较小。低温锻炼期短日照处理对淀粉积累诱导作用显著高于长日照。低温锻炼期温度对笃斯越橘抗冻性起主要作用;短光周期可提高低温锻炼效果,主要与脂肪酸不饱和度提高及淀粉含量增加有关。研究揭示笃斯越橘抗冻性形成的生理生态机制,为越橘属植物抗寒栽培、种质筛选和新品种培育提供理论依据。
笃斯越橘;低温锻炼;脂肪酸;碳水化合物;抗冻性
低温是主要非生物胁迫因子,限制植物生产率和地理分布。绝大多数温带植物通过低温锻炼获得对极端低温气候适应能力。木本植物一般对光周期高度敏感。通过缩短光周期和降温可提高植物抗冻性[1],如短日照和低温对垂枝桦低温锻炼具有加性效应,可提高其抗冻性[2]。但Erwin等发现欧洲赤松、樟子松抗冻性分别由短日照和低温独立诱导,不具有加性效应[3-4];红树莓和楸树低温锻炼则不受光周期而受低温影响[5-6]。光周期与低温对多年生木本植物低温锻炼诱导作用存在种间特异性。此外,生长在不同纬度及小环境下同种植物个体对光周期响应也存在差异性,形成不同抗冻性生态型[7-8]。
木本植物低温锻炼过程复杂,涉及多种生理生化过程。植物细胞膜结构和稳定性与植物抗冻性密切相关。植物遭受低温胁迫时,生物膜系统最先受到伤害。植物抗冻性与膜脂组分和结构有关[9]。John等研究表明,不饱和脂肪酸含量随温度降低而增加;随不饱和脂肪酸积累,植株抗冻性不断增强[10]。植物暴露于低温条件导致碳水化合物积累[11]。可溶性糖在低温胁迫解除后可作为直接能源,也可作为稳定细胞膜渗透保护剂并保持膨压[12]。蔗糖、葡萄糖和果糖在低温锻炼初期含量显著提高,而棉子糖家族寡糖(棉子糖和水苏糖)与几种木本植物低温锻炼后期及季节性抗寒性相关[13]。
笃斯越橘主要分布在我国长白山及大小兴安岭,其果实较高丛越橘含抗氧化成分更高[14],且抗冻性极强,可达-35℃。因此作为野生植物资源和越橘属植物遗传改良重要亲本材料受到重视,但其抗冻生理及分子机制尚不清楚。低温锻炼期光周期对笃斯越橘枝条脂肪酸组成和含量以及碳水化合物含量影响,其变化情况与抗冻性形成关系尚不清晰。通常光周期作用部位是植物叶片,可诱导其他器官如花芽、枝条代谢。因此,本文以3年生笃斯越橘为材料,采用气质联用和高效液相色谱方法测定、分析低温锻炼期不同光周期处理21 d后幼苗枝条脂肪酸、碳水化合物含量及组成,以期阐明低温锻炼期光周期诱导抗冻性形成生理机制,为越橘属植物栽培和抗冻育种提供依据。
1 材料与方法
1.1 材料及处理
笃斯越橘苗来自黑龙江省黑河市嫩江县多宝山镇,苗龄3年,苗平均高40 cm。
预处理:选取生长良好且规格相对一致的100株笃斯越橘苗,栽植在营养钵(高16 cm、上口径16 cm,栽培基质为草炭土)中。2016年9月10日将苗木置于人工气候室(PQX-1000 C,宁波东南仪器制造厂)预处理。处理温度23℃,光照强度180 μmol·(m2·s)-1,光周期10 h/14 h(昼/夜),空气湿度75%/65%(昼/夜)。预处理21 d后,分别取9株苗木当年生枝条(不带花芽及叶片),每3株混合取样,3次重复,测定各项生理指标,所得数值为对照(CK)。
低温下不同光周期处理:分为低温下短日照与低温下长日照处理。将苗木分置于2个人工气候室,温度4℃,光照强度180 μmol·(m2·s)-1,空气湿度为75%/65%(昼/夜),光周期分别为10 h/14 h(昼/夜)和14 h/10 h(昼/夜)。预处理温度以每小时下降2℃降至处理温度。处理期间,适时浇水,使栽培基质保持湿润。在低温下不同光周期处理21 d后,取样,每个处理3次重复,测定各项生理指标。所有用于脂肪酸和可溶性糖测定的样品经液氮迅速冷冻后,于-80℃超低温冰箱保存。
1.2 方法
1.2.1 相对电导率测定
首先用清水冲洗样品去除表面污染物,再用去离子水冲洗3次,吸干表面水分,封口塑料袋分装后分别置于低温冰箱中低温处理。共设置3个低温处理组:-15℃、-20℃和-25℃。每小时降温4℃,到达设定温度后保持24h,取出放入4℃冷藏室解冻24h。参考高俊凤方法,测定相对电导率[15]。
1.2.2 脂肪酸含量测定
脂肪酸组成和含量由苏州帕诺米克生物科技有限公司代测。
样品预处理(甲酯化):准确称取枝条100 mg,加入1 mL氯仿甲醇溶液,1%的硫酸-甲醇溶液2 mL,80℃水浴,甲酯化0.5 h,再加1 mL正己烷萃取,5 mL纯水洗涤,吸取上清液500 μL,加内标25 μL(500 ppm水杨酸甲酯),振荡后进样。
GC/MS检测程序:使用Agilent 7890A/5975C气质联用仪(安捷伦,美国)测定。
色谱条件:色谱柱agilent DB-WAX毛细管柱(30 mm×0.25 mm ID,0.25 μm);分流进样,进样量1 μL,分流比10:1。进样口温度280℃,离子源温度230℃;传输线温度250℃。程序升温起始温度50℃;保持3 min,每分钟升高10℃直至220℃,保持20 min。载气为氦气,载气流速1.0 L·min-1。以Sigma Supelco 37种脂肪酸甲酯混标溶液作为外标,作脂肪酸定量计算。
MS条件:电子轰击电离(EI)源,SIM扫描模块式,电子能量70 eV。
样品分析:根据上述样品前处理及分析方法,对各样品作脂肪酸检测分析,使用MSD ChemStation计算各样本检测浓度,最终根据称样量折算脂肪酸实际含量。
本试验中总饱和脂肪酸含量(SFA)和总不饱和脂肪酸含量(USFA)分别指测定得到的饱和脂肪酸含量和不饱和脂肪酸含量总和。
脂肪酸不饱和指数(IUFA)=C18:1+C18:2×+ C18:3N6×3+C18:N3×3+C20:1+C20:4×4+C20:3× 3+C20:5×5+C22:1。
1.2.3 可溶性糖及淀粉含量测定
可溶性糖提取方法:称取枝条样品0.5 g,放入研钵中,加入1 mL预冷提取液,冰浴匀浆后,转移至2 mL离心管中,冰浴超声15 min,4℃下8 000 g离心10 min,取上清,定容,用针头式过滤器过滤于具有内衬管样品瓶内待测。
HPLC液相条件:Rigol L3000高效液相色谱仪,Kromasil C18反相色谱柱(250 mm×4.6 mm,5 μm),配制流动相。进样量10 μL,流速0.6 mL·min-1,柱温80℃,走样时间30 min。
蔗糖、葡萄糖和果糖标准品由美国Sigma公司提供。以标准品质量浓度为横坐标,标准品峰面积为纵坐标,绘制峰面积-质量浓度工作曲线。每个浓度重复3次。采用外标法,通过糖标准品保留时间和标准曲线确定蔗糖、葡萄糖和果糖含量。
本试验中总可溶性糖含量指以上几种糖总和。淀粉含量采用硫酸-蒽酮比色法测定。
1.3 数据分析
应用SPSS 22.0统计软件对数据作差异显著性分析与多重比较、简单相关分析,用Excel 2010绘制数据图表。文中相关分析中相对电导率为枝条经-25℃处理后数据,以平均值±标准误表示。
2 结果与分析
2.1 光周期对不同低温处理后枝条相对电导率影响
由表1可知,低温锻炼期不同光周期处理21 d笃斯越橘枝条在不同低温处理后,相对电导率显著均低于对照(P<0.05);短日照处理相对电导率低于长日照,且-20℃处理前显著低于处理后。此外,随着处理温度降低,各处理枝条相对电导率呈上升趋势,与-15℃胁迫处理相比,-20℃胁迫处理后缓慢增加;-25℃胁迫处理后,短日照以及长日照处理后相对电导率较-20℃分别显著增加110.29%和108.76%(P<0.05),接近半致死温度。表明低温锻炼降低枝条细胞膜相对电导率,提高抗冻性。低温在诱导抗冻性形成中起主要作用,短日照处理增强低温锻炼效果。
2.2 低温和光周期对枝条脂肪酸组分及含量影响
2.2.1 脂肪酸组分含量变化
通过GC/MS技术检测低温锻炼前后笃斯越橘枝条中脂肪酸组分共有24种(见表2)。其中饱和脂肪酸(SFA)15种,占脂肪酸总量73.65%~77.95%,主要为棕榈酸、硬酯酸、花生酸、山嵛酸、二十四烷酸和肉豆蔻酸,其中棕榈酸和硬酯酸含量分别占总脂肪酸37.25%~39.00%和27.73%~31.18%。不饱和脂肪酸(USFA)9种,占脂肪酸总量22.15%~26.35%,主要为亚麻酸、亚油酸和油酸,分别占总脂肪酸10.99%~12.92%、7.53%~9.71%和1.99~ 2.97%。其他组分含量不等且变化趋势不同,其协同作用引起饱和脂肪酸和不饱和脂肪酸总量变化。
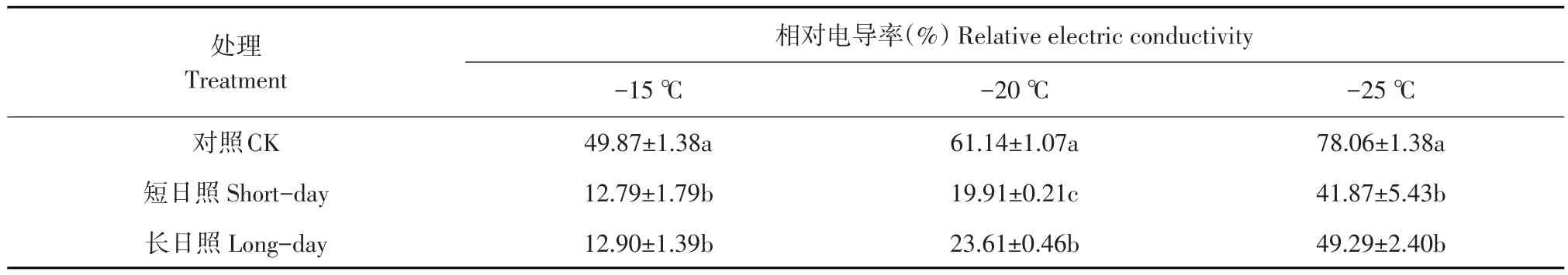
表1 光周期对笃斯越橘枝条相对电导率影响Table 1 Effect of photoperiod on the relative electric conductivity(REC)in shoot of Vaccinium uligiuosum L.
与对照相比,低温锻炼期不同光周期处理后总饱和脂肪酸含量呈下降趋势,短日照比对照处理显著降低16.33%,而长日照比对照处理降低7.79%。短日照处理后,棕榈酸和硬酯酸含量显著低于对照(P<0.05),而长日照处理后与对照差异不显著;低温锻炼后花生酸含量变化不显著;长日照处理后山嵛酸和二十四烷酸含量显著高于对照(P<0.05),而在短日照处理后与对照差异不显著;不同光周期处理下肉豆蔻酸含量与对照差异不显著。表明低温锻炼期不同光周期处理下饱和脂肪酸含量变化趋势不同,但短光周期处理显著降低总饱和脂肪酸含量,而长光周期处理对总饱和脂肪酸合成无显著影响。
与对照相比,低温下不同光周期处理后亚麻酸含量均增加,但与对照差异不显著;低温下长日照处理后,亚油酸含量显著高于对照(P<0.05),而短日照处理后与对照差异不显著;在两种光周期处理下油酸含量均减少,但与对照相比差异不显著;总不饱和脂肪酸含量增加不显著。但总不饱和脂肪酸含量占总脂肪酸含量比例即相对含量在短日照处理后显著提高18.96%;长日照处理后提高16.63%,与对照相比差异不显著,说明低温下光周期处理对总不饱和脂肪酸含量影响较小,但短光周期处理显著提高总不饱和脂肪酸比例。
2.2.2 脂肪酸相关指标分析
由表3可知,在低温下不同日照条件处理后,IUFA相比对照有所增加,分别提高5.60%和11.63%,但差异不显著,说明低温下光周期对IUFA影响较小。在低温下不同光周期处理后USFA/SFA分别比对照提高28.57%和21.43%,方差分析表明前者显著高于对照(P<0.05),而后者与对照无显著差异。这说明低温下短日照处理对USFA/SFA影响大于长日照。低温不同光周期处理下,C18:3/(C18:1+C18:2)和C18:3/(C18:1+C18:2+C18:3)与对照无显著差异;C18:2/(C18:1+C18:2+C18:3)不同程度提高,其中长光周期处理显著高于对照,而短光周期处理与对照无显著差异。说明低温锻炼期光周期对亚麻酸合成无影响;长光周期处理比短光周期处理对亚油酸合成影响较大。
2.3 低温下不同光周期与枝条抗冻性的关系
2.3.1 脂肪酸指标之间关系
由表4可知,C18:1与C18:3/(C18:1+C18:2)呈显著负相关,与C18:3/(C18:1+C18:2+C18:3)呈极显著负相关。C18:2与C18:3和C18:2/(C18:1+ C18:2+C18:3)呈显著正相关。IUFA与C18:2和C18:3呈极显著正相关。C18:3/(C18:1+C18:2)与C18:3/(C18:1+C18:2+C18:3)呈极显著正相关。这说明C18:1、C18:2、C18:3、C18:3/(C18:1+C18:2+C18:3)、C18:3/(C18:1+C18:2)以及IUFA可共同反映低温锻炼后细胞膜稳定性变化情况。
2.3.2 脂肪酸指标与相对电导率之间关系
考虑到-25℃处理后相对电导率接近50%(半致死温度),更能反映抗冻性强弱,所以采用该组数据作相关分析。由表4可知,相对电导率与USFA/SFA均呈显著负相关;硬脂酸与相对电导率呈显著正相关。低温下不同光周期处理诱导棕榈酸、硬脂酸、花生酸及总饱和脂肪酸含量降低,亚麻酸、亚油酸以及总不饱和脂肪酸含量增加,USFA/SFA值升高,导致相对电导率降低,表明低温下不同光周期通过调节脂肪酸组分含量变化而维持膜稳定,提高抗冻性。

表2 低温锻炼期不同光周期处理下笃斯越橘枝条中脂肪酸组分及含量Table 2 Fatty acid components and contents in shoot of Vaccinium uligiuosum L.under different photoperiod during cold acclimation
2.4 低温和光周期处理对枝条碳水化合物含量影响
由表5可知,在低温2种光周期处理下,笃斯越橘枝条蔗糖含量显著高于其他2种可溶性糖含量;总可溶性糖含量以及蔗糖、葡萄糖和果糖含量均显著高于对照(P<0.05),但2种光周期处理之间差异不显著。表明碳水化合物含量主要由低温诱导提高。低温不同光周期处理下淀粉含量及总糖/淀粉显著高于对照(P<0.05),而且低温短日照处理淀粉含量显著高于低温长日照处理(P<0.05),低温下短日照处理总糖/淀粉显著低于低温下长日照处理(P<0.05),表明低温短日照处理更有利于淀粉积累。

表3 低温锻炼期不同光周期处理下笃斯越橘枝条中主要不饱和脂肪酸相关指标分析Table 3 Analysis on index related to major unsaturated fatty acids in branch of Vaccinium uligiuosum L.under different photoperiod during cold acclimation

表4 不同光周期处理下笃斯越橘枝条中脂肪酸指标间及其与相对电导率的相关系数Table 4 Correlation coefficients of fatty acid indexes and REC under different photoperiod

表5 低温锻炼期光周期对笃斯越橘枝条碳水化合物含量影响Table 5 Content of carbohydrate in shoot of Vaccinium uligiuosum L.under different photoperiod during cold acclimation(mg·g-1FW)
2.5 碳水化合物含量与相对电导率相关性
由表6可知,笃斯越橘枝条蔗糖、葡萄糖、果糖和总可溶性糖含量及总糖/淀粉与相对电导率之间呈极显著性负相关,淀粉含量与相对电导率呈显著负相关。表明低温下不同光周期处理可诱导可溶性糖及淀粉大量合成,其含量与抗冻性关系密切。

表6 低温锻炼期光周期处理下笃斯越橘枝条中碳水化合物与相对电导率相关系数Table 6 Correlation coefficients of fatty acid indexes and REC under different photoperiod during cold acclimation
3 讨论
3.1 低温和光周期对抗冻性形成的影响
低温锻炼与温带地区落叶木本植物抗冻性密切相关。通过低温和短日照共同作用对植物生理、代谢和转录水平产生影响,增加木本植物抗冻性。转基因杂种白杨由短日照和低温独立诱导抗冻性形成,光敏色素A(PHY A)参与光周期感知[16];苹果、梨等光周期不敏感蔷薇科植物低温锻炼仅与低温有关,与光周期无关[17]。本研究中,低温不同光周期处理均提高枝条抗冻性,低温短日照处理抗冻性强于长日照,表明低温在笃斯越橘抗冻性形成中起主要诱导作用,短光周期增强低温诱导效果。植物低温锻炼通常由CBF依赖或CBF独立途径介导,其中CBF依赖途径在调节低温度锻炼中起主要作用[18]。光周期对CBF基因表达至关重要。长日照条件下草本植物拟南芥CBF基因表达受到抑制,而短日照下抑制解除,诱导CBF基因表达和低温锻炼,提高植株抗冻性[19]。木本植物笃斯越橘低温锻炼是否由光周期控制CBF依赖途径介导尚不清楚,需进一步研究探讨。
3.2 低温下光周期对枝条脂肪酸组分及含量影响
在低温锻炼过程中,膜脂脂肪酸含量及比例对膜稳定性有重要影响。细胞膜参与代谢和营养成分交换[20]。细胞膜向植物传送环境刺激信号,在调节植物细胞运输和信号转导中起重要作用[21]。李志辉等发现桉树、龙眼叶片脂肪酸主要组成基本相同,且亚麻酸、棕榈酸和亚油酸含量较高[22-23]。本试验中,经检测发现笃斯越橘枝条中存在24种脂肪酸,主要含量依次为棕榈酸>硬脂酸>亚麻酸>亚油酸>油酸>花生酸>山嵛酸>二十四烷酸>肉豆蔻酸,与茶树叶片中亚麻酸>棕榈酸>亚油酸>油酸>硬脂酸>棕榈油酸研究结果不同[24];此外本试验鉴定到脂肪酸数量更多,可能与物种、植物器官以及鉴定方法不同有关。本试验利用基于气相色谱-质谱(GC-MS)技术代谢组学平台,监测到低温锻炼过程脂肪酸种类、含量变化,可准确、高效揭示植物组织脂肪酸对低温及光周期因子复杂响应。
脂肪酸不饱和度增加是生物体对气温下降普遍反应,与抗冻性密切相关。耐冻植物含有高比例不饱和脂肪酸。高寒山区牧草、苜蓿研究发现低温可改变膜脂脂肪酸组成比例,诱导不饱和脂肪酸相对含量提高,增加亚油酸、亚麻酸等相对含量[25-26]。本试验中,低温下短光周期处理显著降低硬脂酸、棕榈酸及总饱和脂肪酸含量和比例,显著提高总不饱和脂肪酸比例和脂肪酸不饱和度,而长光周期处理对其影响较小,表明短光周期与低温共同作用通过调整膜脂肪酸组分含量和比例,改善膜流动性,提高抗冻性,与胡兹苓等对杨树研究结果一致[27]。此外,在本试验中,低温锻炼后山萮酸含量增加,因其作为表皮蜡质成分而非膜脂肪酸[28],与羽衣甘蓝低温锻炼后山萮酸含量提高结果一致[29]。
某些脂类物质相对丰度与植物抗冻性密切相关,可作为鉴定植物抗冻性指标[30]。本试验低温锻炼后硬脂酸含量和脂肪酸不饱和度变化较大,与冰冻温度处理后相对电导率呈显著负相关,可反映抗冻性强弱,作为笃斯越桔抗冻性脂肪酸指标。这与前人对其他植物研究结论不同,如亚麻酸和棕榈酸可作为冬小麦抗冻指示性脂肪酸[31],葡萄茎以棕榈酸和亚油酸为指示性脂肪酸[32],菊花叶片中亚麻酸/(亚油酸+油酸)可作为鉴定秋菊品种抗寒性有效指标[30]。
3.3 低温下光周期对碳水化合物含量影响
低温锻炼期间细胞膜稳定性与渗透平衡有关。为保持渗透平衡,降低凝固点,结合和保护特定分子,植物积聚各种抗冻保护剂,如棉子糖、果糖等。油菜叶可溶性糖在低温锻炼期间随着抗冻性增强而显著积聚[33]。此外蔗糖积累对低温锻炼过程能量驱动尤为重要。本试验低温下不同光周期处理诱导蔗糖、葡萄糖、果糖,尤其是蔗糖大量积聚,且与抗冻性提高有关。高糖积聚源于低温锻炼下光合作用大于呼吸作用,叶中糖积累转移到枝条中,这与2个高丛越橘品种在低温锻炼前期可溶性糖变化情况基本一致[34],也与芦竹低温锻炼后蔗糖、葡萄糖和果糖含量显著升高结果一致[35]。
淀粉降解在抗冻性中具有重要作用。通过淀粉酶作用淀粉分解形成糖,维持碳水化合物代谢,用于保护性物质合成和光合作用停止时能量补充[36]。施征等研究中,低温锻炼期淀粉含量增加,随着环境温度继续下降淀粉含量下降,当春季植物开始生长时再次升高[37]。越冬过程淀粉含量与植物抗冻性相关程度不高[38]。本试验低温锻炼期温度为零度以上,植株叶片无脱落,仍可进行光合作用,但生长停止,光合作用所产碳水化合物多于植物生长需求,以淀粉形式积累。通过光合产物转移及转换,枝条中淀粉含量明显增加,且与抗冻性关系密切。与本研究相似,八仙花属植物落叶前枝条淀粉含量提高,落叶后淀粉降解[39]。此外,本试验中低温短日照处理后淀粉积累量显著高于长日照,但二者均显著高于对照,与光周期诱导休眠过程油桃叶淀粉含量变化规律相同[40]。淀粉积累可能由短日照诱导淀粉合成酶基因上调表达引起,与外界温度关系较小[41]。淀粉含量增加,有利于低温下枝条进入“深过冷”状态,维持细胞水分,保证温度在同质晶核点前不结冰[42]。
4 结论
低温与短日照共同作用显著降低笃斯越橘枝条中饱和脂肪酸含量,显著提高不饱和脂肪酸比例和脂肪酸不饱和度。硬脂酸含量和脂肪酸不饱度与抗冻性关系密切。低温锻炼期间笃斯越橘枝条中蔗糖、葡萄糖、果糖含量显著提高,主要与低温诱导相关,而与光周期无显著关联。短日照诱导淀粉积累量显著大于长日照。低温在笃斯越橘低温锻炼期诱导抗冻性形成中起主要作用,短光周期可提高低温锻炼效果,即低温和短日照对低温度锻炼具有加性效应,主要与脂肪酸不饱和度提高及淀粉含量增加有关。
[1]Hellergren J.Cold acclimation of suspension cultures of pinus sylvestris in response to light and temperature treatments[J].Plant Physiology,1983,72(4):992-995.
[2]Li C,Puhakainen T,Welling A,et al.Cold acclimation in silver birch(Betula pendula)development of freezing tolerance in different tissues and climatic ecotypes[J].Physiologia Plantarum, 2002,116(4):478-488.
[3]Erwin H B,Richard H,Jens H.Plant resistance to cold stress: Mechanisms and environmental signals triggering frost hardening and dehardening[J].Journal of Biosciences,2004,29(4):449-459.
[4]王爱芳,张钢,魏士春,等.温度与光周期对樟子松实生苗针叶抗寒性的影响[J].中国农学通报,2007,23(2):156-161.
[5]Palonen P.Vegetative growth,cold acclimation,and dormancy as affected by temperature and photoperiod in six red raspberry (Rubus idaeus L.)cultivars[J].European Journal of Horticultural Science,2006,71(1):1-6.
[6]邸葆,孟昱,张钢,等.不同光周期和温度对楸树电阻抗参数的影响[J].河北农业大学学报,2013,36(5):54-59.
[7]Kwit M C,Rigg L S,Goldblum D.Sugar maple seedling carbon assimilation at the northern limit of its range:The importance of seasonal light[J].Canadian Journal of Forest Research,2010,40 (2):385-393.
[8]Malyshev A V,Henry H,Kreyling J.Relative effects of temperature vs.photoperiod on growth and cold acclimation of northern and southern ecotypes of the grass Arrhenatherum elatius[J].Environmental&Experimental Botany,2014,106(1):189-196.
[9]Nishida I,Murata,N.Chilling sensitivity in plants and cyanobacteria:The crucial contribution of membrane lipids[J].Annual Review of Plant Physiology&Plant Molecular Biology,1996,47 (1):541-568.
[10]John R,Anjum N A,Sopory S K,et al.Some key physiological and molecular processes of cold acclimation[J].Biologia Plantarum, 2016,60(4):1-16.
[11]卢精林,李丹,祁晓婷,等.低温胁迫对葡萄枝条抗寒性的影响[J].东北农业大学学报,2015,46(4):36-43.
[12]孙永梅,刘丽杰,冯明芳,等.植物在低温胁迫下的糖代谢研究进展[J].东北农业大学学报,2015,46(7):95-108.
[13]Krasensky J,Jonak C.Drought,salt,and temperature stressinduced metabolic rearrangements and regulatory networks[J]. Journal of Experimental Botany,2012,63(4):1593-1608.
[14]Kraujalyte V,Venskutonis P R,Pukalskas A,et al.Antioxidant properties,phenolic composition and potentiometric sensor array evaluation of commercial and new blueberry(Vaccinium cory-mbosum)and bog blueberry(Vaccinium uliginosum)genotypes[J]. Food Chemistry,2015,188:583-590.
[15]高俊凤.植物生理学实验指导[M].北京:高等教育出版社, 2006.
[16]Welling a A,Moritz T,Palva E T,et al.Independent activation of cold acclimation by low temperature and short photoperiod in hybrid aspen[J].Plant Physiology,2002,129(4):1633-1641.
[17]Heide O M,Prestrud A K.Low temperature,but not photoperiod, controls growth cessation and dormancy induction and release in apple and pear[J].Tree Physiology,2005,25(1):109-114.
[18]Polashock J J,Arora R,Peng Y,et al.Functional identification of a C-repeat binding factor transcriptional activator from blueberry associated with cold acclimation and freezing tolerance[J].Journal of the American Society for Horticultural Science,2010,135(1): 40-48.
[19]Lee C M,Thomashow M F.Photoperiodic regulation of the C-repeat binding factor(CBF)cold acclimation pathway and freezing tolerance in Arabidopsis thaliana[J].Proceedings of the National Academy of Sciences,USA,2012,109(37):15054-15059.
[20]Cruz R,Sperotto R A,Cargnelutti D,et al.Avoiding damage and achieving cold tolerance in rice plants[J].Food&Energy Security, 2013,2(2):96-119.
[21]苏李维,李胜,马绍英,等.葡萄抗寒性综合评价方法的建立[J].草业学报,2015,24(3):70-79.
[22]李志辉,杨波,黄丽群,等.桉树抗寒性研究—膜脂脂肪酸定量分析[J].中南林学院学报,2006,26(3):28-31.
[23]余泽宁.龙眼叶片膜脂脂肪酸组分与龙眼耐寒性的关系[J].亚热带植物科学,2003,32(2):15-17.
[24]马宁,王玉,周克福,等.自然降温过程中茶树叶片脂肪酸含量分析[J].青岛农业大学学报:自然科学版,2012,29(2):101-105.
[25]周瑞莲,赵哈林.高寒山区牧草根质膜和脂肪酸组分对冷冻低温的适应反应[J].植物生态学报,2001,25(1):115-118.
[26]夏明,刘亚学.低温下苜蓿叶片膜脂脂肪酸组分的研究[J].中国草地,2002,24(6):28-31,37.
[27]胡兹苓,包宏,郭会玲.杨树膜脂脂肪酸和磷脂的组成与抗寒性的关系[J].林业科学,1993,29(6):543-546.
[28]Millar A A,Smith M A,Kunst L.All fatty acids are not equal: discrimination in plant membrane lipids[J].Trends in Plant Science,2000,5(3):95-101.
[29]Steindal A L H,Rødven R,Hansen E,et al.Effects of photoperiod,growth temperature and cold acclimatization on glucosinolates,sugars and fatty acids in kale[J].Food Chemistry,2015,174: 44-51.
[30]王翠丽,李永,崔洋,等.9个秋菊品种叶片脂肪酸组成及其抗寒性评价[J].西北农林科技大学学报:自然科学版,2014,42 (11):61-68.
[31]谢冬微,王晓楠,付连双,等.低温胁迫对冬小麦分蘖节膜脂脂肪酸的影响[J].麦类作物学报,2013,33(4):746-751.
[32]邓令毅,王洪春.葡萄的膜脂和脂肪酸组分与抗寒性关系研究[J].植物生理学报,1982,8(3):273-283.
[33]Dahal K,Kane K,Gadapati W,et al.The effects of phenotypic plasticity on photosynthetic performance in winter rye,winter wheat and Brassica napus[J].physiologia plantarum,2012,144(2): 169-188.
[34]Lee J H,Yu D J,Su J K,et al.Intraspecies differences in cold hardiness,carbohydrate content and β-amylase gene expression of Vaccinium corymbosum during cold acclimation and deacclimation[J].Tree Physiology,2012,32(12):1533-1540.
[35]Pompeiano A,Vita F,Miele S,et al.Freeze tolerance and physiological changes during cold acclimation of giant reed [Arundo donax(L.)][J].Grass&Forage Science,2015,70(1):168-175.
[36]Guy C,Kaplan F,Kopka J,et al.Metabolomics of temperature stress[J].Physiologia Plantarum,2008,132(2):220-235.
[37]施征,任军,曾立雄,等.常绿杂交卫矛越冬期间叶片中非结构性碳水化合物含量变化[J].北方园艺,2014(18):74-77.
[38]Guy C L,Huber J L,Huber S C.Sucrose phosphate synthase and sucrose accumulation at low temperature[J].Plant Physiology, 1992,100(1):502-508.
[39]Majken P,Liu F,Christianr J,et al.Effects of chilling temperatures and short photoperiod on PSII function,sugar concentrations and xylem sap ABA concentrations in two Hydrangea species[J]. Plant Science,2008,175(4):547-555.
[40]李冬梅.光周期诱导设施桃树休眠的生理生化变化及蛋白质组学初探[D].泰安:山东农业大学,2012.
[41]Die J V,Rowland L J.Elucidating cold acclimation pathway in blueberrybytranscriptomeprofiling[J].Environmentaland Experimental Botany,2014,106(1):87-98.
[42]赵昶灵,武绍波,杜孝宇,等.人工低温条件下滇中砀山酥梨休眠花芽及其着生处枝条中糖类含量的变化[J].植物生理学报, 2000,36(5):414-417.
Effect of photoperiod on contents of fatty acids and carbohydrate in shoot ofVaccinium uligiuosumL.during cold acclimation/
WU Fengzhang
(ModernAgriculture ResearchAcademy of Dalian University,Liaoning,Dalian 116622,China)
Effect of photoperiod treatments on the fatty acid contents and carbohydrate contents in shoot ofVaccinium uligiuosumL.during cold acclimation was studied by GC/MS and HPLC,aimed to explore the relationship between freezing resistance and fatty acids or carbohydrate and elucidate the physiological and ecological mechanism of freezing resistance formation.The three-year-old seedlings ofVaccinium uligiuosumL.were selected as the testing materials.The seedlings were exposed to short day(10 h),4℃and long day(14 h),4℃under controlled conditions for 21 d,respectively.The changes of relative conductivity,fatty acid content,soluble sugar content and starch content in shoot after treatments were recorded.The results showed that the saturated fatty acid content was reduced,the proportion of unsaturated fatty acids and fatty acid unsaturation were significantly increased by interaction of low temperature and short day.Stearic acid content and fatty acid unsaturation were associated with the freezing resistance.The contents of sucrose,glucose,fructose and the total solublesugar were increased during cold acclimation,which mainly related to the low temperature,not to photoperiod.The accumulation of starch induced by short day treatment was significantly higher than that induced by long day treatment during cold acclimation.The results indicated that low temperature played a major role for the formation of freezing resistance in shoot ofVaccinium uligiuosumL.during cold acclimation;short photoperiod improved the effect of cold acclimation,which was related to the increasing of the fatty acid unsaturation and the starch content.The results preliminarily revealed the physiological and ecological mechanism of the freezing resistance formation,which provided the theoretical evidence to some extents for the cultivation of cold resistance,screening of germplasm and the breeding of new variety inVaccinium.
Vaccinium uligiuosumL.;cold acclimation;fatty acid;carbohydrate;freezing resistance
S663.9
A
1005-9369(2017)08-0051-09
时间2017-9-12 11:37:29[URL]http://kns.cnki.net/kcms/detail/23.1391.S.20170912.1137.014.html
乌凤章.低温锻炼期光周期对笃斯越橘脂肪酸和碳水化合物含量的影响[J].东北农业大学学报,2017,48(8):51-59.
Wu Fengzhang.Effect of photoperiod on contents of fatty acids and carbohydrate in shoot ofVaccinium uligiuosumL.during cold acclimation[J].Journal of Northeast Agricultural University,2017,48(8):51-59.(in Chinese with English abstract)
2017-06-13
辽宁省自然科学基金(2015020785);大连市科技计划项目(2015B11NC084)
乌凤章(1965-),男,副教授,硕士生导师,研究方向为果树抗逆生理及分子生物学。E-mail:wfz1965@126.com

