PLEKHQ1基因敲除小鼠的永生化骨髓来源巨噬细胞系的建立*
陆 琤 周晨辰 张鹏飞 张 硌 查玉华*
PLEKHQ1基因敲除小鼠的永生化骨髓来源巨噬细胞系的建立*
陆 琤①周晨辰①张鹏飞①张 硌①查玉华①*
目的:建立PLEKHQ1基因敲除小鼠的永生化骨髓来源巨噬细胞系,为PLEKHQ1基因功能的研究奠定基础。方法:用慢病毒感染的方法将包装质粒pCDH-SV40/GFP导入野生型和PLEKHQ1基因敲除小鼠的骨髓来源巨噬细胞,建立永生化细胞系;观察永生化细胞的生物学性状,用聚合酶链反应(PCR)检测目的基因的整合,用RT-PCR鉴定目的基因的表达,并对永生化和非永生化骨髓来源巨噬细胞的生长状况进行比较。结果:构建的骨髓来源巨噬细胞系已扩大培养并稳定传代,经鉴定,SV40LT抗原已整合入细胞并稳定表达。结论:通过慢病毒感染细胞的方法成功构建了PLEKHQ1基因敲除小鼠的永生化骨髓来源巨噬细胞系。
PLEKHQ1基因敲除小鼠;骨髓来源巨噬细胞;永生化;SV40LT抗原
基因PLEKHQ1(pleckstrin homology domain containing,family Q member 1),又被称为基因PLEKHO2(pleckstrin homology domain containing,family O member 2),是一种包含490个氨基酸的蛋白质,属于含有Pleckstrin同源区结构域(Pleckstrin homolgy domain,PHD)的蛋白超家族,目前尚无文献专门对其功能进行报道[1]。本研究的前期实验研究表明,PLEKHQ1可能在巨噬细胞的功能调控中发挥作用。因此,通过转录激活因子样效应物核酸酶(transcription activator-like effector nuclease,TALEN)技术[2-6]剪切PLEKHQ1外显子DNA,使DNA发生修复后形成移码突变,从而使控制PLEKHQ1蛋白表达的基因失活,得到PLEKHQ1基因敲除小鼠,经过繁殖筛选后,分离其骨髓细胞并诱导成巨噬细胞进行研究[7]。但是,原代培养的骨髓来源巨噬细胞(bone marrow-derived macrophage,BMDM)生存期短,传代次数有限,分离原代细胞不但工作量巨大,而且由于每批细胞来源于不同的个体,不可避免存在差异,限制了研究工作的开展。因此,有必要建立稳定的细胞系以便深入研究PLEKHQ1的功能。本研究采用慢病毒介导的方法,将SV40LT整合至野生型(wild type,WT)小鼠和PLEKHQ1基因敲除(knockout,KO)小鼠的BMDM基因组,使其永生化,为进一步探讨PLEKHQ1基因的功能奠定基础。
1 材料与方法
1.1 主要材料和仪器
(1)C57BL/6 PLEKHQ1基因敲除及野生型小鼠各1只,均为雄鼠,包装质粒PMD、SPA、pCDHSV40/GFP,均由本实验室保存;293TX细胞为本实验室保存;Q5超保真DNA聚合酶购自(英国NEB公司);Lipofectamine 2000购自美国Invitrogen Life Technologies公司;RPMI1640培养基购自美国GIBCO公司;血清购自Hyclone;反转录试剂盒购自日本TaKaRa公司;细胞DNA、RNA提取试剂盒均购自(北京)TIANGEN公司。其余常用试剂均为国产分析纯。聚合酶链反应(polymerase chain reaction,PCR)引物由北京天一辉远有限公司合成。
(2)GL-1800型梯度基因扩增(PCR)仪(美国伯乐,BIO-RAD,C1000 Touch);Thermo LABOFUGE 400R型低温离心机(美国Thermofisher公司);WD-9413B型凝胶成像分析仪(北京市六一仪器厂);BIORAD,TC20细胞计数仪(美国伯乐公司);EX 450-490 DM 505 BA520型荧光倒置显微镜(日本尼康,Nikon Eclipse Ts 100)。
1.2 实验方法
1.2.1 骨髓来源巨噬细胞的分离和培养
将C57BL/6小鼠脱颈处死后,无菌条件下取后肢骨,将股骨和胫骨中的骨髓冲入培养皿中,此过程重复2次。过滤,加入红细胞裂解液静置10 min。1000 r/min,离心5 min,弃上清,1 ml培养基重悬骨髓细胞,接种于60 mm培养皿内。加入含20%的L929上清条件培养基,刺激骨髓细胞向巨噬细胞分化。放置于37 ℃、5%CO2培养箱中培养,于3 d换液1次,约8 d后贴壁细胞为巨噬细胞。
1.2.2 SV40LT慢病毒的包装
293TX细胞于对数生长期时接种于60 mm培养皿中,用含10%血清的RPMI1640培养基培养。将PMD 1 μg、SPA 3 μg、pCDH-SV40/GFP 4 μg与100 μl无血清RPMI1640培养基温和混匀,Lipofectamine 2000 16与100 μl无血清RPMI1640温和混匀,室温静置5 min,再将二者混匀,室温静置20 min,将混合液缓慢滴入293TX细胞中,即完成转染过程。转染后8 h或过夜后换液,24~36 h收1次上清,补液5 ml。约72 h后再收上清,3 000 r/min 离心5 min,使得细胞等杂质沉淀,取上清用0.22 μm滤器过滤后加入millipore超滤离心管,3 000 r/min,离心5 min,后得约200 μl浓缩病毒,于-40 ℃保存或立刻使用。
1.2.3 骨髓来源巨噬细胞的感染及培养
待感染的BMDM少量接种至12孔板中的1孔,加入浓缩病毒20 μl,感染后72 h,在倒置荧光显微镜下,激发光于450~490 nm蓝光波长照射下,观察BMDM感染情况,判定感染率。
1.2.4 SV40T基因在BMDM中的整合及表达
(1)PCR扩增。收集PLEKHQ1基因KO小鼠及WT小鼠非永生化BMDM及永生化BMDM,提取基因组DNA。根据SV40大T抗原基因序列设计引物,上游引物5'-CGCAGTGAGTTTTTGTTAGA-3';下游引物5'-TGTGGTATGGCTGATTATGA-3',扩增产物应为391 bp。使用Q5高保真聚合酶,反应条件:预变性98 ℃ 30 s,然后98 ℃ 10 s,59 ℃ 30 s,72 ℃ 30 s,34个循环,72 ℃延伸2 min,4 ℃保持。PCR产物用1%琼脂糖凝胶电泳分析。
(2)RT-PCR分析。按TIANGEN试剂盒操作法提取细胞RNA,进行反转录。SV40大T抗原基因引物序列及大小同上。内参β-肌动蛋白,上游引物为:5'-CCTAGAAGCATTTGCGGTGCACGA TG-3',下游引物为:5'-CATCGTGCACCGCA AATGCTTCTAGG-3',扩增产物为260 bp,反应条件同上,PCR产物用1% 琼脂糖凝胶电泳分析。
1.2.5 KO小鼠的原代BMDM和永生化BMDM生长情况比较
取KO小鼠的原代BMDM和永生化第5代BMDM各接种3个孔至24孔板中,每孔接种10 000个细胞,用细胞计数仪每隔1 d计数取平均值,连续15 d,绘制细胞生长曲线。
2 结果
2.1 永生化BMDM的生物学性状
BMDM具有粘附平展能力,在体外培养中呈贴壁生长。以KO小鼠为例,在平皿中可看到呈梭形、星形或圆形的贴壁细胞,有许多伪足和凸起。永生化的BMDM与非永生化的BMDM相比,在形态结构上无明显差异,但能见到较多的细胞分裂相。在荧光显微镜下观察,前者能观察到绿色荧光,而后者观察不到。如图1所示。
2.2 BMDM中SV40的PCR扩增结果
使用质粒pCDH-SV40/GFP作阳性对照,对WT小鼠非永生化BMDM、WT小鼠第5代永生化BMDM、KO小鼠非永生化BMDM和KO小鼠第5代永生化BMDM,提取基因组DNA,后进行PCR,产物用1%琼脂糖凝胶进行电泳分析。结果3号条带和5号条带在391 bp处有一特异扩增条带,与1号条带位置相同,而2号条带和4号条带在该处无扩增条带,如图2所示。
2.3 BMDM中SV40的RT-PCR结果
永生化BMDM,无论是WT小鼠的还是KO小鼠的,有特异性扩增条带,大小为391 bp,而非永生化的BMDM未见该条带,内参为β-肌动蛋白,大小为260 bp,如图3所示。
2.4 永生化BMDM和原代BMDM生长情况比较
将KO小鼠的第5代永生化BMDM与原代BMDM生长速率进行比较,二者均在培养第3 d进入快速增长期,但前者一直保持较快速率生长,而后者在培养约两周后生长缓慢,进入平台期,如图4所示。
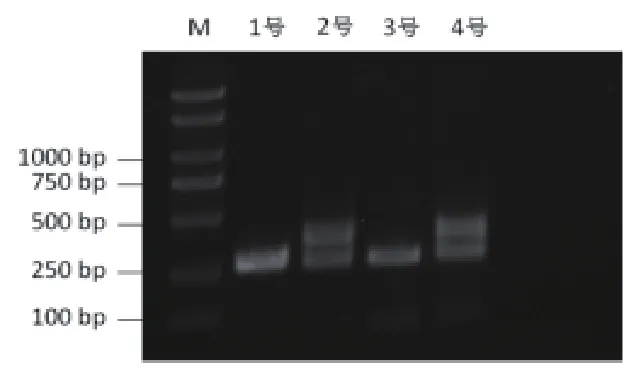
图3 SV40T mRNA在非永生化BMDM和永生化BMDM中的表达电泳图
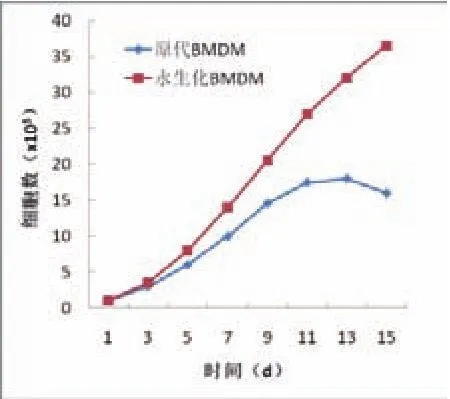
图4 KO小鼠永生化BMDM和原代BMDM生长情况示图
3 结论
前期的研究结果表明,PLEKHQ1基因可能参与细胞因子与受体的相互作用,可能在调控细胞炎症反应中发挥重要作用,且表达谱数据显示其在巨噬细胞中特异高表达,因而本研究选择小鼠巨噬细胞来进行PLEKHQ1基因的研究。但前期实验已证实,原代培养的BMDM生长缓慢、生存期短,限制了实验的开展[1]。因此,迫切需要建立永生化的骨髓来源巨噬细胞系,为下一步研究打下基础。
永生化细胞是体外培养细胞自发的或在外界因素影响下获得无限增殖能力的细胞[8]。建立永生化BMDM是实验标准化、规范化的重要基础。有些研究建立永生化细胞系只是单纯用转染的方法直接将pCDH-SV40/GFP导入细胞,效果不好,而本实验研究先将pCDH-SV40/GFP包装成慢病毒,再用慢病毒去感染细胞,能建立更加稳定的永生化细胞系
SV40是20世纪60年代发现的一种猴肾细胞病毒,目前被广泛用于转基因动物模型的建立和各种人类及动物细胞的永生化,SV40 T抗原基因的导入能加快转化细胞的生长速率,同时也能保留其原始细胞的许多分化表型,可作为体外研究原始细胞的标准细胞模型[9-13]。本研究就是利用SV 40的这些特点,用慢病毒包装并感染目的细胞的方法将BMDM永生化。本研究结果显示,利用SV40T基因使WT和KO小鼠骨髓来源巨噬细胞永生化是一种可行、可重复的建系方法,且该永生化细胞系已稳定培养了半年,为PLEKHQ1基因的功能研究提供了可实行的方法和手段,成功构建了PLEKHQ1基因敲除小鼠的永生化骨髓来源巨噬细胞系。
[1]陆琤,周晨辰,张鹏飞,等.原核质粒pGEX-4T-2-PLEKHQ1及真核质粒pCMV-Myc-PLEKHQ1的构建与蛋白表达[J].中国医学装备,2015,12(5):5-8.
[2]Boch J,Scholze H,Schornack S,et al.Breaking the code of DNA binding specificity of TAL-typeⅢ effectors[J].Science,2009,326(5959):1509-1512.
[3]Li T,Huang S,Jiang WZ,et al.TAL nucleases(TALNs):hybrid proteins composed of TAL effectors and FokⅠDNA-cleavage domain[J]. Nucleic Acids Res,2011,39(1):359-372.
[4]Kim Y,Kweon J,Kim A,et al.A library of TAL effector nucleases spanning the human genome[J].Nat Biotechnol,2013,31(3):251-258.
[5]Moscou MJ,Bogdanove AJ.A simple cipher governs DNA recognition by TAL effectors[J]. Science,2009,326(5959):1501-1503.
[6]Gingras AC,Raught B,Sonenberg N.elF4 initiation factors:effectors of mRNA recruitment to ribosomes and regulators of translation[J]. Annu Rev Biochem,1999(68):913-963.
[7]张鹏飞,张硌,陆琤,等.PLEKHQ1基因敲除小鼠基因型鉴定方法[J].中国医学装备,2015,12(8):1-3.
[8]李培杰,赵国强.重组SV40大T抗原慢病毒表达载体的构建.肿瘤基础与临床,2008,21(5):384-387.
[9]Obinata M.Immortalized cell lines with differentiation potentials:their establishment and possible application[J].Seikagaku,2008,80(1):5-12.
[10]Yu Y,Alwine JC.Interaction between simian virus 40 large T antigen and insulin receptor substrate 1 is disrupted by the K1mutation,resulting in the loss of large T antigen-mediated phosphorylation of Akt[J].J Virol,2008,82(9):4521-4526.
[11]Kirchhoff C,Araki Y,Huhtaniemi I,et al.Immortalization by large T-antigen of the adult epididymal duct epithelium[J].Mol Cell Endocrinol,2004,216(1/2):83-94.
[12]Inozemtseva LS,Chemikov VG,Manuilova ES,et al. Immortalization of human fibroblasts using ts A mutant of SV40 and p SV3neo plasmid[J].Ts itologiia,2001,43(10):944-953.
[13]Markovics JA,Carroll PA,Robles MT,et al.Intestinal dysplasia induced by simian virus 40 T antigen is independent of p53[J].J Virol,2005,79(12):7492-7502.
《中国医学装备》杂志社加入中国知网(CNKI)学术期刊优先数字出版平台

近日,《中国医学装备》杂志社与中国知网(CNKI)达成合作协议,加入学术期刊优先数字出版平台。
中国知网是面向全球的数字出版和知识服务网站,对于优先数字出版的学术期刊及其论文,将在“中国知网”各出版平台予以展示及重点推荐。“中国知网”学术期刊数字出版平台是快速实现各学术期刊论文按篇即时在线出版的平台,功能是切实提高学术期刊文献出版的时效性和影响力。
发表快慢意味着作者的研究成果的首发权能否及时得到确认。读者可及时获取科研情报和新知识。加入学术期刊优先数字出版平台是本刊坚持“开拓学术视野,加强深层服务”的办刊理念的重要环节,以加快科技传播速度、辅助提升作者的学术影响力。
Establishment of an immortalized bone marrow-derived macrophage cell line in PLEKHQ1 knockout mouse/
LU Cheng, ZHOU Chen-chen, ZHANG Peng-fei, et al//
China Medical Equipment,2017,14(9):167-170.
Objective: To establish an immortalized bone marrow-derived macrophage(BMDM) cell line in PLEKHQ1 knockout mouse so as to pave the way for further studies on the function of PLEKHQ1 gene. Methods: Packaging plasmid pCDH-SV40/GFP was transfected into wild type mouse BMDM and PLEKHQ1 knockout mouse BMDM by the means of lentivirus infection so as to establish immortalized cell lines. The cell morphology of immortalized cell lines was observed and Polymerase chain reaction(PCR)was used to detect the integration of the target gene, and RTPCR was used to identified the expression of target gene. The proliferation between the immortalized BMDM and nonimmortalized BMDM was compared and analyzed in the finally. Results: The established immortalized BMDM cell line has achieved stable growth and serial propagation, and the results of identification showed that SV40LT antigen gene has been integrated in cell and been stably expressed. Conclusion: An immortalized BMDM cell line of PLEKHQ1 knockout mouse has been successfully established by the mean of. lentivirus infecting cells.
PLEKHQ1 knockout mouse; Bone marrow-derived macrophage; Immortalization; SV40 LT antigen
Department of Medical Engineering, The Affiliated Hospital to Academy of Military Medical Sciences, Beijing 100071, China.
1672-8270(2017)09-0167-04
R516.8
A
10.3969/J.ISSN.1672-8270.2017.09.047

2017-06-07
国家自然科学基金(31400739)“PH结构域蛋白PLEKHQ1协调巨噬细胞迁移与激活的机制研究”;军事医学创新基金(2015CXJJ29)“PLEKHQ1调控细菌性脓毒败血症的功能和机制研究”
①军事医学科学院附属医院医学工程科 北京 100071
*通讯作者:ygk307@sina.com
陆琤,女,(1987- ),硕士,助理工程师。军事医学科学院附属医院医学工程科,从事细胞信号转导研究工作。

