补肾益髓方及其拆方对自身免疫性脑脊髓炎小鼠脑和脊髓中BDNF/TrkB的影响
师一民 王永强 安 辰 赵 晖 李君玲 齐 放 张秋霞 陈振振 樊永平 李 明 王 蕾
(1 首都医科大学中医药学院,中医络病研究北京市重点实验室,北京,100069; 2 首都医科大学附属北京天坛医院,北京,100050)
补肾益髓方及其拆方对自身免疫性脑脊髓炎小鼠脑和脊髓中BDNF/TrkB的影响
师一民1王永强1安 辰1赵 晖1李君玲1齐 放1张秋霞1陈振振1樊永平2李 明1王 蕾1
(1 首都医科大学中医药学院,中医络病研究北京市重点实验室,北京,100069; 2 首都医科大学附属北京天坛医院,北京,100050)
目的:观察补肾益髓(Bu Shen Yi Sui,BSYS)方及其拆方补肾(Bu Shen,BS)和化痰活血(Hua Tan Huo Xue,HTHX)方对实验性自身免疫性脑脊髓炎(Experimental Autoimmune Encephalomyelitis,EAE)小鼠脑和脊髓中脑源性神经营养因子(Brain-derived Neurotrophic Factor,BDNF)与受体TrkB的影响。方法:将EAE造模小鼠于当天和第7天背部皮下注射髓鞘少突胶质细胞糖蛋白(Myelin Oligodendrocyte Glycoprotein,MOG)35-55抗原,并在免疫当天和第2天后腹腔注射百日咳毒素(Pertussis toxin,PTX)。每日对小鼠进行不同药物的灌胃,并于造模第20和40天分别取脑和脊髓,采用实时荧光定量RT-PCR(qRT-PCR)与Western Blot法检测BDNF和TrkB的表达。结果:BSYS及其拆方BS方与HTHX方均可明显上调EAE小鼠脑和脊髓BDNF和TrkB mRNA与蛋白的表达,与模型组比较,差异均有统计学意义(P<0.05或P<0.01)。BSYS方作用优于其BS与HTHX方,但差异无统计学意义(P>0.05)。结论:BSYS及其拆方促进轴突修复的作用可能与增强BDNF/TrkB表达有关,BSYS全方更有显著趋势。
补肾益髓方;拆方;多发性硬化;实验性自身免疫性脑脊髓炎;脑源性神经营养因子/TrkB
实验性自身免疫性脑脊髓炎(Experimental Autoimmune Encephalomyelitis,EAE)是一种T细胞介导的中枢神经系统疾病,由于其临床表现和病理变化与人类多发性硬化症非常相似,因此,目前常常制备动物EAE作为研究MS的实验模型[1]。前期研究发现,补肾益髓(Bu Shen Yi Sui,BSYS)方对MS患者及其EAE动物模型具有明显的神经保护作用[2]。拆方研究发现,补肾益髓及其拆方补肾和化痰活血(HTHX)方均能降低EAE小鼠的神经功能评分,减轻其脑和脊髓的病理炎性反应损伤,减轻轴突损伤和促进其神经修复[3-5]。但其促进损伤的轴突修复机制还不清楚。研究证实,神经营养因子能够促进神经细胞的存活、生长、分化。在众多的神经生长因子中,脑源性神经营养因子(Brain-derived Neurotrophic Factor,BDNF)是成年大鼠脑内分布最为广泛的神经营养因子,主要在皮质和海马中合成。BDNF共有2个受体,一个是低亲和力的P75受体,另一个是高亲和力受体Trk,BDNF与TrkB结合后激活RAS/ERK与PI3K/AKT信号通路,进而调节其下游分子来发挥其神经修复作用[6-8]。TrkB受体在此信号通路中起着至关重要的作用。其为了深入探讨补肾益髓及其拆方促进在轴突修复的作用机制,本实验主要采用实时荧光定量RT-PCR(qRT-PCR)与Western Blot法观察补肾益髓及其拆方补肾和化痰活血方对EAE小鼠脑与脊髓中BDNF和TrkB表达的影响。
1材料与方法
1.1 实验材料
1.1.1 实验动物 70只SPF级C57BL/6雌性小鼠(体重15~17 g)购于北京维通利华实验动物技术有限公司[许可证号为SCXK(京)2012-0001]。动物饲养于首都医科大学实验动物中心(许可证号SYXK(京)2010-0020)的独立通气笼内,温度18~22 ℃,相对湿度40% ~60%,自由饮水和饮食。所有实验项目均通过首都医科大学伦理委员会批准。
1.1.2 实验药物补肾益髓及其拆方补肾和化痰活血方均有北京亚东生物制药有限公司制备。补肾益髓方由生地黄、熟地黄、浙贝母、水蛭、全蝎、益母草等组成;补肾方由生地黄、熟地黄等组成;化痰活血方由浙贝母、水蛭、全蝎、益母草等组成。醋酸泼尼松片(Prednisone Acetate,PA)由天津力生制药有限公司生产,梓醇(Catapol,CA)由杭州康木科技有限公司提供。
1.1.3 主要试剂髓鞘少突胶质细胞糖蛋白(Myelin Oligodendrocyte Glycoprotein,MOG)35-55由北京旭和源生物科技有限公司合成;灭活结核分支杆菌(Mycobacterium Tuberculosis,TB,货号231141)由美国BD公司提供。完全弗氏佐剂(Complete Freund′s Adjuvant,CFA,货号F5881)、百日咳毒素(Pertussis Toxin,PTX,货号P7208)均由美国Sigma公司提供;PCR引物由大连TaKaRa公司合成,RNA prep pure动物组织总RNA提取试剂盒(离心柱型)(DP431),TIANScript cDNA第一链合成试剂盒(KR104),RealMasterMix(SYBR Green)试剂盒(FP204),2×Taq PCR MasterMix(KT201-01),50bp DNA Ladder(MD108),MarkⅢ(MD103),GeneGreen核酸染料(RT210),均购自天根生化科技有限公司。
1.2 方法
1.2.1 分组与模型制备 将小鼠随机分为7组:正常(NC)、模型(MO)、PA组、CA组、BS组、HTHX组及BSYS组。每组10只。EAE造模小鼠于造模当天与造模后第7天背部皮下注射0.2 mL抗原,包括MOG35-55(50 μg)、CFA(100 μL)和TB(0.3 mg),当天和第2天后腹腔注射500 ng的PTX。NC小鼠注射相同剂量的生理盐水。
1.2.2 给药方法 BSYS方组小鼠给予BSYS混悬液(3.02 g生药/kg体重)灌胃;BS方组给予BS混悬液(1.44 g生药/kg体重);HTHX方组给予HTHX混悬液(1.57 g生药/kg体重);PA组小鼠给予PA混悬液(5 mg/kg体重);CA组给予CA(40 mg/kg体重);NC和MO组均给予等体积的蒸馏水灌胃。1次/d,共计40 d。
1.2.3 标本采集 于造模第20天(急性期)和第40天(缓解期),小鼠10%水合氯醛(190 mg/kg)腹腔注射麻醉后,取其脑及脊髓,快速放入液氮后移至-80 ℃冷冻保存。
1.2.4 qRT-PCR检测小鼠脑及脊髓中BDNF、TrkB mRNA的表达 按照动物组织总RNA提取试剂盒说明书提取小鼠脑组织与脊髓组织RNA,然后根据RT-PCR kit的说明反转录为cDNA。引物序列见表1。扩增条件为95 ℃ 5 min变性,95 ℃ 10 s,52 ℃ 30 s,72 ℃ 30 s,共40个循环。以基因β-tubulin为内参对照,2-△△Ct(Ct代表循环阀值)表示BDNF和TrkB mRNA相对表达量。
1.2.5 Western Blot检测小鼠脑及脊髓中BDNF和TrkB蛋白的表达 取小鼠脑与脊髓组织,按1∶7的比例加入蛋白裂解液,匀浆后,置于冰上30 min,4 ℃离心20 min后,取上清液。建立标准曲线,每孔加上清液100 μL,将96孔板置于37 ℃,反应120 min后,严格按照试剂盒说明书步骤进行检测。用酶标仪测定450 nm处吸光值,制作标准曲线,计算样本浓度,根据样本蛋白浓度,稀释使其终浓度为3 μg/μL。取样本7 μL(含21 μg蛋白)蛋白样品进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,电转50 min,5%脱脂奶粉室温封闭1 h,分别加入BDNF(1∶10 000)/TrkB(1∶20 000)/β-tubulin(1∶100 000)的单克隆抗体,4 ℃过夜后,TBST洗膜4次,每次10 min,加入辣根过氧化物酶标记的二抗(1∶20 000,抗兔/小鼠),室温孵育1 h,洗膜4次,每次5 min后,于暗室进行胶片曝光、显影和定影。通过Image J图像分析系统测定各蛋白条带的灰度值,以目的蛋白条带的灰度值与内参β-tubulin条带灰度值的比值表示各蛋白的相对表达水平。

表1 引物序列
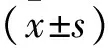
2结果
2.1.1 BSYS及其拆方BS和HTHX方对EAE小鼠脑与脊髓中BDNF mRNA表达的影响 QRT-PCR结果显示,在造模的第20天和第40天,MO组小鼠脑和脊髓的BDNF mRNA表达较NC组明显下降(P<0.01)。与MO组比较,各观察组均能显著升高BDNF mRNA表达,尤其PA和BSYS方组差异更为明显(P<0.01),但治疗各组差异无统计学意义。见表2。

表2 7组小鼠脑和脊髓中BDNF mRNA的变化
注:与NC组比较,**P<0.01;与MO组比较,△P<0.05,△△P<0.01
2.1.2 BSYS及其拆方BS和HTHX方对EAE小鼠脑与脊髓中TrkB mRNA表达的影响 qRT-PCR结果显示,在造模第20天和第40天时,和NC组比较,MO组小鼠脑和脊髓的TrkB mRNA表达明显下降(P<0.01)。与MO组比较,各观察组均能显著升高TrkB mRNA表达,尤其PA和BSYS方组差异有统计学意义(P<0.01)。而治疗各组之间差异无统计学意义(P>0.05)。见表3。

表3 7组小鼠脑和脊髓中TrkB mRNA的变化
注:与NC组比较,**P<0.01;与MO组比较,△P<0.05,△△P<0.01
2.1.3 BSYS及其拆方BS和HTHX方对EAE小鼠脑与脊髓中BDNF蛋白表达的影响 WB结果显示,第20天和第40天,MO组小鼠脑和脊髓的BDNF蛋白表达较NC组明显下降(P<0.01)。与MO组比较,各观察组均能显著升高BDNF蛋白表达,尤其PA和BSYS方组更为明显(P<0.01),但治疗各组之间差异无统计学意义(P>0.05)。见图1-2,表4。

表4 7组小鼠脑和脊髓中BDNF蛋白的变化
注:与NC组比较,**P<0.01;与MO组比较,△P<0.05,△△P<0.01

图1 各组小鼠脑中BDNF蛋白的表达

图2 7组小鼠脊髓中BDNF蛋白的表达
2.1.4 BSYS及其拆方BS和HTHX方对EAE小鼠脑与脊髓中TrkB蛋白表达的影响 WB结果显示,第20天和第40天,MO组小鼠脑和脊髓的TrkB蛋白表达较NC组明显下降(P<0.01)。与MO组比较,各观察组均能显著升高TrkB蛋白表达,尤其PA和BSYS方组更为明显(P<0.01),但治疗各组之间差异无统计学意义(P>0.05)。见图3-4,表5。

图3 7组小鼠脑中TrkB蛋白的表达变化

图4 7组小鼠脊髓中TrkB蛋白的表达

组别只数脑第20天第40天脊髓第20天第40天NC4193±072199±034192±029197±010MO4040±014∗∗056±004∗∗042±004∗∗057±010∗∗PA4174±030△△183±021△△177±012△△182±008△△CA4090±014△105±007△090±009△102±011△BS4144±016△△165±021△△140±025△△160±012△△HTHX4092±056△108±006△091±005△103±009△BSYS4173±033△△189±023△△177±024△△185±020△△
注:与NC组比较,**P<0.01;与MO组比较,△P<0.05,△△P<0.01
3讨论
BDNF是1982年由德国生物学家Barde及其同事首次从猪脑中纯化并发现具有防止神经元死亡功能的一种蛋白质,是目前研究最为广泛的神经营养因子之一。内嗅皮层是位于颞叶、邻近海马的区域,内嗅皮层和海马通过纤维投射和神经元换元,形成内嗅皮层-海马环路[9-10]。内嗅皮层是BDNF产生的主要部位,并能够转运到海马[11]。Marchetti和Marie[12]认为BDNF和TrkB的减少会降低突触可塑性和损伤神经元,是皮层和海马损伤的主要原因。有研究结果显示BDNF与其受体TrkB共同作用可增加突触可塑性,促进轴突及树突生长,增加突触末端密度[13-14],并激活下游的PI3K/AKT通路发挥神经保护作用[15-16]。
本课题组的前期研究发现,EAE小鼠存在轴突损伤状态,主要表现在神经细胞骨架蛋白β-tubulin、NF200及MAP-2显著下降,而β-APP,P-Tau及CSPGs则显著上升,说明神经轴突损伤后神经细胞内运输物质、塑性等方面发生障碍。经过BSYS及其拆方BS与HTHX方治疗后,上述指标得到了明显改善[3-5],说明BSYS及其BS与HTHX方对EAE小鼠轴突损伤修复作用。但其作用机制不清楚。近年来研究发现,轴突修复再生过程中存在着多种影响因素,神经营养因子类物质的缺乏是导致再生困难的主要因素之一。BDNF与其TrkB受体参与了神经保护作用[8]。MS和EAE小鼠脑BDNF表达显著降低,基因敲除BDNF缺失后制备EAE小鼠模型,其神经损伤症状加重[17]。本实验也发现,EAE小鼠的神经营养因子BDNF及其受体TrkB的基因和蛋白表达无论在急性期还是在缓解期均明显降低。但在MS患者脱髓鞘区域BDNF表达增高,推测是起到神经保护和自我修复作用[18]。外源性BDNF可以延长其潜伏期,降低神经功能评分[19]。而经过BSYS及其拆方BS与HTHX方治疗后,BDNF/TrkB的表达明显增加。结合前期发现的BSYS及其拆方BS与HTHX方能够促进轴突再生修复的实验结果,推测BSYS及其拆方促进轴突修复的作用机制可能与增加神经营养因子及其受体的表达有关,并且BSYS全方较拆方的作用更有显著趋势。进一步的研究发现,BDNF-TrkB活化后激活其下游信号的PI3K/AKT通路,并参与了轴突损伤后的神经修复。研究MS患者大脑白质的基因表达发现PI3K/AKT信号通路有助于脑内环境的稳定与神经保护作用[20]。上述研究为BSYS方治疗MS的机制提供的部分客观依据,深入的作用机制还有待进一步研究。
[1]王维治.神经系统脱髓鞘疾病[M].北京:人民卫生出版社,2011:99-114.
[2]房玲,樊永平,赵晖,等.补肾益髓方防治多发性硬化的研究进展[J].中医药导报,2013,19(12):108-110.
[3]安辰,王永强,师一民,等.补肾益髓方及其拆方对实验性自身免疫性脑脊髓炎小鼠脑和脊髓中β-APP和MAP-2表达的影响[J].中国中医急症,2016,25(4):565-568,587.
[4]安辰,王永强,师一民,等.补肾益髓方及其拆方对实验性自身免疫性脑脊髓炎小鼠的神经保护作用及NF200和CSPGs表达的影响[J].中华中医药杂志,2016,31(4):1215-1220.
[5]师一民,王永强,安辰,等.补肾益髓方及其拆方对实验性自身免疫性脑脊髓炎小鼠脑和脊髓中p-Tau和Beta-tubulin表达的影响[J].世界中医药,2016,9(11):1825-1830.
[6]Yoshii A,Constantine-Paton M.Postsynaptic BDNF-TrkB signaling in synapse maturation,plasticity,and disease[J].Dev Neurobiol,2010,70(5):304-322.
[7]Gonzalez A,Moya-Alvarado G,Gonzalez-Billaut C,et al.Cellular and molecular mechanisms regulating neuronal growth by brain-derived neurotrophic factor[J].Cytoskeleton(Hoboken).2016,73(10):612-628.
[8]师一民,李明,王蕾,等.神经营养因子在多发性硬化神经再生修复中的作用研究进展[J].医学综述,2016,22(24):4785-4787.
[9]Pilly PK,Grossberg S.How do spatial learning and memory occur in the brain:coordinated learning of entorhinal grid cells and hippocampal place cells[J].J Cogn Neurosci,2012,24(5):1031-1054.
[10]Buzsáki G,Moser EI.Memory,navigation and theta rhythm in the hippocampal-entorhinal system[J].Nat Neurosci,2013,16(2):130-138.
[11]Lu B.BDNF and activity-dependent synaptic modulation[J].Learn Mem,2003,10(2):86-98.
[12]Marchetti C,Marie H.Hippocampal synaptic plasticity in Alzheimer′s disease:what have we learned so far from transgenicmodels[J].Rev Neurosci,2011,22(4):373-402.
[13]Yang LC,Li J,Xu SF,et al.L-3-n-butylphthalide Promotes Neurogenesis and Neuroplasticityin Cerebral Ischemic Rats[J].CNS NeurosciTher.2015,21(9):733-741.
[14]Zhao W,Luo C,Wang J,et al.3-N-butylphthalide improves neuronal morphology after chronic cerebral ischemia[J].Neural Regen Res,2014,9(7):719-726.
[15]Xing M,Sun Q,Wang Y,et al.Hydroxysafflor yellow A increases BDNF and NMDARs in the hippocampus in a vascular dementia rat model[J].Brain Res,2016,1642:419-425.
[16]Fang M,Yuan Y,Lu J,et al.Scutellarin promotesmicroglia-mediated astrogliosis coupled with improved behavioral function in cerebral ischemia[J].Neurochem Int,2016,97:154-171.
[17]De Santi L,Annunziata P,Sessa E,et al.Brain-derived neurotrophic factor and TrkB receptor in experimental autoimmune encephalomyelitis and multiple sclerosis[J].J Neurol Sci,2009,287(1-2):17-26.
[18]Lee DH,Geyer E,Flach AC,et al.Central nervous system rather than immune cell-derived BDNF mediates axonal protective effects early in autoimmune demyelination[J].Acta Neuropathol,2012,123(2):247-258.
[19]Makar,TK.,Trisler,D,Sura,KT.et al.Brain derived neurotrophic factor treatment reduces inflammation and apoptosis in experimental allergic encephalomyelitis[J].J Neurol Sci,2008,270(1-2):70-76.
[20]Graumann U,Reynolds R,Steck AJ.Molecular changes in normal appearing white matter in multiple sclerosis are characteristic of neuroprotective mechanisms against hypoxic insult[J].Brain Pathol,2003,13(4):554-573.
(2016-11-10收稿 责任编辑:杨觉雄)
EffectsofBushenyisuiFormulaandItsDecomposedFormulasonExpressionsofBDNF/TrkBinBrainandSpinalCordofMicewithExperimentalAutoimmuneEncephalomyelitis
Shi Yimin1,Wang Yongqiang1,An Chen1,Zhao Hui1,Li Junling1,Qi Fang1,Zhang Qiuxia1, Chen Zhenzhen1,Fan Yongping2,Li Ming1,Wang Lei1
(1CapitalMedicalUniversity,Beijing100069,China; 2BeijingTiantanHospitalAffiliatedCapitalMedicalUniversity,Beijing100050,China)
Objective:To observe effects of Bushenyisui (BSYS) formula and its decomposed formulas,Bu Shen (BS) and Hua Tan Huo Xue (HTHX),on the expressions of brain-derived neurotrophic factor (BDNF) and TrkB in the brain and spinal cord of mice with experimental autoimmune encephalomyelitis (EAE).Methods:The EAE mice were injected subcutaneously with the myelin oligodendrocyte glycoprotein (MOG)35-55in the back on the 1st day and the 7th,and were injected intraperitoneally with pertussis toxin (PTX).All the mice were administered intragastrically with the different medicine or distilled water once a day.The brain and spinal cord of mice were removed for the examination on day 20th and 40th.The expressions of BDNF and TrkB mRNA and proteins were detected by real time fluorescent quantitative (qRT-PCR) and Western Blot analysis.Results:The expressions of BDNF and TrkB in the brain and spinal cord of EAE mice were significantly up-regulated by BSYS and its decomposed BS and HTHX,compared with the EAE mice (P<0.05).The effective trend of BSYS on the above indexes was better than that of the decomposed BS and HTHX formulas,but there was no statistical significance (P>0.05).Conclusion:The effect of BSYS and its decomposed formulas,BS and HTHX,on promoting axonal repair might be related to enhance the expression of BDNF/TrkB,and that of BSYS was more significant.
Bu Shen Yi Sui and its decomposed formulas; Multiple sclerosis; Experimental autoimmune encephalomyelitis; BDNF/TrkB
R228;R242
:Adoi:10.3969/j.issn.1673-7202.2017.09.041
国家自然基金项目(81273742,81573898);北京市教委重点项目(KZ201310025023);北京市属高等学校高层次人才引进与培养计划-长城学者项目(CIT&TCD20140329)
师一民(1990.06—),男,在读硕士,首都医科大学中医药学院,主要从事中医药防治脑病的基础研究
李明(1963.11—),女,博士,教授,研究方向:方剂配伍规律及功效机制研究,E-mail:13611386113@163.com;王蕾(1967.10—),女,博士,教授,研究方向:中医药防治脑病的功效及机制研究,Tel:(010)83911626,E-mail:tmwangl@ccmu.edu.cn

