I型鸭甲型肝炎病毒VP0基因在杆状病毒表达系统中的表达
王安平,顾玲玲,王永娟,吴 双,左伟勇,洪伟鸣,朱善元
(江苏农牧科技职业学院江苏省兽用生物制药高技术研究重点实验室,江苏 泰州 225300)
I型鸭甲型肝炎病毒VP0基因在杆状病毒表达系统中的表达
王安平,顾玲玲,王永娟,吴 双,左伟勇,洪伟鸣,朱善元
(江苏农牧科技职业学院江苏省兽用生物制药高技术研究重点实验室,江苏 泰州 225300)
为在昆虫细胞中表达I型鸭甲型肝炎病毒(duck hepatitis A virus type-I, DHAV-I) SH株的结构蛋白VP0,首先根据DHAV-I SH株VP0基因序列设计一对引物,RT-PCR方法扩增出VP0基因,亚克隆至杆状病毒转移载体pFastBac1,获得重组质粒pFB-VP0,将其转化到DH10Bac感受态细胞中,经抗性和蓝白斑筛选,获得重组穿梭质粒rBacmid-VP0,在脂质体介导下转染昆虫细胞Sf9,获得重组杆状病毒rBac-VP0。Western-blot结果显示,表达的重组蛋白相对分子量约为29 kD,间接免疫荧光结果显示重组蛋白能与鸭抗全病毒阳性血清发生特异性反应。研究结果表明,DHAV-I SH株的结构蛋白VP0在昆虫细胞中获得了成功表达,为VP0结构蛋白的功能研究和基因工程疫苗的研制奠定了基础。
I型鸭甲型肝炎病毒;VP0基因;昆虫细胞;表达
鸭病毒性肝炎(Duck Viral Hepatitis,DVH)是一种由鸭甲型肝炎病毒(Duck Hepatitis A Virus,DHAV)感染导致的急性和高度致死性传染病,可引起21日龄以下的雏鸭发生急性肝炎,病死率高达100%,是严重危害中国养鸭业的疾病之一。DHAV包括经典型(即中国原Ⅰ型鸭肝炎病毒)、中国台湾新型、韩国新型3种亚型,即Ⅰ、Ⅱ、Ⅲ型,3个亚型之间存在明显的差异,无交叉免疫性[1-3],其中Ⅰ型鸭肝炎病毒(DHAV-I)为中国的主要流行血清型[4-6]。鸭甲型肝炎病毒属于小RNA病毒科,病毒粒子无囊膜,呈二十面体对称,核心为单股正链RNA,基因组大小约为7 690 nt,只编码一个开放阅读框,编码的产物为多聚蛋白,多聚蛋白在翻译过程中不断被自身编码的蛋白酶水解,分解成P1、P2 和P3 产物,P1、P2和P3 又进一步分别分解为小片段蛋白,即VP0、VP1、VP3、2A1、2A2、2B、2C、3A、3B、3C、3D。VP0、VP1、VP3为病毒的结构蛋白。其中,VP0蛋白位于病毒粒子表面,为其主要结构蛋白之一。目前,研究主要集中于结构蛋白VP1的功能和免疫原性研究,而对VP0的研究却很少[7]。本研究利用杆状病毒/昆虫细胞表达系统表达DHAV-1 SH株的VP0基因,为VP0蛋白的功能研究、诊断试剂及亚单位疫苗的研制奠定基础。
1 材料与方法
1.1毒株、菌株和载体
DHAV-I SH毒株由中国科学研究院上海兽医研究所惠赠;大肠杆菌DH5α感受态细胞由本室保存;Sf9细胞、杆状病毒Bac-to-Bac表达系统(包括重组杆状病毒转移载体pFastBac1、E.coliDH10Bac 受体菌)购自Invitrogen公司。
1.2工具酶和试剂
pfuDNA Polymerase、T4 DNA连接酶、限制性内切酶BamH I、XhoI购自Fermentas公司;转染试剂Cellfectin Ⅱ Reagent购自Invitrogen公司;昆虫细胞培养基Sf-900ⅡSFM (Serum free medium) 购自GBICO公司;HRP标记的羊抗鼠IgG、FITC标记的羊抗鸭IgG购自KPL公司;其他试剂均为国产分析纯级。
1.3引物的设计与合成
参考GenBank中登录的DHAV-ISH株病毒基因组序列设计一对引物扩增VP0基因,为便于基因的克隆及表达载体的构建,在VP0引物的上下游5′端分别引入BamH I和XhoI酶切位点。通用引物M13F/M13R参照Bac-to-Bac杆状病毒表达系统设计,引物均由上海英潍捷基生物技术有限公司合成。引物序列为:VP0-F:5′-CGAGGATCCACCATGGATACTCTTACTAAAAAC-′3(下划线为BamH I酶切位点),VP3-R: 5′-GTACTCGAGTTACTGATTGTCAAATGGTCGGGG-′3(下划线为XhoI酶切位点)。通用引物序列为:M13-F: 5′-GTTTTCCCAGTCACGAC-
′3,M13-R: 5′-CAGGAAACAGCTATGAC-′3。
1.4DHAV-I的增殖与病毒RNA的提取
取10倍稀释的原代病毒0.2 mL接种于10日龄SPF鸡胚尿囊腔,于37 ℃孵化箱孵化。选择48~72 h之内死亡的鸡胚,置于4 ℃过夜,收集尿囊液。按Trizol法抽提尿囊液总RNA,操作参照说明书。
1.5DHAV-IVP0基因的扩增
以提取的总RNA为模板,根据Invitrogen公司的RT-PCR试剂盒说明书进行操作,反应程序设定为:25 ℃,10 min;42 ℃,90 min;70 ℃,10 min。 以扩增的cDNA为模板,再进行高保真PCR扩增VP3基因。反应程序为:95 ℃ 预变性3 min,95 ℃变性 30 s,52 ℃ 退火30 s,72 ℃延伸 1.5min,30个循环后,72 ℃延伸10 min。反应结束后,PCR产物经0.8%琼脂糖凝胶电泳检测。
1.6重组杆状病毒转移载体pFB-VP0的构建
PCR产物经琼脂糖凝胶电泳分离后,按胶回收试剂盒说明书回收目的基因,经BamH I和XhoI酶切后,与经同样酶切的杆状病毒转移载体pFastBac1连接。连接产物的转化和重组子的筛选参照常规方法进行[8]。重组子用BamH I 和XhoI双酶切鉴定正确后送由上海英潍捷基生物技术有限公司测序,鉴定正确的克隆命名为pFB-VP0。
1.7重组杆状病毒穿梭载体的制备
参考Invitrogen公司的Bac-to-Bac Baculovirus Expression System使用说明,将鉴定正确的重组质粒pFB-VP0转化DH10Bac感受态细胞,涂布于含有Kan+(50 mg·L-1)/Gen+(7 mg·L-1)/Tet+(10 mg·L-1)/X-Gal(100 mg·L-1)/IPTG(40 mg·L-1)的LB平板上,37 ℃培养箱内培养,直至蓝白斑出现。随机挑取白色菌落,分别接种于5 mL含有Kan+(50 mg·L-1)/Gen+(7 mg·L-1)/Tet+(10 mg·L-1)的LB培养基,37 ℃,250 r·min-1摇床培养过夜,碱裂法提取重组杆粒DNA。用引物M13F /M13R进行PCR鉴定,反应程序为:94 ℃预变性3 min,94 ℃变性45 s,52 ℃退火45 s,72 ℃延伸3 min,35个循环后,72 ℃终延伸10 min。PCR产物用0.8%琼脂糖凝胶电泳检测,获得的阳性重组转座子命名为rBacmid-VP0。
1.8重组杆状病毒rBac-VP的制备
将rBacmid-VP0和野生型Bacmid DNA参照Cellfectin II Reagent转染试剂说明书转染对数生长期Sf9昆虫细胞。转染后每隔12 h观察一次细胞,直至细胞出现明显病变。收集上清液,500 g 离心5 min,将上清液转移至新的无菌管中,此即为P1代rBac-VP0,4 ℃避光保存备用。将P1代rBac-VP0按MOI为0.1感染对数生长期Sf9细胞,直至约72 h后,细胞出现明显病变,收集上清即为P2代重组病毒,按此方法将病毒传至P3代。
1.9重组蛋白的间接免疫荧光鉴定
将P3代rBac-VP0及不含目的基因的野生型杆状病毒分别按MOI为1、5、10接种24孔板中处于对数生长期的Sf9细胞,以鸭抗全病毒血清为一抗,以FITC标记的羊抗鸭IgG为二抗,按常规方法进行间接免疫荧光试验[9]。
1.10重组蛋白的Western-blot分析
将P3代rBac-VP0及不含目的基因的野生型杆状病毒分别按MOI为1、5、10接种24孔板中处于对数生长期的Sf9细胞,分别在感染后24 h、48 h、72 h收集细胞沉淀,PBS洗涤一次,于沉淀中加入5×loading buffer煮沸3 min后,取15 μL进行SDS-PAGE分析,以未接种病毒的细胞沉淀作为阴性对照。样品电泳结束后转印PVDF膜,以VP0单抗作为一抗,以HRP标记的羊抗鼠作为二抗,按常规方法进行Western-blot反应[10]。
2 结果与分析
2.1VP0基因的扩增
以VP0-F和VP0-R为上、下游引物扩增VP0基因,产物经0.8%的琼脂糖凝胶电泳,可见大约780 bp的条带(图1),与预期结果相符。

M: DNA相对分子质量标准;1: VP0基因扩增产物。 M: 1 kb DNA ladder; 1: PCR products of VP0 genes.
2.2重组转座载体pFB-VP0的构建与鉴定
VP0基因回收后用BamH I和XhoI酶切,与经同样酶切的pFastBac1连接,获得重组子。经BamH I和XhoI酶切出约4 800 bp和780 bp的2条带(图2),与预期相符,且DNA测序证明VP0基因克隆正确且无突变。
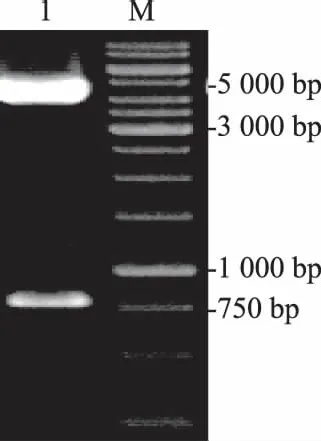
M: DNA相对分子质量标准;1: pFB-VP0的BamH I+Xho I酶切鉴定 M: 1 kb DNA ladder; 1: digestion of pFB-VP0 by BamH I and Xho I
2.3重组杆状病毒穿梭载体的鉴定
以M13F/M13R为引物对重组杆粒进行PCR鉴定,产物经0.8%琼脂糖凝胶电泳后,在约3 200 bp处有一特异性条带,与预期片段大小相符(图3),表明VP0基因转座成功。
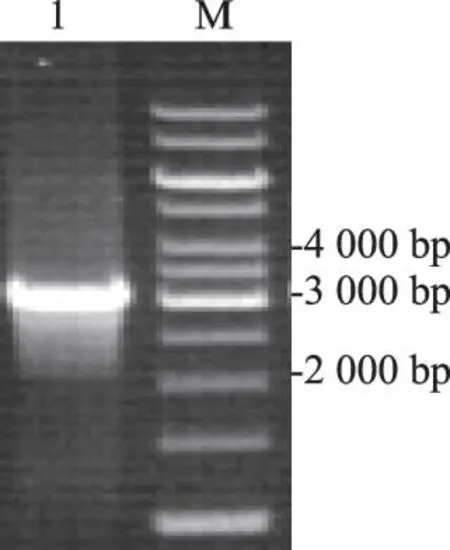
M: DNA分子质量标准;1: 重组杆粒rBacmid-VP0为模板。 M: 1 kb DNA ladder; 1: PCR products of rBacmid-VP0.
2.4重组杆状病毒的收获及感染细胞的病变
rBacmid-VP0转染对数生长期Sf9细胞,5 d后可见明显的细胞病变现象:细胞生长停止,细胞内出现颗粒,细胞变大,有些细胞肿大而破碎,而未转染组的细胞未出现此现象(图4)。
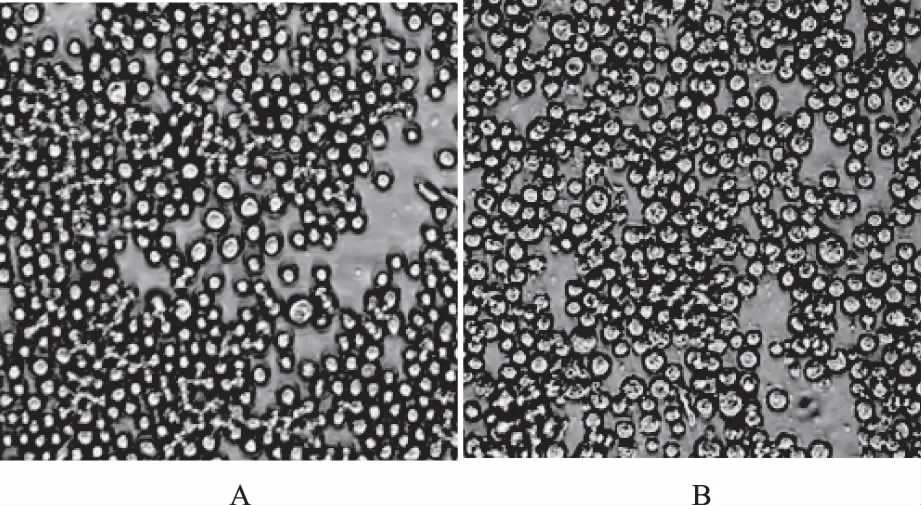
图4 正常Sf9细胞(A)和转染rBacmid-VP0 5 d后的Sf9细胞(B)(×400)Fig.4 Normal Sf9 cells(A) and Sf9 cells transfected with rBacmid-VP0 after 5 d(B)( ×400)
2.5重组蛋白的间接免疫荧光检测
为检测重组蛋白在昆虫细胞中的表达情况,将P3代rBac-VP0感染24孔板中对数生长期的Sf9细胞,以鸭抗全病毒血清为一抗,进行间接免疫荧光检测,结果显示在rBac-VP0感染的Sf9细胞中出现特异性荧光,而野生型杆状病毒感染组则未出现特异荧光(图5)。

A: 感染重组病毒的Sf9昆虫细胞; B: 正常Sf9昆虫细胞。 A: Sf9 insect cells infected with recombinant virus; B: normal Sf9 insect cells.
2.6重组蛋白的Western-blot分析
为鉴定重组蛋白的大小,将P3代rBac-VP0感染后的细胞沉淀进行western-blot分析,以VP0单抗为一抗。结果显示在相对分子量约为29 kD处出现了特异性条带,相对分子量与目的蛋白相同,而野生型杆状病毒感染则未出现特异条带(图6)。
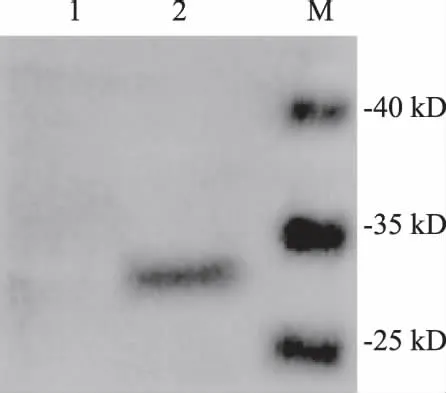
M: 蛋白质marker;1:感染野生型杆状病毒的细胞裂 解液;2:感染rBac-VP3的细胞裂解液。 M: Protein molecular weigh Marker; 1: Sf9 insect cells lysate infected with wild type baculovirus; 2: Sf9 insect cells lysate infected with rBac-VP3.
3 讨论
鸭甲型肝炎病毒为无囊膜的二十面体对称的RNA病毒,其衣壳由VP0、VP1和VP3 3种结构蛋白组成,VP1作为其主要的保护性抗原蛋白,对于其功能的相关研究较多,而相关VP0的研究报道则较少。不同DHAV血清型之间VP1基因变化较大,而VP0则相对保守[11-12]。根据亲缘关系最近的人双埃柯病毒的研究,推测DHAV-1结构蛋白VP0上可能存在保守的B细胞表位,可产生中和抗体[13]。
杆状病毒表达系统作为一种体外基因表达系统,不但克服了大肠杆菌原核表达系统不能对重组蛋白进行翻译后加工的缺陷,而且也克服了动物细胞真核表达系统操作复杂、成本高等弊端,已成为外源基因表达的主要候选系统。本研究选择利用Bac-to-Bac杆状病毒系统来表达DHAV-I VP0蛋白,Western-blot结果显示表达的蛋白大小正确,间接免疫荧光结果说明重组蛋白能与阳性鸭抗全病毒血清发生特异性反应,说明昆虫细胞中表达的VP0蛋白具有良好的反应原性。
杆状病毒系统表达外源蛋白有时需要对外源基因进行密码子优化。密码子适应指数(CAI)接近1.0时,蛋白表达水平较高,GC含量平均在30%~70%之间,蛋白能够进行有效的转录和翻译,许多研究者通过优化密码子实现了对目的基因的高效表达[14]。本试验中在用SDS-PAGE对外源蛋白表达水平进行检测分析时,与对照组相比,未能观察到明显的差异条带,而Western-blot分析时则出现了特异性的差异条带,说明重组蛋白的表达量不高,为提高重组蛋白的表达水平,以后将对VP0基因的密码子进行优化,以提高VP0的表达量,促进其进一步应用。
[1] 张艳芳, 罗薇, 刘内生, 等. 鸭肝炎病毒的研究进展[J]. 中国畜牧兽医, 2011, 38(7): 171-174.
[2] WANG L, PAN M, FU Y, et al. Classification of duck hepatitis virus into three genotypes based on molecular evolutionary analysis[J]. Virus Genes, 2008, 37(1): 52-59.
[3] 施少华, 程龙飞, 傅光华, 等. 鸭肝炎病毒新血清型基因组序列分析[J]. 微生物学报, 2009, 49(3): 309-313.
[4] KIM M C, KWON Y K, JOH S J, et al. Molecular analysis of duck hepatitis virus type 1 reveals a novel lineage close to the genusParechovirusin the familyPicornaviridae[J]. Journal of General Virology, 2006, 87(11): 3307-3316.
[5] KIM M C, KWON Y K, JOH S J, et al. Recent Korean isolates of duck hepatitis virus reveal the presence of a new geno-and serotype when compared to duck hepatitis virus type 1 type strains[J]. Archives of Virology, 2007, 152(11): 2059-2072.
[6] TSENG C H, KNOWLES N J, TSAI H J. Molecular analysis of duck hepatitis virus type 1 indicates that it should be assigned to a new genus[J]. Virus Research, 2007, 123(2): 190-203.
[7] LIU G, WANG F, NI Z, et al. Genetic diversity of theVP1 gene of duck hepatitis virus type 1(DHV-1) isolates from southeast China is related to isolate attenuation[J]. Virus Research, 2008, 137(1): 137-141.
[8] 王安平, 朱善元, 吴双, 等. 鸭新城疫病毒M基因的原核表达与多抗制备[J]. 河南农业科学, 2016, 45(1): 124-126.
[9] 王安平, 朱善元, 王永娟, 等. I型鸭甲型肝炎病毒VP0基因的原核表达与多抗的制备[J]. 河南农业大学学报, 2015, 49(5): 658-661.
[10] 王安平, 朱善元, 王永娟, 等. 鸭源新城疫病毒F基因在昆虫细胞中的表达和鉴定[J]. 中国畜牧兽医, 2015, 42(11): 2862-2866.
[11] SONG C, HAN X, QIU X, et al.Complete sequence and analysis of duck hepatitis virus type 1 strain FC64[J]. Prog Vet Med,2011, 32: 13-17.
[12] DING C Y, ZHANG D B. Molecular analysis of duck hepatitis virus type 1[J]. Virology, 2007, 361(1): 9-17.
[13] CHA S Y, ROH J H, KANG M, et al. Isolation and characterization of a low pathogenic duck hepatitis A virus 3 from South Korea[J]. Vet Microbiol,2013, 162: 254-258.
[14] SMITH J M, AMARA R R, CAMPBELL D, et al. DNA/MVA vaccine for HIV type I: effects of codon-optimization and the expression of aggregates or virus-like particles on the immunogenicity of the DNA prime[J]. AIDS Res Hum Retroviruses, 2004, 20(12): 1335-1347.
(责任编辑:蒋国良)
ExpressionofVP0genesofduckhepatitisAvirustype-Iininsectcells
WANG Anping, GU Lingling, WANG Yongjuan, WU Shuang, ZUO Weiyong, HONG Weiming, ZHU Shanyuan
(Jiangsu Agri-animal Husbandry Vocational College, Jiangsu Key Laboratory for High-Tech Research and Development of Veterinary Biopharmaceuticals, Taizhou 225300, China)
In order to express the structural protein VP0 of duck hepatitis A virus type-I (DHAV-I) in insect cells, one pair of specific primers were designed according to the published genome sequences of DHAV-I to amplifyVP0 genes by PCR, the amplified fragment was cloned into Baculovirus expression vector pFastBac1. The recombinant vector pFB-VP0 was transformed into DH10BacE.coli, and the positive recombinant bacmid rBacmid-VP0 was screened according to the resistant and the blue-white plague screening. The recombinant bacmid rBacmid-VP0 was transfected into the Sf9 insect cells by liposome. Once the cytopathic effect was found, the rBac-VP0 was aquired. The result of Western blot showed that the molecular weight of the recombinant proteins was about 29 kD. Indirect immunofluorescence analysis showed that the recombinant proteins could be recognized by the positive anti-virus serum. These results suggest that the structural proteins VP0 of DHAV-I have been expressed successfully in insect cells, which can lay the foundation of function study on VP0 protein.
duck hepatitis A virus type-I;VP0 gene; insect cells; expression
S834
:A
2016-11-20
国家自然科学基金项目(31302096);江苏省农业支撑项目(BE2013415);江苏省六大人才高峰项目(NY-009)
王安平(1980-),女,江苏泰州人,副教授,博士,主要从事兽用生物制药的研究。
朱善元(1968-),男,江苏泰州人,教授,博士。
1000-2340(2017)03-0365-05

