茶树β-淀粉酶基因CsBAM3的克隆及其响应低温的表达模式
郝心愿岳 川唐 湖钱文俊王玉春王 璐王新超,*杨亚军,*中国农业科学院茶叶研究所 / 国家茶树改良中心 / 农业部茶树生物学与资源利用重点实验室, 浙江杭州3008;福建农林大学园艺学院, 福建福州35000
作物遗传育种·种质资源·分子遗传学
茶树β-淀粉酶基因CsBAM3的克隆及其响应低温的表达模式
郝心愿1,**岳 川1,2,**唐 湖1钱文俊1王玉春1王 璐1王新超1,*杨亚军1,*
1中国农业科学院茶叶研究所 / 国家茶树改良中心 / 农业部茶树生物学与资源利用重点实验室, 浙江杭州31008;2福建农林大学园艺学院, 福建福州350002
β-淀粉酶(BAM)是植物中参与淀粉水解的关键酶类, 在应对非生物胁迫中发挥重要作用。从前期茶树冷驯化转录组分析中分离到1个参与淀粉代谢的差异表达基因, cDNA全长克隆及序列分析鉴定该基因为拟南芥BAM3同源基因, 命名为CsBAM3。该基因编码548个氨基酸残基, 与拟南芥的BAM1和BAM3一起归为第II亚家族, 推测为叶绿体定位、具有淀粉水解活性的β-淀粉酶编码基因。启动子克隆及序列分析显示该基因可能受生理节律、光、低温及多种激素等信号共同调控。CsBAM3在叶片中表达量最高, 茎和花中表达量较低, 根中基本不表达。CsBAM3在冷驯化初期被显著上调且一直保持相对较高的水平。成熟叶片及嫩芽(一芽二叶)中的CsBAM3均可以被4℃及0℃低温显著上调, 且嫩芽中基因的表达量上调幅度明显高于成熟叶。模拟倒春寒低温条件下, 检测不同萌发阶段新梢中CsBAM3的表达情况表明, CsBAM3在鲜叶初展的嫩芽中即可快速受低温诱导。以上结果表明, CsBAM3是茶树中调控淀粉水解的一个重要β淀粉酶编码基因, 在茶树成熟叶和嫩芽受到不同低温胁迫时其表达可被快速诱导。
β淀粉酶; 茶树; 基因克隆; 低温胁迫; 表达调控
我国大部分茶区冬季都存在较长时间的低温过程, 茶树品种的抗寒能力是影响其地理分布和安全越冬的重要指标[1]。近年来随着早生茶树品种的广泛种植和气候变化的不断加剧, 春季“倒春寒”天气也成为威胁茶树生产的不利因素[2]。研究茶树在不同低温条件下的响应机制, 挖掘参与低温响应的关键基因, 是揭示茶树抗寒机理的重要途径。我们前期以不同冷驯化阶段的茶树叶片为材料, 进行了全面的转录组分析, 果证实糖代谢是参与茶树低温抗性形成的一个关键途径[3]。
增加胞内可溶性糖含量, 是植物响应低温胁迫提高自身抗寒能力的重要途径[4-6]。但这一过程相当复杂, 涉及酶活性、基因表达和信号转导等的改变[7]。糖自身也可以作为一种信号分子, 调控植物的逆境响应和生长发育[8-9]。植物体内的碳水化合物存在形式多样, 种类繁多。其中淀粉是植物中分布最广、储量最丰富的非结构性碳水化合物, 也是叶绿体光合作用的主要产物。叶绿体中淀粉以 6-磷酸果糖为底物, 依次在葡萄糖磷酸异构酶(PGI)、葡萄糖磷酸变位酶(PGM)、ADP-Glc焦磷酸化酶(AGPase)和淀粉合酶(SS)的催化作用下合成; 在 β-淀粉酶(BAM)作用下水解成麦芽糖, 在麦芽糖转运蛋白 MEX1的作用下转运到胞质[10]。α-淀粉酶同样可以通过作用于 α-1,4-糖苷键水解淀粉, 但在叶绿体中过渡型淀粉的水解中并不发挥主要作用[11]。茶树叶片透射电镜观察显示, 冬季自然冷驯化前叶绿体内的淀粉粒在冷驯化结束后明显减小甚至消失; 而叶片中麦芽糖的含量逐渐升高[12]。说明叶片中淀粉的水解是叶片提高胞内可溶性糖含量, 进而增强抗寒能力的重要途径。
BAM不仅是植物中重要的淀粉水解酶, 同时还在逆境胁迫响应中发挥重要的作用。拟南芥中已经鉴定的BAM蛋白有9个, 其中至少4个(BAM1、BAM2、BAM3和BAM4)是定位于叶绿体的[13]。在已知定位于叶绿体的 BAM 中, 体外重组蛋白试验显示仅有BAM1、BAM2和BAM3具有催化活性, 而基因沉默试验表明仅有BAM1和BAM3具有水解淀粉的功能。BAM4虽然没有水解活性, 却可以直接与淀粉及 α-1,4-糖苷键结合, 协助淀粉水解[13-14]。BAM1和BAM3在基因结构和氨基酸组成上都存在差异, 在蛋白特性上体现为BAM1在相对较高的pH和较高的温度下活性高于 BAM3[15]。研究也表明BAM的作用具有一定的节律性, 白天BAM1在淀粉水解中起主导作用, 而在夜晚BAM3则发挥主要作用。BAM3的转录受低温胁迫诱导, 枳中与 BAM3归为同一类的PtrBAM1编码基因则受CBF直接诱导, 在应对冷胁迫中发挥重要作用[15-16]。表达谱分析显示多个 BAM 家族基因均受低温诱导[17-18]。除定位于叶绿体外, 部分BAM蛋白定位于细胞核, 可以通过 BZR1结构域与油菜素内酯(BR)信号途径互作, 调控植物的生长和发育过程[19]。
糖代谢在植物低温胁迫中的作用已被广泛关注,茶树中受低温等逆境胁迫诱导的糖代谢相关基因,如海藻糖8磷酸合成酶TPS、转化酶INV、己糖激酶 HXK等已有相关报道, 丁菲[20]和岳川[21]分别对茶树中糖代谢相关基因在茶树低温胁迫或冷驯化中的表达模式进行了研究, 但茶树中受低温直接诱导的糖代谢相关基因鲜有报道。在前期的冷驯化转录组分析中[3], 我们发掘一条与拟南芥 BAM3高度同源的基因片段, 该基因在冷驯化阶段被显著上调,可能在茶树抗寒中发挥重要作用。本研究对该基因进行了全长克隆及序列分析, 并检测了该基因在冬季冷驯化阶段和早春低温胁迫条件下的表达变化,获得了有意义的结果。
1 材料与方法
1.1 试验材料及处理
供试材料为国家级茶树良种龙井43, 种植于中国农业科学院茶叶研究所试验茶园(30°10′ N, 120° 05′ E)。10月份采集田间健康茶树(20年生)根、幼嫩茎、叶(当年生成熟叶)和花(刚展开), 用于组织特异性表达检测。10月至次年3月份, 每2周采集茶树枝条顶端以下第 2至第 3片完整成熟叶, 统一于上午10∶00采样, 记录采样期间每日温度变化。根据气温变化, 选取 11月至 12月份处于冷驯化阶段的样品用于表达检测。春季一芽二叶期时, 于上午10∶00离体剪下健康的茶树枝条, 立即带回实验室, 分别放入20℃、4℃和0℃恒温培养箱中处理4 h, 分别采集嫩芽(一芽二叶)及上部成熟叶(顶端以下第 2~3片), 每个处理至少取 5片(个)叶或嫩芽, 用于检测基因在低温诱导下的表达。
以自然越冬的萌动期盆栽茶树(8年生)为材料,首先移入模拟春季萌发条件的人工气候室(12~24℃变温, 13 h光照, 70%湿度)。待茶树进入鱼叶期、一芽一叶期、一芽二叶期时, 依次将茶树直接移入模拟倒春寒低温条件的人工气候室(白天4℃, 夜晚2℃, 13 h光照, 70%湿度), 分别于处理24 h和48 h后采集该时期嫩芽, 用于检测不同发育阶段嫩芽响应低温的表达模式。以上试验均设3个生物学重复。所有处理或采集样品立即投入液氮, 冷冻完全后–80℃保存。
1.2 DNA、RNA提取及cDNA合成
茶树叶片 DNA 采用 NucleoSpin Tissue (MACHEREY-NAGEL, 德国)试剂盒提取。参考Chang等[22]的方法提取茶树总RNA。提取RNA浓度及质量经 NanoDrop 2000c分光光度计(ThermoFisher Scientific, 美国)和 1%琼脂糖凝胶电泳检测, 未产生降解的RNA被统一稀释到1000 ng µL–1。每个样品取5 µg RNA经DNase I (Invitrogen,美国)处理后, 采用SuperScript III First-Strand Synthesis System (Invitrogen, 美国)试剂盒合成cDNA。
1.3 cDNA全长及启动子克隆
依据茶树冷驯化转录组分析中目的基因序列信息[3], 按照SMARTScribe RACE cDNA Amplification Kit (Clontech Laboratories, 中国)试剂盒说明, 设计RACE特异引物(表1)。以获得的不同茶树组织RNA为材料, 进行RACE反应(94℃ 30 s, 68℃/65℃ 30 s, 72℃ 2 min, 25个循环), PCR产物经1%琼脂糖凝胶电泳检测, 回收最长片段并进行克隆、测序。所得序列经 SeqMan (DNASTAR.Lasergene v7.1)拼接后获得包含全长ORF的cDNA序列。在ORF两端设计引物(表1), 按照PrimeSTAR HS试剂盒(TaKaRa,中国)的说明扩增全长ORF, 并测序验证。
启动子采用GenomeWalker 2.0 (Clontech Laboratories, 中国)试剂盒克隆。首先将获得的基因组DNA稀释到100 ng µL–1, 经Dra I酶切检验后, 按照试剂盒说明使用Dra I、EcoR V、Pvu II和Stu I酶进行酶切、建库。终产物稀释到 40 µL后用于GenomeWalker PCR试验。依据已知基因序列设计巢式PCR引物(表1), 以构建的4个DNA文库为模板,进行2轮PCR扩增。PCR产物经1.5%琼脂糖凝胶电泳检测, 将大于500 bp的产物条带切胶回收、克隆、测序。利用SeqMan对所得序列进行拼接。
1.4 生物信息学分析
在EXPASY (http://expasy.org/tools/)生物信息学分析平台上, 选择 Compute pI/Mw、TargetP、ChloroP、SWISS-MODEL等工具对氨基酸序列进行生物信息学分析, PyMol 1.2软件进行蛋白3D结构编辑; WoLF PSORT (http://www.genscript.com/psort/ wolf_psort.html)预测蛋白质亚细胞定位; 利用MEGA5.0软件中 ClustalW进行氨基酸序列比对后,以邻近相连法构建系统进化树; 在 PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/ html/)中对启动子中所含顺式作用元件进行预测。
1.5 以qRT-PCR检测基因表达
将 cDNA合成终产物稀释 40倍后用作模板, CsPTB基因为内参[23], Primer-Blast (https://www.ncbi. nlm.nih.gov/tools/primer-blast)设计目的基因特异性定量引物(表1), 在ABI PRISM 7500实时定量PCR仪上进行qRT-PCR分析。采用SYBR Premix Ex Taq (TaKaRa, 中国)试剂根据要求构建10 µL定量反应,其中cDNA模板4 µL。PCR程序为95℃预变性30 s, 40个扩增反应(94℃ 5 s, 60℃ 34 s), 反应结束添加溶解曲线分析(65~97℃)。
2 结果与分析
2.1 CsBAM3基因的cDNA全长克隆及序列分析
2.1.1 CsBAM3基因的cDNA全长克隆 将茶树转录组数据库中已知序列在NCBI中进行BlastX比对, 结果发现该序列 5′端部分缺失, 不含完整的ORF。依据已知序列设计 5′-RACE特异引物进行RACE-PCR扩增, 经产物克隆、测序、拼接, 最终获得了全长cDNA序列。RT-PCR验证序列正确, 且包含完整的ORF (图1)。ORF长度为1647 bp, 编码548个氨基端残基。与NCBI的NR数据库比对显示该基因编码蛋白与拟南芥中的 BAM3蛋白(NP_567523.1)序列相似性较高, 故命名为 CsBAM3基因(GenBank登录号为KF906412.1)。
2.1.2 CsBAM3编码蛋白的序列分析 生物信息学分析显示, CsBAM3蛋白分量为61.73 kD, 理论等电点为6.92。亚细胞定位预测CsBAM3含有长度为41氨基酸残基的N端叶绿体定位信号肽(cTP), 可能定位于叶绿体。系统发育树结果显示, CsBAM3与杨树中的PtBAM2和PtBAM3的亲缘关系最近, 与拟南芥中的 BAM1、BAM3和枳中的 PtrBAM8、PtrBAM1、PtrBAM2一起聚为第II亚家族(图2)。3D结构预测发现, CsBAM3主要包含有10个α-螺旋和8个β-折叠, α-螺旋在外围, β-折叠区位于中心, 相互缠绕包裹形成一个近似圆饼状的高级结构, 底物结合位点和催化位点位于结构的中心(图3)。在81~534氨基酸残基区间的氨基酸序列模拟的结构与数据库中其他 BAM 蛋白的高级结构高度匹配, 具有典型的BAM蛋白的催化作用功能域结构。

表1 引物信息Table 1 Primer information

图1 CsBAM3编码区PCR扩增产物电泳图Fig. 1 Electrophoresis of PCR products of CsBAM3 coding region
2.2 CsBAM3基因的启动子克隆及序列分析
经过 4种不同的酶切建库, 我们扩增出多条长度大于1 kb的片段, 测序拼接后获得了长度大于2kb的启动子序列(GenBank登录号为KY564199) (图4)。启动子序列分析显示, 在长度为2 kb的区域内包含多种顺式作用元件, 其中包括可以被生理节律识别的“circadian”位点, 以及多个受光信号调控的位点, 如Box1、AT1-motif、Box4、AE-box、Sp1等;同时启动子还含有茉莉酸甲酯、水杨酸、乙烯、赤霉素、脱落酸等激素的调控元件和 α-淀粉酶上游区域的保守序列“amylase box”; 还含有 3 个“MYCCONSENSUSAT”位点, 该位点为MYC识别位点, 存在于拟南芥 CBF3以及脱水反应相关的rd22等多个基因的启动子区, 同时也是 ICE1调控CBF/DREB基因转录的识别位点(表2)。
2.3 CsBAM3基因的组织特异性表达
以正常生长的秋季不同茶树组织为材料, 检测了CsBAM3基因的组织特异性表达(图5)。结果显示, CsBAM3在叶片中的表达水平最高, 在幼嫩茎和花中的表达相对较低。叶中的表达水平是其在幼嫩茎和花中的5倍以上。该基因在根中的表达水平最低,仅有微弱的基因表达。
2.4 CsBAM3基因响应低温的表达模式分析
10月份开始采样并记录每日温度变化(图 6-A),检测冷驯化阶段(温度逐渐降低的 11、12月份) CsBAM3基因的表达变化(图6-B)。结果显示CsBAM3在冷驯化前期处于相对较低的表达水平, 在冷驯化阶段表达被显著上调, 是前期的15倍以上。冷驯化后期表达量有所降低。
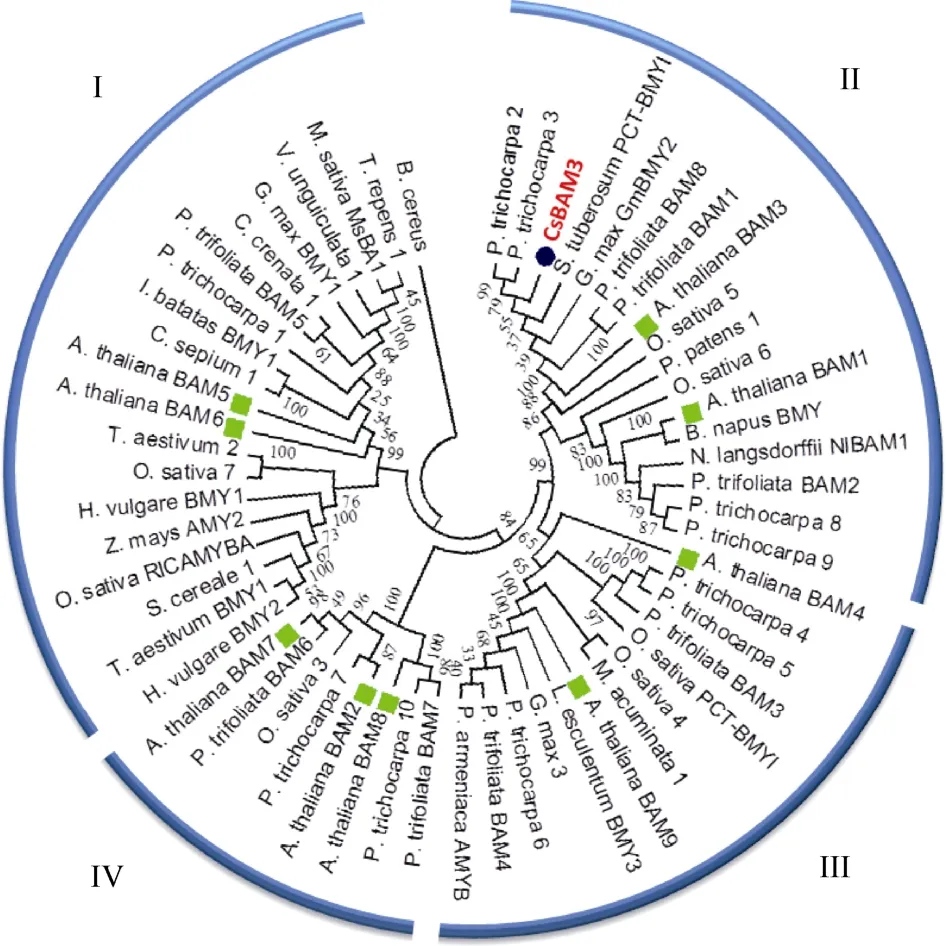
图2 CsBAM3与其他物种中BAMs的系统发育树分析Fig. 2 Phylogeny of CsBAM3 and BAMs from other species
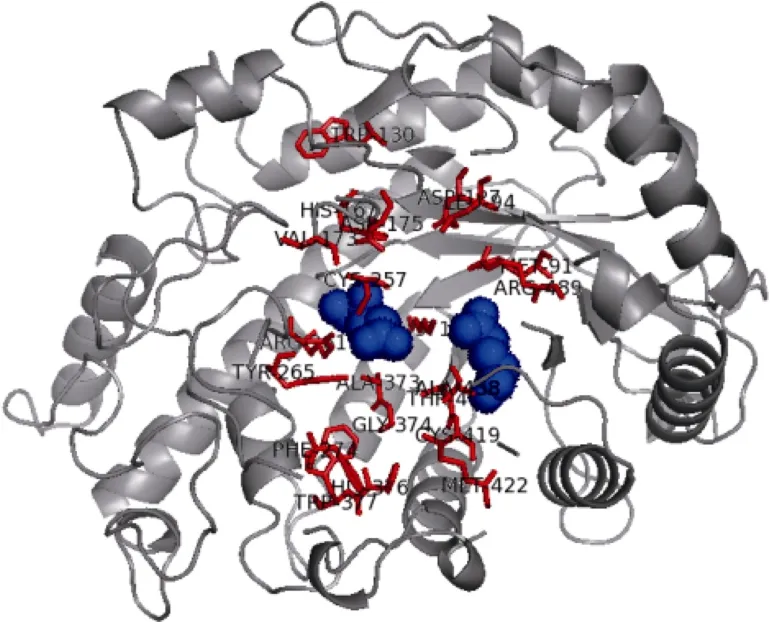
图3 CsBAM3的3D结构预测Fig. 3 3D structure prediction of CsBAM3
以春季萌发阶段的自然生长的成熟叶和嫩梢(一芽二叶)为材料, 分别给予4 h的4℃和0℃低温处理, 以 20℃的处理为对照, 检测 CsBAM3在不同发育状态的叶片中的表达变化(图 7)。结果显示CsBAM3无论在成熟叶还是新梢中, 低温诱导后其表达均被显著上调, 而且0℃处理较4℃处理作用更加明显。另外, 在新梢中 CsBAM3受低温诱导表达的反应比成熟叶明显。
为进一步鉴定CsBAM3在新梢抗寒中的表达变化, 利用人工气候室模拟倒春寒低温条件, 分别在茶树春季萌发的鱼叶期、一芽一叶和一芽二叶期给予不同时间的低温胁迫, 检测 CsBAM3基因的表达变化(图8)。以0 h低温处理为对照, 在3个检测时期CsBAM3基因均在低温胁迫24 h和48 h后显著上调, 而且随着茶树新梢成熟度提高, 其上调幅度更加明显。
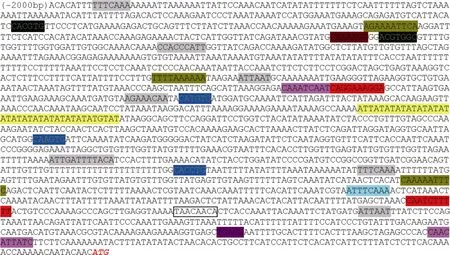
图4 CsBAM3启动子序列及包含的顺式作用元件Fig. 4 Sequence and cis-acting element information of CsBAM3 promoter
3 讨论
BAM是介导植物叶片中淀粉水解的关键酶[10]。拟南芥中已经鉴定的9个BAM蛋白被归为4个亚家族, BAM5和BAM6为第I亚家族, BAM1和BAM3为第 II亚家族, BAM4和 BAM9为第 III亚家族, BAM2、BAM7和BAM8为第IV亚家族[13]。已知BAM1-4是叶绿体定位的淀粉水解酶, 但其中只有BAM1和BAM3具有显著的生理活性, 2个酶均由4个外显子组成, 在系统发育树中被归为同一类[7,25]。系统发育树分析将茶树中的CsBAM3与拟南芥中的BAM3和BAM1归为同一亚家族, 与BAM3的序列相似性较高(图2)。一同被归为该亚家族的还有常绿植物枳、落叶植物杨树以及单子叶植物水稻中的BAM蛋白等。已知在枳中共鉴定8个BAM基因, 其中只有PtrBAM1和PtrBAM8与拟南芥的BAM3关系最近, 氨基酸序列分析显示只有PtrBAM1含有拟南芥BAM3蛋白中所有重要的氨基酸位点[16]。其他植物中与CsBAM3关系较近的BAM蛋白的功能目前还不清楚。BAM1、BAM3以及PtrBAM1均为叶绿体定位蛋白[13,16], CsBAM3同样含有叶绿体定位的信号肽, 推测该蛋白为叶绿体定位。3D结构分析显示CsBAM3有着与数据库中其他BAM蛋白高度匹配的高级结构[13]。与BAM3相似, 在结构中心包含典型的底物结合位点和催化位点(图3), 说明茶树CsBAM3是一个具有淀粉催化功能的蛋白。
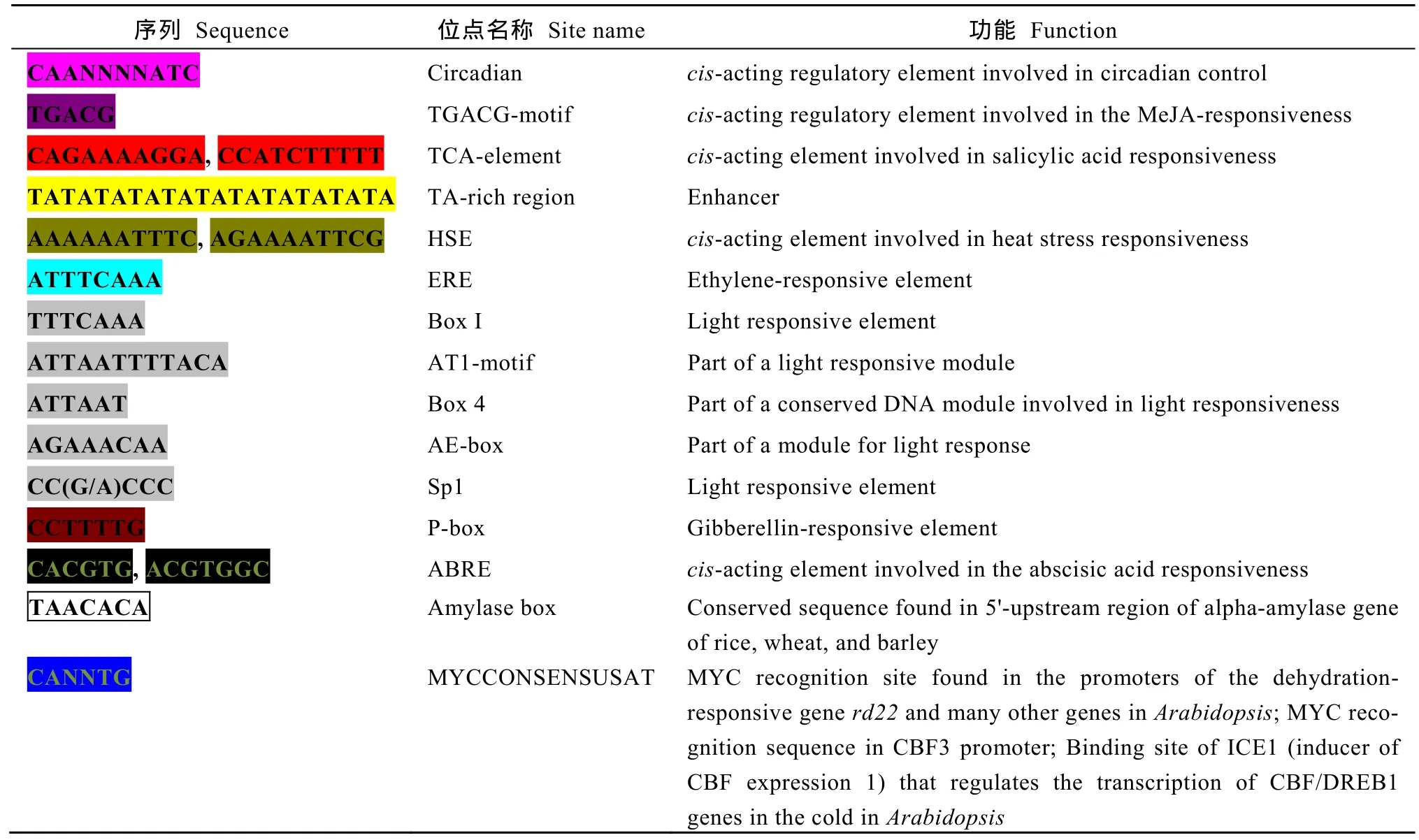
表2 CsBAM3启动子区顺式作用元件功能注释Table 2 Functional annotation of the cis-acting elements in CsBAM3 promoter region
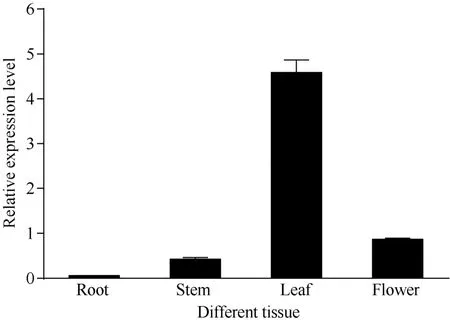
图5 CsBAM3的组织特异性表达检测Fig. 5 Tissue-specific expression detection of CsBAM3
在植物冷驯化研究中发现, 多数 BAMs基因受低温诱导后表达快速上调, 其中 BAM3的表达变化最为显著[18,26]。Peng等[16]对枳中PtrBAM1的启动子序列分析发现, 存在CBF结合顺式作用元件、干旱响应元件、淀粉酶保守序列及响应调节因子(ARR1)结合元件等。利用酵母单杂交试验结合表达分析证实, PtrBAM1受CBF直接诱导。CsBAM3启动子序列分析显示, 除了包含与低温相关的“MYCCONS ENSUSAT”位点以及淀粉酶保守序列外, 还包含生理节律识别的“circadian”位点、多个光信号调控位点和多种激素识别位点。Ingkasuwan等[27]在拟南芥中发现受日变化节律调控的基因有 1480个, 其中 21个来自淀粉代谢途径中不同酶类的编码基因; 而且调控网络分析显示, BAM3是与所有受节律调控基因关系最为密切的信号节点。CsBAM3启动子中的“circadian”位点进一步证实 BAM3可能是受日变化节律调控的关键基因。与激素反应相关的识别位点有多种(图4), 包括与抗逆相关的茉莉酸甲酯、水杨酸、脱落酸调控元件, 以及与生长发育相关的乙烯、赤霉素调控元件等[28]。前人研究表明, ABA处理能够引起BAMs基因表达的显著变化[24,29]。但其他激素在 BAMs基因调控中的作用还需要进一步研究。淀粉代谢具有明显的日变化规律, 可能与每日的光照和黑暗交替变化密切相关[30]。除了每日不同时间光照会发生变化外, 一年不同时间的日长和光照强度都会发生显著, 有时甚至是剧烈的变化。BAMs作为叶绿体光合产物水解的关键调控基因, 要能够适应外界光照的变化。CsBAM3基因启动子区存在的多个光信号作用位点, 表明该基因可能受光信号直接调控。
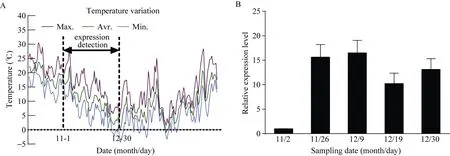
图6 温度变化及CsBAM3在冷驯化阶段的表达模式分析Fig. 6 Temperature information and expression level of CsBAM3 during cold acclimation periods
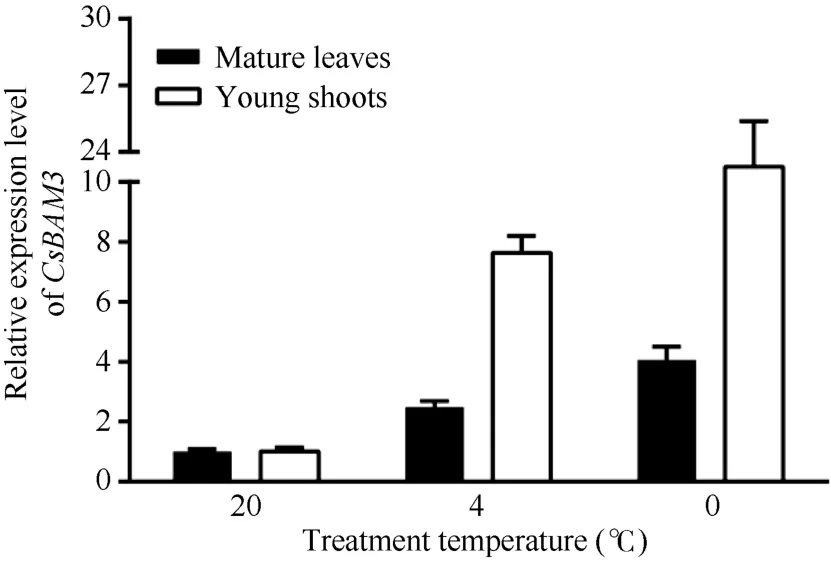
图7 低温诱导条件下CsBAM3在不同组织中的表达水平Fig. 7 Expression levels of CsBAM3 in different organs with the treatment of cold
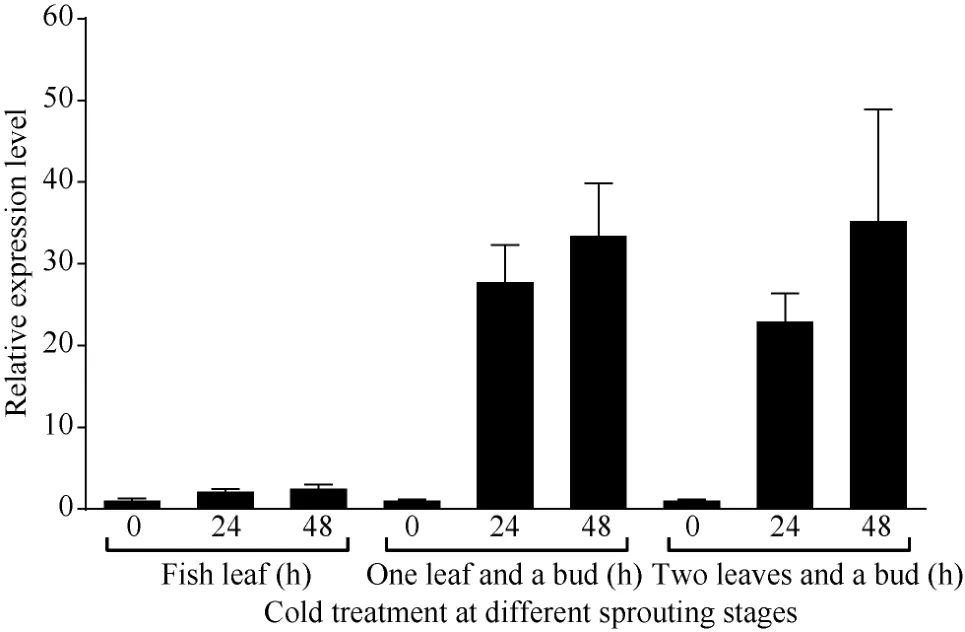
图8 低温诱导条件下CsBAM3在不同萌发阶段嫩芽中的表达Fig. 8 Expression levels of CsBAM3 in young shoots at different sprouting stages after cold treatment
冬季低温和春季倒春寒是威胁茶树生产的重要气候因素[2-3]。为明确CsBAM3在茶树应对低温胁迫中的作用, 我们检测了 CsBAM3基因在不同条件下的表达变化(图 5~图 8)。组织特异性分析显示, CsBAM3在叶片中的表达水平最高, 在根中几乎不表达, 这与该蛋白的叶绿体定位和具有淀粉催化功能的结果相一致。在冬季自然冷驯化早期 CsBAM3在茶树成熟叶中的表达被显著上调。拟南芥中, 4℃低温处理6 h后可以显著增强BAM3的表达信号; 而且在一定的温度区间(0~20℃), 温度越低 BAM3的表达被上调的越明显[17,26]。BAM3被沉默后, 植株的抗寒能力则明显减弱[26]。在枳中同样发现, 8个PtrBAMs基因中有 6个受低温诱导, 在烟草中过表达PtrBAM1基因可以明显增强其抗低温能力, 减少受冻叶片中活性氧的积累[16,24]。当同时给予成熟叶片和嫩芽(一芽二叶)以4℃和0℃低温时, CsBAM3在2种不同组织中均被上调表达。特别是嫩芽中的CsBAM3, 在2种温度处理下其表达量均明显高于成熟叶片。Shin等[31]发现碧桃中的 BAM基因表达量高低与碧桃新梢的抗寒能力强弱成正相关。我们进一步利用人工气候室模拟倒春寒条件, 检测了CsBAM3及CsCBF在茶树越冬芽萌发不同阶段的表达变化(图8)。在越冬芽萌发到一芽一叶时, 虽然此时的叶片还未完全展开, CsBAM3的表达就被明显上调。在鱼叶期时萌动的越冬芽还未长出叶片, 此时CsBAM3的表达虽有上调, 但不明显。说明CsBAM3主要在新梢长出叶片后才发挥作用。因此, 对CsBAM3的深入研究将为揭示茶树新梢低温响应机制, 应对倒春寒危害提供重要理论依据。
4 结论
克隆获得的CsBAM3为β淀粉酶(BAM)编码基因。CsBAM3蛋白与拟南芥的BAM1和BAM3一起归为第 II亚家族, 推测具有叶绿体定位特性和淀粉水解活性。启动子克隆及序列分析显示, 该基因启动子包含生理节律调控元件、低温响应元件, 多个光信号响应元件和多种激素信号识别位点, 可能受生理节律、光、低温及多种激素等信号共同调控。CsBAM3在叶片中表达量最高, 根中基本不表达,在冷驯化初期被显著上调且一直保持相对较高的水平。成熟叶片及嫩芽(一芽二叶)中的 CsBAM3均可以被4℃及0℃低温显著上调, 且嫩芽中基因的表达量上调幅度明显高于成熟叶中。人工模拟倒春寒低温条件显示该基因在鲜叶初展的嫩芽中即可快速受低温诱导。表明CsBAM3是茶树中调控淀粉水解的一个重要 β-淀粉酶编码基因, 在茶树成熟叶和嫩芽中的表达受低温快速诱导。
[1] 蒋跃林, 李倬. 我国茶树栽培界限的气候划分. 生态农业研究, 2000, 8(1): 89–92 Jiang Y L, Li Z. Climate divison of tea tree cultivated limit in China. Eco-Agric Res, 2000, 8(1): 89–92 (in Chinese with English abstract)
[2] 郭湘, 唐茜, 许燕, 陈玖琳, 王自琴. 早春霜冻对不同茶树品种芽叶的生化成分及制茶品质的影响. 云南大学学报, 2015, 37: 930–938 Guo X, Tang Q, Xu Y, Chen J L, Wang Z Q. Effect of frost in early spring on biochemical composition and sensory qulity of new shoots in different tea cultivars. J Yunnan Univ, 2015, 37: 930–938 (in Chinese with English abstract)
[3] Wang X C, Zhao Q Y, Ma C L, Zhang Z H, Cao H L, Kong Y M, Yue C, Hao X Y, Chen L, Ma J Q, Jin J Q, Li X, Yang Y J. Global transcriptome profiles of Camellia sinensis during cold acclimation. BMC Genom, 2013, 14: 415
[4] Benina M, Obata T, Mehterov N, Ivanov I, Petrov V, Toneva V, Fernie A R, Gechev T S. Comparative metabolic profiling of Haberlea rhodopensis, Thellungiella halophyla, and Arabidopsis thaliana exposed to low temperature. Front Plant Sci, 2013, 4: 499
[5] Lee J H, Yu D J, Kim S J, Choi D, Lee H J. Intraspecies differences in cold hardiness, carbohydrate content and beta-amylase gene expression of Vaccinium corymbosum during cold acclimation and deacclimation. Tree Physiol, 2012, 32: 1533–1540
[6] Janska A, Aprile A, Zamecnik J, Cattivelli L, Ovesna J. Transcriptional responses of winter barley to cold indicate nucleosome remodelling as a specific feature of crown tissues. Funct Integr Genom, 2011, 11: 307–325
[7] Gupta A K, Kaur N. Sugar signalling and gene expression in relation to carbohydrate metabolism under abiotic stresses in plants. J Biosci, 2005, 30: 761–776
[8] Baena-Gonzalez E, Sheen J. Convergent energy and stress signaling. Trends Plant Sci, 2008, 13: 474–482
[9] Smeekens S, Ma J, Hanson J, Rolland F. Sugar signals and molecular networks controlling plant growth. Curr Opin Plant Biol, 2010, 13: 274–279
[10] Stitt M, Zeeman S C. Starch turnover: pathways, regulation and role in growth. Curr Opin Plant Biol, 2012, 15: 282–292
[11] Yu T S, Zeeman S C, Thorneycroft D, Fulton D C, Dunstan H, Lue W L, Hegemann B, Tung S Y, Umemoto T, Chapple A, Tsai D L, Wang S M, Smith A M, Chen J, Smith S M. Alpha-amylase is not required for breakdown of transitory starch in Arabidopsis leaves. J Biol Chem, 2005, 280: 9773–9779
[12] Yue C, Cao H L, Wang L, Zhou Y H, Huang Y T, Hao X Y, Wang Y C, Wang B, Yang Y J. Wang X C. Effects of cold acclimation on sugar metabolism and sugar-related gene expression in tea plant during the winter season. Plant Mol Biol, 2015, 88: 591–608
[13] Fulton D C, Stettler M, Mettler T, Vaughan C K, Li J, Francisco P, Gil M, Reinhold H, Eicke S, Messerli G, Dorken G, Halliday K, Smith A M, Smith S M, Zeeman S C. Beta-Amylase 4, a noncatalytic protein required for starch breakdown, acts upstream of three active beta-amylases in Arabidopsis chloroplasts. Plant Cell, 2008, 20: 1040–1058
[14] Li J, Francisco P, Zhou W, Edner C, Steup M, Ritte G, Bond C S, Smith S M. Catalytically-inactive beta-amylase BAM4 required for starch breakdown in Arabidopsis leaves is a starch-bindingprotein. Arch Biochem Biophys, 2009, 489: 92–98
[15] Monroe J D, Storm A R, Badley E M, Lehman M D, Platt S M, Saunders L K, Schmitz J M, Torres C E. Beta-amylase 1 and beta-amylase 3 are plastidic starch hydrolases in Arabidopsis that seem to be adapted for different thermal, pH, and stress conditions. Plant Physiol, 2014, 166: 1748–1763
[16] Peng T, Zhu X, Duan N, Liu J H. PtrBAM1, a beta-amylasecoding gene of Poncirus trifoliata, is a CBF regulon member with function in cold tolerance by modulating soluble sugar levels. Plant Cell Environ, 2014, 37: 2754–2767
[17] Kaplan F, Guy C L. Beta-amylase induction and the protective role of maltose during temperature shock. Plant Physiol, 2004, 135: 1674–1684
[18] Fowler S, Thomashow M F. Arabidopsis transcriptome profiling indicates that multiple regulatory pathways are activated during cold acclimation in addition to the CBF cold response pathway.Plant Cell, 2002. 14: 1675–1690
[19] Reinhold H, Soyk S, Simkova K, Hostettler C, Marafino J, Mainiero S, Vaughan C K, Monroe J D, Zeeman S C. Betaamylase-like proteins function as transcription factors in Arabidopsis, controlling shoot growth and development. Plant Cell, 2011, 23: 1391–1403
[20] 丁菲. 低温胁迫下与茶树糖代谢相关基因的克隆与表达. 安徽农业大学硕士学位论文, 安徽合肥, 2012 Ding F. Cloning and Expression of Genes Related to Glyconmetabolism in Tea Plant (Camellia sinensis (L.) O. Kuntze) Under Low Temperature. MS Thesis of Anhui Agricultural University, Hefei, China, 2012 (in Chinese with English abstract)
[21] 岳川. 茶树糖类相关基因的挖掘及其在茶树冷驯化中的表达研究. 中国农业科学院博士学位论文, 北京, 2015 Yue C. Cloning and Expression Analysis of Sugar-Related Genes during Cold Acclimation in Tea Plant. PhD Dissertation of Chinese Academy of Agricultural Sciences, Beijing, China, 2015 (in Chinese with English abstract)
[22] Chang S, Puryear J, Cairney J. A simple and efficient method for isolating RNA from pine trees. Plant Mol Biol Rep, 1993, 11: 113–116
[23] Hao X, Horvath D P, Chao W S, Yang Y, Wang X, Xiao B. Identification and evaluation of reliable reference genes for quantitative real-time PCR analysis in tea plant (Camellia sinensis (L.) O. Kuntze). Int J Mol Sci, 2014, 15: 22155–22172
[24] 彭婷. 枳叶片抑制差减杂交cDNA文库构建及PtrBAM1基因抗寒功能鉴定. 华中农业大学博士学位论文, 湖北武汉, 2013 Peng T. Suppression Subtractive Hybridization cDNA Library Construction for Low Temperature-treated Poncirus trifoliata and Characterization of PtrBAM1. PhD Dissertation of Huazhong Agurcultural University, Wuhan, China, 2013 (in Chinese with English abstract)
[25] Sparla F, Costa A, Lo Schiavo F, Pupillo P, Trost P. Redox regulation of a novel plastid-targeted beta-amylase of Arabidopsis. Plant Physiol, 2006, 141: 840–850
[26] Kaplan F, Guy C L. RNA interference of Arabidopsis beta-amylase 8 prevents maltose accumulation upon cold shock and increases sensitivity of PSII photochemical efficiency to freezing stress. Plant J, 2005, 44: 730–743
[27] Ingkasuwan P, Netrphan S, Prasitwattanaseree S, Tanticharoen M, Bhumiratana S, Meechai A, Chaijaruwanich J, Takahashi H, Cheevadhanarak S. Inferring transcriptional gene regulation network of starch metabolism in Arabidopsis thaliana leaves using graphical Gaussian model. BMC Syst Biol, 2012, 6: 100
[28] Davies P J. Plant Hormones. Netherlands: Springer-Verlag, XI, 2010, p 833
[29] Takeda S, Kowyama Y, Takeuchi Y, Matsuoka K, Nishimura M, Nakamura K. Spatial patterns of sucrose-inducible and polygalacturonic acid-inducible expression of genes that encode sporamin and β-amylase in sweet potato: gene structure and expression. Plant Cell Physiol, 1995, 36: 321–333
[30] Samojedny D, Orzechowski S. New look at starch degradation in Arabidopsis thaliana L. chloroplasts. Postepy Biochem, 2007, 53: 74–83
[31] Shin H, Oh Y, Kim D. Differences in cold hardiness, carbohydrates, dehydrins and related gene expressions under an experimental deacclimation and reacclimation in Prunus persica. Physiol Plant, 2015, 154: 485–499
Cloning of β-amylase Gene (CsBAM3) and Its Expression Model Response to Cold Stress in Tea Plant
HAO Xin-Yuan1,**, YUE Chuan1,2,**, TANG Hu1, QIAN Wen-Jun1, WANG Yu-Chun1, WANG Lu1, WANG Xin-Chao1,*, and YANG Ya-Jun1,*
1Tea Research Institute, Chinese Academy of Agricultural Sciences / National Center for Tea Improvement / Key Laboratory of Tea Plant Biology and Resources Utilization, Ministry of Agriculture, Hangzhou 310008, China;2College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou 350002
A major enzyme of starch breakdown in plant leaf, β-amylase (BAM), plays important roles in response to abiotic stresses. In tea plant, a differentially expressed gene involved in starch metabolism was identified from previous RNA-Seq analysis of cold acclimation. Its full-length cDNA was cloned and sequenced, showing that it is a homolog of BAM3 in Arabidopsis (named CsBAM3). CsBAM3 contains 548 amino acid residues and is grouped into subfamily II together with BAM1 and BAM3 from Arabidopsis. According to protein sequence and 3D structure analyses, CsBAM3 was considered as a chloroplast-targeted protein with β-amylase activity. Promoter cloning and sequence analysis showed a couple of responsive elements related to circadian, light, cold, and phytohormone, indicating its complex regulating mechanism. CsBAM3 showed the expression higher in leaf, relative lower in stem and flower and extremely low in root. The expression of CsBAM3 in mature leaf was significantly up-regulated during the early time courses of winter cold acclimation and maintained at relative high level during the followingperiod. With the treatments of 4°C and 0°C, the transcript levels of CsBAM3 in both mature leaves and young shoots were dramatically increased, interestingly, much higher level was detected in young shoots. The cold environment similar to spring cold spell was created using climate chamber. And the expression changes of CsBAM3 in shoots were determined then after the tea plants were moved into climatic chamber at different sprouting phrases. CsBAM3 was quickly up-regulated by cold once the first leaf unfolded. Our study illuminated that CsBAM3 is a key β-amylase coding gene involved in starch metabolism of tea plant, which can be stimulated in both mature leaves and young shoots by cold stress.
β-amylase; Tea plant; Gene clone; Cold stress; Expression regulation
(
): 2017-02-13; Accepted(接受日期): 2017-05-10; Published online(网络出版日期): 2017-05-23.
10.3724/SP.J.1006.2017.01417
本研究由浙江省自然科学基金项目(LY16C160001), 国家现代农业产业技术体系建设专项(CARS-19)和中国农业科学院农业科技创新工程(CAAS-ASTIP-2017-TRICAAS)资助。
This study was supported by the Natural Science Foundation of Zhejiang Province (LY16C160001), the China Agriculture Research System (CARS-19), and the Chinese Academy of Agricultural Sciences through an Innovation Project for Agricultural Sciences and Technology (CAAS-ASTIP-2017-TRICAAS).
*通讯作者(Corresponding authors): 王新超, E-mail: xcw75@tricaas.com, Tel: 0571-86653162; 杨亚军, E-mail: yjyang@tricaas.com
**同等贡献(Contributed equally to this work)
联系方式: E-mail: haoxy@tricaas.com, Tel: 0571-86653162
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20170523.1856.012.html

