利用SSR快速鉴定棉花品种真实性和纯度
王欣怡艾先涛王俊铎梁亚军龚照龙郑巨云郭江平 买买提·莫明李雪源,*新疆农业大学农学院/农业生物技术重点实验室, 新疆乌鲁木齐 83005;新疆农业科学院经济作物研究所, 新疆乌鲁木齐 83009
利用SSR快速鉴定棉花品种真实性和纯度
王欣怡1艾先涛2王俊铎2梁亚军2龚照龙2郑巨云2郭江平2买买提·莫明2李雪源2,*
1新疆农业大学农学院/农业生物技术重点实验室, 新疆乌鲁木齐 830052;2新疆农业科学院经济作物研究所, 新疆乌鲁木齐 830091
利用 SSR分子标记技术对棉花品种真实性和纯度进行分析研究, 旨在为棉花品种提供分子鉴定依据。以具有代表性的棉花品种为材料, 经过引物初筛和复筛, 确定26对均匀分布于棉花染色体上的SSR核心标记。结果表明, 26对核心标记在120份材料中筛选得到138个等位位点, 其中129个为多态性位点, 多态性比率达93.48%。以标准样品为对照, 利用26对核心标记对10份棉花常规种进行真实性鉴定, 发现仅有源棉6号与标准品种的DNA图谱高度一致,其他9份常规种与标准品种均存在8~18个差异位点, 分子鉴定结果与田间鉴定相符。另外分别筛选5对特征引物作为纯度检测标记, 采用单位点平均法统计 4份常规棉品种检测结果表明, 源棉 6号纯度最高, 为 98.0%, 源棉 1号最低, 为90.5%, 检测结果与田间纯度鉴定呈现正相关性。研究表明利用SSR标记技术鉴定棉花品种真实性和纯度的方法完全可行。
棉花; 真实性鉴定; 纯度检测; SSR分子标记
品种真实性和纯度是种子质量的重要指标。据《农作物种子检验规程》中定义, 品种真实性(cultivar genuineness或trueness)是指一批种子所属品种与文件(品种证书、标签等)是否相同; 而品种纯度(varietal purity)则是指品种在特征、特性方面典型一致的程度。品种混杂和纯度降低会明显降低作物产量、影响作物品质。Ashok等[1]研究认为若种子纯度每降低 1%, 那么每公顷棉花减产可达 100 kg。近年来, 我国棉花品种“套牌”、“冒牌”现象严重, 品种质量较差, 严重影响棉花生产安全和健康发展, 因此,生产和市场迫切需要一种科学有效的品种鉴定方法。长期以来, 国内外棉花品种真实性和纯度鉴定的权威方法, 是以形态学为基础的田间小区种植鉴定。由于许多形态学性状鉴定周期长、调查性状易受栽培条件及环境因素影响,使其时效性和可靠性受到一定限制[2], 难以及时监控市场上的种子质量问题和解决品种侵权等纠纷。
分子生物学的发展使农作物品种鉴定进入基因水平,其中以微卫星序列为基础的SSR标记具有扩增稳定可靠、重复性好等优点, 因此被广泛应用于棉花品种鉴定[3]。武耀廷等[4]利用48对SSR标记检测了30个陆地棉栽培品种和 4个高优势杂交种亲本的多态性, 并建立了杂交种的SSR指纹图谱用于分子鉴定和纯度检测。朱美霞等[5]以5个棉花栽培品种为材料, 利用15对SSR引物确定了分析品种纯度所需引物数, 为棉花品种指纹图谱的建立提供了理论依据。殷剑美等[6]从 217对引物中筛选出 21对多态性引物, 构建苏杂118的SSR指纹图谱, 实现了对苏杂118真实性和纯度的快速鉴定。Yu等[7]选择105对均匀分布于染色体的引物, 对棉属6个种的12个基因型进行多态性分析, 揭示了棉属种间和陆地棉种内的DNA多态信息。刘国栋等[8]利用78个SSR标记对12个棉花品种进行标记基因型分析, 通过分析非纯位点率和异型单株率对品种遗传纯度的影响, 建立了利用 SSR标记鉴定棉花品种纯度的方法。
目前利用分子标记对棉花品种进行真实性鉴定和纯度检测的研究主要是针对杂交种, 有关常规种的研究报道还比较少。本研究利用 26对均匀分布于染色体上的SSR标记对棉花品种真实性和纯度分析研究, 并针对如何提高检测效率、降低检测成本, 提出了合理混合 DNA样品的方法, 确定了一种快速鉴定棉花常规品种真实性与纯度的 SSR分子标记方法, 为今后棉花品种鉴定提供分子水平上的依据。
1 材料与方法
1.1 试验材料与取样方法
对于棉花品种真实性鉴定选用常规品种源棉6号、新陆早13、新陆早26、新陆早37、新陆中9、新陆中37、鲁棉研28、中棉所35、中棉所41、中棉所43共10个品种为材料, 随机选取每个品种 15个单株, 将每 5个单株DNA等量混合进行SSR分析, 以SSR位点有2个或2个以上等位变异的组, 对构成混样的5个单株DNA进行检测。
对于棉花品种纯度 SSR检测与田间鉴定选用常规品种中棉所49、源棉1号、源棉2号和源棉6号为材料, 取每个品种100个单株, 对单株DNA进行SSR检测; 在盛铃期[9]分别调查4个品种的株型、铃形、叶形等, 作为田间品种纯度鉴定的依据。
1.2 试验方法
1.2.1 棉花基因组DNA的提取 采用改良CTAB法快速提取棉花基因组 DNA[10]。利用紫外分光光度计检测DNA纯度和浓度, 通过1%的琼脂糖凝胶电泳进一步确定其质量。
1.2.2 SSR扩增与电泳分析 SSR引物信息来源于CMD数据库(http://www.cottonmarker.org/)、CottonDB数据库(http://www.cottondb.org/)以及文献资料[8,11-12]已公布的引物。采用10 µL PCR体系, 包括DNA模板(60 ng µL–1) 1 µL, 正、反向引物(4 pmol µL–1)各0.5 µL, 10×缓冲液1µL, dNTPs (2.5 mmol L–1) 0.2 µL, Taq酶(5 U µL–1) 0.1 µL和ddH2O 6.7 µL。参考艾先涛等[13]PCR方法, 产物经8%的非变性聚丙烯酰胺凝胶电泳分离, 快速银染法[14]染色(仅需12 min)。
1.2.3 数据记录与位点判读 利用均匀分布的26对核心标记, 将供试样本电泳谱带与标准样品比较, 根据谱带一致性判定供试样品的真实性, 结果用不同、近似、相同表示。当供试样品与标准样品差异位点>2时, 判定为不同品种; 当差异位点≤2时, 判定为相似品种; 若供试样品与标准样品无差异位点, 则判定为相同品种[15]。从供试样品中随机选取 100个单株作为检测样本, 根据真实性鉴定时核心引物的扩增结果, 分别选取 5对特征引物作为纯度检测标记。品种纯度P = (NT–ND)/NT×100%, 式中NT为供检品种总株数, ND为杂株数, 以平均值表示该品种的纯度值。
2 结果与分析
2.1 SSR标记多态性分析
以8份遗传背景差异较大的品种对分布于棉花全基因组的586对多态性引物进行初步筛选, 随后利用120份具有广泛代表性的材料复筛, 最终确定26对多态性高、带型清晰的SSR引物定为本次试验的核心引物(表1)。26对核心引物均匀分布于棉花26条染色体上, 在120份复筛材料上共检测到138个等位基因变异, 平均每个SSR有5.31个,变幅为2~9, 其中具有多态性的位点为129个, 多态性比率达93.48%。26对核心引物总体上鉴别能力尚可, 进行棉花品种的鉴定是可行的。
2.2 棉花品种真实性鉴定
2.2.1 取样量的确定 单个植株无法代表整个品种群体的基因型信息, 综合考虑工作量及操作可行性, 将品种真实性鉴定的样品量确定为15个单株, 再将单株DNA合并为若干混合样本进行SSR分析。
为确定混合样本中个体DNA份数, 将A (新陆早26)和B (新陆中37) 2个品种按10∶0、9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9、0∶10的比例混合DNA, 分别记作样1~样11, 利用多态性SSR引物对11个样本进行 PCR扩增, 扩增产物表现为2个品种的杂合带型(图1)。随着2个品种DNA浓度在各个样本中比例的改变, 其 PCR产物中 2个品种的带纹清晰度也逐渐加强或减弱。
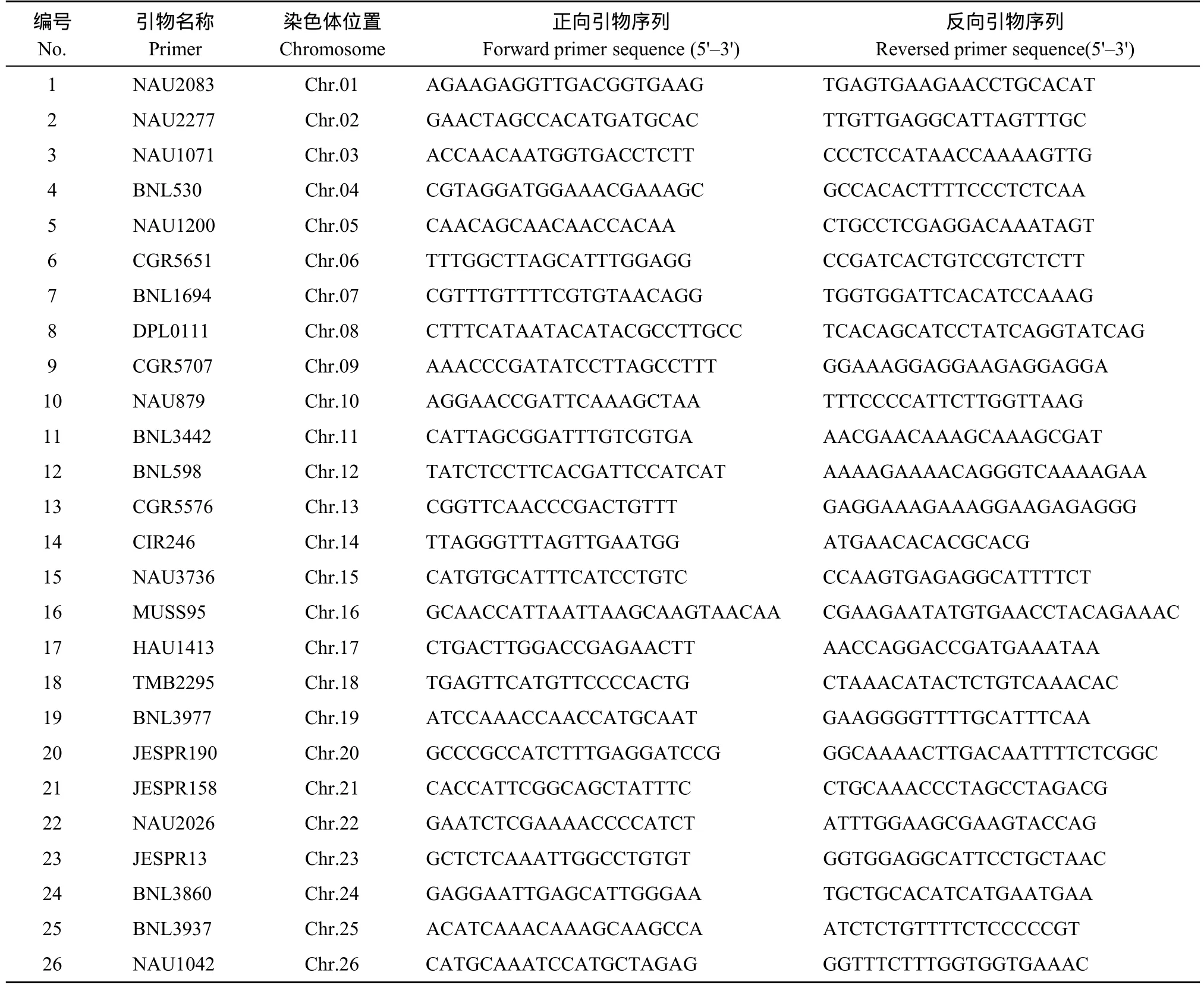
表1 用于棉花品种鉴定的26对SSR核心引物Table 1 Twenty-six pairs of SSR core primers for cotton varieties identification

图1 A和B不同比例DNA混合样本标记扩增结果Fig. 1 SSR bands of mixed DNA samples from Xinluzao 26 and Xinluzhong 37
检测到供试品种和杂株的多态性位点时, 混合样本中的杂株达到20%, 杂株带型清晰可见。据此认为5个单株DNA合并为1个混合样本最为合理。只要该混合样本中有1个杂株, 此位点的带型将表现为测试品种与杂株的杂合带型, 进一步检测5个单株, 便能找出与其余4株带型不同的单株。
2.2.2 真实性鉴定的结果判定 选取10个棉花常规品种将其编号(表2), 随机选取15株源棉6号品种, 以5个单株DNA均匀混合为1组, 制成3个样本(A1、A2、A3)作为标准样品。将供试样品也按照上述方法制成3个样本(X1、X2、X3), 利用26对核心标记进行扩增分析, 通过对比供试样品与标准样品整体图谱的差异位点, 判断待检样品的真实性。2.2.3 同一样品 3组混样间差异位点分析 通过对比同一样品3组混合样本电泳图谱发现(图2), 源棉6号和中棉所43的3组混合样本在26个标记中谱带均一致; 其余8个品种3组混合样本之间存在4~13个差异位点。对于相同位点谱带不一致的3组混合样本, 进一步分析构成该混样的15个单株图谱(图3), 确定非本品材料。
2.2.4 供试样品与标准样品间差异位点分析 10个供试样品中, 仅 A1~A3样品与标准样品在26个位点上扩增图谱完全一致, 判定为相同品种; 其余样品与标准样品间存在8~18个差异位点(图4), 判定为不同品种。事实上A1~A3样品即为源棉6号品种的3个分样。
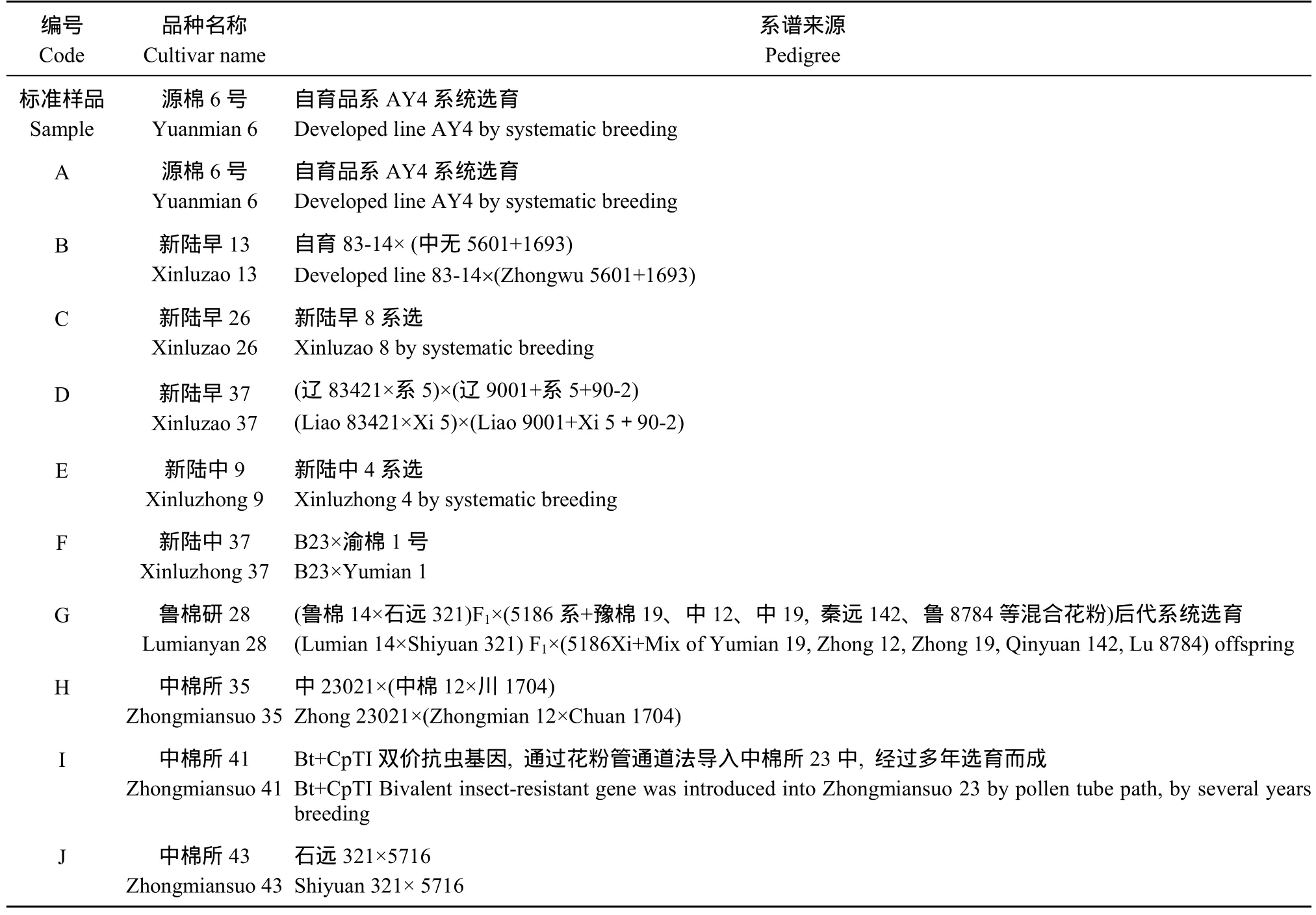
表2 用于真实性鉴定的10个常规棉花品种Table 2 List of 10 inbred cotton varieties for authenticity identification
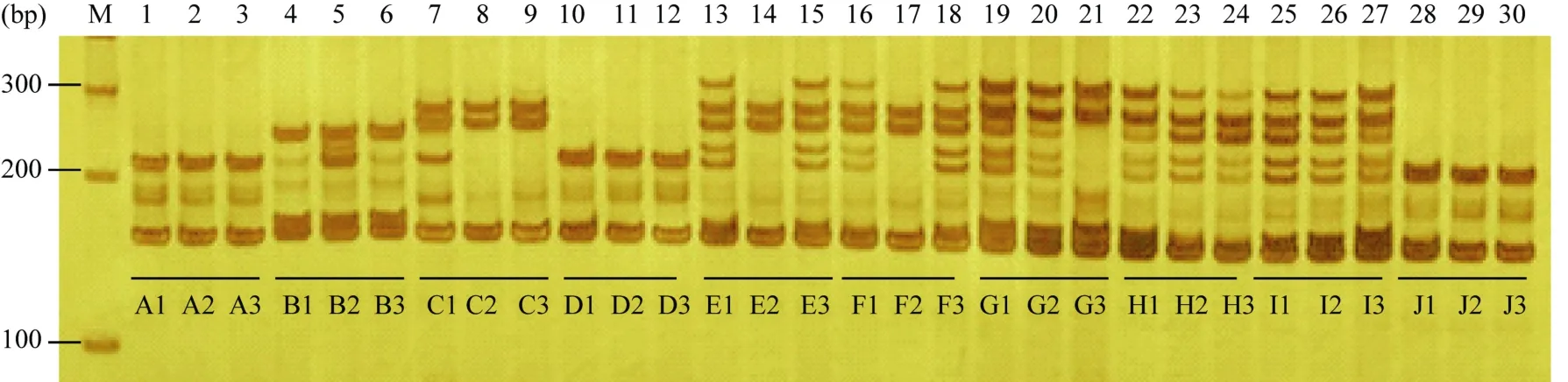
图2 引物NAU2083在不同品种3组混合样本中的扩增结果Fig. 2 Amplified bands of three mixed samples by the different varieties with primer NAU2083

图3 引物NAU2083在15个单株(新陆早13和新陆中37)的扩增结果Fig. 3 Amplified result of 15 single plants (Xinluzao 13 and Xinluzhong 37) with primer NAU2083
利用该方法不仅实现了供试样品与标准样品的鉴定,而且10个供试样品也能够相互区分, 统计结果如表3。26对核心引物成功鉴定出了 10份棉花材料的真实性, 说明所选核心引物具有鉴别能力和区分能力。
2.3 棉花品种纯度检测
2.3.1 SSR分子检测 分别从26对核心引物中筛选5对特征引物作为纯度检测标记(表4), 采用单位点平均法统计4份常规棉品种100个单株的纯度检测结果(图5)。带型统计结果表明, 同一品种不同引物的一致性带型存在较大的差异, 中棉所49在5对引物中的一致性变化范围在94%~98%之间, 平均95.3%, 经统计, 源棉1号品种的纯度为90.5%,源棉2号品种的纯度为94.7%, 源棉6号品种的纯度为98%。
2.3.2 SSR分子检测与田间种植鉴定分析 为了进一步验证分子检测结果的可靠性, 根据中棉所 49、源棉 1号、源棉2号、源棉6号品种区域试验和审定所描述的田间表型性状, 在盛铃期对其进行调查(表5)。
结果显示两种方法鉴定结果一致, 其纯度由高到低均为源棉6号>中棉所49>源棉2号>源棉1号, 但对同一品种的纯度, 田间种植鉴定结果均高于分子标记检测结果(表6)。
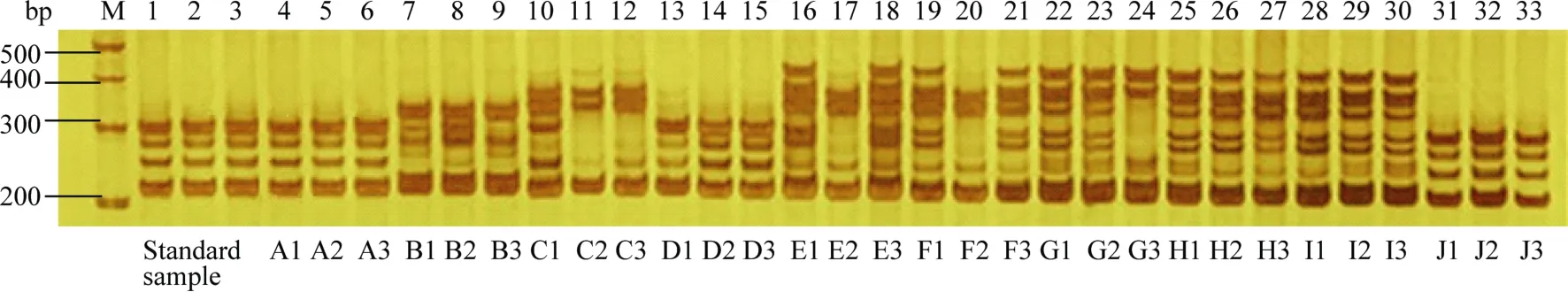
图4 引物CGR5707在标准样品与10个供试样品的扩增结果Fig. 4 Amplified result of standard sample and 10 detection varieties with primer CGR5707 M: marker; A~J: 10个供试品种。M: marker; A–J: 10 tested varieties.
3 讨论
棉花品种真实性和纯度鉴定结果是棉花质量监控和品种权保护的依据。利用 SSR标记进行品种真实性鉴定和纯度检测在大多作物中已有报道[16-18], 在棉花品种鉴定研究中也取得了一定进展。随着分子标记技术不断简化,完成1个品种鉴定的试验仅需1 d左右, 与形态标记相比,具有准确、快速、经济的优势。

表3 10份供试样品真实性鉴定结果统计表Table 3 Authenticity identification result of ten varieties

表4 常规棉品种纯度检测引物信息表Table 4 Primer information of purity test in inbred cotton varieties
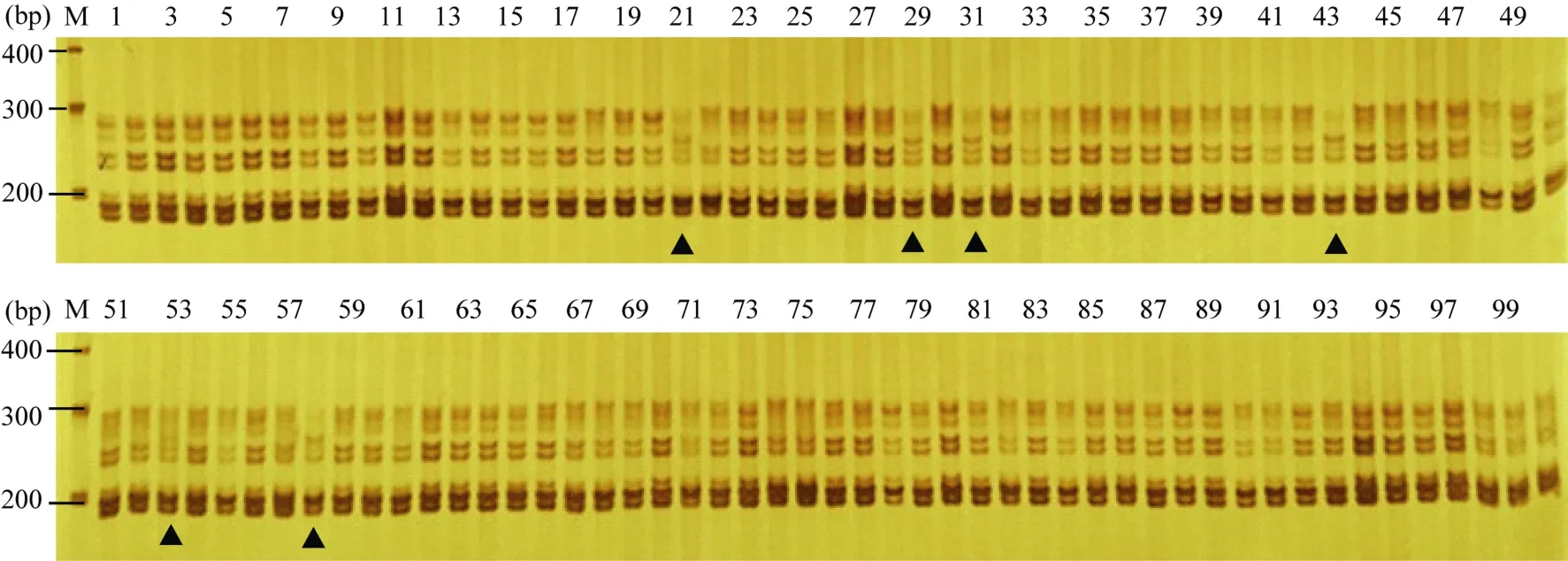
图5 引物BNL3860在100个单株(中棉所49)的纯度扩增结果Fig. 5 Amplified result of 100 plants of Zhongmiansuo 49 with primer NAU2083
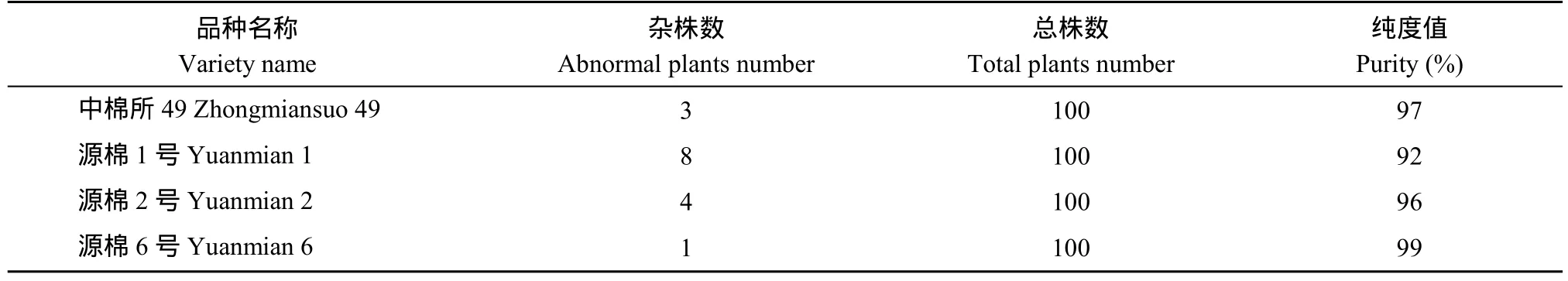
表5 4个棉花品种纯度的田间形态鉴定结果Table 5 Purity of four cotton varieties identified by morphological method
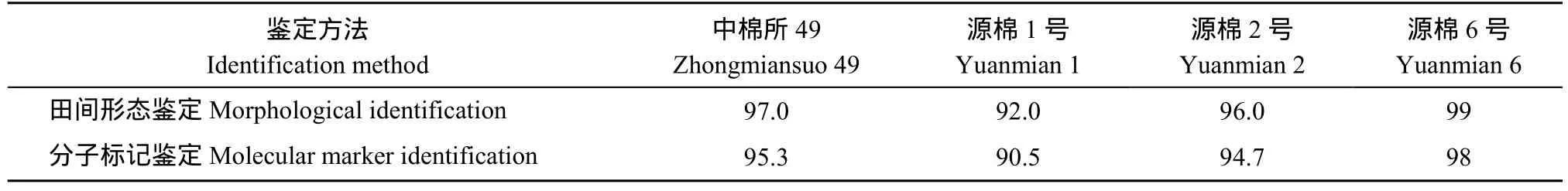
表6 分子标记鉴定法与田间形态鉴定纯度结果比较Table 6 Comparison of purity by molecular marker identification and morphological identification (%)
利用SSR标记进行品种鉴定, 引物的筛选是关键。刘国栋等[8]认为选择标记时, 应尽量覆盖到棉花的26条染色体。本研究以具有典型代表性的材料, 从分布于棉花全基因组的586对SSR标记中筛选出26对具有稳定多态性的引物, 作为SSR分子鉴定的核心标记, 26对核心标记均匀分布于棉花26条染色体上。每条染色体上选择一对引物, 能最大限度地减少位点间的连锁, 以保证真实性和纯度鉴定时结果的可靠性。
真实性鉴定涉及不同样品之间的关系, 检测结果用不同、近似、相同表示。结果判读时, 设定不同棉花品种界定以2个差异标记为限: 当两个品种混样图谱之间2个以上差异标记时, 可判读为不同品种; 当两品种混样图谱之间有小于等于2个差异标记时, 可判读为近似品种或相同品种。26个核心标记不仅实现了不同供试样品与标准对照的鉴定, 且不同样品间也能相互区分。这与王俊芳[18]在棉花上的研究结果一致。棉花是常异花授粉作物, 天然异交率达5%~20%[19], 种群内遗传多样性丰富, 刘文献等[20]认为最佳取样量应包含品种95%以上的遗传变异类型。研究发现, 当取样量为3个单株时, 所包含的遗传变异占比为82.4%~92.3%, 随着取样量的增加, 所包含的遗传变异占比也随之增加。当取样量在12个及12个以上单株时, 品种包含的遗传变异占比均超过 95%, 且随着取样量的增加占比变化幅度不显著[11]。本文选定的15个单株取样量,既能较好地满足群体遗传信息的要求, 又能合理控制工作量。混合样品法能够提高鉴定效率, 本试验先对5个单株叶片的DNA等量混合进行SSR鉴定, 对于同一位点上谱带不一致的组, 再对构成各组混样的单株进行检测。这种先采用混合取样鉴定, 再对表现杂合组个体鉴定的方法, 使工作量减少了 4/5, 远比对单株进行检测节省时间和成本。
品种纯度的鉴定则以本品种的株数占供检样品总株数的百分率表示, 匡猛等[21]认为用 SSR标记鉴定棉花品种纯度时, 不同的统计方法与标记类型获得的分子标记检测结果差异较大; 朱美霞等[5]认为对于纯度较高的品种只需要2~4对引物即可获得满意的检测结果; 但对于纯度较低的棉花品种, 则至少需要5对引物, 甚至10对引物才可以获得较为精确的检测结果。本研究利用5个核心标记及单位点平均法统计样品纯度。SSR标记检测结果均低于田间检测结果, 且SSR标记检测纯度较低的品种, 田间检测纯度也相对较低, 反过来也是如此, 两者呈正相关性,表明 SSR标记检测结果在一定程度上可以反应形态学检测的品种纯度高低。
[1] Ashok B D, Mamta P R, Manoj R B, Kshanada J M. Identification and genetic purity testing of cotton F1Hybrid using molecular markers. Indian J Biotechnol, 2011, 10: 301–306
[2] 刘峰, 冯雪梅, 钟文, 刘玉栋, 阴祖军, 韩秀兰, 徐子初, 沈法富. 适合棉花品种鉴定的 SSR核心引物的筛选. 分子植物育种, 2009, 7: 1160–1168 Liu F, Feng X M, Zhong W, Liu Y D, Yin Z J, Han X L, Xu Z C, Shen F F. Screening of SSR core primer pairs for identificating cotton cultivar. Mol Plant Breed, 2009, 7: 1160–1168 (in Chinese with English abstract)
[3] 周大云, 杨伟华, 魏守军, 王延琴, 匡猛, 马磊, 方丹, 侯爱玲.棉种纯度和真实性3种鉴定方法简介. 中国棉花, 2015, 42(8): 5–7 Zhou D Y, Yang W H, Wei S J, Wang Y Q, Kuang M, Ma L, Fang D, Hou A L. A brief introduction of 3 methods for identification of purity and authenticity of cotton seed. China Cotton, 2015, 42(8): 5–7 (in Chinese)
[4] 武耀廷, 张天真, 郭旺珍, 殷剑美. 陆地棉品种SSR标记的多态性及用于杂交种纯度检测的研究. 棉花学报, 2001, 13: 131–133 Wu Y T, Zhang T Z, Guo W Z, Yin J M. Detecting polymorphism among upland cotton (Gossypium hirsutum L.) cultivars and their roles in seed purity of hybrids with SSR markers. Cotton Sci, 2001, 13: 131–133 (in Chinese with English abstract)
[5] 朱美霞, 李英芝, 王建书, 侯英梅, 孟艳玲. 利用 SSR方法鉴定棉花品种纯度. 安徽农业科学, 2005, 33: 2010–2016 Zhu M X, Li Y Z, Wang J S, Hou Y M, Meng Y L. Purity identification of cotton varieties with SSR technique. J Anhui Agric Sci, 2005, 33: 2010–2016 (in Chinese with English abstract)
[6] 殷剑美, 陈旭升, 狄佳春, 许乃银, 肖松华, 刘剑光, 吴巧娟.杂交棉苏杂118的SSR指纹图谱构建. 江苏农业科学, 2007, (4): 29–31 Yin J M, Chen X S, Di J C, Xu N Y, Xiao S H, Liu J G, Wu Q J. Establishment of finger printing of SSR mark for Suza 118 hybrid. Jiangsu Agric Sci, 2007, (4): 29–31 (in Chinese)
[7] Yu J Z, Fang D D, Kohel R J, Ulloa M, Hinze L L, Percy R G, Zhang J F, Chee P, Scheffler B E, Jones D C. Development of a core set of SSR markers for the characterization of Gossypium germplasm. Euphytica, 2012, 187: 203–213
[8] 刘国栋, 王芙蓉, 宫永超, 马和欢, 张军. 棉花品种遗传纯度的SSR分子标记鉴定技术研究. 棉花学报, 2013, 25: 382–387 Liu G D, Wang F R, Gong Y C, Ma H H, Zhang J. A new method for identification of the genetic purity of cotton varieties by SSR markers. Cotton Sci, 2013, 25: 382–387 (in Chinese with English abstract)
[9] 白静. 杂交棉品种SSR核心引物的筛选与真实性和纯度鉴定.华中农业大学硕士学位论, 湖北武汉, 2011 Bai J. Screening of SSR Core Primer and the Identification of Genuineness and Purity on Hybrid Cotton. MS Thesis of Huazhong Agricultural University, Wuhan, China, 2011 (in Chinese with English abstract)
[10] Porebski S, Bailey L G, Baum B R. Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components. Plant Mol Biol Rep, 1997, 15: 8–15
[11] 张小娟, 陆徐忠, 何团结, 路曦结, 郑曙峰, 倪金龙, 张冰清,杨剑波. 利用 SSR分子标记进行棉花品种鉴定的研究. 棉花学报, 2014, 26: 483–491 Zhang X J, Lu X Z, He T J, Lu X J, Zheng S F, Ni J L, Zhang B Q, Yang J B. Identification of cotton varieties using SSR molecular markers. Cotton Sci, 2014, 26: 483–491 (in Chinese with English abstract)
[12] 聂新辉, 尤春源, 李晓方, 秦江鸿, 黄聪, 郭欢乐, 王夏青, 赵文霞, 林忠旭. 新陆早棉花品种DNA指纹图谱的构建及遗传多样性分析. 作物学报, 2014, 40: 2104–2117 Nie X H, You C Y, Li X F, Qin J H, Huang C, Guo H L, Wang X Q, Zhao W X, Lin Z X. Construction of DNA fingerprinting and analysis of genetic diversity for Xinluzao cotton varieties. Acta Agron Sin, 2014, 40: 2104–2117
[13] 艾先涛, 梁亚军, 沙红, 王俊铎, 郑巨云, 吐尔逊江, 多力坤,李雪源, 华金平. 新疆自育陆地棉品种SSR 遗传多样性分析.作物学报, 2014, 40: 369–379 Ai X T, Liang Y J, Sha H, Wang J D, Zheng J Y, Tu-Er-Xun-Jiang, Duo L K, Li X Y, Hua J P. Genetic diversity analysis on local upland cotton cultivars in Xinjiang based on SSR markers. Acta Agron Sin, 2014, 40: 369–379 (in Chinese with English abstract)
[14] 张军, 武耀廷, 郭旺珍, 张天真. 棉花微卫星标记的 PAGE/银染的快速检测. 棉花学报, 2000, 12: 267–269 Zhang J, Wu Y T, Guo W Z, Zhang T Z. Fast screening of microsatellite markers in cotton with PAGE/ silver staining. Cotton Sci, 2000, 12: 267–269 (in Chinese with English abstract)
[15] 李莉, 杨剑波, 汪秀峰, 向太和, 吴家道. 利用 RAPD和微卫星标记对协优杂交稻及其亲本进行区别与鉴定. 中国水稻科学, 2000, 14: 203–207 Li L, Yang J B, Wang X F, Xiang T H, Wu J D. Identification of Xieyou combinations of hybrid rice and their three parents by using RAPD and microsatellite markers. Chin J Rice Sci, 2000, 14: 203–207 (in Chinese with English abstract)
[16] Yao Q L, Yang K C, Pan G T. Genetic diversity of maize (Zea mays L.) landraces from Southwest China based on SSR data. J Genet Genom, 2007, 34: 851–860
[17] 王立新, 李云伏, 常利芳, 黄岚, 李宏博, 葛玲玲, 刘丽华, 姚骥, 赵昌平. 建立小麦品种DNA指纹的方法研究. 作物学报, 2007, 33: 1738–1740 Wang L X, Li Y F, Chang L F, Huang L, Li H B, Ge L L, Liu L H, Yao J, Zhao C P. Method of ID constitution for wheat cultivars. Acta Agron Sin, 2007, 33: 1738–1740 (in Chinese with English abstract)
[18] 王俊芳. 基于 SSR标记的棉种真实性和品种纯度鉴定技术研究. 中国农业科学院硕士学位论文, 北京, 2009 Wang J F. SSR Markers-Based Cotton Purity and Authenticity Identification. MS Thesis of Chinese Academy of Agricultural Sciences, Beijing, China, 2009 (in Chinese with English abstract)
[19] 计怀春, 孙君灵, 周中立, 潘兆娥, 贾银华, 何守朴, 庞保印,王立如, 杜雄明. 陆地棉繁殖群体大小对遗传完整性的影响.棉花学报, 2014, 26: 145–152 Ji H C, Sun J L, Zhou Z L, Pan Z E, Jia Y H, He S P, Pang B Y, Wang L R, Du X M. Effects of population size on seed increase for genetic integrity of cotton. Cotton Sci, 2014, 26: 145–152 (in Chinese with English abstract)
[20] 刘文献, 李立会, 刘伟华, 张正茂, 吴振海, 王成社. 华山新麦草居群取样策略的 SSR分析. 麦类作物学报, 2006, 26: 16–20 Liu W X, Li L H, Liu W H, Zhang Z M, Wu Z H, Wang C S. SSR analysis on the sampling strategy of psathyrostachys Huashanic keng population. J Triticeae Crops, 2006, 26: 16–20 (in Chinese with English abstract)
[21] 匡猛, 杨伟华, 张玉翠, 许红霞, 王延琴, 周大云, 冯新爱, 苏畅, 周红. 棉花杂交种纯度的 SSR标记检测及其与田间表型鉴定的相关性. 作物学报, 2011, 37: 2295–2305 Kuang M, Yang W H, Zhang Y C, Xu H X, Wang Y Q, Zhou D Y, Feng X A, Su C, Zhou H. Cotton hybrid purity tested by SSR markers and its correlation with phenotype identification in field. Acat Agron Sin, 2011, 37: 2295–2305 (in Chinese with English abstract)
Rapid Identification System of Purity and Authenticity in Cotton Varieties by SSR Markers
WANG Xin-Yi1, AI Xian-Tao2, WANG Jun-Duo2, LIANG Ya-Jun2, GONG Zhao-Long2, ZHENG Ju-Yun2, GUO Jiang-Ping2, MAMAT Mo-Ming2, and LI Xue-Yuan2,*
1Key Laboratory of Agriculture Biological Technology / College of Agronomy, Xinjiang Agricultural University, Urumqi 830052, China;2Economic Crop Research Institute, Xinjiang Academy of Agricultural Sciences, Urumqi 830091, China
SSR molecular markers were used to analyze the authenticity and purity of cotton varieties, providing a molecular basis for the identification of cotton varieties. Typical cotton varieties were used as materials, and 26 pairs of primers well-distributed on the cotton genome were ascertained as the core primers in SSR molecular identification by preliminary and multiple screening. A total of 138 alleles from 120 varieties were screened by using 26 pairs of core primers, 129 of which were polymorphic loci, with a polymorphism rate of 93.48%. Ten inbred cotton varieties were used with 26 pairs of SSR core primers to identify the variety purity. The DNA fingerprint of one variety (Yuanmian 6) shared high uniformity with that of the standard cultivar, and DNA fingerprints of other nine varieties had 8–18 loci different from those of standard cultivar. The results from SSR molecular marker matched with those from field experiments. Five specific primers were selected for testing authenticity of each cultivar from 26 core primers. The variety with highest purity was Yuanmian 6, with the purity of 98.0% and that with lowest purity was Yuanmian 1, with the purity of 90.5%. It suggests that identifying authenticity and purity of cotton varieties is feasible by SSR molecular markers.
Cotton; Authenticity identification; Purity testing; SSR marker
(
): 2016-12-20; Accepted(接受日期): 2017-05-10; Published online(网络出版日期): 2017-05-19.
10.3724/SP.J.1006.2017.01565
本研究由国家自然科学基金项目(31360351)资助。
The study was supported by the National Natural Science Foundation of China (31360351).
*通讯作者(Corresponding author): 李雪源, E-mail: xjmh2338@163.com
联系方式: E-mail: 15999173011@163.com, Tel: 15999173011
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20170519.1200.008.html

