两种邻苯二甲酸酯类污染物对斑马鱼胚胎发育的影响
穆希岩,李成龙,黄 瑛,沈公铭,李绪兴,雷云雷,黄 岚,逄 森,李应仁,李学锋,王成菊*(.中国水产科学研究院资源与环境研究中心,北京 004;.中国农业大学理学院,北京 0093)
两种邻苯二甲酸酯类污染物对斑马鱼胚胎发育的影响
穆希岩1*,李成龙2,黄 瑛1,沈公铭1,李绪兴1,雷云雷1,黄 岚2,逄 森2,李应仁1,李学锋2,王成菊2*(1.中国水产科学研究院资源与环境研究中心,北京 100141;2.中国农业大学理学院,北京 100193)
研究了邻苯二甲酸二辛酯(DEHP)和邻苯二甲酸二丁酯(DBP)对斑马鱼胚胎发育形态学指标的影响,并利用酶联免疫法检测了DEHP和DBP暴露后两种与胚胎发育相关的蛋白(Nkx2.5和LOX)及甲状腺素(T3、T4)水平的变化.结果发现试验浓度下(10~500 µg/L)的DEHP和 DBP可诱导斑马鱼胚胎出现一系列发育异常,包括自主运动异常、心率下降、脊柱弯曲及心包水肿等,同时伴随心脏发育蛋白 Nkx2.5含量显著下降.ELISA检测结果表明,500µg/L的DEHP和DBP暴露后,斑马鱼胚胎T3、T4含量显著上升.上述结果表明DEHP和DBP对鱼类早期生命阶段同样具备内分泌干扰作用.另外,本研究中DEHP和DBP对斑马鱼胚胎的最低可观察效应浓度(LOEC)为10µg/L,已经接近它们在一些环境水域的检出浓度,因此其对水环境中处于早期生命阶段的生物的潜在危害急需重视.
邻苯二甲酸二辛酯;邻苯二甲酸二丁酯;斑马鱼胚胎;发育毒性;激素含量
增塑剂(又称塑化剂)是一种能够增加材料可塑性、柔韧性和膨胀性的添加剂,在塑料生产中的使用十分频繁.邻苯二甲酸酯(Phthalate Esters,PAEs)是目前应用最为普遍的增塑剂,广泛用于食品包装、儿童玩具、建筑材料、医疗用品和化妆品等领域[1].邻苯二甲酸酯与塑料分子之间由氢键或范德华力连接,彼此保留各自相对独立的化学性质,因此随着时间的推移,PAEs很容易从塑料中扩散到外环境[2],从而污染水和空气等.目前邻苯二甲酸酯类污染物已经引起国际环保部门的普遍重视,美国环保局(EPA) 将邻苯二甲酸二辛酯(DEHP)、邻苯二甲酸二甲酯(DMP)等六种邻苯二甲酸酯类化合物列入了重点控制的环境污染物名单中[3].中国将DMP、DEHP和邻苯二甲酸二丁酯(DBP)列为优先控制的环境污染物[4].《地表水环境质量标准》也已经将DBP和DEHP 作为检测项目[5].
随着我国对邻苯二甲酸酯环境监测工作的重视,国内不断有环境地表水中PAEs的检出情况被报道.如重庆主城长江和嘉陵江中丰水期时 DEHP和 DBP的检出浓度分别达到 5.2和 4.6μg/L[6].而在松花江、长江武汉段、黄河中下游等重要水域中均检测出较高浓度的邻苯二甲酸酯类污染物(表1),其中DEHP和DBP在一些渔业水域的检出浓度已经超过《地表水环境质量标准》中的限量(DEHP: 8μg/L; DBP: 3μg/L)[5].因此,环境水体中的PAEs可能对所在水域中的水生生物产生影响,开展邻苯二甲酸酯类污染物对水生生物生态毒理学研究十分必要.
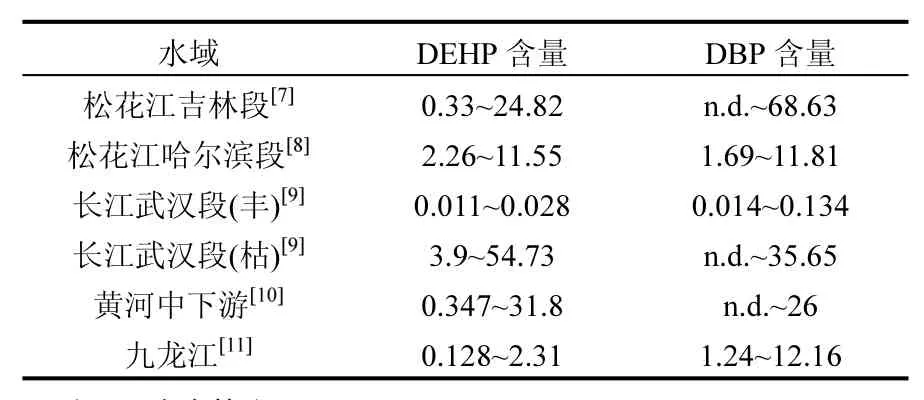
表1 邻苯二甲酸二辛酯和邻苯二甲酸二丁酯在我国重要环境水域中的含量(µg/L)Table 1 Detected concentrations of DEHP and DBP in Chinese important environmental water areas (µg/L)
大量的离体试验和哺乳动物活体试验已经证实邻苯二甲酸酯类污染物属于环境激素,具有较强的内分泌干扰作用.因此在邻苯二甲酸酯类污染物的水生生物毒理学研究中,其对激素水平和生殖系统影响的研究一直占据着重要地位. Wang等[12]的研究表明,成年稀有鮈鲫在 DEHP暴露21d后,雌鱼血液中雌二醇含量显著下降;而雄性血液中雌二醇含量显著上升.Golshan等[13]发现1μg/L的DEHP长期暴露后,雄性金鱼的精子质量和精子活性均显著下降,同时伴随雄鱼体内睾丸酮含量下降和类固醇合成基因StAR表达量下调.除对水生生物成年个体的内分泌干扰作用外,近些年邻苯二甲酸酯类污染物对水生生物早期生命阶段的影响也逐渐受到关注.Jia等[14]的研究发现DEHP可干扰斑马鱼胚胎甲状腺,包括影响仔鱼体内甲状腺素含量及甲状腺相关基因表达水平.Wood等[15]检测了 DEHP对黑头呆鱼的 DNA甲基化作用,研究发现环境浓度下的DEHP暴露14d后,黑头呆鱼仔鱼体内DNA甲基转移酶基因表达量未见明显异常,也未发现DNA甲基化.
斑马鱼胚胎具备量大易得、体外发育、透明、发育周期短等特点,可以全程、完整观察和研究其内部所有器官和结构的变化,目前被广泛用于污染物的毒性评价研究中[16].另外胚胎毒性试验还可以避免杀死动物或解剖动物,这符合环境毒理学为保护动物权利而寻求替代的毒性试验材料发展方向[17].本试验通过形态学观察,研究两种邻苯二甲酸酯类污染物DEHP和DBP对斑马鱼胚胎的发育影响,同时利用酶联免疫方法检测DEHP和DBP暴露后,斑马鱼胚胎中两种发育相关蛋白和雌激素及甲状腺素水平的变化情况,进而揭示邻苯二甲酸酯类污染物对水生生物早期生命阶段的影响和危害.
1 材料与方法
1.1 试验鱼与饲养条件
斑马鱼亲鱼,体长 3.50~4.50cm,体重 0.30~0.60g,按照本试验组已报道的方法[18]在实验室条件下长期驯养. 斑马鱼胚胎由试验室亲鱼产卵获得,斑马鱼亲鱼繁殖过程和胚胎收集过程均按照本试验组已发表论文中的方法进行[19].
1.2 药品与试剂
99.5 %邻苯二甲酸二辛酯(CAS: 117-81-7)和 99%邻苯二甲酸二丁酯(CAS: 84-74-2)均购自 Sigma-Aldrich公司.用分析纯丙酮配置邻苯二甲酸酯储存溶液,储存液进一步用重组水稀释至指定浓度作为暴露介质.重组水配置方法参考OECD的推荐方法[20],配好的重组水中含分别含有2mmol/L Ca2+、0.5mmol/L Mg2+、0.75mmol/LNa+和0.074mmol/L K+.
1.3 暴露试验
1.3.1 形态学指标检测暴露试验 参照 OECD试验指导和 Fraysse et al. (2006)的方法进行试验
[20-21],将斑马鱼胚胎暴露在10, 50, 500μg/L浓度的DEHP和DBP溶液中(实验用水均为重组水).设助剂对照(丙酮含量为0.01mL/L)和重组水空白对照.分别把受精卵转移到 24孔板中,每板使用20个孔,每孔含有2mL试验药液和1枚受精卵,一张板为一个重复,对照和各暴露组均设置三个重复.保证在胚胎发育囊胚期阶段(产卵受精后 2h)开始前完成暴露.把孔板盖好放在人工气候箱中培养,27~28℃,光照:黑暗=14h:10h.按照Nagel提出的致死终点(卵凝结、发育停滞、心跳停止)记录胚胎的死亡情况[22].暴露持续 96h,其间每24h更换3/4药液以保持稳定的测试物浓度和洁净的水质.
1.3.2 蛋白和激素水平检测暴露试验 将斑马鱼胚胎暴露于50和500μg/L浓度的DEHP和DBP溶液中,以1L烧杯为暴露容器,每个烧杯中呈有暴露溶液500mL和胚胎100颗,作为一个重复,每个处理组设3个重复.暴露持续96h,其间每24h更换3/4药液以保持稳定的测试物浓度和洁净的水质.
1.4 胚胎发育形态学指标检测
参考Nagel提出的毒理指标,用倒置显微镜观察其致死效应、亚致死效应和致畸效应.其中亚致死效应的检测包括:(1)每天观察所有胚胎的发育情况,记录发育异常和畸形的个体; (2)24hpf (hours post fertilization,受精后小时数)时,从每个重复随机取 5粒有活性的胚胎,在倒置显微镜下观察斑马鱼胚胎自主运动(明显的全身性扭动)情况,记录 20S内自主运动的次数.(3)分别在48、72hpf时,在倒置显微镜下观察斑马鱼心跳情况,每个重复随机取 5粒活胚胎,记录20S内心跳次数.
1.5 激素含量检测
1.5.1 样品收集与前处理 在 96hpf暴露结束后,用吸管从每个重复中移取40个胚胎到1.5mL EP管(即eppendorf 离心管)中,小心吸出药液后,用蒸馏水轻柔冲洗胚胎3次,然后将蒸馏水吸出,置于冰上放置,待所有样品收集完毕后,统一储存于-20℃冰箱中,等待下一步检测.
1.5.2 ELISA检测 将样品置于冰水混合物中解冻后,向胚胎样品中加入适量生理盐水后匀浆,3000r/min离心10min后,取上清液待测.
赖氨酰氧化酶(LOX)、心脏特异性同源盒转录因子 Nkx2.5、三碘甲状腺原氨酸(T3)和四碘甲状腺原氨酸(T4)的检测均使用商品化试剂盒(北京冬歌生物科技有限公司)进行,操作过程及每种激素浓度的计算方法参照试剂盒说明书完成.
1.6 数据统计与分析
使用SPSS 16.0对试验所得数据进行统计分析.采用One-Way ANOVA法进行单因素方差分析,以 Dunnett post hoc方法完成显著性比较; P<0.05表示差异显著,P<0.01表示差异极显著.
2 结果
2.1 溶剂效应
显著性分析结果表明,溶剂对照组和空白对照组中试验涉及的所有指标的检测结果之间不存在显著差异(数据未给出).在本文中出现的对照组(control)数据均来自于溶剂对照.
2.2 PAEs对斑马鱼胚胎发育形态学指标的影响
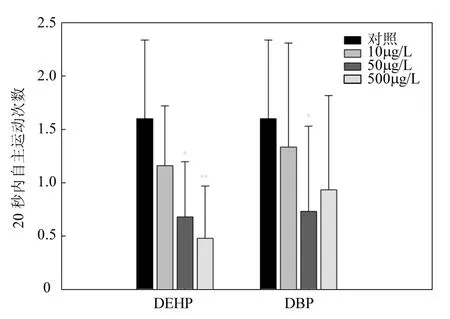
图1 DEHP和DBP对斑马鱼胚胎24hpf自主运动的影响Fig.1 The effect of DEHP and DBP on spontaneous movements of zebrafish embryos
2.2.1 PAEs对斑马鱼胚胎24hpf自主运动的影响 斑马鱼胚胎发育到 24hpf时,会出现有规律的自主运动.DEHP和DBP在试验浓度下均对斑马鱼胚胎的 24hpf自主运动产生了较明显的抑制作用,其中 DEHP的抑制作用更强.由图 1可知,DEHP对斑马鱼胚胎 24hpf自主运动的抑制作用呈现出浓度梯度效应,随暴露浓度升高,抑制作用逐渐加强.DBP仅在50μg/L浓度时,可显著抑制斑马鱼胚胎自主运动.
2.2.2 PAEs对斑马鱼胚胎心率的影响 由图2可知,DEHP和DBP在试验浓度下对斑马鱼胚胎心率有明显的抑制作用,且抑制作用随暴露浓度的升高和暴露时间的延长而增强.在 72hpf时, DEHP-500µg/L和DBP-500µg/L组,胚胎20s心跳次数分别为对照组的75%的79%.
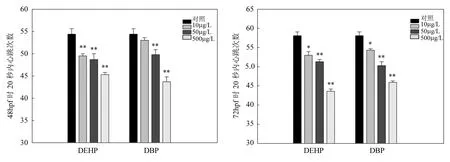
图2 DEHP和DBP对斑马鱼胚胎心率的影响Fig.2 The effect of DEHP and DBP on heart rate of zebrafish embyos


图3 DEHP和DBP的致畸作用Fig.3 The teratogenic effects of DEHP and DBP
2.2.3 PAEs对斑马鱼的致畸作用 DEHP和DBP暴露后,斑马鱼胚胎出现多种畸形症状,主要包括心包水肿(图 3A2)、脊柱弯曲(图 3A4).而对照组胚胎未观测到这些畸形症状.其中,最明显的畸形是脊柱弯曲.在96hpf,当DEHP和DBP的暴露浓度达到 50μg/L时可引起斑马鱼胚胎出现脊柱弯曲,畸形率分别为为7%和9%.随着暴露浓度的增加,胚胎的畸形率进一步升高,500μg/L的DEHP和 DBP引起的脊柱弯曲率分别为 13% (P<0.01)和18%(P<0.01)(图3B1).心包水肿的出现率相对较低,500μg/L的DEHP和DBP诱导的心包水肿率分别为7%和13%(P<0.01)(图3B2).
2.3 PAEs对斑马鱼胚胎发育相关蛋白含量的影响
由图4A可知,DEHP和DBP均能明显抑制斑马鱼胚胎Nkx2.5蛋白含量,DEHP-500 μg/L和DBP-500μg/L暴露组中的Nkx2.5含量分别为对照组的73%和61%.
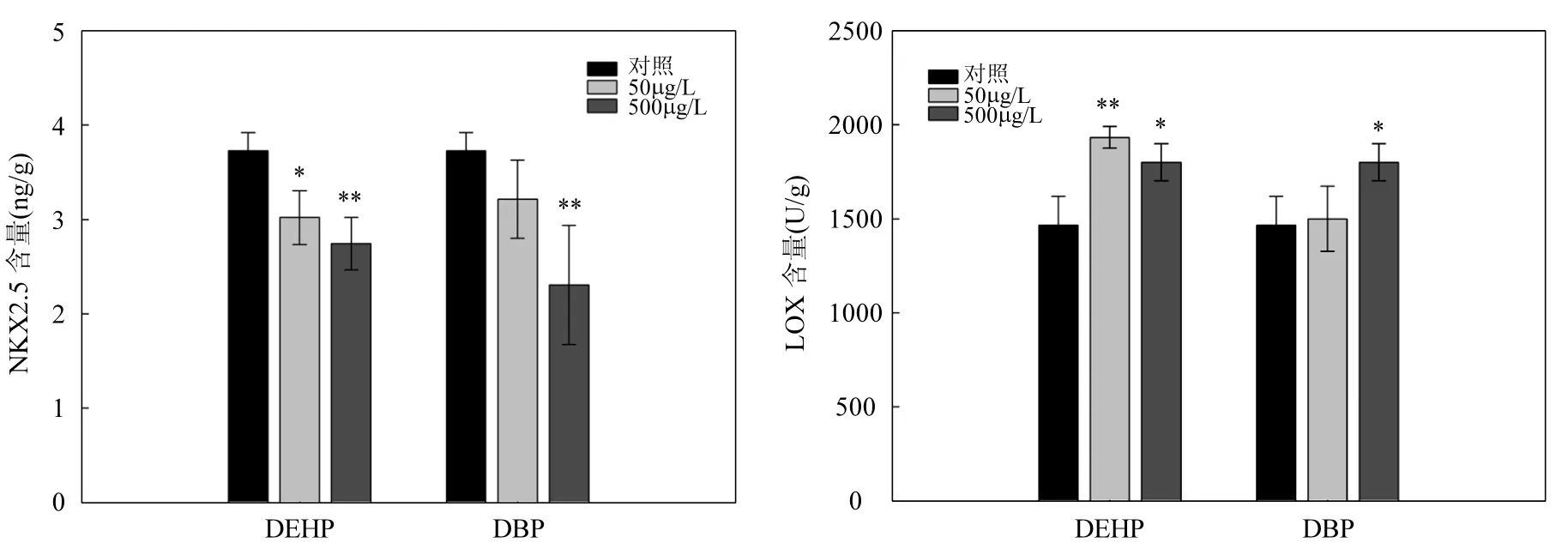
图4 DEHP和DBP暴露后,斑马鱼胚胎中Nkx2.5(A)和LOX(B)蛋白含量Fig.4 The protein level of Nkx2.5 and LOX in zebrafish embryos after DEHP and DBP exposure
DEHP和DBP均能促进斑马鱼胚胎中LOX含量(图4B).50和500μg/L的DEHP暴露后,斑马鱼胚胎中 LOX含量分别为对照组的 1.3倍 (P<0.01)和1.2倍(P<0.05).500μg/L的DBP可显著诱导LOX水平,蛋白含量约为对照组的1.2倍(P<0.05),而50μg/L的DBP对斑马鱼胚胎LOX含量无明显影响.
2.4 PAEs对斑马鱼胚胎甲状腺素含量的影响
由图5可知, T3含量在DEHP和DBP暴露后显著上升,DEHP-500μg/L组和 DBP-500μg/L组中T3含量分别为对照组的 1.4倍(P<0.01)和1.6倍(P<0.01).T4含量在暴露后变化趋势与 T3的趋势接近,500μg/L的 DEHP和 DBP暴露后,斑马鱼胚胎 T4含量明显升高,分别为对照组含量的1.6倍(P<0.01)和1.5倍(P<0.01).

图5 DEHP和DBP暴露后,斑马鱼胚胎中甲状腺素含量Fig.5 The level of T3and T4in zebrafish embryos after DEHP and DBP exposure
3 讨论
由于邻苯二甲酸酯类污染物在水环境中分布广泛,其对水生生物早期发育的影响时有报道.Shen等(2011)[23]研究发现,DBP及其主要代谢产物邻苯二甲酸单丁酯(MBP)可显著影响非洲爪蟾(Xenopus laevis)的生长发育,包括体长生长抑制和眼间距离变短等,LOEC值为 15mg/L. Gardner等(2016)[24]比较了三种邻苯二甲酸酯类污染物(DBP,DEP和DnPP)对非洲爪蟾胚胎的致死能力和致畸能力,发现三种污染物中,DBP毒性最强,致死和致畸的 LOEC分别为 14.7和8.3mg/L,DEP毒性最弱,致死和致畸的LOEC分别为50.3和41.7mg/L.而根据本研究结果, DBP对斑马鱼胚胎的致畸 LOEC仅为 500μg/L,说明斑马鱼对 DBP的敏感性远高于非洲爪蟾.Wood等[25]检测了 DEHP对黑头呆鱼(Pimephales promelas)的发育影响,其研究结果表明 0.1~100μg/L的DEHP暴露14d,对黑头呆鱼的发育无明显影响.而在本研究中,10μg/L的DEHP即可显著抑制斑马鱼胚胎的心率,50μg/L的DEHP还能干扰胚胎的 24hpf自主运动.而本研究的暴露时间比Wood等[26]的周期更短,由此推断斑马鱼对DEHP的敏感性可能高于黑头呆鱼.Chikae等的研究发现,0.01~10μg/L的 DEHP暴露后,青鳉鱼(Oryzias latipes)胚胎的死亡率显著升高,且体长生长较对照组明显被抑制.古皮鱼(Poecilia reticulata)长期(91d)暴露于 1μg/L 和 10μg/L DEHP后,出现了多种发育异常,包括体长生长抑制和体重抑制等,其中10μg/L DEHP还能显著引起古皮鱼死亡[27].上述研究中DEHP对鱼类发育影响的 LOEC值低于本研究结果(10μg/L),一方面可能由于暴露周期较长;另一方面可能因为青鳉鱼和古皮鱼的敏感性比斑马鱼更高.
近年来,多个研究对DEHP和DBP对水生生物的毒性进行了比较.Zhao等[28]的研究发现DBP对鲤鱼(Cyprinus carpio)的毒性比DEHP更强,它们对鲤鱼的 96h-LC50值分别为 16.30and 37.95mg/L.相反,Huang等[29]以大型溞(Daphnia magna)为模型开展的急性毒性试验发现 DEHP的毒性高于DBP,它们对大型溞的24h-EC50值分别为 2.1和 8.0mg/L.在本研究中,相同浓度暴露后,DBP引起斑马鱼胚胎的畸形率高于DEHP,说明DBP对斑马鱼胚胎的致畸能力强于DEHP;而胚胎发育指标结果表明 DEHP对斑马鱼心率和24hpf自主运动的影响比DBP更强,因此根据本研究结果难以判断DEHP和DBP对斑马鱼胚胎的毒性顺序.
脊柱弯曲是DEHP和DBP暴露后斑马鱼胚胎出现的最明显的畸形效应,多种污染物已经被证实能够引起水生生物出现脊柱弯曲的症状.造成脊柱弯曲的可能原因之一是赖胺酰氧化酶(LOX)的活性被抑制,Zhou等[30]和 van Boxtel等[31]先后证明了杀螟丹和二硫代胺类农药引起水生生物脊柱畸形的机制在于对赖胺酰氧化酶的抑制作用.而在本研究中,DEHP和DBP对赖胺酰氧化酶蛋白含量表现为促进作用(图3),由此推断邻苯二甲酸酯类污染物引起斑马鱼胚胎出现脊柱弯曲的原理可能与上述两类农药不同.
心包水肿是斑马鱼胚胎发育阶段最典型的畸形症状之一.多种污染物都被证明能够诱导斑马鱼胚胎出现此类畸形,但不同类别的化合物引起心包水肿的机制存在差异.已有研究证明视黄酸缺乏是引起斑马鱼胚胎出现心包水肿的原因之一[32],Mu等[33]的研究发现苯醚甲环唑处理后的斑马鱼胚胎出现明显心包水肿,同时伴随视黄酸代谢基因 CYP26A1表达显著上调,由此作者推断苯醚甲环唑引起的斑马鱼心包水肿可能与CYP26A1上调引起的视黄酸缺乏有关[33].而本课题组之前的研究发现0.60mg/L的嘧菌酯可显著诱导斑马鱼胚胎出现心包水肿,结合嘧菌酯的杀菌机理(阻碍线粒体呼吸电子传递进而抑制ATP合成),推断其引起的心脏功能异常是由于嘧菌酯抑制线粒体呼吸,进而引起能量供应不足导致的[34].而在本研究中,DBP和DEHP在达到一定浓度时均可引起斑马鱼胚胎出现心包水肿.为研究DEHP和DBP导致胚胎出现心包水肿的机制,进一步检测了两种邻苯二甲酸酯类污染物暴露后,与胚胎心脏发育相关的蛋白Nkx2.5的表达变化情况.Nkx2.5是调节胚胎心脏发育的重要蛋白,参与了心脏的形成及心肌生长等过程.已有研究证实Nkx2.5的突变可导致心脏传导异常,室间隔缺损(VSD)和心房间隔缺损(ASD)等先天性心脏疾病[35].Jamali等通过P19细胞体外试验发现,在抑制Nkx2.5活性后,P19细胞的心肌生长同时被阻遏,由此证明Nkx2.5的活性在心肌发育过程中是必不可少的[36].本研究中,斑马鱼胚胎Nkx2.5蛋白含量在DEHP和DBP暴露后,较对照组明显下降,尤其是 DBP-500 μg/L组中的Nkx2.5含量仅为对照组的 61%.由此推断,DBP和 DEHP引起的心率异常和心包水肿,可能与Nkx2.5含量的下降有关.Zhang等(2012)的研究发现低浓度的芘可引起斑马鱼胚胎心脏出现一系列异常,包括心率异常、心包水肿和心脏循环缺陷等,同时伴随Nkx2.5蛋白的编码基因表达显著下调,这一结果与本研究的结果相符[37].
内分泌干扰效应一直是邻苯二甲酸酯类污染物生态毒理学研究的重点内容,近十年来,大量研究关注于 PAEs对鱼类激素水平的影响.Wang等检测了环境相关浓度下的DEHP长期暴露对成年稀有鮈鲫的内分泌干扰作用,发现39.4μg/L及更高浓度的DEHP暴露后,雄鱼血液中 17β-雌二醇含量显著上升,同时雌鱼血液中 17β-雌二醇明显下调12.除性腺外,甲状腺是邻苯二甲酸酯类污染物在生物体内的另一重要靶标.Ye等[38]的研究表明,DEHP可抑制大鼠血液中的 T3、T4和促甲状腺激素释放激素含量.Dong等[39]同样发现DEHP暴露可以抑制大鼠血液中甲状腺素含量,并能干扰多个调节甲状腺素的基因表达.Park等(2017)[40]通过对6000名韩国成人的调查,发现成人血液中的T3和T4含量与其尿液中的邻苯二甲酸酯类代谢产物呈负相关性.上述结果均表明,邻苯二甲酸酯类污染物对哺乳动物血液中的甲状腺素具有抑制作用.而根据本研究的结果,500 μg/L 的DEHP和DBP能够显著促进斑马鱼胚胎中的T3和T4含量,这一结果与哺乳动物研究结果趋势相反.Jia等[14]的研究发现400μg/L的DEHP暴露168小时后,斑马鱼仔鱼中T3和T4含量均显著上升,而低浓度(40~200μg/L)的DEHP对胚胎中的T3和 T4含量无显著影响,上述结果与本研究的结果呈现出良好的一致性.综合上述研究结果可知,邻苯二甲酸酯类污染物对不同类生物的甲状腺素含量的影响可能存在差异.
近年来,关于DEHP代谢物的内分泌干扰效应也开始受到关注.Zhai等[41]的研究发现DEHP的代谢产物邻苯二甲酸单乙基己基酯(MEHP)能够显著影响斑马鱼仔鱼中的T3、T4含量,LOEC值为200μg/L,在该浓度下的MEHP暴露后,斑马鱼仔鱼中T3含量显著上升,而T4含量则显著下降.而根据本研究和Jia等的研究,DEHP影响斑马鱼胚胎甲状腺素含量的LOEC值分别为500μg/L和 400μg/L.以上结果表明,MEHP对鱼类甲状腺的干扰能力可能比DEHP更强.相反,叶婷等比较DEHP和MEHP对海洋青鳉的内分泌干扰作用后,发现0.1和0.5mg/L的DEHP长期暴露可通过激活肝性激素受体调控肝雌激素响应基因(VTG和Chg)和过氧化物增殖激活受体(PPARα和PPARγ)的表达而对海洋青鳉产生内分泌干扰效应,并且显示出性别特异性,而MEHP对海洋青鳉的内分泌干扰效应弱于 DEHP[42].综合上述结果说明,以不同指标评价邻苯二甲酸酯类污染物的内分泌干扰能力,可能得到不同的结论.
除发育毒性和内分泌干扰作用外,邻苯二甲酸酯类污染物还可导致鱼类出现氧化应激作用和免疫反应.Huang等的研究发现,0.1和 1mg/L的 DEHP暴露后,海洋青鳉(Oryzias melastigma)肝脏中免疫基因IL-1β和CCL20表达量显著上调,而 CAT和 GPx基因表达水平未见明显变化[43].Xu等[44]发现 2μmol/L(约为 0.28mg/L)的DBP可导致斑马鱼胚胎出现明显的免疫反应,包括巨噬细胞减少和免疫相关基因表达异常.为比较邻苯二甲酸酯类污染物引起的三种毒性效应的敏感性,将以斑马鱼胚胎为模式生物的研究结果进行对比(表 2),根据已报道的 LOEC数据,在DEHP和DBP暴露后,胚胎发育指标比内分泌干扰效应和免疫反应指标更加敏感.
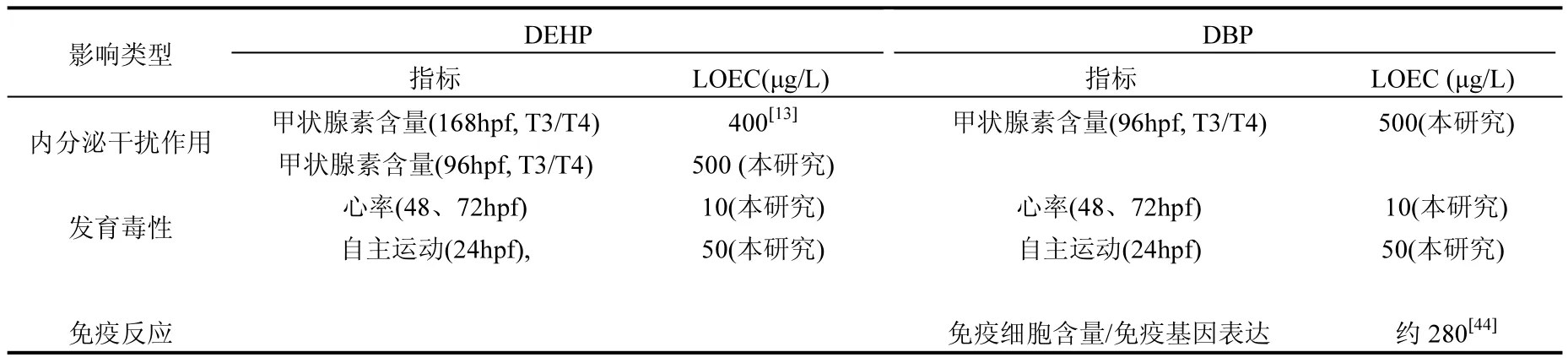
表2 DEHP和DBP暴露后斑马鱼胚胎中三类毒性指标敏感性比较Table 2 Comparison of sensitivity of three categories of indicators towards DEHP and DBP exposure
4 结论
4.1 试验浓度下(10~500μg/L)DEHP和DBP能诱导斑马鱼胚胎出现心率下降、自主运动异常、脊柱弯曲和心包水肿等一系列发育影响,并能显著抑制心脏发育相关蛋白Nkx2.5的含量.
4.2 500μg/L的DEHP和DBP暴露后,斑马鱼胚胎中三碘甲状腺原氨酸和四碘甲状腺原氨酸含量显著上升.表明DEHP和DBP对斑马鱼胚胎同样具备内分泌干扰作用.
4.3 10μg/L的DEHP和DBP即可对斑马鱼胚胎的发育造成影响,这一浓度低于两种污染物在一些水域的检出浓度,因此DEHP和DBP对环境中水生生物的危害急需重视.
[1]Boas M, Frederiksen H, Feldt-Rasmussen U, et al. Childhood exposure to phthalates: associations with thyroid function, insulin-like growth factor I, and growth [J]. Environ. Health. Perspect. 2010,118(10):1458-1464.
[2]Zota A R, Calafat A M, Woodruff T J. Temporal trends in phthalate exposures: findings from the National Health and Nutrition Examination Survey, 2001~2010 [J]. Environ. Health. Perspect., 2014,122(3):235-41.
[3]李 彬,吴 山,梁金明,等.中山市农业区域土壤-农产品中邻苯二甲酸酯(PAEs)污染特征 [J]. 环境科学, 2015,36(6):2283-2291.
[4]杨 彦,于云江,李定龙.太湖流域(苏南地区)农业活动区人群PAEs健康风险评估 [J]. 中国环境科学, 2013,33(6):1097-1105.
[5]国家环境保护总局,国家质量监督检验检疫总局.地表水环境质量标准(GB3838-2002) [S]. 2002,中国环境科学出版社出版,北京.
[6]杜 娴.重庆主城两江水体与沉积物中邻苯二甲酸酯和多环芳烃污染水平及特征 [D]. 重庆:重庆大学, 2012.
[7]魏 薇,谢 莹,王建刚,等.邻苯二甲酸酯在松花江吉林段水体中的分布规律 [J]. 中国环境监测, 2011,27(5):60-64.
[8]宋郭静.松花江水体部苯二甲分布特征及研究 [D]. 长春:东北师范大学, 2014.
[9]王 凡,沙玉娟,夏星辉,等.长江武汉段水体邻苯二甲酸酯分布特征研究 [J]. 环境科学, 2008,29(5):1163-1169.
[10]沙玉娟,夏星辉,肖翔群.黄河中下游水体中邻苯二甲酸酯的分布特征 [J]. 中国环境科学, 2006,26(1):120-124.
[11]陆 洋,袁东星,邓永智.九龙江水水源及其出厂水邻苯二甲酸酯污染调查 [J]. 环境与健康杂志, 2007,2(6):438-440.
[12]Wang X, Yang Y, Zhang L, et al. Endocrine disruption by di-(2-ethylhexyl)-phthalate in Chinese rare minnow (Gobiocypris rarus) [J]. Environ Toxicol Chem., 2013,32(8):1846-1854.
[13]Golshan M, Hatef A, Socha M, et al. Di-(2-ethylhexyl)-phthalate disrupts pituitary and testicular hormonal functions to reduce sperm quality in mature goldfish [J]. Aquat. Toxicol,. 2015,163: 16-26.
[14]Jia P, Ma Y, Lu C, et al. The Effects of Disturbance on Hypothalamus-Pituitary-Thyroid (HPT) Axis in Zebrafish Larvae after Exposure to DEHP [J]. PLoS One, 2016,11(5): e0155762.
[15]Wood R K, Crowley E, Martyniuk C J. Developmental profiles and expression of the DNA methyltransferase genes in the fathead minnow (Pimephales promelas) following exposure to di-2-ethylhexyl phthalate [J]. Fish Physiol. Biochem., 2016,42:7-18.
[16]Yang L, Ho N Y, Alshut R, et al. Zebrafish embryos as models for embryotoxic and teratological effects of chemicals [J]. Reprod. Toxicol., 2009,28:245-253.
[17]Embry M R, Belanger S E, Braunbeck T A, et al. The fish embryo toxicity test as an animal alternative method in hazard and risk assessment and scientific research [J]. Aquat. Toxicol., 97:79-87.
[18]穆希岩,黄 瑛,沈公铭,等.苯醚甲环唑对斑马鱼抗氧化酶的影响 [J]. 中国环境科学, 2016,36(4):1242-1249.
[19]Mu X, Pang S, Sun X, et al. Evaluation of acute and developmental effects of difenoconazole via multiple stage zebrafish assays [J]. Environ. Pollut., 2013,175:147-157.
[20]OECD. OECD Guidelines for the Testing of Chemicals [S]. In: Section 2: Effects onBiotic Systems Test No. 236: Fish Embryo Acute Toxicity (FET) Test. Organization for Economic Cooperation and Development, Paris, France.
[21]Fraysse B, Mons R, Garric J. Development of a zebrafish 4-day embryolarval bioassay to assess toxicity of chemicals [J]. Ecotoxicol. Environ. Saf., 2006,63:253-267.
[22]Nagel, R. DarT: the embryo test with the zebrafish Danio rerio e a general model in ecotoxicology and toxicology [J]. ALTEX, 2002,19:38-48.
[23]Shen O, Wu W, Du G, et al. Thyroid Disruption by Di-n-Butyl Phthalate (DBP) and Mono-n-Butyl Phthalate (MBP) in Xenopus laevis [J]. PLoS ONE, 2011,6(4):e19159.
[24]Gardner S T, Wood A T, Lester R, et al. Assessing differences in toxicity and teratogenicity of three phthalates, Diethyl phthalate, Di-npropyl phthalate, and Di-n-butyl phthalate, using Xenopus laevis embryos [J]. J. Toxicol. Environ. Health. Part A, 2016, 79(2):71-82.
[25]Wood R K, Crowley E, Martyniuk C J. Developmental profiles and expression of the DNA methyltransferase genes in the fathead minnow (Pimephales promelas) following exposure to di-2-ethylhexyl phthalate [J]. Fish Physiol. Biochem., 2016,42:7-18.
[26]Chikae M, Hatano Y, Ikeda R, et al. Effects of bis (2-ethylhexyl) phthalate and benzo[a]pyrene on the embryos of Japanese medaka (Oryzias latipes) [J]. Environ. Toxicol. Pharmacol., 2004,16:141-145.
[27]Zanotelli V R, Neuhauss S C, Ehrengruber M U. Longterm exposure to bis (2-ethylhexyl) phthalate (DEHP) inhibits growth of guppy fish (Poecilia reticulata) [J]. J Appl. Toxicol., 2010,30: 29-33.
[28]Zhao X, Gao Y, Qi M. Toxicity of phthalate esters exposure to carp (Cyprinus carpio) and antioxidant response by biomarker [J]. Ecotoxicology, 2014,23:626-632.
[29]Huang B, Li D, Yang Y. Joint Toxicity of Two Phthalates with Waterborne Copper to Daphnia magna and Photobacterium phosphoreum [J]. Bull. Environ. Contam. Toxicol., 2016,97:380-386.
[30]Zhou S, Dong Q, Li S, et al. Developmental toxicity of cartap on zebrafish embryos [J]. Aquat Toxicol, 2009,95:339-346.
[31]van Boxtel A L, Kamstra J H, Fluitsma D M, et al. Dithiocarbamates are teratogenic to developing zebrafish through inhibition of lysyl oxidase activity [J]. Toxicol. Appl. Pharmacol., 2010,244:156-161.
[32]侯 佳.视黄酸缺乏对斑马鱼心脏发育影响的机制研究 [D].上海:复旦大学, 2008.
[33]Mu X, Chai T, Wang K, et al. The developmental effect of difenoconazole on zebrafish embryos: A mechanism research [J]. Environ. Pollut. 2016,212:18-26.
[34]穆希岩,黄 瑛,罗建波,等.通过多阶段暴露试验评价嘧菌酯对斑马鱼的急性毒性与发育毒性 [J]. 环境科学学报, 2017,37(3): 1122-1132.
[35]Olson E N. Gene regulatory networks in the evolution and development of the heart [J]. Science, 2006,313:1922-1927.
[36]Jamali M, Rogerson P, Wilton S, et al. 2001. Nkx2—5Activity IsEssential for Cardiomyogenesis [J]. J. Biol. Chem. 2001,276(45): 42252-42258.
[37]Zhang Y, Wang C, Huang L, et al. Low-level pyrene exposure causes cardiac toxicity in zebrafish (Danio rerio) embryos [J]. Aquat. Toxicol. 2012,114-115:119-124.
[38]Ye H, Ha M, Yang M, et al. Di2-ethylhexyl phthalate disrupts thyroid hormone homeostasis through activating the Ras/Akt/ TRHr pathway and inducing hepatic enzymes [J]. Sci. Rep. 2017, 7:40153.
[39]Dong X, Dong J, Zhao Y, et al. Effects of Long-Term In Vivo Exposure to Di-2-Ethylhexylphthalate on Thyroid Hormones and the TSH/TSHR Signaling Pathways in Wistar Rats [J]. Int. J. Environ. Res. Public Health, 2017,14:44.
[40]Park C, Choi W, Hwang M, et al. Associations between urinary phthalate metabolites and bisphenol A levels, and serum thyroid hormones among the Korean adult population - Korean National Environmental Health Survey (KoNEHS) 2012~2014 [J]. Sci Total Environ. 2017,S0048-9697(17):30154-7.
[41]Zhai W, Huang Z, Chen L, et al. Thyroid Endocrine Disruption in Zebrafish Larvae after Exposure to Mono-(2-Ethylhexyl) Phthalate (MEHP) [J]. PLoS ONE, 2014,9(3):e92465.
[42]叶 婷,康 美,黄乾生,等.邻苯二甲酸二(2-乙基己)酯(DEHP)和邻苯二甲酸单乙基己基酯(MEHP)长期暴露对海洋青鳉(Oryzias melastigma)内分泌干扰效应的评价 [J]. 生态毒理学报, 2014,9(2):253-260.
[43]Huang Q, Chen Y, Chi Y, et al. Immunotoxic effects of perfluorooctane sulfonate and di (2-ethylhexyl) phthalate on the marine fish Oryzias melastigma [J]. Fish Shellfish Immunol., 2015,44:302-306.
[44]Xu H, Dong X, Zhang Z, et al. Assessment of immunotoxicity of dibutyl phthalate using live zebrafish embryos [J]. Fish Shellfish Immunol. 2015,45:286-292.
Effects of two phthalate esters on zebrafish embryos.
MU Xi-yan1*, LI Cheng-long2, HUANG Ying1, SHEN Gong-ming1, LI Xu-xing1, LEI Yun-lei1, HUANG Lan2, PANG Sen2, LI Ying-ren1, LI Xue-feng2, WANG Cheng-ju2*(1.Fishery Resource and Environment Research Center, Chinese Academy of Fishery Sciences, Beijing 100141, China;2.College of Sciences, China Agricultural University, Beijing 100193). China Environmental Science, 2017,37(9):3566~3575
The effects of di (2-ethylhexyl) phthalate (DEHP) and dibutyl phthalate (DBP) on morphological indicators during zebrafish embryonic development were investigated in this study. In addition, the protein level of Nkx2.5 and LOX (two proteins that are associated with embryonic development) as well as the thyroid hormone level (triiodothyronine (T3) and tetraiodothyronine (T4)) were detected after DEHP and DBP exposure. The results indicated that the exposure of tested concentrations (10~500µg/L) of DEHP and DBP could induce a suite of abnormities on zebrafish embryos, including abnormal spontaneous movement, heart rate decrease, pericardial edema and spinal curvature, which occurred along with the decrease of Nkx2.5level. ELISA assay results showed that the level of T3 and T4 significantly increased after exposure of 500 µg/L DEHP and DBP, which indicated that PAEs have endocrine disrupting effects on fish during early life stage. Furthermore, the LOEC of DEHP and DBP towards zebrafish embryos was 10µg/L, which was close to their detected concentrations in environmental water areas. Thus their potential risk on environmental aquatic organisms during early life stages should be concerned.
DEHP;DBP;zebrafish embryo;developmental toxicity;hormone level
X171.5
A
1000-6923(2017)09-3566-10
2017-02-10
中央级公益性科研院所基本科研业务费专项(2016C008);中央级公益性科研院所基本科研业务费专项(2017HY-ZD0201)
* 责任作者, 博士, muxiyan@cafs.ac.cn;wangchengju@cau.edu.cn
穆希岩(1987-),男,博士,北京人,中国水产科学研究院资源与环境研究中心助理研究员.主要研究方向为渔业污染物的生态毒理学研究.发表论文20余篇.

