一株产电菌Klebsiella oxytoca d7的分离及产电机理
刘 玥,袁林江(西安建筑科技大学,陕西省环境工程重点实验室,教育部西北水资源和环境生态重点实验室 陕西 西安 710055)
一株产电菌Klebsiella oxytoca d7的分离及产电机理
刘 玥,袁林江*(西安建筑科技大学,陕西省环境工程重点实验室,教育部西北水资源和环境生态重点实验室 陕西 西安 710055)
采用厌氧双层平板法从运行稳定的双室型微生物燃料电池(Microbial fuel cell,MFC)阳极生物膜上分离纯化出一株优势产电纯菌Klebsiella oxytoca,并对其产电机理进行了研究.通过对该纯菌的循环伏安扫描分析,表明该菌具有较强的电化学活性,并且在胞外存在电子受体时就会进行胞外产电呼吸.对该菌培养物进行三维荧光扫描和比较,发现该菌主要是利用腐殖质作为胞外电子传递的介体来完成产电呼吸.铁还原性测试的结果表明过量的3价铁没有给菌株带来额外的增长,该菌对3价铁的还原量有限.研究认为,胞外呼吸不是Klebsiella oxytoca在无氧条件下的主要呼吸方式,而是当有外在电子受体存在时细菌进行胞内呼吸的一种辅助方式,即使环境中存在充分的胞外电子受体,也不会带来Klebsiella oxytoca生长量的显著增加,该菌无法从胞外还原中获得足够的生长需要的能量,仍然主要是通过胞内呼吸获得细胞生长所需的能量,有机物氧化所产生的电子只有少部分用于胞外电子受体的还原.
MFC;生物产电;克雷伯氏菌;循环伏安法;三维荧光分析
微生物燃料电池(MFC),是一种利用微生物作为“催化”者,能将有机物中的化学能转化为电能、可利用生物质来产生可替代能源的装置[1]. Logan[2]认为MFC依赖“Electricigens”(产电微生物)产出电子.微生物是影响MFC性能最重要的因素,直接影响着MFC的内阻、功率密度和库伦效率等.因此,产电微生物直接关系到微生物燃料电池的电能产出[3].
胞外呼吸是近年来发现的新型微生物能量代谢方式[4,6],MFC产电被认为是胞外呼吸电子传递的结果.微生物分解基质中产生的电子通过外电路传递至阴极用以还原电子受体,微生物获得能量来供自身生长繁殖[5].
但目前对产电微生物的产电过程及相关产电机理尚不清楚,缺少指导调控 MFC产电的理论基础.产电微生物为何要进行胞外电子传递?胞外电子传递和胞内电子的产生、传递有什么关联?这些问题尚不完全清楚.
MFC的研究中,纯菌体系更有利于产电机理的揭示,所以近年来优势产电菌的研究备受关注,所分离纯化出来的产电菌的种类也逐渐增多,迄今为止,已报道的产电微生物已达到 30余种,研究较多的是Shewanella sp.[7-8]和Geobacter sp.[9]这两类产电菌,MFC产电性能的优化一直以来都是研究的热点,但对产电微生物产电呼吸代谢的研究尚不充分,已有的研究多针对于所分离出纯菌产电性能的测试[10-11]以及对其胞外电子传递机制的探讨[12-13],而对于产电机理也不完全清楚.产电微生物在不同环境下,电子传递途径有什么变化,微生物为什么会选择胞外产电呼吸等,有待探明.
本研究采用厌氧双层平板法从运行稳定的双室型MFC阳极上的生物膜里分离纯化出了优势产电纯菌,通过三维荧光分析、循环伏安扫描、铁还原性测试等探究了该纯产电菌的产电与呼吸作用途径.
1 材料与方法
1.1 产电微生物的富集与分离
在多年运行稳定的、以1g/L的葡萄糖为电子供体的双室型 MFC装置中,刮取少许阳极生物膜,采用厌氧双层平板法分离反应器中产电菌.在无菌操作台上采用无菌的接种环刮取一定的阳极生物膜接入灭过菌的厌氧 LB培养基中(厌氧培养基在灭菌前曝氮气15min),水浴锅中35℃恒温静置培养24h后,采用双层平板法稀释涂布于厌氧柠檬酸铁培养基中,培养2天后,根据菌落的形态、颜色等差异选取不同的单菌落接种至厌氧柠檬酸铁液体培养基中,如此反复纯化5~7代,得到一个纯培养菌株,命名为d7.
所用的柠檬酸铁培养基配方为:胰蛋白胨(Tryptone)10g/L,酵母提取物(Yeast extract)5g/L,氯化钠(NaCl)10g/L,添加 20mmol/L的柠檬酸铁为电子受体,并用 NaOH调节该培养基的pH=7±0.3,固体培养基则加入 18g/L琼脂粉后制成.
1.2 菌种鉴定
1.2.1 形态观察 将菌株稀释涂布于柠檬酸铁固体培养基(厌氧)中和营养琼脂培养基(好氧)中35℃恒温培养 2d,观察菌落形态,采用草酸铵结晶紫进行简单染色,染色后采用Nikon 90i光学显微镜观察菌体特征.
1.2.2 菌株d7的biolog鉴定 由于菌株d7可在好氧条件下生长,所以采用 biolog GENⅢ(用于好氧菌的鉴定)微平板进行鉴定[14].
1.3 循环伏安分析
1.3.1 菌株d7批式培养循环伏安分析 循环伏安分析中,主要通过观察循环伏安曲线中的氧化-还原峰来判断其电化学活性,氧化-还原峰的峰电流越大,说明其氧化还原能力越强,电化学活性越高[15].
将菌株d7接种至含有灭过菌的厌氧柠檬酸铁液体培养基的三电极体系中进行批式培养,每隔 24h进行一次循环伏安扫描,培养 72h后, 9000r/min离心10min,取上清液再次进行循环伏安扫描.其中以钛丝穿过碳毡(一起培养)为工作电极,铂丝电极为对电极,Ag/AgCl电极为参比电极,在电化学工作站中的扫速为100mV/s,扫描电压范围为-1~1V.
1.3.2 不同条件下菌株d7的循环伏安分析 将菌株d7分别以相同的接种量接种至好氧LB培养基、厌氧LB培养基、好氧柠檬酸铁培养基、厌氧柠檬酸铁培养基中(好氧培养基在灭菌前曝空气15min,厌氧培养基在灭菌前曝氮气15min).控制温度相同,好氧进行35℃恒温摇床150r/min培养,厌氧进行35℃恒温水浴锅培养,均培养36h后(经过 36h,两种条件下的细菌生长都能进入稳定期),分别进行循环伏安扫描,以未接种菌株的培养基为空白对照.
1.4 三维荧光分析
将菌株d7分别在好氧LB培养基、厌氧LB培养基、好氧柠檬酸铁培养基和厌氧柠檬酸铁培养基中培养进入稳定期后,离心取上清液经过0.45μm滤膜过滤后采用F-7000型荧光分光光度计来进行代谢产物的测定,激发波长和发射波长范围分别为 200~450nm、220~500nm,均以 5nm步长递增,激发和发射狭缝宽度均为5nm,扫描速度为 12000nm/min.用超纯水做空白,先减去空白样并采用 Delaunnay三角插值法去除瑞丽散射,绘制处理后的3DEEM等高线图.
1.5 铁还原实验
1.5.1 三价铁的存在对菌株d7生长的影响 将菌株d7以相同的接种量接种至含有不同浓度梯度3价铁离子(采用柠檬酸铁作为外电子受体)的液体培养基中,分别在好氧条件和厌氧条件下进行批式培养,以未接种菌株的不同浓度柠檬酸铁培养基为空白对照,采用UV紫外/可见分光度计测量OD600,绘制其在不同浓度铁离子存在条件下的生长曲线.
1.5.2 菌株d7的铁还原性试验 将菌株d7以相同的接种量接种至含有不同浓度梯度 3价铁离子(采用柠檬酸铁作为外电子受体)的液体培养基中,分别在好氧条件和厌氧条件下培养,培养36h后,9000r/min离心10min,取上清液对其进行铁还原性测试,以未接种菌株的不同浓度柠檬酸铁培养基为空白对照,铁离子的测定采用邻菲罗啉分光光度法[16].所测得的 Fe(Ⅱ)的浓度与培养基中原 Fe(Ⅱ)的浓度之差,除以培养基中总铁浓度的百分比,即得Fe(Ⅲ)还原率.
2 结果与讨论
2.1 菌株d7的分离和鉴定
2.1.1 形态学观察 从长期运行稳定的双室型MFC阳极生物膜上分离得到一株纯培养菌株,命名为d7,如图1.
菌株d7在厌氧柠檬酸铁固体培养基中35℃恒温培养 2d后,菌落形态呈圆形,边缘整齐有光泽,黑褐色,直径 1.5mm左右.在营养琼脂固体培养基中培养 2d后,菌落形态呈圆形,边缘整齐有光泽,乳白色,低凸起状,有粘性,易挑,直径 2.5mm左右.染色后在 1000X显微镜下观察,短杆菌,菌体宽度为0.3~0.5μm左右,菌体长度为0.8~1.0μm左右.
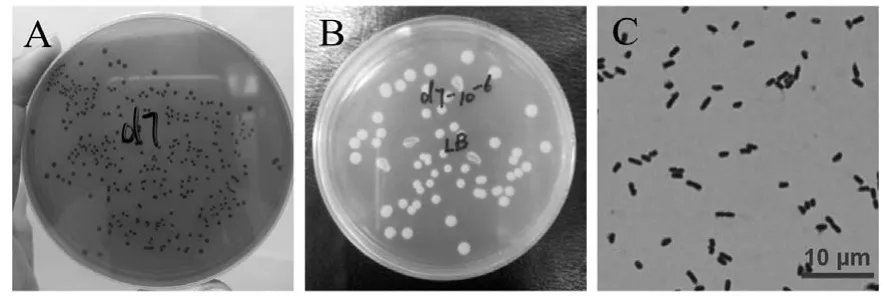
图1 菌株d7在厌氧柠檬酸铁培养基上的菌落形态(A)、菌株d7在好氧营养琼脂培养基上的菌落形态(B)菌株d7在1000X显微镜下图像(C)Fig.1 Colony morphology in the anaerobic ferric citrate medium (A), in the nutrient agar medium (B) and the electron-microscope photo (1000X) (C) of the strain d7
2.1.2 biolog鉴定 采用 biolog专用接种液将菌株d7接种至biolog GENⅢ微平板中,35℃恒温培养24h后,采用biolog自动微生物鉴定系统进行鉴定,结果显示为Klebsiella oxytoca(以下简称d7).
克雷伯氏菌属是多次被报道过的高效产电菌[17-18].Klebsiella oxytoca GEB-1是Kim[19]首次于2006年从活性污泥中分离得到的,属于γ-变形菌纲,不运动,有荚膜,是一种革兰氏阴性、异养兼性厌氧菌,试验中发现这种细菌具有较强的电化学活性.随后,也有研究者分离出克雷伯氏菌属.2008年,Zhang等[20]从土壤沉积物中分离出一株Klebsiella pneumoniae L17,将其接种至MFC中,以 2g/L葡萄糖为电子供体时,最大可产生0.3326V的电压.2013年,Yue等[21]从以污水处理厂的活性污泥接种的MFC中分离出了一株产电微生物Klebsiella oxytoca Z6,并对其产电性能进行测定发现,以柠檬酸钠为底物时,将该菌株接种到单室空气阴极MFC中可产生0.31V的最大输出电压,同时以柠檬酸钠、乳酸钠、葡萄糖、丙三醇、谷氨酸为电子供体测试了其产电性能,产生的最大输出电压分别为0.31V、0.26V、0.213V、0.207V、0.107V.
2.2 菌株d7的循环伏安分析
2.2.1 菌株d7的批式培养循环伏安分析 为了进一步验证其产电效果,将菌株d7接种至灭过菌的含有柠檬酸铁厌氧液体培养集的三电极体系中,每隔24h进行一次循环伏安扫描,培养72h后,再离心取上清液进行循环伏安扫描,结果如图2.

图2 菌株d7的批式培养循环伏安分析Fig.2 Cyclic voltammetry analysis of the strain d7 in the batch culture
由图2可知,随着培养时间的延长,循环伏安曲线的氧化还原峰逐渐升高,电化学活性变得越来越好,离心取上清液后,上清液也出现了较好的氧化还原峰,说明菌株d7可能是利用胞外电子介体来传递电子、完成产电呼吸的.随着培养时间的延长,生物量的增长使胞外电子介体的量逐渐增多,有了一定的积累,所以逐渐表现出越来越好的电化学活性.但是上清液的氧化还原峰的峰电流没有培养 72h时的峰电流高,所以可以认为胞外电子介体传递电子不是d7唯一的胞外电子传递方式[22],有研究者对克雷伯氏菌进行过阳极包裹式MFC(即碳毡阳极经0.22μm微孔滤膜包裹)产电测试[23],结果发现包裹型 MFC虽仍能成功启动,但其启动时间相对延长、输出电压降低,所以克雷伯氏菌也可利用生物膜机制进行胞外电子传递.
2.2.2 菌株 d7在不同环境下培养的循环伏安分析 有研究者[24]认为产电呼吸是产电微生物在厌氧条件下的一种被迫行为,也有研究者使用曝气+停曝这种间歇的方式来优化MFC的产电性能[25],因此,为探究菌株d7的产电呼吸机理,将菌株分别在好氧LB培养基、厌氧LB培养基、好氧柠檬酸铁培养基、厌氧柠檬酸铁培养基中培养 36h后,分别进行循环伏安扫描,结果如图3.
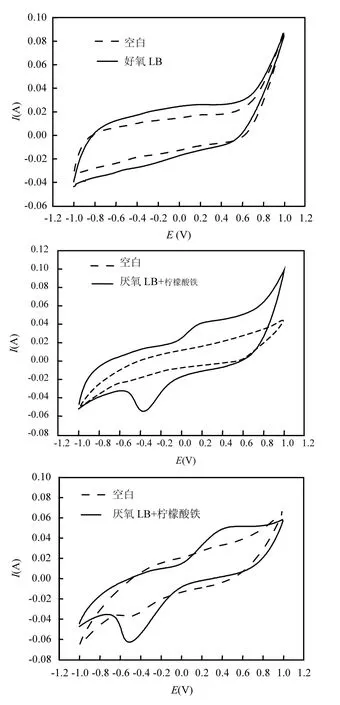
图3 菌株d7在不同条件下的循环伏安分析Fig.3 Cyclic voltammetry analysis of the strain d7 in the different condition
由图3可知,菌株d7在没有3价铁存在时,无论在好氧还是厌氧条件下,都无法进行胞外呼吸,没有胞外电子传递现象.而当有3价铁存在时,无论是好氧还是厌氧,循环伏安分析都表现出明显的氧化还原峰,说明菌株d7会进行一部分的胞外呼吸,产生胞外电子传递.这说明对于 d7而言,胞外呼吸并不是其在没有溶解氧作为内电子受体时的一种被迫行为,而是在进行正常胞内呼吸时所附加的一种呼吸方式.
2.3 菌株d7代谢产物的三维荧光分析
通过比较分析菌株d7在有胞外电子受体和没有胞外电子受体存在时的代谢产物的不同,可以得出菌株d7进行胞外电子传递的电子介体以及其电子传递机制.三维荧光分析的扫描结果如图4.根据扫描结果确定峰值所对应物质,好氧LB培养基培养菌株d7的代谢产物中出现一个荧光峰(Em/Ex=385/340,荧光强度 765.9),厌氧 LB培养基培养菌株d7的代谢产物中出现一个荧光峰(Em/Ex=372/335,荧光强度 858.9),这两种荧光峰主要为微生物代谢物,即溶解性微生物代谢产物对应的荧光峰.好氧柠檬酸铁培养基培养菌株d7的代谢产物中出现两个荧光峰(1、Em/Ex=387/ 342,荧光强度754.3;2、Em/Ex=421/385,荧光强度553.9),厌氧柠檬酸铁培养基培养菌株d7的代谢产物出现两个荧光峰(1、Em/Ex=381/338,荧光强度 864.3;2、Em/Ex=430/383,荧光强度 713.9),其中第一个荧光峰主要为微生物代谢产物,第二个荧光峰是腐殖酸类荧光物质.

图4 菌株d7代谢产物的三维荧光分析Fig.4 Three dimensional fluorescence analysis of the strain d7’s metabolite
由此实验结果可知,当有胞外电子受体存在时,无论在好氧条件下还是厌氧条件下,菌株 d7除了产生正常的微生物代谢产物外,还会有腐殖酸类物质,而这类物质在没有胞外电子受体存在时并没有出现,所以可以得知这类腐殖质就是菌株d7进行胞外呼吸时的胞外电子传递介体.腐殖质是由动植物及微生物残体演化而成的高分子醌类聚合物,广泛存在于土壤、沉积物和水生环境中[26].它既可以作为微生物胞外呼吸的电子受体,也可以充当电子穿梭体促进其他形式的胞外呼吸.
微生物氧化有机物,将产生的电子传递给胞外氧化态的腐殖质,由腐殖质传递电子至铁氧化物,并产生能量供自身生长.腐殖质及其类似物的氧化还原电位在-180mV到+300mV之间,相对于铁氧化物来说,电位差异较大,因而腐殖质可能充当铁氧化物和微生物之间的电子穿梭体.而且,大量的研究已经证实,腐殖质及其类似物确实可以作为电子穿梭体,促进铁氧化物的还原[27].如: Xia等[22]利用三维荧光和紫外-可见波长扫描手段推断klebsiella sp. ME17可能通过醌类物质作为电子传递中间体来传递电子;Yue等[21]的研究中将所分离的克雷伯氏菌接种至 MFC中后,通过添加外源性 AQDS使接种了克雷伯氏菌的MFC产电性能有明显提高.
2.4 菌株d7的铁还原性测试
2.4.1 三价铁的存在对菌株d7生长的影响 为进一步探究3价铁存在时胞外呼吸对菌株d7生长量的影响,将菌株以相同的接种量接种至含有不同浓度梯度3价铁离子的液体培养基中,分别在好氧条件和厌氧条件下进行批式培养,测量OD600绘制其在不同浓度铁离子存在条件下的生长曲线,结果如图5.
由图5可知,在好氧条件下,3价铁对菌株d7生长的影响很小,只在铁离子浓度较低时能使菌株快速进入稳定期,但促进作用也很微弱,当Fe(Ⅲ)的浓度在2mmol/L、5mmol/L、10mmol/L、20mmol/L时,菌株d7的生长曲线基本重合,可见在好氧条件下,菌株虽然可以还原3价铁,但3价铁的存在对于菌株的生长基本没有好处,没有因为过量铁离子的存在使菌株d7通过胞外呼吸而获得更多的生长.
厌氧条件下,随着铁离子的浓度从 0mmol/L升高到20mmol/L,菌株d7进入稳定期的时间越来越短,说明在厌氧条件下,铁离子的存在可以使菌株在厌氧呼吸的同时进行胞外产电呼吸,通过两种呼吸方式共同获得细胞生长所需能量,完成细胞代谢,在这一时期,3价铁作为外电子受体对细胞生长起到促进的作用,但进入稳定期后,菌株的生物量就基本一致,此时的生物量约为好氧条件下的一半,厌氧条件下也没有因为过量铁的存在而给菌株d7带来过量的增长,说明铁呼吸在厌氧条件下也不能作为菌株d7的主要呼吸方式来完成细菌的正常生长代谢.细菌还是主要通过发酵产能.
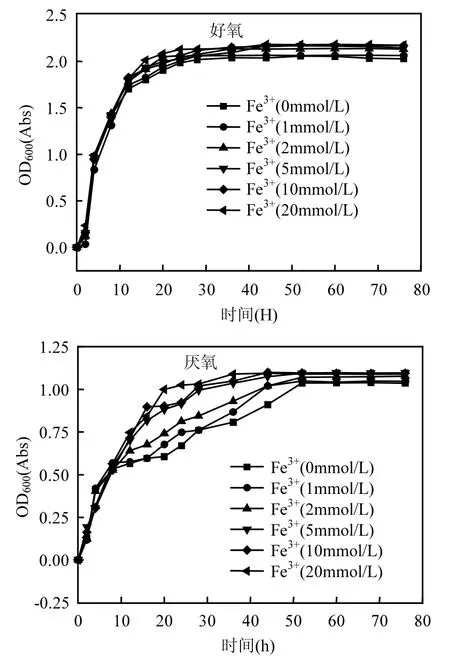
图5 菌株d7在不同铁浓度下培养的生长曲线Fig.5 The growth curve of the strain d7in the different Fe(Ⅲ) concentration
2.4.2 菌株d7的铁还原性试验 为更深入的研究菌株d7对3价铁离子的利用率,对菌株d7进行铁还原性测试.将菌株以相同的接种量接种至含有不同浓度梯度 3价铁离子的液体培养基中,分别在厌氧条件和好氧条件下培养,进入稳定期后测定其 Fe(Ⅱ)的产出量和 Fe(Ⅲ)的还原率,结果如图6.
由图6可知,在好氧条件下,菌株d7产出的Fe(Ⅱ)量很少,而且当培养基中 Fe(Ⅲ)的浓度从0.5mmol/L增加到20mmol/L时,菌株d7所能还原的3价铁都是很少的,还原产生的Fe(Ⅱ)最高只有 0.24mmol/L,产出的 Fe(Ⅱ)的量基本相当,总体而言铁还原率逐渐下降.虽然好氧条件下铁还原率小,但是仍有 Fe(Ⅱ)的产出,说明好氧条件下菌株 d7仍能进行一部分的胞外呼吸,这也解释了菌株 d7在好氧柠檬酸铁培养基中培养36h后进行循环伏安分析时表现出明显氧化还原峰的原因.
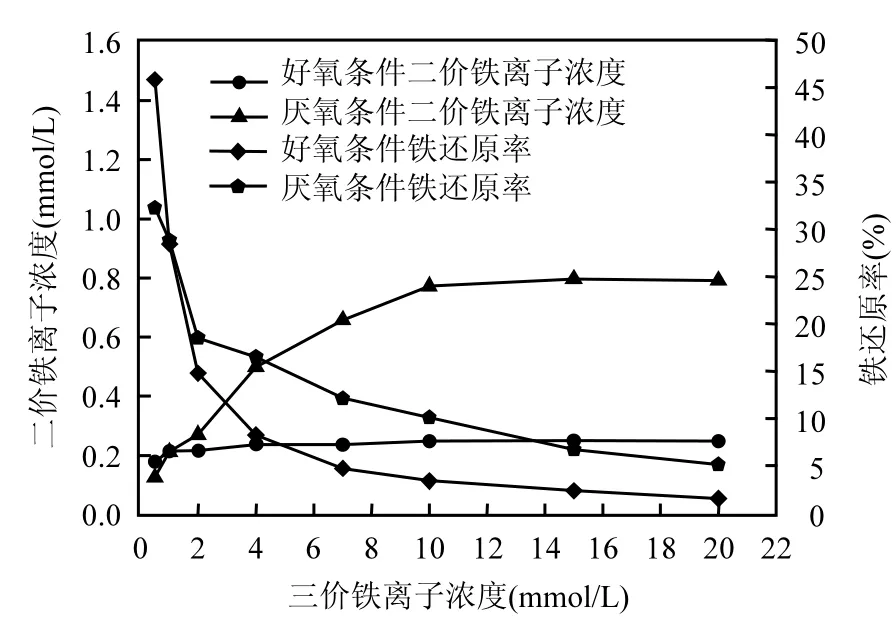
图6 菌株d7的铁还原性测试Fig.6 The ferric reducing ability of the strain d7
厌氧条件下,菌株d7还原的3价铁较好氧条件下多,当培养基中 Fe(Ⅲ)的浓度从 0.5mmol/L增加到10mmol/L时,菌株d7产出的Fe(Ⅱ)逐渐增多,当Fe(Ⅲ)高于10mmol/L时,菌株d7产出的Fe(Ⅱ)也不再增加,保持持平,最多产出0.79mmol/L的Fe(Ⅱ),铁还原率逐渐下降.
根据铁还原性测试的结果结合菌株d7在不同浓度铁离子存在时的生物量的变化可以看出,对于菌株d7而言,胞外产电呼吸并不能作为其主要的呼吸产能方式完成细胞的生长代谢,在厌氧条件下,低浓度的铁离子能促进细胞的生长,但细菌所能还原的铁离子也是很有限的,高浓度的铁没有给菌株 d7带来过量的增长,所以,细菌还是主要通过发酵获得细胞生长所需的能量,其呼吸作用所产生的电子只有少部分用于胞外电子受体的还原.
虽然产电呼吸不是克雷伯氏菌的主要呼吸代谢方式,但克雷伯氏菌可利用的碳源种类丰富,且类似于克雷伯氏菌这种发酵型产电微生物的种类繁多,这类细菌在自然界中分布广泛、数量大,所以其对于产电呼吸机理的研究和 MFC性能的提升都具有重要意义[28].
2.5 对菌株 d7的电子传递和呼吸作用方式的分析
从本研究所得出的数据出发,菌株d7可在不同环境条件下进行不同的电子传递和呼吸作用方式.
像诸多兼性厌氧的klebsiella菌属的细菌一样,d7在有氧培养状态下,如果没有胞外电子受体存在,菌株 d7就主要进行胞内呼吸,是以氧作为最终电子受体的好氧呼吸,产生CO2和H2O.在无氧环境下,进行厌氧发酵,以中间代谢产物的小分子有机物为最终电子受体.

图7 菌株d7的电子传递示意Fig.7 The electron transfer map of the strain d7
当加入Fe(Ⅲ)时,有了胞外电子受体,由代谢产物的三维荧光分析结果显示,此时的代谢产物中多出了腐殖酸类物质,而其它主要的微生物代谢产物与没有加入胞外电子受体时相同;另外加入了过量的 Fe(Ⅲ)并没有给菌株带来过量的增长,菌株d7仍主要以胞内呼吸作为主要的呼吸代谢方式,而此时胞外电子受体的存在会激发菌株产生腐殖质,从而诱导一部分电子通过腐殖质传递至胞外再传递给 Fe3+,使 Fe3+得到电子被还原为Fe2+,完成了胞外产电呼吸.不同条件下的循环伏安分析结果说明,菌株d7的这种胞外呼吸的现象在好氧时和厌氧时均可发生,但是,由菌株的铁还原性测试的结果可知:加入同样的Fe(Ⅲ)后,厌氧时产生的Fe(Ⅱ)均较好氧时多,所以,厌氧条件下菌株进行胞外呼吸的能力较好氧时强.其四种不同条件下的呼吸电子传递示意图如图 7所示.在厌氧且存在 3价铁离子的环境下,如实验中MFC内,菌株d7发酵有机基质时,脱下的少量电子就可能是通过腐殖质传递到电极再到 3价铁,实现了胞外呼吸.在胞内产生了可供细胞生长的能量AT,在MFC中形成了电流.
3 结论
3.1 高效产电菌Klebsiella oxytoca d7主要是通过利用胞外电子介体腐殖质传递电子来完成胞外电子传递的.
3.2 胞外呼吸只能给Klebsiella oxytoca d7产生很少量的能量,再多的胞外电子受体也不能给菌株带来更多的生长量;该产电菌不能从胞外电子受体还原中获得足够的用于生长的能量,氧化分解有机物产生的电子只有少部分被用于胞外电子受体的还原.
3.3 产电菌Klebsiella oxytoca d7进行胞外呼吸产生胞外电子传递是细菌在受到胞外电子受体的诱发而产生的现象,其通过利用胞外电子介体,将分解有机物产生的一小部分电子通过胞外电子介体传递至胞外电子受体,在胞内呼吸的基础上完成产电呼吸.
[1]Chaudhuri S K, Lovley D R. Electricity generation by direct oxidation of glucose in mediatorless microbial fuel cells [J]. Nat Biotechnol, 2003,21:1229-1232.
[2]Logan B E. Exoelectrogenic bacteria that power microbial fuel cells [J]. Nature Reviews Microbiology, 2009,7:375-381.
[3]刘晶晶,孙永明,孔晓英.不同接种条件下微生物燃料电池产电特性分析 [J]. 中国环境科学, 2011,31(10):1651-1656.
[4]Lovley D R. Bug Juice. Harvesting electricity with microorganisms [J]. Nat Rev Microbiol, 2006,4:497-508.
[5]Lovley D R, Nevin K P. Electricity Production with Electricigens [J]. Bioenergy, 2008:295-306.
[6]Jeffrey A, Gralnick, Dianne K.Newman. Extracellular respiration. Molecular Microbiology, 2007,65(1):1-11.
[7]Biffinger J C, Byrd J N, Dudley B L et al. Oxygen exposure promotes fuel diversity for Shewanella oneidensis microbial fuel cells [J]. Biosensors & Bioelectronics, 2008,23(6):820-826.
[8]Newton G J, Mori S, Nakamura R, et al. Analyses of Current-Generating Mechanisms of Shewanella loihica PV-4and Shewanella oneidensis MR-1in Microbial Fuel Cells [J]. Applied & Environmental Microbiology, 2009,75(24):7674-7681.
[9]Commault A S, Lear G, Packer M A, et al. Influence of anode potentials on selection of Geobacter strains in microbial electrolysis cells [J]. Bioresource Technology, 2013,139C(7): 226-234.
[10]Wang Biao, Huang Jiexun, Zhang Xiaobo, et al. Isolation and Characterization of an Electricity-producing Strain Shewanella sp. S2from Marine [J]. Microbiology China, 2010, 37(3):342-348.
[11]李 明,梁 湘,骆健美,等.一株产电菌嗜根考克氏菌(Kocuria rhizophila)的分离及其产电性能优化 [J]. 环境科学学报, 2015, 35(10):3078-3087.
[12]卢 娜,周顺桂,倪晋仁.微生物燃料电池的产电机制 [J]. 化学进展, 2008,20(7/8):1235-1240.
[13]Commault A S, Lear G, Packer M A, et al. Influence of anode potentials on selection of Geobacter strains in microbial electrolysis cells [J]. Bioresource Technology, 2013,139C(7): 226-234.
[14]於建明,刘 靓,蔡文吉.一株苯乙烯高效降解菌的分离鉴定及降解特性研究 [J]. 中国环境科学, 2014,34(6):1564-1571.
[15]Carmona-Martinez A A, Harnisch F, Fitzgerald L A, et al. Cyclic voltammetric analysis of the electron transfer of Shewanella oneidensis MR-1and nanofilament and cytochrome knock-out mutants [J]. Bioelectrochemistry, 2011,81(2):74-80.
[16]Paipa C, Mateo M, Godoy I, et al. Comparative study of alternative methods for the simultaneous determination of Fe+3and Fe+2in leaching solutions and in acid mine drainages [J]. Minerals Engineering, 2005,18(11):1116-1119.
[17]Kim C, Ainala S K, Oh Y K, et al. Metabolic flux change in Klebsiella pneumoniae L17 by anaerobic respiration in microbial fuel cell [J]. Biotechnology and Bioprocess Engineering, 2016, 21(2):250-260.
[18]Deng L F, Li F B, Zhou S G, et al. A study of electron-shuttle mechanism in Klebsiella pneumoniae based-microbial fuel cells [J]. Science Bulletin, 2010,55(1):99-104.
[19]Kim G T, Webster G, Wimpenny J W, et al. Bacterial community structure, compartmentalization and activity in a microbial fuel cell [J]. Journal of Applied Microbiology, 2006,101(3):698-710.
[20]Zhang L X, Zhou S G, Zhuang L, et al. Microbial fuel cell based on Klebsiella pneumoniae biofilm. Electrochemistry Communications, 2008,10(10):1641-1643.
[21]Peng Y, Zhu N, Nie H. Isolation of an electrogen Klebsiella sp. Z6from anodic biofilm and its electricity-generating characteristics [J]. Acta Scientiae Circumstantiae, 2013,33(4): 1035-1042.
[22]Xia X, Cao X X, Liang P. Electricity generation from glucose by a Klebsiella sp. in microbial fuel cells [J]. Applied Microbiology Biotechnology, 2010,87(1):383-390.
[23]Deng L F, Li F B, Zhou S G, et al. A study of electron-shuttle mechanism in Klebsiella pneumoniae based-microbial fuel cells[J]. Chinese Sci Bull, 2009,54(19):2983-2987.
[24]Qiao Y, Li C M, Bao S J, et al. Direct electrochemistry and electrocatalytic mechanism of evolved Eschericha coli cells in microbial fuel cells [J]. Chem Commun, 2008,21(11):1290-1292.
[25]H Zhao, J Zhao. Influence of different operation modes on ammonia nitrogen wastewater treatment of microbial fuel cell [J]. Chemical Industry & Engineering Progress, 2016,35(5):1549-1554.
[26]X M Li, S G Zhou, F B Li, et al. Fe(III) oxide reduction and carbon tetrachloride dechlorination by a newly isolated Klebsiella pneumoniae strain L17 [J]. Journal of Applied Microbiology, 2009,106(1):130-139.
[27]Wu Chun-Yuan, Li Fang-Bai, Zhou S G. Humus respiration and its ecological significance [J]. Acta Ecologica Sinica, 2009, 29(3):1535-1542.
[28]Yi W, Wang B, Qu D. Diversity of isolates performing Fe(III) reduction from paddy soil fed by different organic carbon sources [J]. African Journal of Biotechnology, 2012,(19):4407-4417
Isolation of an electrogen Klebsiella oxytoca d7 and its electricity-generating mechanism.
LIU Yue, YUAN Lin-jiang*, (Key Laboratory of Environmental Engineering, Shaanxi Province, Key Laboratory of Northwest Water Resources, Environment and Ecology, Ministry of Education, Xi’an University of Architecture and Technology, Xi’an, 710055, China), China Environmental Science, 2017,37(9):3540~3548
An electrogen strain Klebsiella oxytoca-d7 was isolated from biofilm on the anode of a stable operating double chamber microbial fuel cell (MFC) using anaerobic double-plate method and its electricity-generating mechanism was investigated in this study. The results show that the bacteria Klebsiella oxytoca d7 performed high electrochemical activity according to the cyclic voltammetry analysis. It carried out extracellular electricigenic respiration in the environment with extracellular electron acceptor. The strain accomplished electricity generating respiration mainly through humus secreted as extracellular electron media detected by the three simensional fluorescence analysis of the strain’s metabolite. Ferric reducing experiments implied that excessive ferric ion did not result in extra growth of the strain, and the ferric ion reduction rate of the strain was limited. This research suggests that extracellular respiration is not the mainly respiration path way of the klebsiella oxytoca d7under anaerobic condition, but a subsidiary one as of the intracellular respiration in the presence of extracellular electron acceptor in the environment. Even there are enough extracellular electron acceptor in the environment, the strain’s growth won’t increase significantly. It is considered the strain does not obtain main growth energy from extracellular reduction, but from intracellular respiration. Only a small part of the electrons produced by oxidation of organic is used to reduce the extracellular electron acceptor.
microbial fuel cell;electricity generation;Klebsiella sp.;cyclic voltammetry;three dimensional fluorescence analysis
X172
A
1000-6923(2017)09-3540-09
2017-01-20
重大水专项(2009ZX07212-002)
* 责任作者, 教授, yuanlinjiang@xauat.edu.cn
刘 玥(1991-),女,陕西铜川人,西安建筑科技大学硕士研究生,主要研究方向为城市污水生物处理理论与技术.

